游离亚硝酸对亚硝酸盐氧化菌活性的抑制作用机制
2022-02-13杨昕怡常焕焕李晓强王光杰孙洪伟
杨昕怡,常焕焕,于 雪,李晓强,王光杰,孙洪伟,*
(1.兰州交通大学环境与市政工程学院,甘肃 兰州 730070;2.烟台大学环境与材料工程学院,山东 烟台 264000;3.山东同济测试科技股份有限公司,山东 烟台 264000)
硝化反应包括亚硝化和硝化两步反应,第一步:氨氧化菌(ammonia-oxidizing bacteria,AOB)将氨氮氧化成亚硝酸盐;第二步:亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)将亚硝化反应生成的亚硝酸盐进一步氧化为硝酸盐。AOB和NOB属于典型的化能自养菌,铵盐和亚硝酸盐[1-3]通过这两种细菌的作用最终转化为硝酸盐。虽然NOB从氧化亚硝酸盐这一过程中获得生命活动需要的能量,但是大多NOB对周围环境中亚硝酸盐浓度的高低非常敏感[2,4],并不是亚硝酸盐浓度越高越好。
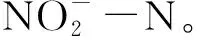
硝化反应过程中,FNA是NOB的基质底物,又是一种NOB活性抑制剂。当FNA浓度较低时,能够加快亚硝酸盐的氧化反应,但同时基于底物抑制动力学,当FNA浓度较高时,又会对NOB活性产生抑制作用。因此,硝化反应过程中真正的抑制剂是FNA[8-10]。孙洪伟等[11]研究发现,FNA对NOB活性具有显著抑制影响,该抑制影响可通过基质抑制动力学模型描述,且具有明显的分段现象。当0.004 mg·L-1≤FNA≤0.178 mg·L-1,随着FNA浓度增加,NOB活性逐渐增强,表明该浓度条件下,FNA会提高NOB活性;当0.191 mg·L-1≤FNA≤0.702 mg·L-1时,NOB活性随着FNA浓度的增加呈降低趋势,表明该浓度条件下,FNA可能抑制了NOB的活性;当FNA>0.702 mg·L-1时,NOB几乎没有活性,表明NOB活性被完全抑制。
目前,尚未有基于富集NOB的SBR系统中开展FNA对NOB的抑制动力学及亚硝酸盐氧化功能基因的相关研究。作者以长期富集的NOB菌属为研究对象,通过动力学模型探究不同pH 值(6.5、7.0、8.0)条件下,FNA对NOB菌属活性的抑制动力学影响,筛选能够准确描述该抑制影响的动力学模型,并结合荧光定量PCR技术,考察不同pH值条件下亚硝酸盐氧化还原酶基因(nxrA和nxrB)的变化规律,从生化反应动力学和统计学两方面阐述FNA对NOB活性的抑制机制。
1 实验
1.1 实验用水及接种污泥
接种污泥,取自兰州市某污水处理厂氧化沟工艺的活性污泥,具有良好的生物脱氮性能和硝化功能,其混合液挥发性悬浮固体浓度(MLVSS)为830 mg·L-1。
1.2 方案
1.3 荧光定量PCR技术
绝对定量PCR(absolute quantification PCR,AQ-PCR)技术是先绘制标准曲线(由拷贝数已知的标准品测出),然后测定未知样品的阈值循环(Ct)值,最后根据标准曲线推出该样品的起始浓度,以达到绝对定量样品基因mRNA、DNA 分子拷贝数的目的。样品在测定过程中,需要同时对未知样品和标准品进行PCR循环,未知样品cDNA 的起始拷贝数是通过将未知样品的Ct值与标准曲线结合起来而得出。把PCR 扩增过程中扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数定义为Ct值,其具有重现性。质粒DNA、RNA和ssDNA都可以作为测定过程中的标准品使用。实验中检测的功能基因和PCR引物信息[13]见表1。
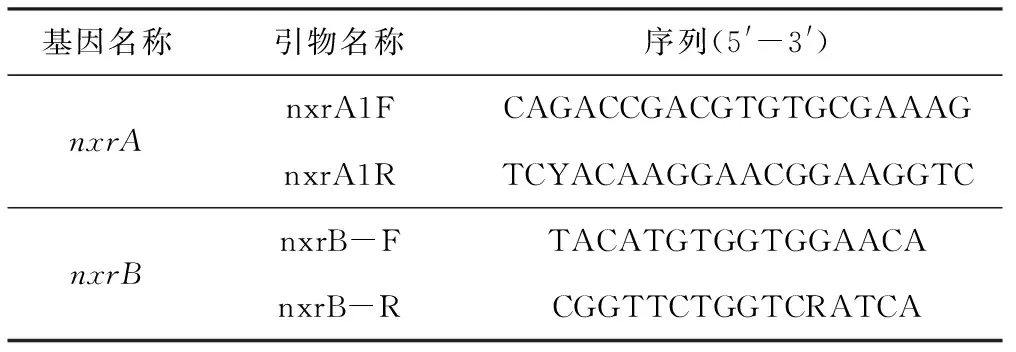
表1 功能基因和PCR引物信息Tab.1 Information of functional gene and PCR primer
按式(1)计算拷贝数(X0):
Ct=-KlogX0+b
(1)
式中:K为标准曲线斜率;b为标准曲线截距。
至此,中国掀起了大规模建设高速公路的热潮。如今中华大地上突破13万公里的高速公路织密成网,大大缩短了时间和空间距离,带来了发展新动力,成就举世瞩目。
1.4 基质抑制动力学模型
(1)Haldane模型[14]
1930年,Haldane发现在生化反应过程中,基质底物和催化作用的酶会形成酶-底物的中间复合物,该中间复合物会对酶产生较强的抑制作用,建立了Haldane模型(式2)来描述这种抑制影响。
(2)
(2)Aiba模型[15]
1968年,Aiba等发现酒精的发酵产物能够显著抑制微生物的生化反应过程,建立了产物抑制模型(式3)。
(3)
(3)Edwards模型[16]
1970年,Edwards建立了基质抑制动力学模型(式4),该模型被广泛应用于描述硝化反应过程中基质底物对微生物活性的抑制作用。
(4)
(4)Luong模型[17]
1987年,Luong建立了用于描述基质底物浓度对微生物增殖过程的影响的动力学模型(式5)。
(5)
上述式中:S为底物浓度,mg·L-1;r为底物的比降解速率,d-1;rmax为微生物最大比降解速率,d-1;KS为半饱和常数,mg·L-1;KI为抑制常数,mg·L-1;P为产物浓度,mg·L-1。
2 结果与讨论
2.1 NOB富集系统内活性污泥微生物菌群特性
NOB富集系统属水平的微生物群落组成结构(3个平行样品)如图1所示。
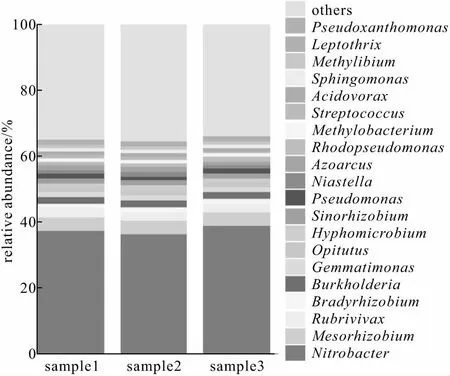
图1 NOB富集系统属水平微生物群落组成结构Fig.1 Microbial community composition at genus level in NOB enrichment system
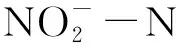
2.2 FNA对NOB活性的抑制动力学
为了探究FNA对NOB活性的抑制动力学影响,通过批次实验获得了不同FNA浓度在3种pH值条件下的比亚硝酸盐氧化速率(SNiOR),并采用上述4种基质抑制动力学模型对实验数据进行拟合,结果如图2所示。
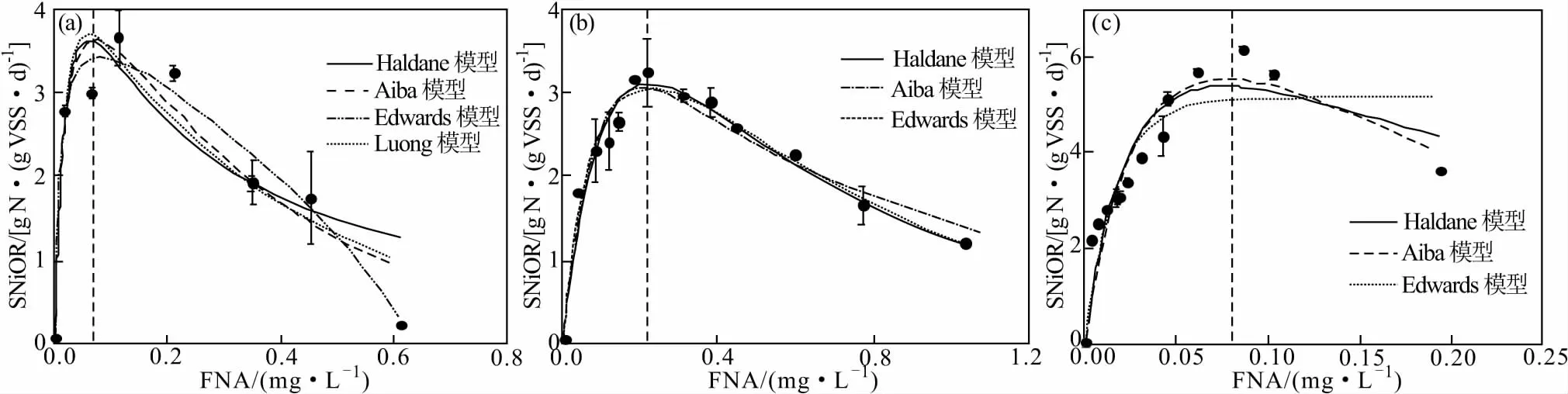
(a)pH=6.5 (b)pH=7.0 (c)pH=8.0图2 FNA对NOB活性抑制动力学模型的拟合曲线Fig.2 Fitting curves for kinetic model of inhibition on NOB activity by FNA
从图2可以看出,在3种pH值条件下,SNiOR的变化规律均适合Haldane模型、Aiba模型和Edwards模型,动力学模型拟合曲线均呈先上升后下降的趋势。此外,当pH值为6.5时,Luong模型也可以很好地反映FNA对SNiOR的影响。因此,上述4种基质动力学模型均可描述FNA对NOB活性的抑制影响。
在3种pH值条件下,当FNA浓度较低时,即pH=6.5,FNA<0.07 mg·L-1;pH=7.0,FNA<0.21 mg·L-1;pH=8.0,FNA<0.08 mg·L-1,随着FNA浓度的增加,SNiOR均表现出显著加快的趋势,NOB活性显著增强,也就是说,在较低的FNA浓度范围内,FNA对NOB的活性具有显著的促进作用。然而,当FNA浓度高于上述临界浓度时,随着FNA浓度的增加,SNiOR却逐渐减慢,NOB活性逐渐被抑制。因此,FNA对NOB的活性表现出明显的“低促高抑”的影响规律。
当基质底物为FNA时,采用Haldane模型、Aiba模型和Edwards模型均能较好地描述FNA对NOB活性的抑制影响,但是分析统计参数(RSS、R2、F、P)时发现,Aiba模型的RSS较小,R2较大,F值最大,P值最小。因此,综合考虑,Aiba模型最适宜描述FNA对NOB活性的抑制影响。
不同pH值条件下,Aiba模型的动力学参数及拟合结果的统计学分析如表2所示。
从表2可以看出,基于Aiba模型获得的动力学参数rmax具有显著差异,pH值为8.0 时,rmax最大,为13.63 g N·(g VSS·d)-1, pH值为7.0 时的rmax略高于pH值为6.5的。因此,NOB菌属在pH值为8.0时具有最高的活性,反应速率最快。对于Aiba模型中KS和KI值,两者均在pH值为7.0时最大,分别为0.13 mg·L-1和0.63 mg·L-1,显著高于pH值为8.0、6.5的。说明基质FNA与亚硝酸盐氧化还原酶的亲和力在pH值为7.0时最小,而在pH值为6.5时最大。
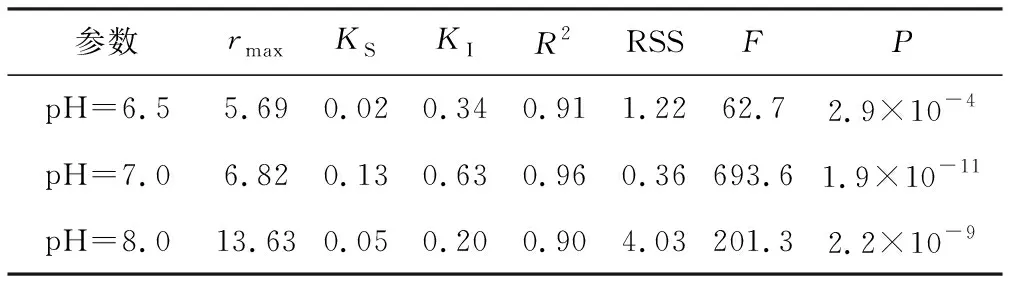
表2 不同pH值条件下,Aiba模型的动力学参数及统计学分析Tab.2 Kinetic parameters and statistical analysis ofAiba model under different pH values
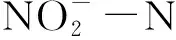
2.3 pH值对NOB菌属亚硝酸盐氧化还原酶的影响
为了进一步探究在大量富集了NOB的系统内,pH值变化对nxrA、nxrB的影响,对pH值分别为6.5、7.0和8.0条件下的活性污泥进行取样(每个pH值选3个平行样),采用荧光定量PCR技术对nxrA和nxrB基因进行定量,nxrA和nxrB基因的拷贝数如图3所示。
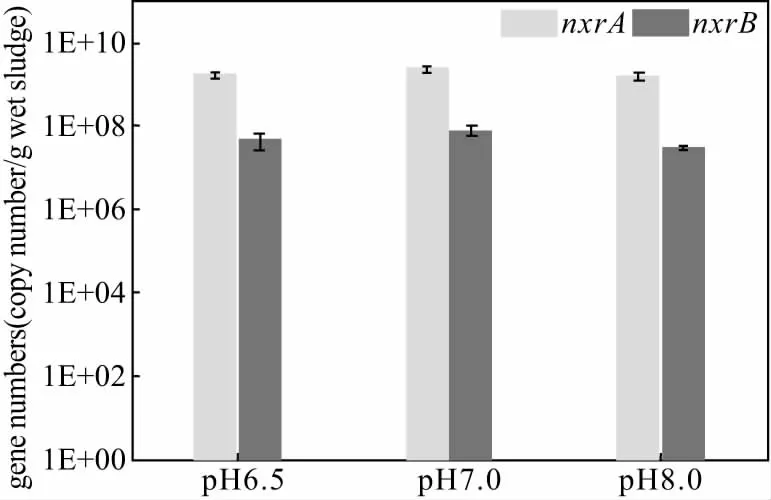
图3 不同pH值条件下,nxrA和nxrB基因拷贝数的变化规律Fig.3 Changes of nxrA and nxrB genes copy numbers under different pH values
从图3可以看出,nxrA和nxrB基因的拷贝数分别介于1.6×109~2.6×109拷贝数/g湿污泥和3.1×107~4.6×107拷贝数/g湿污泥之间,并且nxrB基因的拷贝数比nxrA基因的拷贝数低1~2个数量级。分析原因在于:nxrA属于Nitrobacter菌群的功能基因[23],nxrB为Nitrospira菌群的功能基因[24],即nxrA和nxrB分别是Nitrobacter和Nitrospira的功能基因指示物;本实验过程中,Nitrobacter是主导活性污泥系统内的最优势功能菌属(38.0%),而Nitrospira的相对丰度较低(0.26%);此外,pH值的变化会对nxrA和nxrB基因的绝对丰度造成一定的影响,当pH值从6.5增大到7.0时,nxrA和nxrB基因的绝对丰度均表现出逐渐升高的趋势,而当pH值从7.0增大到8.0时,绝对丰度却表现出了降低的趋势。
众多研究报道了pH值是影响NOB菌属生物活性的重要因素之一,因为微生物对环境的pH值有一定要求,即有最佳生长环境[25-27]。这种影响的本质应体现在活性污泥中的NOB菌属内,nxrA和nxrB基因对不同pH值的响应。本实验发现,pH值能够显著影响nxrA和nxrB基因的绝对丰度,进而导致NOB活性的变化。因此,控制适宜的pH 值将有利于生物脱氮系统内亚硝酸盐的积累[28-29],使NOB的生物活性维持在较高水平。
3 结论
(1)Nitrobacter是NOB富集系统内丰度最高的菌属,相对丰度达到38.0%,而NOB的其它菌属如Nitrospira等硝化菌占比均低于0.5%。
(2)统计学分析结果表明,Haldane、Aiba、Edwards和Luong等4种抑制动力学模型中,Aiba模型最适宜描述FNA对NOB活性的抑制影响,且表现出“低促高抑”的特征。
(3)荧光定量PCR结果显示,nxrA和nxrB基因的绝对丰度与pH值存在一定关系,且在pH值为7.0时,nxrA和nxrB基因拷贝数最多,分别为2.6×109拷贝数/g湿污泥和4.6×107拷贝数/g湿污泥。此外,在大量富集了NOB的活性污泥系统内,nxrA的绝对丰度高于nxrB,视为主导亚硝酸盐氧化的功能基因。
