黄芩苷通过调控LncRNA-MALAT1/miR-361-3p/TGF-β轴治疗低氧性肺动脉高压
2022-02-13吴佩亮陈马云王良兴黄晓颖
吴佩亮,陈马云,王良兴,黄晓颖
温州医科大学附属第一医院 呼吸与危重症医学科,浙江 温州 325015
肺动脉高压(pulmonary hypertension, PH)是指肺动脉压力异常升高导致的以不可逆右心室衰竭为特征的进行性疾病[1]。长链非编码RNA(long non-coding RNA, LncRNA)是一类长度大于200 nt并且不编码蛋白质的非编码RNA[2]。一种新的LncRNA肺腺癌转移相关转录物1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)是一种真正的LncRNA,长度超过8 000 nt[3],研究表明MALAT1可作为PH易感性的潜在指标[4]。miRNAs在转录后调控中起着至关重要的作用。据报道,miR-361-3p可调节癌细胞的增殖、迁移、侵袭和干细胞性[5-6]。转化生长因子β(transforming growth factor-β, TGF-β)在调节细胞的生长、增殖、分化、迁移和凋亡方面也发挥着重要的作用[7]。本课题组前期研究发现黄芩苷(Baicalin)能抑制慢性低氧诱导的肺动脉平滑肌细胞增殖和迁移,可能具有改善PH的作用。本研究通过建立低氧性肺动脉高压(hypoxia induced pulmonary hypertension, HPH)模型和低氧肺动脉平滑肌细胞模型,探讨黄芩苷是否通过LncRNA-MALAT1/miR-361-3p/TGF-β信号通路来调控PH的发生发展。
1 材料和方法
1.1 实验动物和细胞 健康SPF级雄性C57BL/6小鼠18只,体质量20~25 g,购于浙江省医学科学院,饲养在温州医科大学实验动物中心,本研究通过动物实验伦理学批准。小鼠肺动脉平滑肌细胞(murine pulmonary artery smooth muscle cells,MPASMCs)购自美国典型培养物保藏中心(美国ATCC),并在含有10%胎牛血清(美国Gibco公司)和1%青链霉素的DMEM培养基(美国Gibco公司)中培养。
1.2 方法
1.2.1 实验分组和造模:将18只C57BL/6小鼠按体质量随机分成3组(每组6只):常氧对照组(Normal)、慢性低氧性肺动脉高压组(Hypoxia+Saline)、慢性低氧性肺动脉高压+黄芩苷组(Hypoxia+Baicalin)。动物造模:将Normal组小鼠置于常压常氧的SPF屏障中,Hypoxia+Saline组及Hypoxia+Baicalin组小鼠置于全自动常压低氧大小鼠实验舱内,在CO2、O2、湿度三合一监测仪的控制下,最终使得箱体内的O2浓度维持在10%±1%,CO2浓度维护在2%±1%,造模21 d;Hypoxia+Baicalin组小鼠每日入实验舱前腹腔注射60 mg/kg Baicalin;每日密切关注C57BL/6小鼠活动情况、饮食情况、精神状态。将MPASMCs按照实验目的随机分为:常氧对照组(Normal)、常氧+高剂量黄芩苷组(Normal+ 100 μmol/L Baicalin)、低氧组(Hypoxia)、低氧对照组(Hypoxia+Saline)、低氧+低剂量黄芩苷组(Hypoxia+50 μmol/L Baicalin)、低氧+高剂量黄芩苷组(Hypoxia+100 μmol/L Baicalin)。细胞造模:MPASMCs在低氧培养箱中培养,持续注入92% N2+5% CO2+3% O2,并在37 ℃下持续培养48 h。对于Normal组,将MPASMCs置于常氧培养箱中,持续注入74% N2+5% CO2+21% O2,并在37 ℃下持续培养48 h。
1.2.2 血流动力学指标测定:腹腔注射1%戊巴比妥钠溶液(0.1 mL/20 g)麻醉C57BL/6小鼠,固定小鼠后分离右颈外静脉,PE微导管插管至右心室,随即用Powerlab生理信号记录系统动态记录小鼠右心室压力(right ventricular systolic pressure, RVSP)。分离左颈总动脉,PE微导管插入小鼠左颈总动脉后记录颈总动脉的压力(mean carotid arterial pressure, mCAP)。
1.2.3 肺血管结构重塑指标及TGF-β、p-smad2、p-smad3测定:取小鼠右肺下叶放入4%多聚甲醛中固定48 h,肺组织常规石蜡包埋切片,行苏木素-伊红(HE)染色及免疫组化染色。应用Image-Pro Plus 6.0图像分析软件分析肺小动脉管壁直径/管总直径(wall thickness/total thickness, WT/TT)、肺小动脉管壁面积/管总面积(wall area/total area,WA/TA)、TGF-β、p-smad2、p-smad3的表达量。
1.2.4 细胞转染:细胞转染阴性对照(miR-NC)、miR-361-3p模拟物(miR-361-3p mimics)和miR-361-3p抑制剂(miR-361-3p inhibitor)购自广州锐博生物公司。pcDNA3.1-MALAT1过表达载体(MALAT1 vector)、针对MALAT1的小干扰RNA(siRNA)和siRNA阴性对照(si-NC)购自上海吉玛生物公司;转染试剂使用Lipofectamine 3000(美国Invitrogen公司)。
1.2.5 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction, RT-qPCR):使用TRIzol试剂(美国Invitrogen公司)分离出总RNA,使用高容cDNA反转录试剂盒(Thermo Fisher Scientific, USA)进行cDNA合成。使用SYBR Green PCR Master Mix试剂盒(大连Takara公 司)进行PCR。使用GAPDH或U6对表达值进行标准化,并通过2-ΔΔCt方法进行量化。引物序列如下:TGF-β, F 5’-GGCCAGATCCTGTCCAAGC-3’、R 5’-GTGGGTTTCCAC CATTAGCAC-3’;MALAT1,F 5’-CAGCACATGACGGAGGTTG T-3’,R 5’-TCATCCAAATACTCCACACGC-3’;GAPDH,F 5’-AGTGGCAAAGTGGAGATT-3’,R 5’-GTGGAGTCATACTGGA ACA-3’;miR-361-3p,F 5’-CCCTCAGTGGCTCAGTAG-3’,R 5’-CCACCAGAGACCCAGTAG-3’;U6,F 5’-CTCGCTTCGG CAGCACA-3’,R 5’-AACGCTCTCACGAATTTGCGT-3’。
1.2.6 细胞增殖实验:应用细胞计数试剂盒8(cell counting kit-8, CCK-8)法检测MPASMCs的活力。MPASMCs(每孔5 000个细胞)接种在96孔板过夜,然后与10 μL CCK-8溶液(美国Thermo Fisher Scientific公司)在37 ℃每孔4 h。最后,每个孔在450 nm处的吸光度通过分光光度计(美国Bio-Rad公司)检测。
1.2.7 伤口愈合实验测定:将MPASMCs置于6孔板上培养,待细胞生长汇合度达到80%时,用移液管在细胞中划出一条垂直划痕。用PBS去除细胞碎片后,将细胞培养在新鲜的无血清中培养基24 h。拍照测量MPASMCs的迁移距离以量化细胞迁移率。
1.2.8 蛋白质印迹(Western blot)分析 利用蛋白裂解液(上海碧云天公司)裂解细胞提取蛋白质,BCA法测定蛋白浓度,然后10% SDS PAGE电泳,转膜,封闭。应用TGF-β、p-smad2、p-smad3,cyclin B1、PCNA、Ki-67、MMP2和MMP9(武汉三鹰公司)进行一抗孵育过夜,TBS-T溶液洗膜3次,每次10 min。室温下加入荧光二抗抗体(美国Abcam公司)孵育 1.5 h,洗膜3次,每次10 min,用Odyssey近红外双色激光成像系统选择800通道进行扫描条带,以GAPDH作为内参照标化。
1.2.9 荧光素酶报告基因检测:TGF-β mRNA 3’UTR或MALAT1结合序列的突变体(mutant)或野生型(wild)被克隆到荧光素酶报告基因中,建成pmiR-RB-报告载体[Promega(北京)公司]。之后,MPASMCs被共转染到使用miR-361-3p模拟物或miRNC模拟物和相应的荧光素酶报告基因。孵育48 h后,双荧光素酶检测试剂盒[Promega(北京)公司]用于分析荧光素酶活性。
1.3 统计学处理方法 采用SPSS20.0统计软件进行处理。计量资料用±s表示,两组间比较用t检验;多组间比较用单因素方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 黄芩苷对低氧诱导的MPASMCs增殖和迁移能力的影响 与Normal组比,Hypoxia组MPASMCs的增殖能力显著增加(P<0.05);而经黄芩苷干预后,Hypoxia组MPASMCs增殖能力显著下降,其中Hypoxia+100 μmol/L Baicalin组较Hypoxia+ 50 μmol/L Baicalin组的抑制作用更明显(P<0.05),见图1A、图1B。与Hypoxia组比,Hypoxia+ 50 μmol/L Baicalin组和Hypoxia+100 μmol/L Baicalin组MPASMCs细胞的迁移能力显著下降,其中100 μmol/L Baicalin组较50 μmol/L Baicalin组抑制作用更为明显(P<0.05),见图1C、图1D。与Hypoxia组比,Hypoxia+100 μmol/L Baicalin组MPASMCs中增殖标志物cyclin B1、PCNA和Ki-67的蛋白表达量显著下降(P<0.05),见图1E。与Hypoxia组比,Hypoxia+100 μmol/L Baicalin组MPASMCs中细胞迁移标志物MMP2和MMP9的蛋白表达量显著下降,见图1F。

图1 黄芩苷对低氧诱导的MPASMCs增殖和迁移能力的影响
2.2 黄芩苷对肺小动脉重构、RVSP、mCAP的影响 HE染色结果提示与Normal组比,Hypoxia+Saline组小鼠肺组织中肺动脉中膜平滑肌细胞明显增生,管腔明显狭窄;Hypoxia+Baicalin组较Hypoxia+ Saline组肺动脉中膜平滑肌细胞增生减少,管腔狭窄减轻,见图2A。与Normal组比,Hypoxia+Saline组小鼠WA/TA、WT/TT和RVSP显著升高(P<0.01);与Hypoxia+Saline组比,Hypoxia+Baicalin组WA/TA、WT/TT和RVSP显著下降(P<0.05),见图2B、图2C、图2D。但Normal、Hypoxia+Saline、Hypoxia+Baicalin三组间mCAP差异无统计学意义(P>0.05),见图2E。

图2 黄芩苷对HPH模型小鼠肺病理组织学以及血流动力学的影响
2.3 黄芩苷抑制TGF-β信号通路激活 与Normal组比,Hypoxia组MPASMCs中TGF-β、p-smad2、p-smad3蛋白表达显著增加(P<0.05);与Hypoxia组比,Hypoxia+100 μmol/L Baicalin组MPASMCs中TGF-β、p-smad2、p-smad3蛋白表达显著下降(P<0.05),见图3A。与Hypoxia+Saline组比,Hypoxia+Baicalin组小鼠肺动脉内TGF-β、p-smad2、p-smad3蛋白表达表达显著下降(P<0.05),见图3B。

图3 黄芩苷对TGF-β信号通路的影响
2.4 黄芩苷调控LncRNA-MALAT1/miR-361-3p/TGF-β轴 基于GEO数据库分析了COPD和健康对照人群中差异表达的miRNA(GSE38974),并利用在线预测工具(Starbase和miRanda)筛选出能够靶向TGF-β的miRNA,对上述集合取交集后筛选出候选基因miR-361-3p,见图4A、图4B、图4C。双荧光素酶报告结果显示,与mutant组比,wild组miR-361-3p荧光活性明显减弱(P<0.05),见图4D。MPASMCs细胞过表达miR-361-3p后,TGF-β mRNA表达水平显著下降;而沉默miR-361-3p后,TGF-β mRNA表达水平显著升高(P<0.05),见图4E。提示miR-361-3p能够靶向抑制TGF-β表达。生物信息预测提示MALAT1能够靶向吸附miR-361-3p,见图4F。双荧光素酶报告基因实验和RT-qPCR实验证实MALAT1能够抑制MPASMCs中miR-361-3p的表达(P<0.05),见图4G、图4H。与Normal组比,Normal+100 μmol/L Baicalin组MPASMCs中miR-361-3p和MALAT1表达水平无明显变化,而Hypoxia组MPASMCs中miR-361-3p表达显著下降,MALAT1表达水平显著升高(P<0.05);与Hypoxia组比,Hypoxia+100 μmol/L Baicalin组MPASMCs中miR-361-3p表达显著升高,MALAT1表达水平显著下降(P<0.05),见图4I、图4J。与Normal组比,Hypoxia+Saline组小鼠肺组织中miR-361-3p显著下降,MALAT1表达水平显著升高(P<0.05);与Hypoxia+Saline组比,Hypoxia+Baicalin组小鼠肺组织中miR-361-3p显著升高,MALAT1表达水平显著下降(P<0.05),见图4K、图4L。

图4 黄芩苷对LncRNA-MALAT1/miR-361-3p/TGF-β轴的调控
2.5 LncRNA-MALAT1/miR-361-3p/TGF-β轴的体外Western blot鉴定 与Normal组比,Hypoxia组MPASMCs中TGF-β、p-smad2、p-smad3蛋白表达显著升高(P<0.05);而对MALAT1进行干扰沉默后,TGF-β、p-smad2、p-smad3蛋白表达水平较Hypoxia组显著下降(P<0.05);对miR-361-3p进行过表达后,TGF-β、p-smad2、p-smad3蛋白表达水平较Hypoxia组显著下降(P<0.05),见图5。
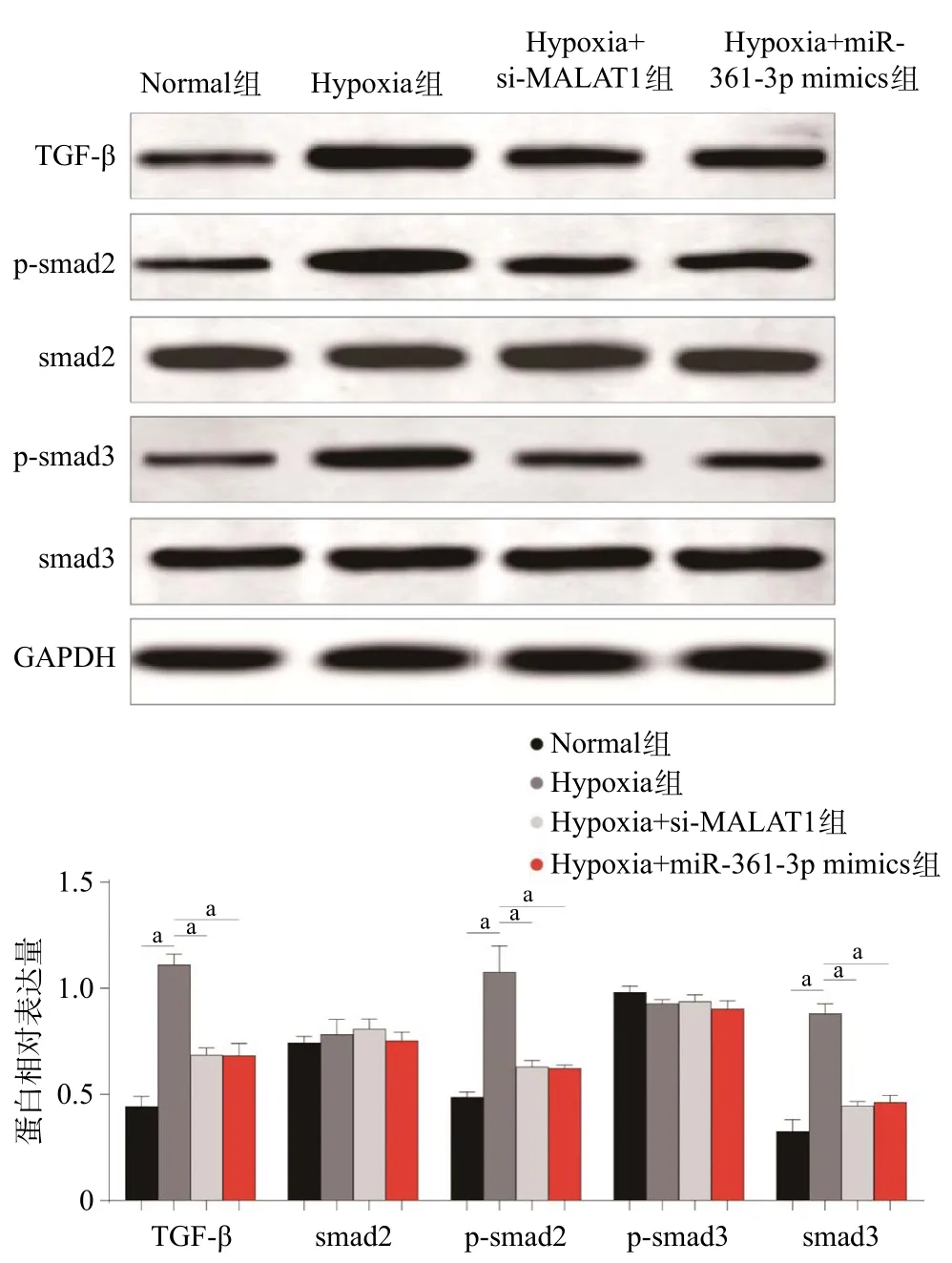
图5 LncRNA-MALAT1/miR-361-3p/TGF-β轴对TGF-β信号通路的影响
3 讨论
PH的特征是肺动脉内皮细胞、平滑肌细胞的异常增殖,最终导致肺血管重构,从而使患者肺血管阻力增加,右心衰竭致死亡[8]。近年来PH的治疗取得了一定进展,但肺移植依然是其最有效的治疗选择。目前临床上已被批准用于治疗PH的药物主要针对以下三个关键途径:内皮素途径、前列环素途径和一氧化氮/可溶性鸟苷酸环化酶途径[9]。这些药物可以降低肺动脉的张力,从而在一定程度上改善患者的症状,但不能预防或逆转疾病的进展[10]。
HPH模型是目前公认的兼顾稳定性且重复率较高的PH建模方式[11]。本研究中,小鼠经低氧诱导后,肺组织及肺动脉壁产生明显的病理变化,同时低氧组小鼠RVSP显著增加,提示小鼠HPH建模成功。黄芩苷(7-葡萄糖醛酸,5,6-二羟基黄酮)是从黄芩中纯化提取的类黄酮成分,目前已被广泛用于治疗各种疾病,如支气管炎、肾炎、肝炎和哮喘[12-13]。 研究发现黄芩苷具有广泛的药理活性,包括抗炎、抗氧化、抗血栓形成、抗肿瘤和抗增殖作用[14]。在心肌炎中,黄芩苷通过下调IL-6和TNF-α抑制脂多糖诱导的炎症[15];在口腔炎症中,黄芩苷通过抑制TNF-α、IL-6和核因子-κB的表达发挥抗炎作用[16]。 本研究中细胞实验结果显示:黄芩苷可显著抑制MPASMCs的增殖能力并且细胞增殖相关蛋白的表达水平也显著下降;同时黄芩苷还能够显著抑制MPASMCs的迁移和侵袭能力。动物实验结果表明黄芩苷能够改善HPH的肺动脉病理学变化,进而减轻肺动脉结构重塑。以上体内外实验结果提示黄芩苷能够缓解HPH的发生发展。
研究发现,PH患者血浆中的TGF-β表达量高于正常健康人,PH患者平均肺动脉压力的增高与TGF-β的血浆浓度水平成正相关[17]。另有研究表明,使用IN-1233可抑制TGF-β的表达,且能够显著抑制PASMCs的迁移作用,表明TGF-β信号通路可诱导平滑肌细胞迁移,进而参与了PH的发展进程[18]。非编码RNA在体内表达丰富且灵敏高效,作为一类新的免疫调控因子参与了机体的固有免疫应答和对炎性反应的调控,一系列非编码RNA已经被证实参与PH的发病过程,研究发现对炎症相关的非编码RNA进行靶向干预进而减轻炎症反应可能是治疗PH的有效手段[19]。本研究中我们利用生物信息学技术筛选并基于实验证实了能够靶向调控TGF-β的MALAT1/miR-361-3p/TGF-β信号调控轴。有研究发现miR-361-3p在PH患者中低表达,并且miR-361-3p能够抑制PASMCs细胞的增殖,与本研究结果一致[20]。本研究表明MALAT1在低氧MPASMCs模型中显著上调,并能够通过靶向吸附miR-361-3p促进TGF-β的表达。另有报道同样也证实MALAT1能够促进PASMCs的增殖和迁移并抑制其凋亡[21]。
综上所述,本研究结果证实黄芩苷能够减轻HPH小鼠的肺动脉压力,改善肺血管重塑,抑制低氧诱导的PASMCs异常增殖。进一步探究其作用机制发现黄芩苷能够抑制LncRNA-MALAT1的表达水平,继而通过ceRNA机制吸附miR-361-3p抑制TGF-β的表达,最终达到抑制HPH的发生发展。
