消化道大出血儿童禁食时间及进食种类对再出血和住院时间影响的回顾性队列研究
2022-02-11付丽琴汪志凌白辉科李秋平万朝敏
付丽琴 汪志凌 白辉科 李秋平 万朝敏
消化道出血在儿童中并非罕见,据报道其发病率在住院患儿中占0.5%,多数为自限性,预后较好,但仍有部分患儿会发生严重的大出血[1,2]。由于儿童总体血容量少,且对失血的自我调节能力较差,消化道大出血可短期内出现循环衰竭甚至死亡。近年来随着诊疗技术的不断进步,儿童消化道大出血的诊断率及救治率不断提高,但消化道出血后的禁食问题及营养管理在临床上的重要性被低估了[3]。儿童消化道大出血后通常被要求禁食,这可能是预防早期再出血的一种安全措施,但消化道出血后是否需要严格禁食一直存在着争议,且儿童对于禁食的耐受性差,容易出现营养迅速消耗、内环境紊乱及器官功能受损、免疫功能下降等问题[4],进而影响临床结局。儿童消化道大出血后是否能通过严格禁食获益,进食后饮食的类型是否对结局有影响,值得临床关注。
1 方法
1.1 研究设计 回顾性队列研究。以住院的消化道大出血患儿为队列人群,以出院时为队列终点,观察不同禁食时间及进食后饮食类型对再出血和住院时间的影响。本研究得到四川大学华西第二医院(我院)伦理委员会批准(审批号:2020-111)。
1.2 病例纳入标准 2011年10月1日至 2021年10月31日于我院儿科住院、年龄28 d至18岁且符合消化道大出血诊断标准的病例。
1.3 病例排除标准 符合以下任意1项,①消化道出血未控制自动出院或转外科治疗的病例;②合并其他原因贫血,无法判断Hb下降是否主要源于消化道出血的病例;③危重病并发消化道出血、濒死前消化道出血及假性消化道出血(口咽部、鼻腔出血咽下)[5]。④进食种类或进食时间不详的病例。
1.4 提取临床信息的定义
1.4.1 消化道出血 包括呕血、含血或咖啡渣物质的鼻胃抽吸物、黑便或便血[6]或无消化道症状的隐匿性消化道出血(表现为贫血或其他症状,胃肠镜证实消化道出血)。
1.4.2 消化道大出血 至少符合以下任意1项,①初始Hb在24 h内下降>20 g·L-1[7];②临床判断需输血、失血性休克、需要血管加压药维持循环稳定,或需侵入性治疗止血[8]。
1.4.3 消化道再出血[9]本次住院期间发生以下任意1项:①呕血好转或停止后再次呕血,或胃管内再次引流出新鲜血性物质(排除胃管损伤胃黏膜所致出血);②黑便或便血好转或停止后再次出现黑便或便血;③有再出血的辅助证据(Hb持续降低、血压下降、需要再次输血);④内镜、核素扫描或血管造影等检查发现有活动性出血。
1.4.4 开放饮食指征 由主治医生根据以下指征决定开放饮食时间,①经有效止血治疗消化道出血明显好转或停止;②血流动力学稳定;③无其他开放饮食的禁忌证(如频繁呕吐、过敏性紫癜引起的严重腹痛等)。
1.4.5 肠外营养应用指征[10]①因消化道出血禁食或经肠内摄入营养不足>5 d;②进食后出现消化道再出血、剧烈腹痛等不能耐受继续进食;③无肠外营养相关禁忌证(如严重水电解质紊乱、酸碱失衡等)。
1.5 信息采集 ①基本情况:性别,年龄,心率,呼吸,血压,消化道出血病史,合并失血性休克,凝血障碍,本次发病合并症数量、出院诊断;②实验室检查:Hb的最低值及同次PLT值,入院时AST、ALT、白蛋白(ALB)、 尿素、肌酐(Cr)、国际标准化比值(INR)、血钠(Na+)、血钾 (K+);③禁食和进食相关指标:入院后禁食时间、开放饮食后膳食类别、进食方式;④治疗措施:输血、使用生长抑素、肠外营养、吸氧;⑤临床结局,包括主要结局指标:再次出血、住院时间;次要结局指标:感染、进食后不良反应(如腹痛、腹胀、腹泻、恶心、呕吐等)、转归(好转出院或死亡)。
1.6 分组 按禁食时间分为4组:<24 h组、~48 h组、~72 h组和>72 h组;按开放饮食时的进食种类分为3组:碳水化合物饮食组(包括米汤、稀饭、米粉、糖水等)、蛋白质饮食组(包括母乳、配方奶、豆浆、蛋类饮食等)和混合饮食组(碳水化合物+蛋白质饮食)。
1.7 统计方法 所有统计分析均通过SPSS 26.0完成,采用双侧检验,P<0.05表示差异或关联有统计学意义。对于计量资料,正态分布或近似正态分布的连续性变量用xˉ±s描述,组间比较采用单因素方差分析;偏态分布的连续性变量用M(P25,P75)描述,组间比较采用Kruskal-WallisH秩和检验;计数资料采用例数和百分数描述,组间比较分别采用χ2检验或Fisher′s精确检验。校正组间差异有统计学意义的变量,采用二项Logistic回归或多重线性回归进行分析,对住院时间行ln转换,命名为lnLOS,使其满足多重线性回归分析要求。
2 结果
2.1 基本情况 图1显示,满足纳入和排除标准的266例消化道大出血病例进入本文分析,男175例 (65.8%), 女91例;年龄6.0(2.4, 10.9)岁。

图1 病例纳入及排除流程图
226例消化道大出血患儿中,既往有消化道出血病史43例(16.1%),伴有凝血功能障碍37例(13.9%),失血性休克29例(10.9%)。合并症主要包括肺炎、脑炎、脓毒症、肝功能异常、内环境紊乱等,存在1种和≥2种合并症分别为70例(26.3%)和57例(21.4%)。再出血57例(21.4%)。
266例消化道大出血患儿中,明确病因142例(53.4%);消化道再出血57例中,明确病因32例(56.1%),病因前3位分别为梅克尔憩室9例、消化性溃疡病6例、食管胃底静脉曲张及过敏性紫癜各4例;其中再次大出血5例(禁食~48 h组、~72 h组各1例,>72 h组3例;碳水化合物饮食组和蛋白质饮食组各2例,混合饮食组1例);消化道未再出血者209例,明确病因110例,病因前3位分别为消化性溃疡病29例、食管胃底静脉曲张26例、过敏性紫癜16例。发生院内感染14例,其中上呼吸道感染6例、下呼吸道感染4例、消化道感染4例。进食后出现不良反应54例(20.3%),其中腹泻18例,腹痛16例,呕吐12例,腹胀和低热各3例,恶心2例。输血治疗204例(76.7%),肠外营养170例(63.9%)。死亡1例(严重脓毒症、内环境紊乱、呼吸循环衰竭),余均好转出院。
2.2 不同禁食时间分组临床特征、实验室指标的比较 表1显示,禁食<24 h组、~48 h组、~72 h组和>72 h组分别占32.3%、18.0%、16.5%和33.1%。组间比较显示,舒张压水平、合并症构成比、使用生长抑素比例、PLT数量、ALT水平和住院时间差异均有统计学意义。
表2显示,调整了表1中差异有统计学意义的自变量(舒张压、合并症、使用生长抑素、PLT和ALT)后,以禁食时间<24 h为参照,多因素Logistic回归分析结果显示,禁食时间与再出血、院内感染发生风险的关联差异无统计学意义(P>0.05)。多重线性回归分析结果显示,禁食时间>72 h的患儿lnLOS增加0.192(95%CI: 0.047~0.337)d,差异有统计学意义(P=0.010),即禁食时间>72 h的患儿住院时间延长。

表1 不同禁食时间组患儿临床特征的比较[n(%)]

表2 不同禁食时间组患儿临床结局的多因素回归分析

续表 HB/g·L-1( ±s)67.8±15.167.0±14.764.1±18.270.4±17.21.530.207PLT/×109·L-1[M(P25,P75)]271.5(174.7, 349.0)307.5 (207.5, 406.0)217.5(149.7, 345.5)238.5(169.0, 326.3)9.490.023ALT/U·L-1[M(P25,P75)]22.5 (14.5, 29.8)23.0 (18.8, 32.0)22.0 (14.8, 29.3)28.5 (19.8, 39.0)9.250.026AST/U·L-1[M(P25,P75)]29.0 (24.0, 38.8)35.5 (25.0, 51.3)29.5 (23.0, 36.5)35.0 (23.8, 45.3)1.280.233白蛋白/g·L-1( ±s)35.9±7.235.0±7.734.0±6.533.1±6.52.4440.065尿素/mmol·L-1[M(P25,P75)]4.8 (3.6, 6.3)4.6 (3.2, 6.0)4.8 (3.9, 6.5)5.3 (3.6, 6.5)1.760.623肌酐/μmol·L-1[M(P25,P75)]36.5 (26.3, 45.8)31.5 (21.0, 40.3)32.5 (24.0, 44.0)32.5 (23.0, 42.3)4.520.211血钾/mmol·L-1( ±s)4.1±0.64.0±0.64.1±0.54.1±0.70.7130.545血钠/mmol·L-1( ±s)137.6±3.5136.5±5.7137.6±3.3136.9±4.20.9230.43INR[M(P25,P75)]1.1 (1.0, 1.2)1.1 (1.0, 1.2)1.2 (1.1, 1.2)1.2 (1.1, 1.2)4.680.197无再出血66 (76.7)36 (75.0)34 (77.3)73 (83.0)1.5820.663再出血20 (23.3)12 (25.0)10 (22.7)15 (17.0)无院内感染81 (94.2)45 (93.8)44 (100)82 (93.2)-0.3501)院内感染5 (5.8)3 (6.3)0 (0)6 (6.8)住院时间/d,[M(P25,P75)]7.0 (5.0, 10.0)7.0(6.0, 9.3)7.5(6.7, 10.0)10.0 (8.0, 14.0)26.2<0.001lnLOS/d( ±s)2.0±0.52.0±0.52.1±0.52.4±0.58.241<0.001
2.3 不同进食种类分组临床特征的比较 表3显示,碳水化合物饮食组、蛋白质饮食组和混合饮食组分别占25.9%、41.4%和32.7%。组间比较显示,年龄、有无凝血障碍、有无合并症及数量、有无失血性休克、进食方式、是否需要吸氧治疗和住院时间,差异均有统计学意义(P<0.05)。

表3 不同进食种类分组患儿临床特征的比较[n(%)]
表4显示,调整了表3中差异有统计学意义的自变量(年龄、凝血障碍、合并症和吸氧等)后,以碳水化合物饮食组为参照,多因素Logistic回归分析结果显示,进食种类与再出血、进食后不良反应发生风险的关联差异均无统计学意义(P>0.05)。多重线性回归分析结果显示,蛋白质饮食组患儿lnLOS差异无统计学意义(P>0.05),混合饮食组患儿lnLOS缩短0.176(95%CI: -0.318~-0.034)d,差异有统计学意义(P=0.015),即混合饮食组患儿住院时间短于单纯给予碳水化合物或蛋白质饮食者。
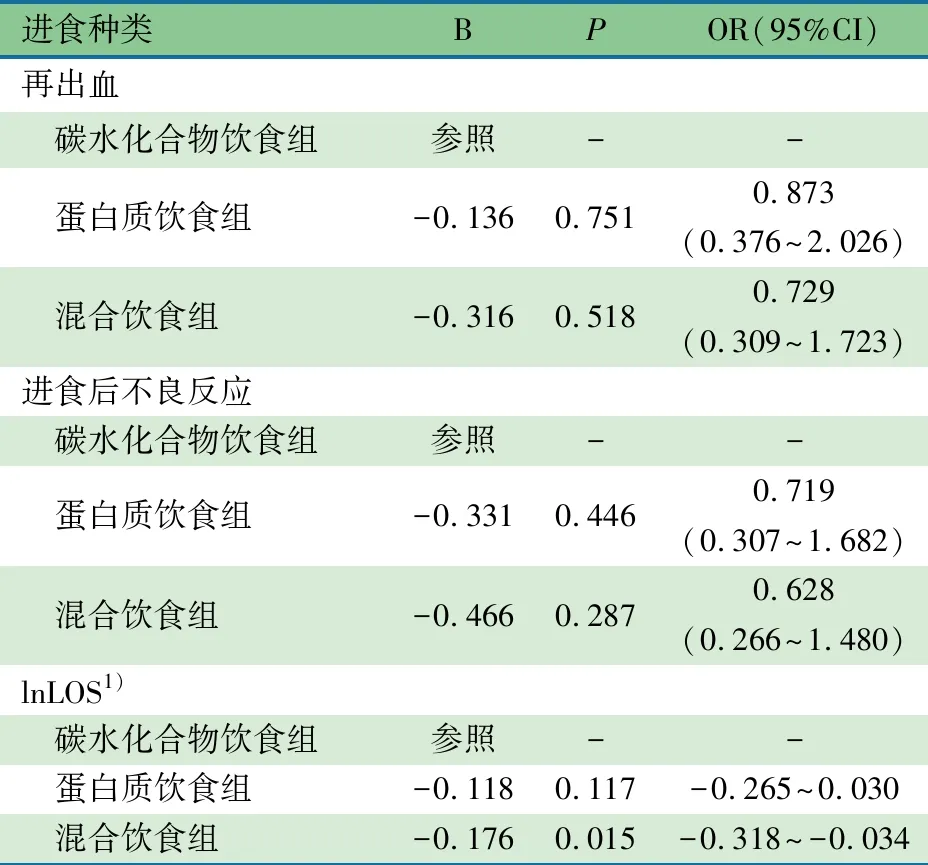
表4 不同进食种类分组患儿临床结局的多因素回归分析
3 讨论
消化道出血可发生在消化道的任何部位,临床可表现为无症状性少量出血,也可出现失血性休克危及生命,少数患儿以原因不明的贫血症状甚至休克为首发表现[11],以往研究发现,消化道大出血在危重患儿中发生率为0.4%~5%[8]。在消化道出血患者的饮食管理中,传统的观念认为禁食可提高胃内pH值、稳定血栓和降低再出血风险[12],且不会妨碍必要时的内镜诊疗或手术,而被作为治疗的必须,因此大部分临床医生习惯于对消化道出血患者开具绝对禁食48~72 h的医嘱。但研究发现,使用抑酸剂的患者,胃酸分泌几乎不受进食的影响[13]。同样,进食也不会使内镜诊疗复杂化或显著增加诊疗风险[14]。随着对消化道出血的病理生理学和治疗策略理解的提高,加之近年的研究多不支持严格禁食而提倡早期肠内营养,因而临床医生对消化道出血患者饮食管理的传统观念也在逐渐改变,但儿童相关研究尚少。
本研究探讨了禁食时间对消化道大出血患儿再出血的影响。在不同的研究中,再出血率差异很大(2%~54%)[15,16,17]。本研究中再出血率为21.4%,各禁食组间再出血率差异无统计学意义。大部分再出血患儿出血量少,经过暂禁食或继续进食出血可自行好转。5例(1.9%)患儿再次发生了消化道大出血,其中禁食~48 h组和~72 h组各1例,>72 h组3例,因发生再次大出血患儿例数少,且基础情况各异,故尚不能判断禁食时间与再次大出血发生的相关性。57例再出血患儿中,25例(43.9%)未明确病因,在明确病因的病例中梅克尔憩室是导致再出血最常见的原因,其次是消化性溃疡病、食管胃底静脉曲张及过敏性紫癜。本研究中未明确病因者124例,占比较大(46.6%),考虑因涉及10年的病例,既往的诊断手段尚有不足,加上一些患儿及家长对侵入性检查的依从性较差,导致较多患儿住院期间未能查明病因。本研究还显示,与禁食<24 h相比,禁食>72 h患儿住院时间延长。1项Meta分析纳入成人消化道出血5项RCT(n=313)[17],结果显示,与延迟肠内营养相比,24 h内早期肠内营养不会导致再出血增加,可缩短住院时间,与本研究结果相似。有研究显示[15],70例食管胃底静脉曲张的肝硬化患者随机分为早期喂养(4 h)和延迟喂养组(48 h),发现在对食管胃底静脉曲张出血成功止血后,2组再出血率无明显差异。也有研究显示,90例急性食管静脉曲张出血患者,早期喂养组在内镜治疗后48 h内开始流质饮食,而延迟喂养组在此期间继续禁食,2组止血率均为100%,前5 d内均未发生再出血[18]。根据Forrest分级高危溃疡的218例接受内镜止血的患者随机分为干预后24 h或48 h恢复进食,7 d内再出血率差异无统计学意义[16]。说明无论是成人或是儿童,即使是存在再出血高风险,在有效止血后可早期进食,延长禁食时间并没有使患者从中获益。
既往报告[14,19,20]消化道出血后禁食时间延长会增加院内感染发生率,可能与住院时间相应延长导致院内感染发生的风险增加有关,也可能与禁食导致患者免疫力下降相关。本研究中发生院内感染者14例(5.3%),其中禁食>72 h组6例(2.3%),发生率高于其他组,但差异无统计学意义,可能与研究对象为儿童及高度重视院内感染防控有关,也可能因例数少导致数值不稳定。本研究仅1例因严重脓毒症、内环境紊乱,呼吸循环衰竭而死亡,无与消化道大出血直接相关的死亡病例,低于文献报告的儿童消化道出血病死率(2.07%)[21],与本研究排除了危重症并发消化道出血、濒死前消化道出血病例有关,也是诊疗技术不断提高及多学科协作管理降低了该类疾病病死率的结果。
关于消化道出血开放饮食时膳食选择的研究很少。在临床实践中,消化道出血后恢复进食多选择流质或半流质饮食,逐渐过渡到正常饮食。英国肠胃病学会内镜委员会指南建议,上消化道出血患者,无论是否接受内镜下治疗,若血流动力学稳定,均可在内镜诊疗4~6 h后进流质饮食[22]。有研究[19]将接受结扎术治疗的活动性食管静脉曲张破裂出血患者(n=101)随机分为两组,早期喂养组在结扎术后1 h进流质饮食,4 h后恢复到常规固体饮食;延迟喂养组术后24 h给予流质饮食,48 h后进软食,72 h恢复到常规固体饮食;与延迟进食相比,早期常规固体饮食是安全的,且能更好地给予营养支持。本研究纳入的266例患儿中,采用流质、半流质饮食作为初始食物选择的分别为246例、20例,92.5%的患儿选择了流质饮食作为初始食物。鉴于儿童与成人在病理生理及对营养的需求等方面均存在差异,本研究进一步将初始食物按主要营养成分进行分组,即碳水化合物饮食、蛋白质饮食和混合饮食组,3组间再出血率差异无统计学意义,而混合饮食组患儿住院时间缩短。
进食后不良反应发生率为20.6%,不良反应以腹泻最多见,其次是腹痛及呕吐,仅有1例过敏性紫癜患儿进食后腹痛剧烈而暂停饮食,余病例均不影响继续进食,提示进食后不良反应多可耐受,对恢复饮食影响不大。本研究显示3组间进食后不良反应发生率差异无统计学意义,提示对于消化道大出血患儿,碳水化合物+蛋白质混合的食物因可提供更全面的营养而更有利于缩短住院时间,且不增加再出血率及进食后不良反应发生率,可作为初始食物选择。
本研究中肠外营养的使用率为63.9%,考虑与消化道大出血患儿病情较重、禁食及开放饮食初期进食不足而容易出现内环境紊乱有关,且儿童营养需求高于成人,故较多患儿给予了部分肠外营养支持。
本研究局限性:①回顾性资料数据的系统完整性会受到一定的限制,如缺乏食物量的数据,导致无法计算热卡而未能进行目标能量的估算;②未明确病因的病例占比较大,导致病因分析受到一定限制;③仅探讨了住院期间禁食时间及食物选择对消化道大出血患儿临床结局的影响。
