L-茶氨酸与表没食子儿茶素没食子酸酯预防肥胖及高胆固醇血症的协同调节作用
2022-02-11刘宝贵陈致印张杨玲刘恩硕韩淑敏肖文军
刘宝贵,陈致印,张杨玲,刘恩硕,韩淑敏,肖文军
(湖南农业大学 茶学教育部重点实验室,国家植物功能成分利用工程技术研究中心,植物功能成分利用省部共建协同创新中心,湖南长沙 410128)
肥胖是全世界公认的一个重要的健康问题,会引发心血管疾病、2型糖尿病、高血压、高脂血症等相关代谢综合征[1]。传统的治疗药物多为化学合成,不仅存在一定的毒副作用,而且难以从根本上有效预防肥胖及并发症[2]。开发利用天然、安全、有效的辅助降脂减肥的营养干预产品将是防治肥胖以及高脂血症的重要发展方向。
绿茶是广受欢迎的天然饮品,含有茶多酚(儿茶素)、L-茶氨酸(L-theanine,LTA)、生物碱等多种生物活性成分,具有改善肥胖、糖尿病、高血压、血脂异常和心血管疾病等多种健康功效[3]。其提取物在多项研究中均表现出降脂减肥的功效[4],在人体实验中也得到证实[5-6]。绿茶中的L-茶氨酸能显著抑制小鼠体重增加和脂肪积累并降低血液中甘油三酯(Triglyceride,TG)和游离脂肪酸(Free fatty acids,FAA)的浓度[7-9],同时可通过下调大鼠肠道与脂肪酸转运相关载体的表达,抑制脂肪的合成[10]。表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)是绿茶中含量最多的儿茶素,具有独特的药理特性,包括抗氧化、抗炎、抗癌、抗肥胖等作用[11],能够抑制小鼠体重的增加和肠道脂质的吸收,促进脂质的排泄[12],并增强与脂肪酸氧化[13]和褐色脂肪(Brown fat,BAT)产热[14]有关的基因表达,促进脂肪氧化和BAT产热,增加机体能量消耗,以达到减肥的效用。同时,EGCG和L-茶氨酸已经被报道在调节机体营养代谢上存在协同作用[15],刘晓慧等[16]的研究也发现EGCG和L-茶氨酸在修复细胞氧化损伤方面存在协同增效的作用。此外,还发现EGCG和L-茶氨酸在调节机体脂代谢的分子机制上存在相似性和差异性[17-18],在调节机体脂质代谢方面存在协同增效的物质基础,但目前EGCG和L-茶氨酸协同干预的实证研究较少。
为此,本研究以成功造模肥胖及高胆固醇血症大鼠的高脂饲料为基础,以L-茶氨酸、EGCG以及茶鲜叶中EGCG与L-茶氨酸的天然质量比(约为5:1)配制而成的EGCG+L-茶氨酸混合物为原料,连续灌喂高脂饮食SPF级SD大鼠56 d,比较研究了L-茶氨酸及EGCG在预防肥胖及高胆固醇血症方面的协同调节作用,为促进食品营养干预多元化发展及茶叶功能成分利用提供科学依据。
1 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 48只,4周龄,体重(170±10)g,由湖南斯莱克景达实验动物有限公司提供,试验动物生产许可证号:SCXK(湘)2019-0004;高脂饲料(High-fat diet,HFD)和正常饲料(Normal diet,ND) 江苏南通特洛菲饲料有限公司,其中高脂饲料(编号23300)提供5.1 Kcal/g能量,正常饲料(编号23302)提供3.6 Kcal/g能量,主要成分包括玉米淀粉、豆油、蔗糖、纤维素等,营养成分如表1所示;EGCG(纯度≥98%)、L-茶氨酸(纯度≥98%) 湖南省三福生物科技公司;辛伐他汀(Simvastatin,Sim)美国Abmole公司;甘油三酯(TG)、总胆固醇(TC)、总超氧化物歧化酶(T-SOD)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、丙二醛(MDA)、谷胱甘肽(GSH-PX)、过氧化氢酶(CAT)等试剂盒 南京建成生物工程研究所;ELISA试剂盒瘦素(LEP)、磷脂(PL)、载脂蛋白A1(Apo-A1)、载脂蛋白B100(Apo-B100) 上海茁彩生物科技有限公司。
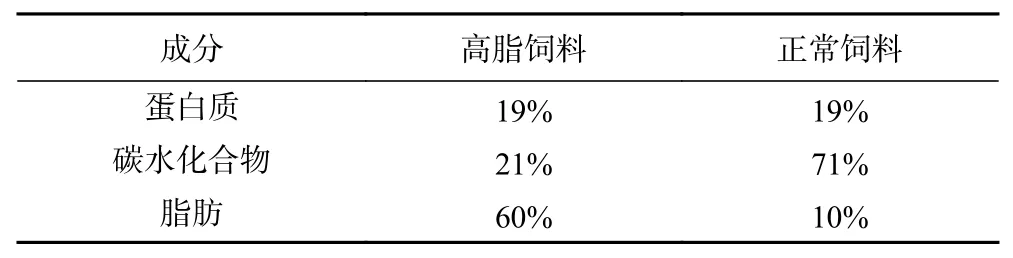
表1 高脂饲料和正常饲料营养成分Table 1 Nutrient composition of high-fat diet and normal diet
Varioskan flash多功能酶标仪、F1-Clop Tip移液枪、PowerGen125高速匀浆机 美国Thermo公司;MIKRO 22R冷冻离心机 德国Hettich公司;病理切片机 上海徕卡仪器有限公司;M2104电子天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 动物分组及处理 所有动物实验方案经湖南农业大学动物实验中心批准并符合动物伦理规范。所有大鼠按实验设计进行处理(表2):将48只SPF级SD大鼠在(25±2)°C条件下适应性饲养一周后,称取体重,随机分为6组(n=8):正常饮食组(ND)及高脂饮食组(HFD)灌胃等量超纯水,辛伐他汀对照组(Sim)灌胃5 mg·kg-1·d-1辛伐他汀,L-茶氨酸干预组(L)灌胃100 mg·kg-1·d-1L-茶氨酸,EGCG干预组(E)灌胃100 mg·kg-1·d-1EGCG,L-茶氨酸+EGCG联 合 干 预 组(LE)灌 胃83.3 mg·kg-1·d-1EGCG+16.7 mg·kg-1·d-1L-茶氨酸,所有剂量设置通过换算并参考自现有的研究[15,17,19],其中辛伐他汀的灌胃剂量采用在人中服用的剂量为准(官方指定的使用剂量)。灌胃体积根据每日体重变化而变化,灌胃浓度固定。

表2 动物实验分组Table 2 Animal experiment grouping
每天灌胃、称重并记录体重和摄食量,为期8周,造模时间、方法及评价标准参考已有研究[20-22],实验结束后禁食12~16 h,每只大鼠注射2%戊巴比妥钠麻醉,主动脉取血。收集各组大鼠脂肪、器官(心脏、肝脏、脾脏、肺、肾脏)和肠道,-80 °C保存。
肥胖及高胆固醇血症模型的建立依据。大鼠肥胖的判别标准:经高脂饲料喂养,大鼠体质量超过普通饲料喂养大鼠体质量的20%作为实验性肥胖大鼠[21]。高脂血症则是以高脂饲料喂养,大鼠血脂显著高于普通饲料喂养的大鼠作为判别依据,根据不同的指标变化有不同的分类,常见的主要分为高甘油三酯血症、高胆固醇血症以及混合双高型(高甘油三酯和高胆固醇)血症[22]。
1.2.2 体重、Lee’s指数测定 每天称量一次体重,观测各组体重增长规律,并根据初始体重W1和最终体重W2计算体重增量,并在最后一次灌胃前测量大鼠体重(g)与体长(cm),根据公式计算李氏指数:

1.2.3 摄食量和食物利用率 测定各组大鼠每日定量添加(120±2)g日粮,定时回收并称量当日剩余日粮,计算食物摄入,通过饲养阶段大鼠的饲料消耗量及其体重增长量来计算食物利用率:
食物利用率(%)=每日体重增长量/每日摄食量×100
1.2.4 脂肪积累相关指标的测定 解剖后称取腹腔和附睾白色脂肪组织以及肩胛骨处的棕色脂肪称重,并计算相关脂肪系数;同时,称取心、肝、脾、肺、肾重量,并计算器官总重量及器官指数和肝脏系数:
脂肪系数(%)=(附睾脂肪质量+腹腔脂肪质量)/体质量×100

1.2.5 血清生化指标检测 主动脉取血于EP管中,在4 °C下3500 r/min离心10 min,分离上层血清,放置-80 °C冰箱中保存。按照试剂盒说明书检测血清中TG、TC、LDL-C、HDL-C、PL、Apo-A1、Apo-B100的含量以及ALT、AST的活性。
1.2.6 肝脏TG和TC含量检测 准确称取冻存的肝脏组织重量,加入9倍体积的无水乙醇于冰水浴条件下机械研磨,制成10%的肝脏匀浆,4 °C下2500 r/min离心10 min后取上清液,试剂盒测定肝脏匀浆的TG、TC水平。
1.2.7 肝脏氧化还原状态检测 准确称取冻存的肝脏组织重量,加入9倍体积的生理盐水于冰水浴条件下机械研磨,离心(离心条件同上)后取上清液,试剂盒测定肝脏匀浆的MDA水平以及T-SOD、CAT、GSH-PX活性。
1.2.8 病理及组织学分析 取大鼠肝脏、肾周白色脂肪、背部褐色脂肪组织的相同部位于4%的多聚甲醛溶液中固定后,对肝脏进行HE染色,显微镜下观察组织病理学变化并拍照。
1.3 数据处理
切片图像应用CaseViewer软件分析;肾周脂肪切片脂肪细胞数目、截面积计算应用Image-J软件完成;实验数据采用SPSS26统计软件对数据进行分析处理,结果以平均值±标准差(Mean±SD)表示;方差分析采用ANOVA和LSD法检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 L-茶氨酸及EGCG对高脂饮食大鼠体重、Lee’s指数的影响
各组大鼠体重变化如图1(图1A,B)所示,高脂饮食诱导大鼠8周后,高脂肥胖模型(HFD)组大鼠体重显著高于正常饮食(ND)组(P<0.05),且高于ND组大鼠体重的21.2%,表明SD大鼠经过8周高脂饮食的诱导,会导致肥胖的形成,这与李秀平等[23]的研究结果一致。与HFD组相比,各干预组体重增长量均显著降低(P<0.05);其中与阳性药物对照组(Sim)相比,仅有EGCG+L-茶氨酸混合干预组(LE)体重增长量显著降低(P<0.05)。同时,LE组与ND组相比,无显著差异(P>0.05)。Lee’s指数主要反映机体脂肪占总体重的比例,该指数比单纯的体重值更能精确地反映机体的肥胖程度[24]。结果如图1C所示,在Lee’s指数中,与ND组相比,HFD组Lee’s指数显著提高(P<0.05)。与HFD组相比,各干预组Lee’s指数均显著降低(P<0.05),且各干预组间与ND组无显著差异(P>0.05)。这说明L-茶氨酸和EGCG的联合干预比L-茶氨酸或EGCG单独干预更能有效地预防长期高脂饮食大鼠体重的增加,降低Lee’s指数缓解肥胖的形成。

图1 L-茶氨酸及EGCG对高脂饮食大鼠体重、Lee’s指数的影响Fig.1 Effects of L-theanine and EGCG on body weight and Lee‘s index of rats on high-fat diet
2.2 L-茶氨酸及EGCG对高脂饮食大鼠摄食量和食物利用率的影响
大鼠在8周饲养过程中的摄食量变化情况如图2A所示,1~3周所有组大鼠摄食量均表现出下降的趋势,而3~8周摄食量则持续增长,其中1~3周摄食量表现出下降的趋势可能与灌胃对大鼠的刺激有关,而3~8周过程,大鼠逐渐适应灌胃和药物的刺激,且由于生长发育的需要,摄食量开始持续增加。同时,结合图2B来看,尽管各周各组大鼠日均摄食量都有浮动,且正常对照组(ND)组摄食量最高,但是各组大鼠之间摄食量并无显著差异,说明辛伐他汀、EGCG、L-茶氨酸及其混合物对大鼠摄食量没有显著影响。在食物利用率中(图2C),与ND组的正常饲料相比,HFD组的高脂饲料食物利用率显著提高(P<0.05);与HFD组相比,除Sim组外,各干预组均显著降低了高脂饲料的食物利用率(P<0.05);其中,在L组、E组、LE组中与Sim组相比,仅有LE组食物利用率显著降低(P<0.05)。这表明EGCG与L-茶氨酸联合干预在不影响摄食量的情况下降低高脂饮食大鼠的食物利用率,减少能量的摄入,进而缓解肥胖的形成。
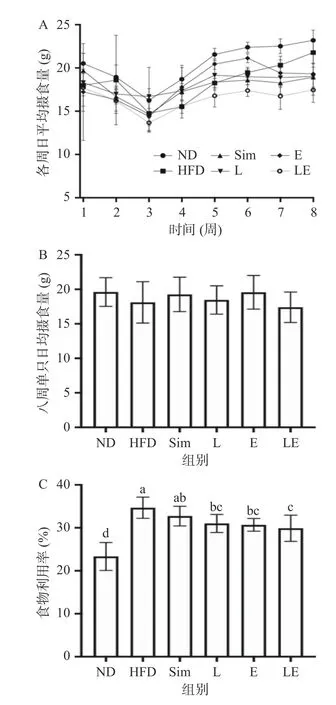
图2 L-茶氨酸及EGCG对高脂饮食大鼠摄食量及食物利用率的影响Fig.2 Effects of L-theanine and EGCG on food intake and food utilization of rats on high-fat diet
2.3 L-茶氨酸及EGCG对高脂饮食大鼠脂肪积累的影响
高脂饮食引起的肥胖往往伴随着脂肪的堆积,内脏脂肪过多的堆积会对机体各器官造成机械压力损伤,影响器官的正常功能[23]。在哺乳动物中,脂肪组织主要被分为三类:白色脂肪组织(WAT)、棕色脂肪组织(BAT)和米色脂肪组织[25]。其中,WAT是储能器官,主要由白色脂肪细胞构成包括腹腔脂肪与附睾脂肪等,可将体内多余的能量以三酰甘油(TG)的形式储存,而BAT主要参与体温调节和能量代谢,通过加快脂肪氧化来促进机体能量消耗[26]。如表3所示,与ND组相比,HFD组以及各干预大鼠的棕色脂肪质量以及系数均有提高,其中,仅有LE组显著提高(P<0.05)。与ND组相比,HFD组腹腔脂肪、附睾脂肪及总白色脂肪组织质量及系数均显著提高(P<0.05),说明长期高脂饮食造成了脂肪的囤积。在腹腔脂肪质量和系数中,与HFD组相比,仅有Sim组和LE组显著降低(P<0.05);在附睾脂肪质量和系数中,与HFD组相比,仅有E组和LE组显著降低(P<0.05),这与LI等[19]的研究一致。在总脂肪及其系数中,与HFD组相比,只有E组、LE组著降低(P<0.05),且LE组更接近ND组(P>0.05)。

表3 L-茶氨酸及EGCG对高脂饮食大鼠脂肪积累的影响Table 3 Effects of L-theanine and EGCG on fat accumulation of rats on high-fat diet
此外,脂肪的积累不仅表现在脂肪组织上,脂质还会沉积在体内各器官,影响其功能的发挥。如表4所示,记录了各器官的质量及相关系数,表中数据显示,与ND组相比,长期高脂饮食的各干预组在心脏、脾脏、肾脏质量上没有显著差异(P>0.05),这说明长期高脂饮食导致的脂质沉积主要发生在肝脏和肺部位。与ND组相比,HFD组的肺质量、肝脏质量及其系数和器官总质量及其指数均显著高于ND组(P<0.05);与HFD组相比,各干预组均显著降低了肝脏系数和器官总质量及其指数(P<0.05);在肺质量中,仅有Sim组和L组显著降低(P<0.05),其余干预组无显著差异(P>0.05);在肝脏质量中,仅有LE组显著降低(P<0.05);在肝脏系数和器官总质量及其指数中,只有LE组与ND组无显著差异(P>0.05)。由此说明,EGCG+L-茶氨酸的联合干预比单独干预更能有效预防长期高脂饮食大鼠脂肪的积累和器官脂质的沉积。
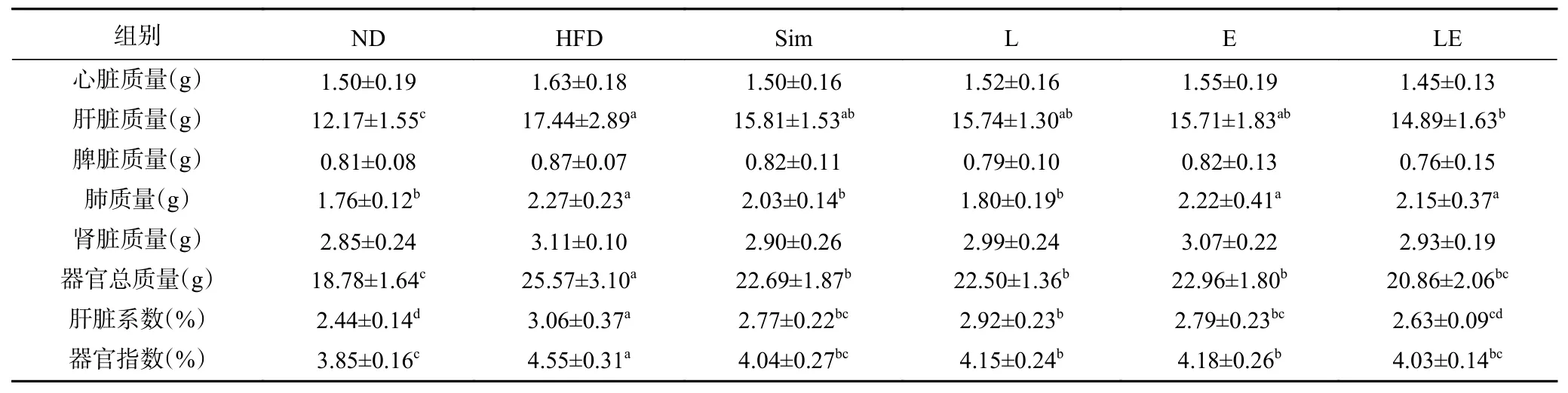
表4 L-茶氨酸及EGCG对高脂饮食大鼠内脏器官脂质蓄积的影响Table 4 Effects of L-theanine and EGCG on lipid accumulation in visceral organs of rats on high-fat diet
2.4 L-茶氨酸及EGCG对高脂饮食大鼠血脂和肝损伤的影响
在本文中血脂指标包括:总胆固醇(TC)、磷脂(PL)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(Apo-A1)、载脂蛋白B100(Apo-B100),其中Apo-A1、Apo-B100及其比值Apo-B100/Apo-A1是预测心血管疾病发生风险的重要指标,二者比值越高心血管疾病的发生风险越高[27]。其次,由于脂质在肝脏的大量积聚,会引发肝损伤,从而造成血清谷丙转氨酶(ALT)和谷草转氨酶(AST)升高。结果如图3(图3,A-I)所示,与ND组相比,HFD组血清TC、PL、LDL-C、Apo-B100、ALT、AST水平均显著升高(P<0.05),HDL-C、Apo-A1显著降低(P<0.05)。这表明肥胖模型大鼠出现严重的高胆固醇血症和肝损伤,并显著增加了心血管疾病的发病风险[27](P<0.05)(图3,E-G)。各组干预后,与HFD组相比,除L组外,各干预组组血清TC、PL、LDL-C、Apo-B100、Apo-B100/Apo-A1、ALT的水平显著降低(P<0.05),HDL-C、Apo-A1含量显著提高(P<0.05);同时LE组在降低Apo-B100、Apo-B100/Apo-A1中的效果显著优于E组(P<0.05),而在TC、PL、LDL-C、ALT上则无显著差异(P>0.05);L组仅显著降低血清LDL-C、Apo-B100、Apo-B100/Apo-A1水平(P<0.05),TC、PL、ALT仍处于较高水平。说明L-茶氨酸和EGCG联合干预比单独干预更能有效地预防长期高脂饮食所导致的高胆固醇血症,降低心血管疾病的发生风险,还能缓解部分长期高脂饮食造成的肝损伤。
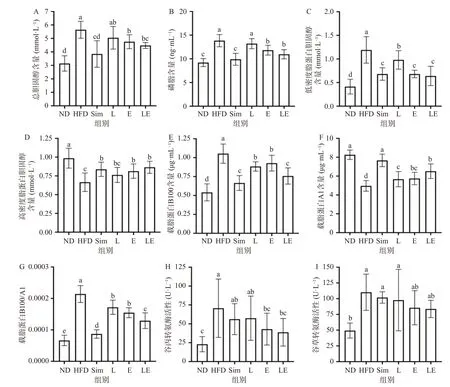
图3 L-茶氨酸及EGCG对高脂饮食大鼠血脂和肝损伤的影响Fig.3 Effects of L-theanine and EGCG on blood lipids and liver injury of rats on high-fat diet
2.5 L-茶氨酸及EGCG对高脂饮食大鼠肝脏TC、TG含量的影响
不同干预组对大鼠肝脏TC、TG含量的影响如图4所示。在TC中,除L组外,各干预组均能显著降低肝脏TC的沉积(P<0.05);同时与L组相比,E组无显著差异(P>0.05),而Sim组和LE组肝脏TC含量水平则显著降低(P<0.05)。在TG中,只有E组、LE组显著降低肝脏TG的沉积(P<0.05)。与Sim组相比,只有LE组肝脏TG含量水平显著降低(P<0.05)。上述结果表明,EGCG+L-茶氨酸联合干预比单独干预更能有效地改善肥胖及高胆固醇血症模型大鼠肝脏TC、TG的沉积。
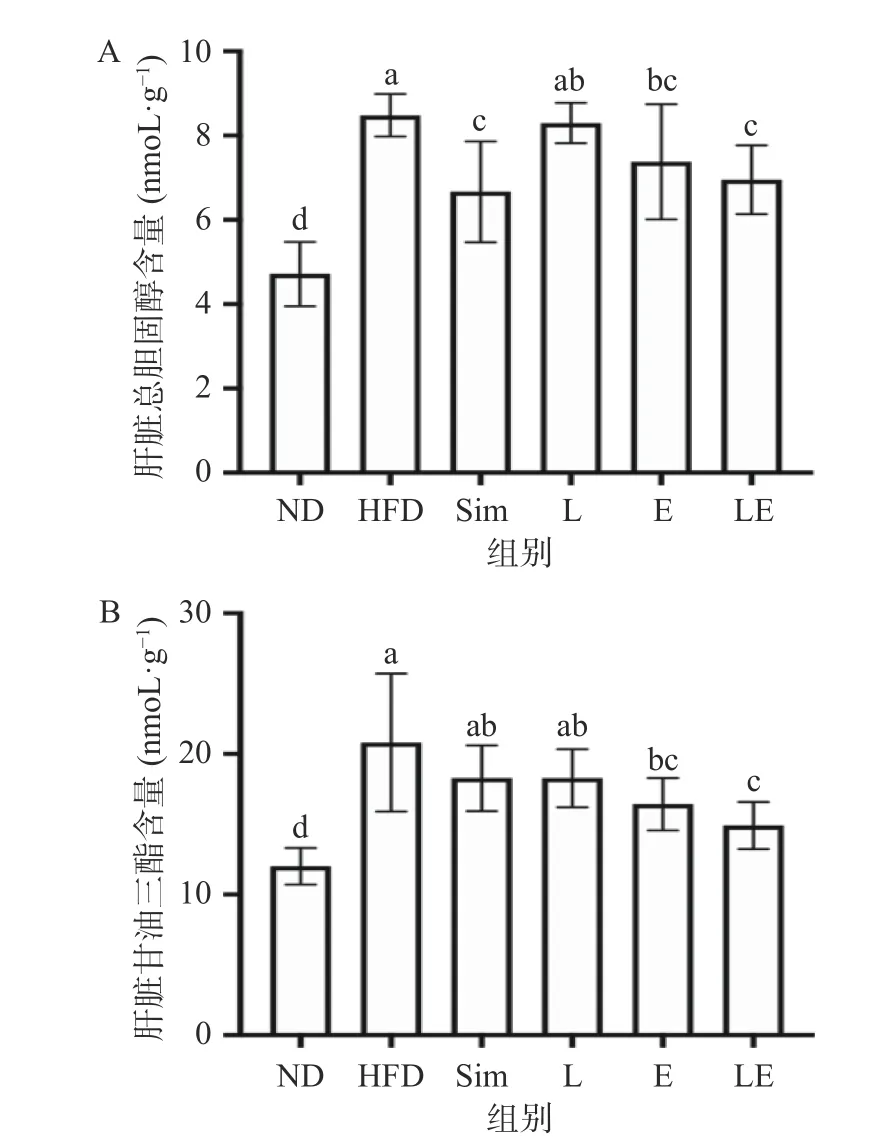
图4 L-茶氨酸及EGCG对高脂饮食大鼠肝脏TC、TG的影响Fig.4 Effects of L-theanine and EGCG on hepatic TC and TG of rats on high-fat diet
2.6 L-茶氨酸及EGCG对高脂饮食大鼠肝脏氧化还原状态的影响
如图5表明,HFD组肝脏氧化还原相关指标(MDA含量和CAT、T-SOD、GSH-PX活性)失衡程度均显著大于ND组(P<0.05)。与HFD组相比,Sim、E、LE组肝脏MDA含量显著降低(P<0.05),且与E组相比,LE组与Sim或ND组已无显著差异(P>0.05)。与ND组相比,Sim、E、LE组GSH-PX活性已无显著差异(P>0.05)。同时在所有的干预组中,只有LE组显著升高了CAT的活性(P<0.05);而在T-SOD中,所有干预组仍处于较低水平。这表明L-茶氨酸+EGCG联合干预比单独干预更能有效缓解长期高脂饮食大鼠肝脏氧化还原的失衡程度。

图5 L-茶氨酸及EGCG对高脂饮食大鼠肝脏氧化还原状态的影响Fig.5 Effects of L-theanine and EGCG on the hepatic redox status of rats on high-fat diet
2.7 L-茶氨酸及EGCG对高脂饮食大鼠肝脏和脂肪组织形态结构的影响
由图6(图6,A和B)可以看出,ND组大鼠肝组织结构完整,肝小叶结构清晰,肝索排列整齐有序,肝细胞形态大小正常,且无变性坏死,几乎未出现脂滴,肝脏外观呈现鲜红色;与ND组比较,HFD组小鼠肝组织中肝小叶结构不清晰,肝索解离,肝窦消失,肝细胞肿胀且体积较明显增大,细胞核被挤向周边,细胞内充满了大小、数量不等的脂滴小空泡,肝脏脂肪变性较严重,导致肝脏外观呈现乳红色。与HFD组比较,Sim组、L组肝脏细胞内脂滴数量虽然明显减少,但仍含有较多脂滴,整个肝脏外观与HFD组相比依然肿胀,其中Sim组肝脏脂滴数量较L组明显减少;与Sim组、L组相比,E、LE组肝脏的肿胀程度与脂肪变性程度明显减轻,脂滴小空泡明显减少,肝脏颜色也部分恢复红色,且LE组脂滴较E组明显减少,比较接近ND组。

图6 L-茶氨酸及EGCG对高脂饮食大鼠肝脏和脂肪组织形态结构的影响Fig.6 Effects of L-theanine and EGCG on the morphological structure of liver and adipose tissue of rats on high-fat diet
各组大鼠脂肪组织的切片如图6(图6,C、D和E)所示。ND组脂肪细胞体积较小,大小均一,形态清晰,结构完整;与ND组相比,HFD组脂肪细胞体积明显增大,细胞大小不均匀,排列不规则;相同视野范围内,HFD组脂肪细胞数量较ND组明显减少,脂肪细胞体积较ND组明显增大,说明高脂饮食诱导可以增加脂肪细胞体积和细胞内脂质含量;与HFD组相比,Sim组、L组、E组和LE组大鼠脂肪细胞都有不同程度的变小,仅有少数脂肪细胞肥大,相同视野范围内的脂肪细胞数量明显增多;其中L组脂肪细胞体积较Sim组仍旧较大,E组和LE组脂肪细胞体积比较相近且均小于Sim组,同时LE组脂肪细胞体积小于E组。这说明EGCG+L-茶氨酸能有效降低肥胖模型大鼠脂肪细胞大小,减少脂滴在脂肪细胞的积聚。
3 讨论与结论
本研究表明EGCG和L-茶氨酸联合应用能有效预防长期高脂饮食所造成的肥胖及高胆固醇血症。一方面,L-茶氨酸和EGCG在预防长期高脂饮食大鼠所导致的肥胖上均表现出积极作用,且与单独使用EGCG或L-茶氨酸的干预组相比,EGCG和L-茶氨酸联合干预有效降低了大鼠体重、腹腔脂肪质量、器官指数;同时,EGCG和L-茶氨酸联合干预组有效的降低了受试大鼠的食物利用率,促进白色脂肪褐变,从而加快机体的能量消耗,降低了皮下脂肪以及各器官中脂质的蓄积,缓解了肥胖的发生[19]。另一方面,L-茶氨酸和EGCG干预组在降低血脂,缓解肝脏抗氧化失衡方面也显示了积极作用,与单独使用EGCG或L-茶氨酸的干预组相比,EGCG和L-茶氨酸联合干预还有效降低血脂、肝脂及肝脏MDA含量,同时提高肝脏CAT的活性。此外,病理切片显示长期高脂饮食所导致的肥胖大鼠脂肪组织(肾周白色脂肪组织、背部褐色脂肪组织)和肝脏脂质大量积聚,而EGCG+L-茶氨酸联合干预组明显改善。说明L-茶氨酸和EGCG对长期高脂饮食导致的肝脏受损具有一定的预防作用,且L-茶氨酸+EGCG联合干预比单独干预组表现出更好的效果。这表明L-茶氨酸对EGCG修复肝脏氧化损伤有一定的协同作用,该结果与刘晓慧等[16]的研究结果一致,推测EGCG+L-茶氨酸联合干预通过保护肝脏、改善脂质代谢、缓解氧化应激,从而有效地预防长期高脂饮食所导致的高脂血症或血脂异常的发生。
此外,EGCG与L-茶氨酸在机体脂质代谢方面存在的协同作用可能与剂量和配比有关,错误的剂量和配比可能不会产生协同作用,这在另一项研究中也被重点强调[28]。本研究选择的是在茶鲜叶中EGCG与L-茶氨酸的天然质量比(约为5:1)的配比[29],EGCG的剂量参考之前的研究,选择100 mg/kg·d-1的安全剂量[19,28]。在此前研究中,EGCG与L-茶氨酸的联合干预已被证实在调节机体营养代谢方面存在协同作用[15]。而L-茶氨酸与EGCG之间的这种协同作用可能因为L-茶氨酸可以改变其他成分在细胞中的浓度,进而间接影响药物的作用[30-31]。还有研究称L-茶氨酸与其他化合物同时作用时,细胞内某些基因会发生改变,这或许也是联合干预效果优于单独干预的原因之一[32]。此外,EGCG与L-茶氨酸之间可能存在一些相互作用,这些相互作用可能改变了EGCG的结构、性能以及利用率等[16]。
综上所述,L-茶氨酸+EGCG联合干预可以有效地预防长期高脂饮食造成的肥胖以及高胆固醇血症的发生。并有可能通过以下三种机制发挥作用:其一,能量消耗和摄入之间的不平衡是导致肥胖发生的根本因素,L-茶氨酸与EGCG的联合干预表现出比单独干预组更低的食物利用率,减少了能量的摄入,同时褐色脂肪组织的增多也增加了机体能量消耗,从而有效地控制肥胖的形成[1];其二,L-茶氨酸和EGCG可能通过调节与脂肪合成与分解相关的酶和蛋白[33],抑制脂肪的合成,促进脂肪的分解[17-18],改善肝脏脂质代谢紊乱,减少肝脏的脂质沉积,从而缓解肥胖并预防高脂血症的发生;其三,由于EGCG和L-茶氨酸之间的相互作用,可能导致其二者在调节机体脂质代谢方面存在协同增效的作用[16],但具体作用效果还需进一步进行研究证实。
