金花茶花总黄酮双水相提取工艺优化及其抗氧化活性分析
2022-02-11徐嘉鸿刘美美戚滇杰许晓路ZHYLKOViachaslau
徐嘉鸿,刘美美,戚滇杰,俞 杰, ,许晓路,ZHYLKO Viachaslau
(1.浙江树人大学生物与环境工程学院,浙江杭州310015;2.白俄罗斯国立大学国际萨哈罗夫环境研究所,明斯克220070)
金花茶组植物(Camelliasect.Chrysantha) 是山茶科(Theaceae) 山茶属(Camellia)植物,常绿灌木或小乔木[1]。金花茶花是茶花家族中唯一花瓣金黄色的珍稀物种,且花中含有黄酮、茶多酚、茶多糖、皂苷、茶氨酸等活性成分[2],在山茶类群中享有“植物界大熊猫”、“茶族皇后”之美誉。
植物体中的黄酮具有抗肿瘤、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抗辐射等多种药理作用[3-7],工业应用前景广阔。关于金花茶花黄酮化合物的提取已有初步研究,然而,现有方法主要是基于乙醇或乙醇/水体系进行的传统溶液提取[8-9],且相应研究报道较少。双水相提取技术是一种新型的萃取分离技术,根据物质在互不相溶两相间溶解性的差异,实现目标成分的萃取和分离,被广泛用于生物化学产品的分离纯化[10-11]。与传统方法相比,双水相提取技术具有操作条件温和、易于工业放大、成本低、过程连续化等优点。目前,双水相体系已经有效应用于黄酮类化合物[12-14]的提取。但双水相体系在金花茶花总黄酮中的提取应用尚未见公开报道。
综上,本研究采用PEG/(NH4)2SO4双水相体系,在室温(25 ℃)下以超声波辅助提取金花茶花总黄酮,以黄酮的萃取率为指标,考察PEG相对分子量、乙醇浓度、PEG质量分数、硫酸铵质量分数、超声时间等因素的影响,采用正交试验进行工艺优化探索,并研究黄酮提取物的抗氧化活性,以期为金花茶的深度开发和综合利用提供科学依据。
1 材料与方法
1.1 材料与仪器
金花茶花 购自广西防城港;芦丁(95%)、槲皮素(98.5%)、山奈酚(97%)等标准品 阿拉丁试剂(上海)有限公司;PEG平均相对分子质量分别为600、1000、1500、2000 国药集团化学试剂有限公司;乙腈 色谱纯,美国TEDIA试剂有限公司;无水乙醇、硫酸铵、硝酸铝、亚硝酸钠、氢氧化钠、磷酸、1,1-二苯基-2-三硝基苯肼(DPPH)、七水合硫酸亚铁、水杨酸、抗坏血酸(Vc)等试剂 分析纯,均购自国药集团化学试剂有限公司;双氧水(30%质量浓度) 上海凌峰化学试剂有限公司;去离子水 为实验室自制。
L6S紫外分光光度计 上海精密科学仪器有限公司;电子分析天平CPA225D分析天平 德国赛多利斯集团公司;DF-101S集热式恒温加热磁力搅拌器 杭州慧创仪器设备有限公司;SK2200H超声波清洗器 上海科导超声仪器有限公司;TDZ5-WS型离心机 长沙湘锐离心机有限公司;DZF型真空干燥箱 上海精宏实验设备有限公司;P230II型高效液相色谱仪 大连依利特分析仪器有限公司。
1.2 实验方法
1.2.1 PEG/(NH4)2SO4双水相体系相图制作 在25 ℃下,用Albertson浊点法[15]测定并制作由PEG 600、PEGl000、PEG1500、PEG2000和(NH4)2SO4溶液所形成的相图。
称取3.5 g PEG600配制成质量分数为35%的溶液,定量滴加40%的(NH4)2SO4溶液至混合溶液出现浑浊状态,记录滴入的硫酸铵质量,加水使体系重新变为澄清状态,记录加入水的质量,然后计算出此时(NH4)2SO4和PEG600在体系中的质量分数,即得相图中一个点。不断重复上述操作,以(NH4)2SO4的质量分数为横坐标,PEG600的质量分数为纵坐标作图,即可得到PEG600/(NH4)2SO4双节线图。
按照上述操作,分别测定并得到PEGl000、PEG1500、PEG2000和(NH4)2SO4的双节线图。
1.2.2 PEG/(NH4)2SO4双水相提取金花茶花总黄酮
1.2.2.1 原料预处理 将金花茶花置于60 ℃真空干燥箱恒温脱水干燥3 h,粉碎制成粉末,密封装于自封袋中低温保存备用。
1.2.2.2 金花茶花总黄酮提取工艺 PEG/(NH4)2SO4双水相提取金花茶花总黄酮提取工艺如下[14,16]:称取0.50 g经预处理后的金花茶花粉末于50 mL锥形瓶中,加入80%乙醇25 mL,超声(200 W)30 min,离心(1500 r/min,15 min)分离得粗提液。固定双水相体系总质量为10 g,在10 mL离心管中加入一定量的PEG和(NH4)2SO4,加入乙醇粗提液2 mL,然后加水至10 g。摇匀,离心(1500 r/min,15 min),静置使两相分离。分别测定上下相的体积及上下相中的黄酮含量。
1.2.3 单因素实验 PEG相对分子质量对总黄酮分配行为的影响:在PEG质量分数为15%,(NH4)2SO4质量分数为20%,乙醇浓度80%,超声时间30 min条件下,分别设置PEG相对分子质量为600、1000、1500、2000,测定金花茶花总黄酮的分配系数K和萃取率Y。
乙醇浓度对总黄酮分配行为的影响:在PEG 600质量分数15%,(NH4)2SO4质量分数20%,超声时间30 min的条件下,分别设定乙醇浓度为0%、20%、40%、60%、80%、100%,测定金花茶花总黄酮的分配系数K和萃取率Y。
PEG600质量分数对总黄酮分配行为的影响:在(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min的条件下,分别设置PEG600质量分数为12%、15%、18%、21%,测定金花茶花总黄酮的分配系数K和萃取率Y。
(NH4)2SO4质量分数对总黄酮分配行为的影响:在PEG600质量分数18%,乙醇浓度80%,超声时间30 min的条件下,分别设置(NH4)2SO4质量分数为14%、16%、18%、20%,22%,测定金花茶花总黄酮的分配系数K和萃取率Y。
超声时间对总黄酮分配行为的影响:在PEG600质量分数18%,(NH4)2SO4质量分数20%,乙醇浓度80%的条件下,分别设置超声时间为0、15、30、45 min,测定金花茶花总黄酮的分配系数K和萃取率Y。
1.2.4 正交试验 在单因素实验基础上,选取PEG600质量分数、(NH4)2SO4质量分数、乙醇浓度、超声时间四因素三水平[L9(34)]进行正交试验,以金花茶花总黄酮的萃取率为指标,优选出最佳提取条件。正交试验的因素和水平设计如表1所示。
1.2.5 金花茶花总黄酮含量测定 实验采用NaNO2-Al(NO3)3-NaOH显色法测定总黄酮含量[17]。取芦丁标准品溶液和金花茶花提取液,以乙醇溶液为空白对照,紫外分光光度计在200~700 nm 波长范围内进行扫描,实验结果显示,芦丁标准品和金花茶花提取液在510 nm 波长下均有最大吸收,结合文献报道,确定选用510 nm 为检测波长。
芦丁标准曲线绘制:称取5 mg芦丁于50 mL容量瓶中,加无水乙醇至溶解后,用60%浓度的乙醇定容至刻度,摇匀后,得到质量浓度为0.1 mg/mL的芦丁标准溶液。取6只标记好的10 mL容量瓶分别加入0、1、2、3、4、5 mL芦丁标准溶液,加水至5 mL,加入5%浓度的NaNO2溶液0.3 mL,摇匀后静置5 min,加入10%浓度的Al(NO3)3·9H2O溶液 0.3 mL,摇匀后静置6 min,再加入4%浓度的NaOH溶液2 mL,加水稀释至刻度线,摇匀后静置10 min。以第一管为对照组在510 nm处测定吸光度值。以浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
按上述芦丁标准曲线绘制中的方法,以稀释后的金花茶花提取液代替芦丁标准溶液,测定其吸光度。按照(1)~(3)式计算金花茶花总黄酮的分配系数(K)和萃取率(Y),按照(4)式计算金花茶花总黄酮得率。

式中,R是双水相体系中上、下相的体积比;V1是双水相体系中上相的体积,mL;V2是双水相体系中下相的体积,mL;K为双水相体系的分配系数;C1是双水相体系中上相所含的黄酮浓度,mg/mL;C2是双水相体系中下相所含黄酮浓度,mg/mL;Y为双水相体系中金花茶花总黄酮的萃取率,%;n为稀释倍数;M为金花茶花粉的质量,mg。
1.2.6 HPLC分析 采用HPLC法对金花茶花提取物中的芦丁、槲皮素和山奈酚等三个黄酮化合物进行定性定量分析。
制样:精密称取适量芦丁、槲皮素和山奈酚标准样品,分别配制成浓度为0.306、0.256、0.258 mg/mL的乙醇溶液,按体积比为1:1:1混合后,得到芦丁、槲皮素和山奈酚浓度分别为0.102、0.085、0.086 mg/mL的混标溶液;按照1.2.4的方法所选出的优化条件,制备金花茶花黄酮提取物,加无水乙醇稀释,过0.22 μm滤膜后,得到待测样品溶液。
色谱条件[18]:Hypersil ODS2 C18 色谱柱(4.6 mm×200 mm, 5 μm);流动相(A)为0.2%磷酸溶液,流动相(B)为乙腈;梯度洗脱(0~5 min,20%~22%B;5~10 min,22%~25%B;10~20 min,25%~35%B;20~25 min,35%~40%B;25~30 min,40%~55%B;30~35 min,55%~20%B);检测波长为360 nm;流速为1.0 mL/min;柱温为30 ℃;运行时间为35 min。
标准曲线的绘制:分别吸取混标溶液2、5、10、15、20 μL,在上述色谱条件下进样,以各组分的质量为横坐标,峰面积为纵坐标,分别绘制标准曲线。
1.2.7 金花茶花总黄酮抗氧化性能研究
1.2.7.1 DPPH·清除能力测定 参照文献的方法[19],略有改动。按照1.2.4的方法所选出的优化条件,提取金花茶花总黄酮,得到黄酮质量浓度分别为0.065、0.163、0.26、0.358、0.455、0.553、0.65 mg/mL的样品溶液。在具塞试管中加入2 mL样品溶液,2 mL浓度为0.2 mmol/L的DPPH乙醇溶液,在室温下,避光反应30 min,测定其在517 nm波长下的吸光值,即为Ai;以2 mL无水乙醇代替样品溶液按照相同方法测定吸光值,即为A0;以2 mL无水乙醇代替DPPH溶液,重复上述步骤测定吸光值,即为Aj。自由基清除率(YA)按式(5)计算:

1.2.7.2 OH·清除能力测定 按照文献的方法[20],略有改动。按照1.2.4的方法所选出的优化条件,提取金花茶花总黄酮,得到黄酮质量浓度分别为0.325、0.488、0.65、0.813、0.975、1.14、1.3、1.46 mg/mL的样品溶液。在具塞试管中依次加入2 mL 9 mmol /L的FeSO4溶液,2 mL样品溶液,再分别加入2 mL 9 mmol/L的水杨酸溶液和2 mL 8 mmol/L的 H2O2溶液,摇匀后静置30 min。测定其在510 nm处的吸光值,即为Ai;以2 mL去离子水代替待测样品溶液按照相同方法测定吸光值,即为A0;以2 mL去离子水代替H2O2溶液,重复上述步骤测定吸光值,即为Aj。自由基清除率(YA)按式(5)计算。
1.3 数据处理
采用Origin8.0数据处理软件进行单因素实验数据分析和图表制作,采用正交设计助手iiv3.1软件进行正交试验设计分析,采用Excel进行相对标准偏差分析。实验中,数据重复测定三次,取平均值。
2 结果与分析
2.1 PEG600/(NH4)2SO4双水相体系相图
PEG600/(NH4)2SO4双水相体系相图如图1所示。曲线上的点为临界点,单相区在曲线下方,体系为均相,无相分离;两相区在曲线上方。由实验结果可知,当(NH4)2SO4的质量分数一定时,PEG的分子量越大,形成两相所需的PEG质量分数越小,越容易形成双水相体系[21]。而PEG分子量越高,黏度越高,相分离时间就越长[14]。在PEG相对分子量固定、质量分数固定的情况下,(NH4)2SO4质量分数过低,体系不能形成两相;而(NH4)2SO4质量分数过高,则会导致盐析出。因此,实验点应选择在曲线上方的合理区域。
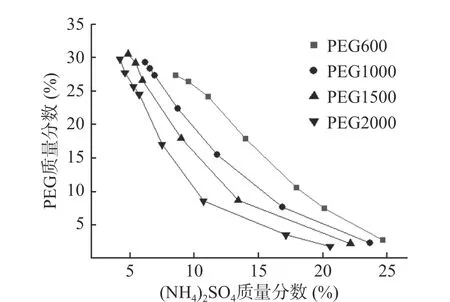
图1 PEG600/(NH4)2SO4双水相体系相图Fig.1 Phase diagram of PEG600/(NH4)2SO4 aqueous twophase system
2.2 单因素实验结果
2.2.1 PEG相对分子质量的影响 PEG相对分子质量对金花茶花总黄酮分配行为的影响如表2所示。由表可知,随着PEG分子量的增加,上下相的体积比R减小。PEG600的分配系数K和萃取率Y都较其它相对分子质量的PEG要大,可能的原因是PEG相对分子质量小时,体系的黏度低,传质阻力小[22]。当PEG的相对分子质量大于1000时,随着其相对分子质量的增大,K值逐渐增大,可能的原因是其空间阻力增大,因此,疏水性增大,更利于黄酮类化合物在上相的分配[22];然而,萃取率无明显变化,说明此时PEG相对分子质量对萃取率已无明显影响。由上可知,PEG600的萃取效果最好,因此后续实验采用PEG600做进一步研究。
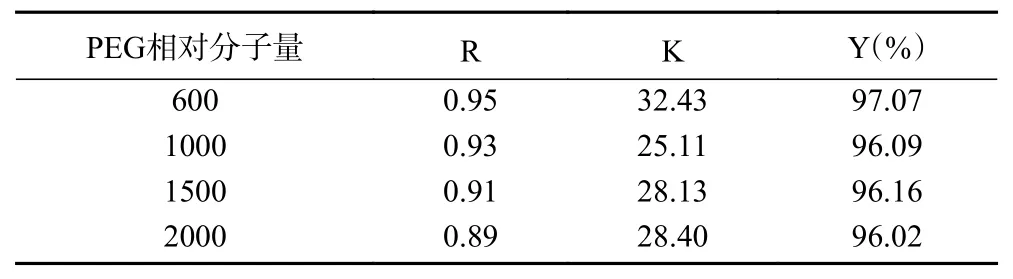
表2 PEG相对分子质量对金花茶花总黄酮分配的影响Table 2 Effect of PEG molecular weight on the distribution of total flavonoids from the flowers of Camellia chrysantha
2.2.2 乙醇浓度的影响 乙醇浓度对金花茶花总黄酮分配行为的影响如表3所示。由表可知,随着粗提液乙醇浓度的增加,上下相的体积比R不断增加,这是因为乙醇主要分布在上相[16],且乙醇具有一定的亲水性。分配系数K和萃取率Y随着乙醇浓度的增加先增加然后下降,当乙醇浓度为80%时,达到最大值。这是因为,一定的乙醇浓度可提高黄酮化合物的溶解度并有利于其在上相中的分配,随着乙醇浓度进一步增加,上相非极性增加,而黄酮苷类物质含有具极性的糖分子结构,此外,一些脂溶性有机物的溶解度也会增加,从而会抑制黄酮类化合物在粗提液中的溶出量以及在双水相体系中上相的分配[23]。由上可知,较佳的乙醇浓度为80%。

表3 乙醇浓度对金花茶花总黄酮分配的影响Table 3 Effect of ethanol concentration on the distribution of total flavonoids from the flowers of Camellia chrysantha
2.2.3 PEG600质量分数的影响 PEG600质量分数对金花茶花总黄酮分配行为的影响如表4所示。由表可知,随着PEG质量分数的增加,上下相的体积比R逐渐增加,分配系数K和萃取率Y也随之增大。随着PEG质量分数的增加,其捕获盐相中水分子的能力随之加强,上相的体积则随之增大,疏水性增加,从而有利于极性较小的黄酮化合物在上相的分布,因此,分配系数和萃取率均逐步增大[14]。当PEG600质量分数大于18%,萃取率增加不明显,且当PEG600质量分数大于21%时,会有盐析出。综合考虑成本的基础上,选取PEG600质量分数为18%进行后续实验研究。

表4 PEG600质量分数对金花茶花总黄酮分配的影响Table 4 Effect of mass fraction of PEG600 on the distribution of total flavonoids from the flowers of Camellia chrysantha
2.2.4 (NH4)2SO4质量分数的影响 (NH4)2SO4质量分数对金花茶花总黄酮分配行为的影响如表5所示。由表可知,随着(NH4)2SO4质量分数的增加,上下相的体积比R逐渐减小,与文献的研究结论一致[14],黄酮的分配系数K和萃取率Y先增加后减小,当硫酸铵质量分数为20%时,达到最大值。这是由于随着(NH4)2SO4质量分数的增加,上相中PEG600的质量分数逐步增加,从而有利于黄酮类物质的萃取。进一步提高(NH4)2SO4质量分数,(NH4)2SO4在上相中的含量也随之增加,从而不利于黄酮类物质的萃取[21]。因此,选取硫酸铵质量分数为20%进行后续实验研究。
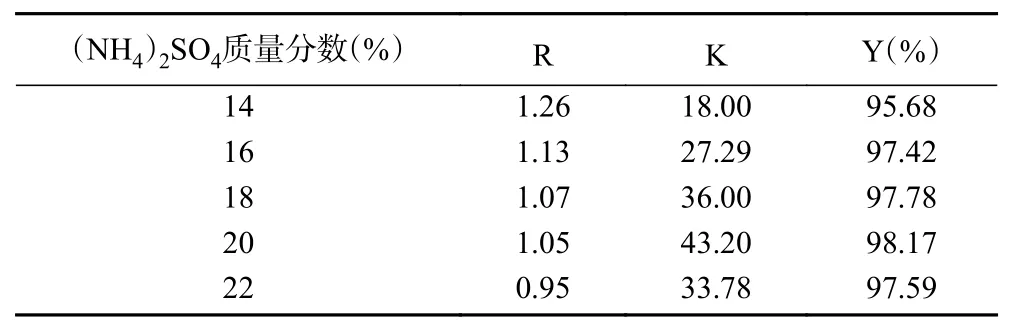
表5 (NH4)2SO4质量分数对金花茶花总黄酮分配的影响Table 5 Effect of mass fraction of (NH4)2SO4 on the distribution of total flavonoids from the flowers of Camellia chrysantha
2.2.5 超声时间的影响 超声时间对金花茶花总黄酮分配行为的影响如表6所示。由表可知,随着超声时间的延长,黄酮的分配系数K和萃取率Y先逐步增加,当超声时间大于30 min时,分配系数和总黄酮萃取率略有减小的趋势。这可能是因为随着超声时间的增加,细胞破碎更完全,更好地促进了黄酮物质的溶出以及在上下相的分配,但随着超声时间达到一定值后进一步增加,会破坏黄酮物质的结构[6]。因此,上述条件下的最佳超声时间为30 min。

表6 超声时间对金花茶花总黄酮分配的影响Table 6 Effect of ultrasonic time on the distribution of total flavonoids from the flowers of Camellia chrysantha
2.3 正交试验结果
正交试验结果见表7。由表可知,根据极差R分析,各因素对金花茶花黄酮类化合物分布的影响顺序为A>D>C>B,即PEG600质量分数>超声时间>乙醇浓度>(NH4)2SO4质量分数。最优条件是A3B2C2D2,即PEG600质量分数19%,(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min。所得的组合为实验组别以外的组合,因此需要进行验证实验,重复三次操作,萃取率分别为98.30%、98.41%、98.78%,平均值98.50%,大于实验表中的任何一组,相对标准偏差(RSD)为0.2553%,重现性好,具有较好的稳定性。在此条件下,总黄酮的得率为13.54%,与文献报道结果接近[1,9]。
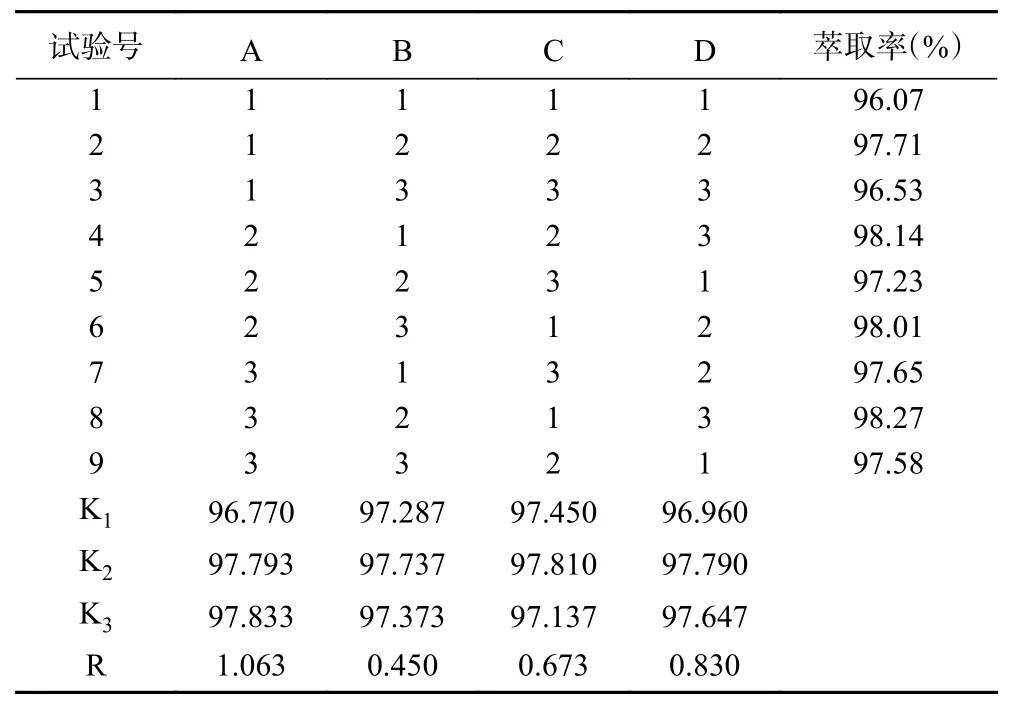
表7 正交试验结果Table 7 Results of the orthogonal experiments
2.4 HPLC分析
由文献报道[8]可知,芦丁、槲皮素和山奈酚为金花茶花中的代表性黄酮类化合物。图2为样品溶液和混标溶液的HPLC图。根据图中各组分的峰型及保留时间可知,样品中含有芦丁、槲皮素和山奈酚等三个黄酮化合物。经定量分析,金花茶花中芦丁为7.15 mg/g,槲皮素为1.23 mg/g,山奈酚为2.66 mg/g。
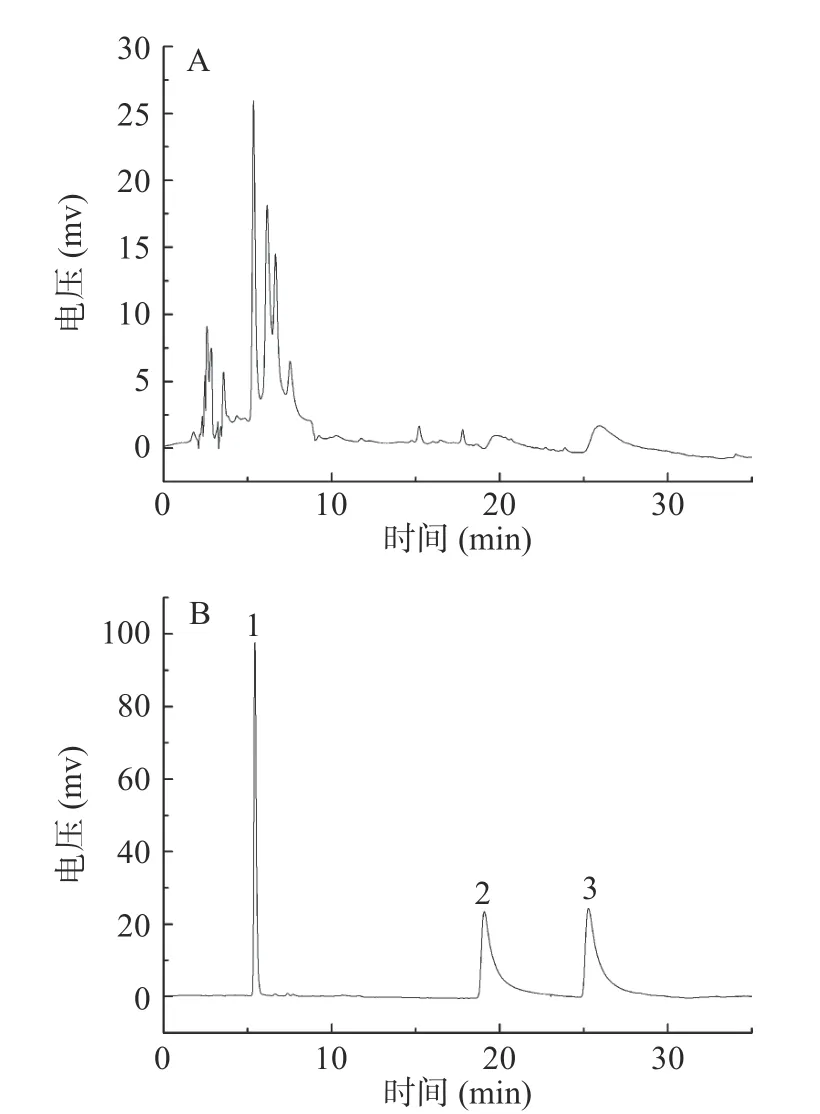
图2 样品溶液(A)和混标溶液(B)的液相色谱图Fig.2 HPLC chromatogram of the sample solution (A) and the mixed standard sample solution (B)
2.5 金花茶花黄酮提取物抗氧化性能评价
2.5.1 DPPH·清除能力 由图3可知,VC清除DPPH·能力随浓度增加而升高,当浓度为0.358 mg/mL时,清除率已达到95.63%,继续增大浓度清除率无明显变化。金花茶花黄酮提取物清除DPPH·能力随浓度的增加而升高,当样品浓度为0.455 mg/mL时,对DPPH·的清除率为86.63%,为VC水平的91%,说明金花茶花黄酮提取物对DPPH·有较强的清除能力[24],文献[9]报道当金花茶花提取物浓度为2 mg/mL时,对DPPH·的清除率为78.05%。采用SPSS 20.0软件分析,VC清除DPPH·的IC50为0.054 mg/mL,金花茶花黄酮提取物清除DPPH·的IC50为0.070 mg/mL。

图3 金花茶花黄酮提取物和VC对DPPH·的清除能力测定Fig.3 Determination of DPPH· radical scavenging ability of the flavonoid extract from the flowers of Camellia chrysantha and VC
2.5.2 OH·清除能力 由图4可知,在所测定浓度范围内,VC对OH·始终保持很高的清除能力,当浓度大于0.65 mg/mL时,清除率几乎接近100%[20]。金花茶花黄酮提取物对OH·表现出一定的清除能力,且在一定的浓度范围内,对OH·清除能力与浓度呈明显的量效关系[25]。当样品浓度为1.46 mg/mL时,对OH·的清除率为75.23%,表现出较好的清除能力[26],文献[25]报道当金花茶花黄酮提取物浓度为1.2 mg/mL时,对OH·的清除率为71.3%。采用SPSS 20.0软件分析,VC清除OH·的IC50为0.176 mg/mL,金花茶花黄酮提取物清除OH·的IC50为0.679 mg/mL。

图4 金花茶花黄酮提取物和VC对OH·的清除能力测定Fig.4 Determination of OH· radical scavenging ability of the flavonoid extract from the flowers of Camellia chrysantha and VC
3 结论
考察了室温下超声波辅助金花茶花总黄酮在PEG/(NH4)2SO4双水相体系中的分配规律。在单因素实验的基础上,采用正交试验优化工艺流程。最佳的萃取条件为PEG600质量分数19%,(NH4)2SO4质量分数20%,乙醇浓度80%,超声时间30 min。在此条件下,总黄酮的萃取率为98.50%,得率为13.54%。该工艺在温和的条件下进行,具有操作简单、绿色的优点,易于工业化。此外,以DPPH·和OH·的清除率为指标,考察了黄酮提取物的抗氧化性能。结果表明,金花茶花黄酮提取物清除DPPH·的IC50为0.070 mg/mL,清除OH·的IC50为0.679 mg/mL,表现出良好的抗氧化活性。该实验结果可为后续黄酮化合物等天然产物的提取及抗氧化性能研究提供参考,具有一定的理论意义及工业化应用价值。
