不同来源皂素对常见食源性致病菌的抑菌效果研究
2022-02-11王承瑞刘思思易有金李昌珠肖志红刘汝宽
王承瑞,刘思思,易有金 ,李昌珠,肖志红,刘汝宽,
(1.湖南省林业科学院省部共建木本油料资源利用国家重点实验室,湖南长沙 410004;2.湖南农业大学食品科学技术学院,湖南长沙 410128)
近年来,由食源性致病微生物引起的食物中毒已经成为了全球共同关注的食品安全问题[1]。据世界卫生组织(WHO)估计,全球每年接近70%的食源性疾病是由食源性致病菌引起的[2]。食源性致病菌约有几十种,通常易引发食源性疾病的致病菌主要有以下7种[3-6]:大肠埃希氏菌(Escherichia coli)、沙门氏菌(Salmonella)、志贺氏菌(Shigella)、单核细胞增生李斯特氏菌(Listeria monocytogenes)、副溶血性弧菌(Vibrio parahaemolyticus)、溶血性链球菌(Streptococcus haemolyticus)、金黄色葡萄球菌(Staphylococcus aureus)。其中,由金黄色葡萄球菌、沙门氏菌、单核细胞增生李斯特氏菌和大肠杆菌O157:H7等细菌性食物中毒引起的食品安全事件约占我国食品安全事件的30%~90%,也是世界范围内的主要公共卫生问题[7-9]。因此,寻找安全、天然及高效的抑菌剂,对抑制食源性致病菌的生长,延长食品保质期及预防食品安全事件具有重大意义。
皂素是一类结构较为复杂的成分,由皂苷和糖、糖醛酸或其他有机酸所组成[10]。根据已知皂苷元的分子结构,可以将皂苷分为两大类,一类为甾体皂苷,另一类为三萜皂苷[11]。如穿山薯蓣皂苷属于甾体皂苷,皂角壳皂素、绿茶皂素和油茶皂素属于三萜皂苷。皂苷广泛存在于植物中,多数研究表明,皂苷具有一定的抑菌作用[12]。如油茶皂素对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、酵母菌有较明显的抑制作用,对白色念珠菌有一定程度的抑制作用,对绿脓杆菌无抑制作用[13-14]。如李万华等[15]从皂角中分离出两种化合物,分别是刺囊酸和皂荚皂苷C,皂荚粗提物对芒果炭疽病和蒂腐菌有较强的抑菌作用[16];任冬冬等[17]利用气化爆鸣法对皂角进行处理,并进行抑菌试验,结果显示,皂角提取液对革兰氏阳性菌和阴性菌均有抑菌效果,其中,对枯草芽孢杆菌(B.subtilis)的效果最佳,MIC为0.23 mg/mL,并且得出皂角提取液对革兰氏阳性菌的抑菌效果比革兰氏阴性菌更好。经研究,绿茶中最主要的抑菌成分为茶多酚,其中茶皂素也有一定的抑菌效果。华德兴等[18]采用琼脂稀释法测定了绿茶中的茶皂素的抑菌活性,结果证明,茶皂素对耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA)有抑菌效果。卢雯静[19]利用茶皂素(山茶花)对金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)、四联球菌(Micrococcus tetragenus)和酵母菌(Saccharomyces)开展抑菌试验,结果显示茶皂素对四种菌均有抑制效果,其中,对酵母菌的抑制作用尤为显著。
从上述研究中可看出,已有研究者对三种不同来源皂素的抑菌效果分别展开研究,但目前利用三萜皂苷进行抑菌效果比较的研究较少,研究不够深入、全面,因此,本研究选取油茶籽、绿茶、皂角壳三种不同来源皂素,对四种常见的食源性致病菌进行体外抑菌试验,旨在为开发绿色、安全和稳定的食品防腐剂提供新的参考。
1 材料与方法
1.1 材料与仪器
不同皂素来源:绿茶、油茶籽和皂角壳粉末 均购于上海麦克林生化科技有限公司;供试菌株:大肠埃希菌(Escherichia coli)ATCC 133264、金黄色葡萄球菌(Staphylococcus aureus)ATCC 186335、枯草芽孢杆菌(Bacillus subtilis)ATCC 109047、沙门氏菌(Salmonellasp.)BNCC 336792 由北京北纳创联生物技术研究院提供;牛肉膏 Thermo Fisher Scientific公司;营养琼脂 合肥博美生物科技有限公司;蛋白胨 上海盛思生化科技有限公司;氯化钠、无水乙醇 分析纯,国药集团化学试剂有限公司;齐墩果酸 标准品,上海如吉生物科技发展有限公司;营养琼脂(NA)培养基 牛肉膏3 g,蛋白胨10 g,氯化钠5 g,营养琼脂20 g,超纯水1000 mL,pH调节至7.2,分装至三角瓶中,121 ℃灭菌后待用;营养肉汤(NB)培养基 牛肉膏3 g,蛋白胨10 g,氯化钠5 g,超纯水1000 mL,pH调节至7.2,分装至三角瓶中,121 ℃灭菌后待用。
101-1AB电热鼓风干燥箱 北京科伟永兴仪器有限公司;SW-CJ-2G双人净化工作台 苏州净化设备有限公司;GZ-280-S生化培养箱 广智科技设备(韶关)有限公司;ME204分析天平 上海梅特勒-托利多仪器有限公司;LMQ.C-80E高压灭菌锅 济南来宝医疗器械有限公司;KK23E18TI冰箱 安徽博西华制冷有限公司。
1.2 实验方法
1.2.1 皂苷含量的测定 由于市面上没有纯的茶皂素和皂角壳皂素的标准品,而三种不同来源皂素均属于齐墩果烷型的五环三萜皂苷,与齐墩果酸结构相似,因此选取齐墩果酸作为标准品,采取香草醛-浓硫酸法[20]进行皂苷含量的测定。
1.2.1.1 齐墩果酸标准溶液的制备 称取0.03 g齐墩果酸标准品,加入无水乙醇溶解,再将液体移入100 mL容量瓶中,用无水乙醇定容至刻度线。
1.2.1.2 试样溶液制备 分别称取0.2 g不同来源皂素(皂角壳、绿茶和油茶籽粉末)的试样,加入无水乙醇进行溶解,再移入100 mL容量瓶中,用无水乙醇稀释溶液至刻度,过滤,取滤液进行使用。
1.2.1.3 标准曲线的制备 分别移取齐墩果酸标准液0.4、0.8、1.2、1.6、2.0和2.4 mL于10 mL的容量瓶中,然后将容量瓶放置在沸水浴中,待溶剂挥发后,用流水冲洗使之冷却至室温,依次加入0.4 mL香草醛乙醇溶液和0.4 mL浓硫酸,立即摇匀。将容量瓶放置于70℃恒温水浴锅中同时加热15 min,取出后,用自来水冲洗冷却,加入乙酸乙酯定容。立即摇匀,使其充分反应,并放置冷却至室温。在550 nm波长处测定吸光度值,以试剂空白作为对照组,以吸光度值为纵坐标,各供试样品总皂苷浓度为横坐标,绘制标准曲线。
1.2.1.4 样品测定 移取0.6 mL试样溶液,放入到10 mL的容量瓶中,按上述步骤中自“放置在沸水浴中,待溶剂挥发后”起,与标准溶液同时进行显色反应,并测定其吸光度值,将测定数值带入标准曲线中计算出总皂苷的浓度。
1.2.1.5 计算公式 试样中总皂苷含量W2,以质量分数(%)表示,按公式(1)计算:

式中:C1—测试试样溶液中总皂苷的浓度,单位为毫克每毫升(mg/mL);m2—试样的质量,单位为克(g)。
1.2.2 皂素溶液的制备 根据1.2.1所测的三种不同来源皂素的含量,计算出油茶籽、皂角壳和绿茶皂素的质量浓度。然后称取来源于油茶籽、皂角壳和绿茶的皂素,用无菌水溶解,分别配制成6、8、10、20、30、40、50、60、70、80、90 mg/mL等不同质量浓度的皂素溶液,于4 ℃冰箱保存备用。
1.2.3 菌种活化 参照文莉等[21]的方法,配置营养琼脂培养基1 L,121 ℃高温灭菌20 min后取出,倒入灭菌后的培养皿,冷却后获得固体培养基。从-80 ℃冰箱取菌株,用接种环挑取细菌在固体培养基上划线,放置在恒温培养箱中培养18 h,培养温度37 ℃。
1.2.4 生长曲线的绘制及菌悬液的制备 采用紫外分光光度法测定细菌的生长曲线[22]。挑取四种食源性致病菌的菌落接种到100 mL的营养肉汤培养基中,置于摇床37 ℃,150 r/min摇床振荡培养,每隔2 h取出,在600 nm波长下,以空白培养基作对照,测定吸光度。以吸光度为纵坐标,以培养时间为横坐标,绘制微生物生长曲线。
菌悬液的制备[23]:用接种环挑取单菌落接种到液体培养基中,37 ℃,150 r/min恒温摇床培养14 h;再以1%接种量接种至10 mL的无菌水中,依次稀释,通过比浊法,使菌落数为106CFU/mL。
1.2.5 不同来源皂素抑菌圈的测定 将营养琼脂培养基倒于无菌培养皿中,待凝固后,将0.1 mL浓度为106CFU/mL菌悬液,用涂布棒均匀涂于培养基表面。用灭菌的镊子取牛津杯垂直并等距离的放入培养基上,其中三个牛津杯中加入不同浓度的皂素溶液,一个加入无菌水,作为空白,重复三个平板,37 ℃培养12~24 h,观察抑菌圈的大小,采用十字交叉法测定菌落直径[24]。
1.2.6 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 采用二倍稀释法[25]测定不同来源皂素对各供试菌的MIC。取7根无菌试管,进行编号,然后向每管试管中加入2 mL培养基,在第一管中加入2 mL,64 mg/mL皂素溶液,混匀后取2 mL加入第二根试管中,依次稀释,最后一根试管混匀后,取2 mL液体弃掉,7根试管最终浓度分别为64、32、16、8、4、2、1 mg/mL。分别向上述试管中接入100 μL的106CFU/mL菌悬液,放置恒温培养箱37 ℃培养24~48 h,观察试管中液体是否变浑浊,空白组为加入100 μL无菌水,重复上述实验3次。
MBC测定[26]:自样品浓度高于 MIC 值(包括MIC 浓度)的试管中各吸取100 μL 混悬液分别滴加到灭菌的平板培养基上,涂布均匀,培养箱中 37 ℃培养 24 h,肉眼观察结果,菌落数小于5个的最低样品浓度确定为 MBC值,上述实验重复3次。
1.3 数据分析
2 结果与讨论
2.1 皂苷含量的测定结果
陈绪涛等[27]以齐墩果酸作为标准品,绘制标准曲线,通过建立回归方程计算得出油茶皂素的含量为96%。同样,王瑜[20]在测定皂角壳皂素的含量时,以齐墩果酸作为标准品,得到自制皂苷含量为24.38%。通过测定齐墩果酸标准品的梯度溶液的吸光度,其标准曲线如图1所示,求得回归方程为:y=0.6725x+0.0501,决定系数为R2=0.9996,其中y为吸光值,x为单位浓度(mg/mL)。测定三种不同来源皂素的吸光度值,计算可得,油茶籽、绿茶和皂角壳来源皂素的皂苷含量分别为86.50%、82.70%和19.13%。
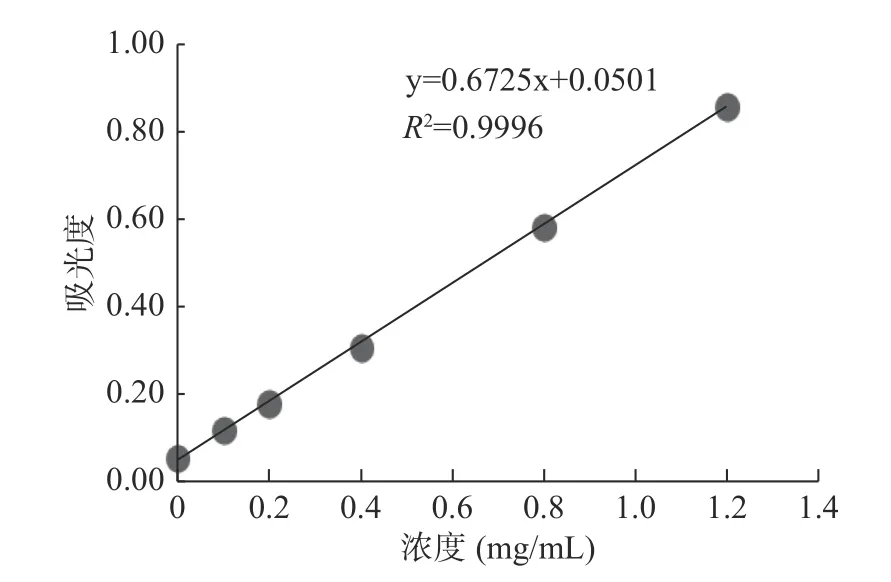
图1 齐墩果酸标准曲线图Fig.1 Standard curve of oleanolic acid
2.2 四种食源性致病菌的生长曲线
由图2可知,随着时间的增长,沙门氏菌、大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌分别经过了微生物生长的三个时期,即迟缓期、对数期、稳定期。具体表现为在0~2 h内,由于菌种刚刚接种到液体培养基内,代谢系统还未适应新的环境,中间代谢产物等还未合成,所以此时期的吸光度变化不明显,吸光度没有明显增大。在3~10 h范围内,因为经过迟缓期的准备,微生物生长所需的物质基础己经足够,同时外界环境也适于菌体生长,除沙门氏菌外,另外三种食源性致病菌的吸光度呈指数型增大;在10 h后达到稳定期,活菌数保持相对稳定、总细菌数达到最大数目、细胞代谢产物积累达到顶峰。而沙门氏菌的迟缓期较长,在10~14 h时才进入对数期,四种食源性致病菌在14 h后都进入稳定期。由于比浊法只能测定培养液中的总菌数,并不能有效区别稳定期和衰亡期,所以14 h以后,吸光度基本保持不变。为了保证实验过程中菌种的活性,每次实验前将菌种在液体培养基中活化12~14 h。
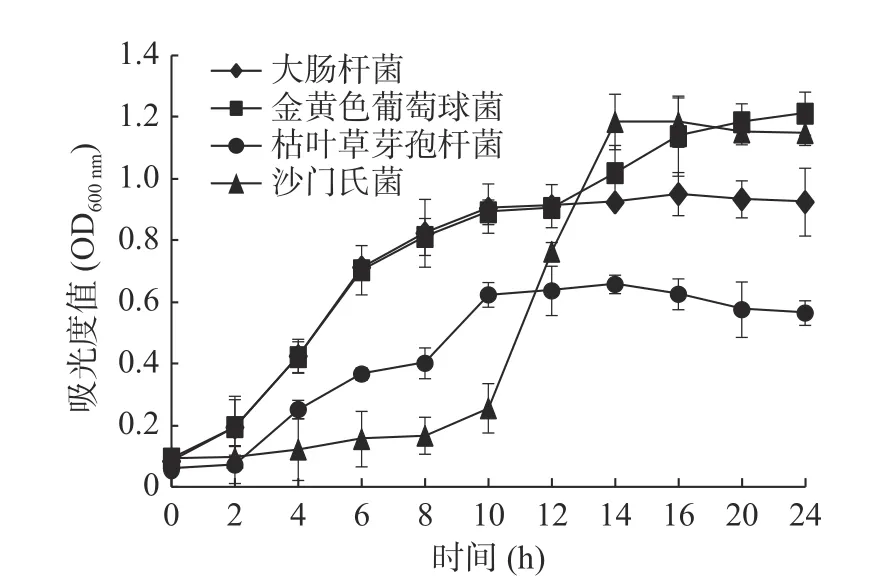
图2 四种食源性致病菌的生长曲线Fig.2 Growth curves of four food-borne pathogens
2.3 抑菌圈试验测定结果
通过采用牛津杯法对待测样品进行抑菌活性定性分析。测定结果表明,三种不同来源皂素对常见的四种食源性致病菌均有良好抑制作用,结果如表1、表2和图3所示。
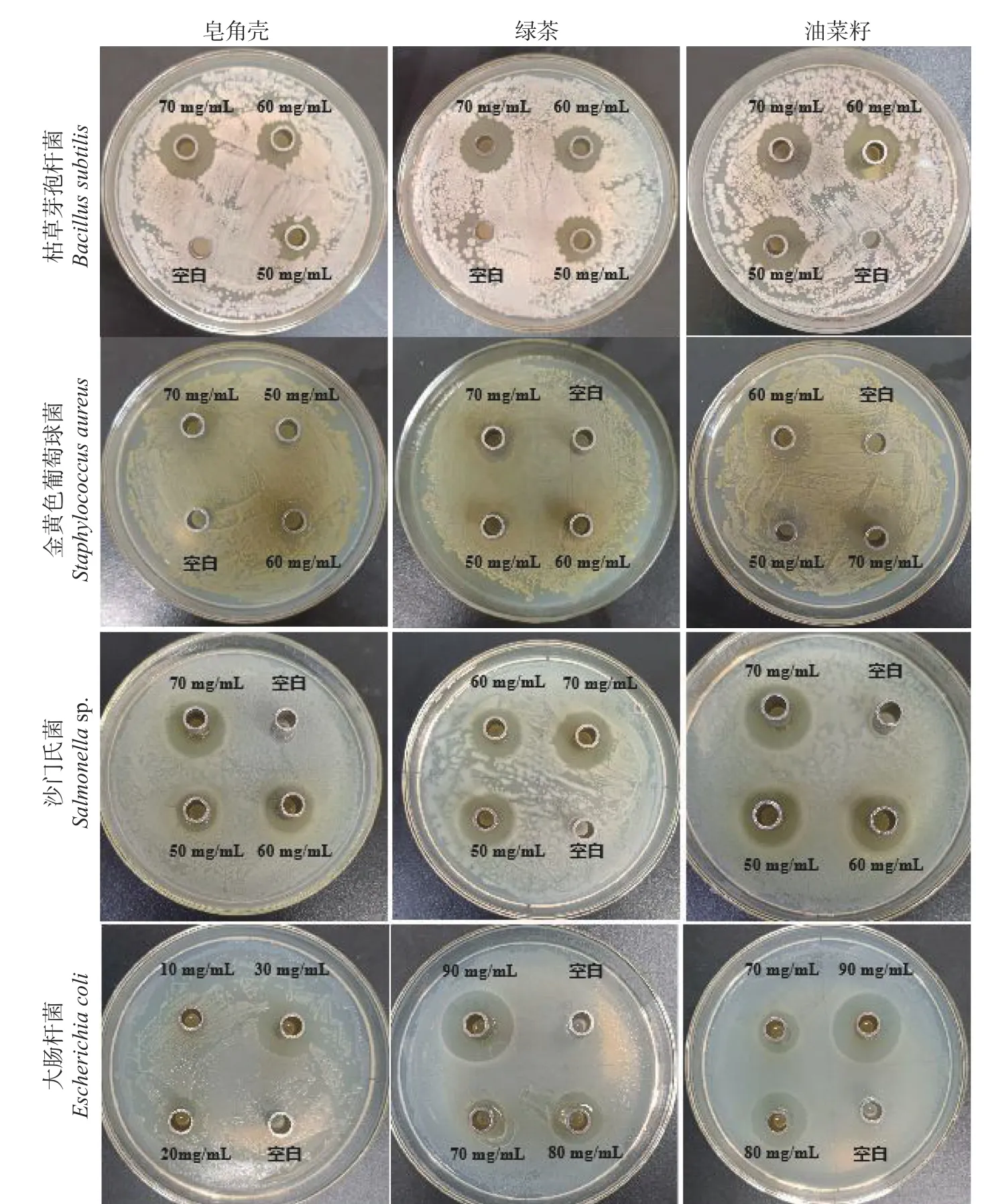
图3 不同来源皂素对四种食源性致病菌的抑菌作用Fig.3 Bacteriostatic effect of saponins from different sources on four food-borne pathogens
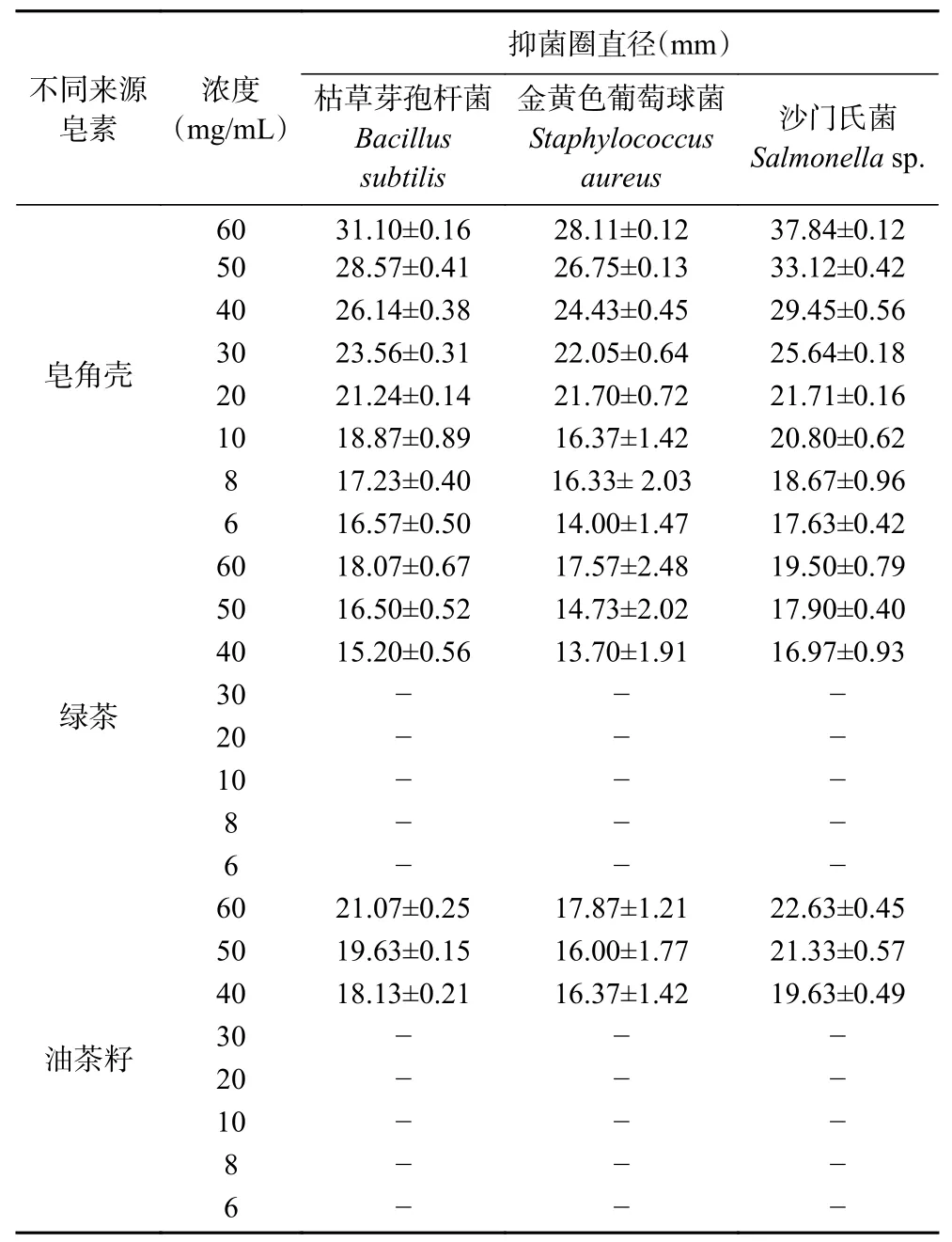
表1 不同来源皂素对3种食源性致病菌抑菌圈的测定结果Table 1 Determination of inhibition zone of saponin from different sources on three food-borne pathogens
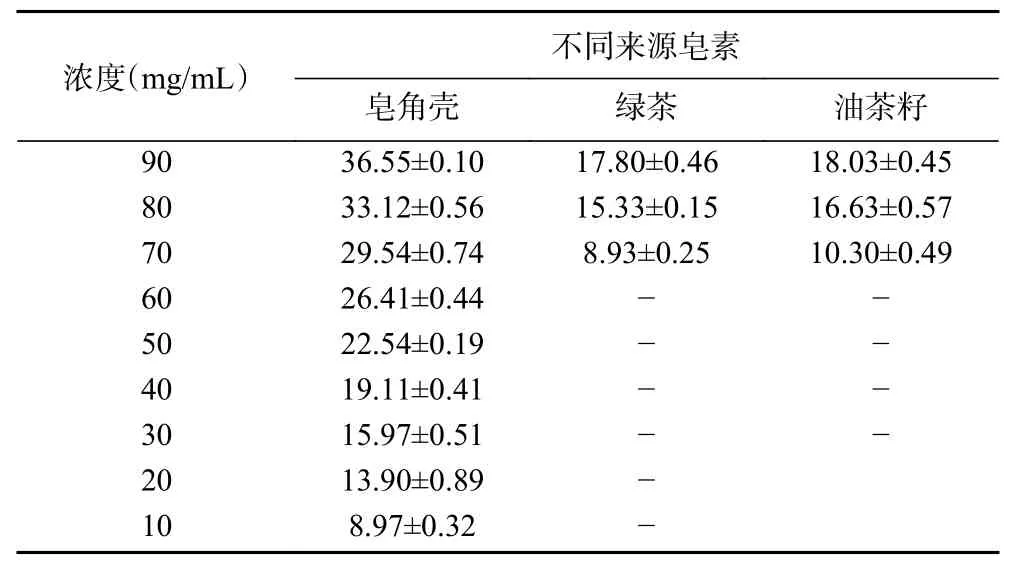
表2 不同来源皂素对大肠杆菌的抑菌圈的测定结果(mm)Table 2 Determination of inhibition zone of saponin from different sources on E.coli(mm)
三种来源皂素对革兰氏阳性菌的抑菌效果比较为枯草芽孢杆菌>金黄色葡萄球菌,对革兰氏阴性菌的抑菌效果比较为沙门氏菌>大肠杆菌。总体来说,三种不同来源皂素对革兰氏阴性菌(沙门氏菌)的抑制作用最佳,对其它三种菌的抑菌效果由强至弱分别为枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌;随着皂素的浓度增大,抑菌效果随之增强。实验结果还表明,三种不同来源皂素的抑菌作用强弱为:皂角壳>油茶籽>绿茶。这与蒋志平等[28]的研究报道一致,充分表明皂角能够有效的抑制革兰氏阳性菌和革兰氏阴性菌。有研究表明,皂角壳中的皂苷类化合物主要是刺囊酸和皂荚皂苷C[15],倪付花等[29]利用双倍营养法测定皂荚皂苷水溶液的抑菌作用,结果表明皂荚皂苷水溶液对大肠杆菌、金黄色葡萄球菌、绿脓杆菌、沙门杆菌及白色念珠菌均有抑菌作用,对细菌的抑制效果较好。与本研究的结果一致。但由于皂角皂苷的含量相对较少,结构复杂,提取纯化难度大,不利于广泛应用。而油茶皂苷是油茶饼粕的主要抑菌活性成分,其抑菌效果较好,将其开发成为一种新型植物源抑菌剂,可实现油茶榨油后副产物的有效利用。
2.4 最小抑菌浓度(MIC)的测定结果
最小抑菌浓度是指在特定环境下孵育 24 h,可抑制某种微生物出现明显增长的最低药物浓度,试验时肉眼未见细菌生长的最低药物浓度即为MIC。同一细菌对不同药物的敏感性用MIC值衡量,值越小,说明越敏感,其抗菌药物的作用越强[30]。实验结果表明(表3),皂角壳来源皂素对枯草芽孢杆菌、金黄色葡萄球菌和沙门氏菌的MIC均为4 mg/mL,而对大肠杆菌的MIC则为8 mg/mL;绿茶和油茶籽来源皂素对沙门氏菌的抑菌效果最佳,其MIC均为8 mg/mL,对枯草芽孢杆菌和金黄色葡萄球菌的MIC均为16 mg/mL,对大肠杆菌的MIC均为32 mg/mL。该测定结果与上述抑菌圈的结果基本一致。
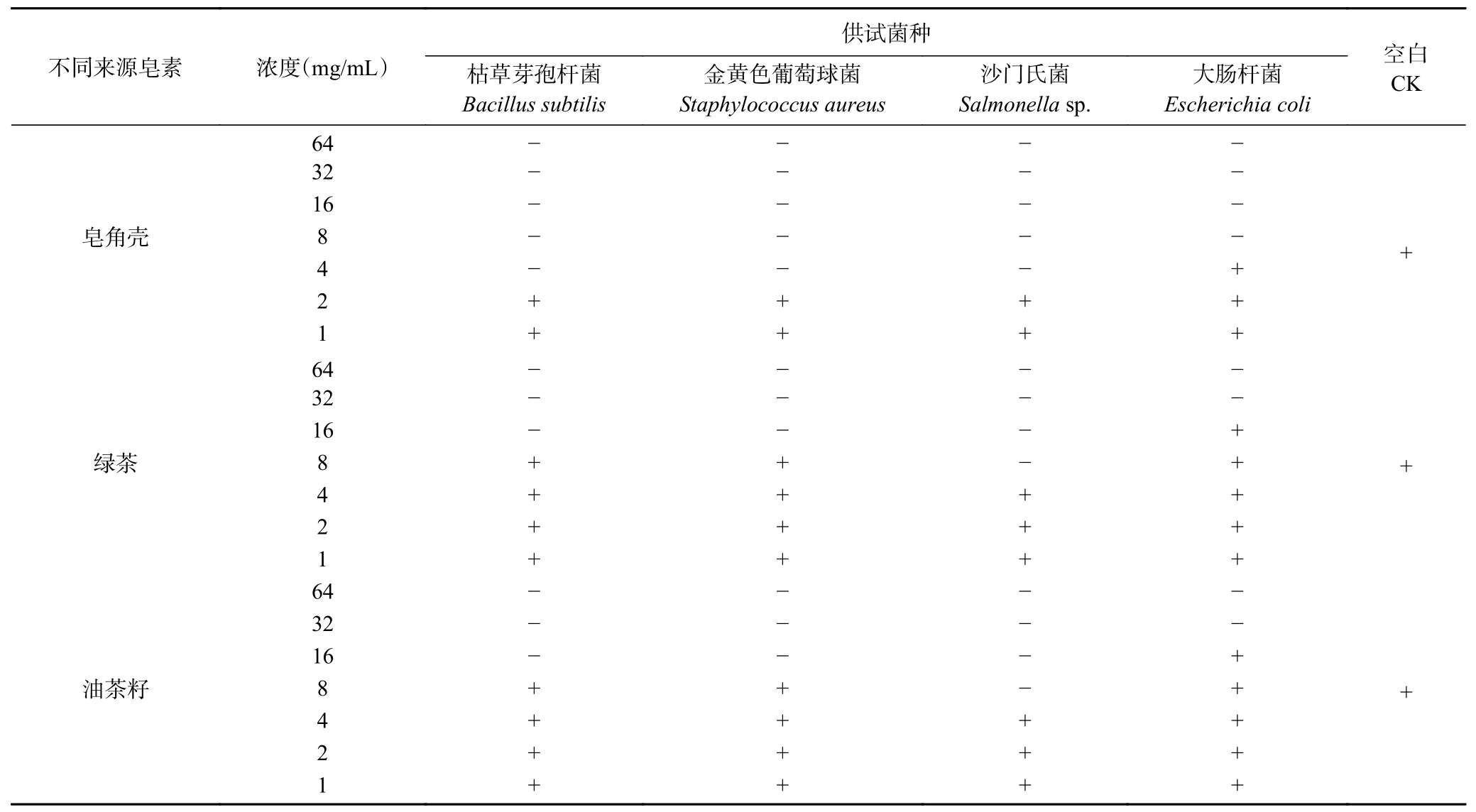
表3 不同来源皂素对4种食源性致病菌最小抑菌浓度的测定结果Table 3 Determination of the minimum inhibitory concentration of saponin from different sources on four food-borne pathogens
2.5 最小杀菌浓度(MBC)的测定结果
由表4可知,皂角壳来源皂素对金黄色葡萄球菌和沙门氏菌的MBC均为8 mg/mL,对枯草芽孢杆菌和大肠杆菌的MBC均为16 mg/mL;绿茶来源皂素对沙门氏菌的MBC为16 mg/mL,枯草芽孢杆菌和金黄色葡萄球菌的MBC均为32 mg/mL,对大肠杆菌作用效果最弱,其MBC为64 mg/mL;油茶籽来源皂素对革兰氏阳性菌(枯草芽孢杆菌和金黄色葡萄球菌)的MBC均为32 mg/mL,对两种革兰氏阴性菌(沙门氏菌和大肠杆菌)分别为16 mg/mL和64 mg/mL。
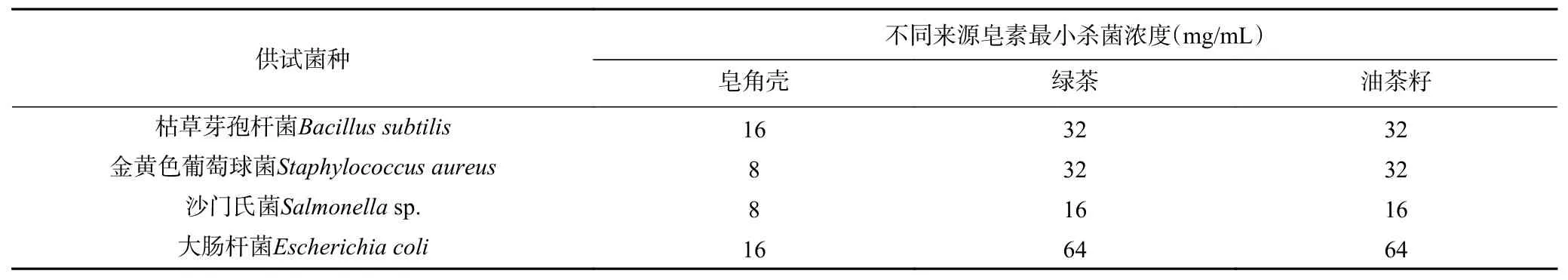
表4 不同来源皂素对4种食源性致病菌最小杀菌浓度的测定结果Table 4 Determination of the minimum bactericidal concentration of saponin from different sources on four food-borne pathogens
3 讨论与结论
本试验结果表明,三种不同来源皂素对枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌和大肠杆菌均有不同程度的抑制效果,强弱依次为皂角壳>油茶籽>绿茶,因此,三种不同来源皂素均有开发成为天然抑菌剂的潜力,但由于皂角壳来源皂素在自然界中结构多样,不易获取,且皂角(皂荚)资源量相对较少,限制了其广泛应用。结合实际,油茶皂素的抑菌效果较绿茶来源皂素好,且油茶为我国大宗油料,资源量丰富,故后续可进一步开展油茶皂素的应用研究,让油茶资源获得更广泛更高值化的应用。
国内外学者已经对油茶皂素的抑菌机制展开了初步研究。如何荣荣等[31]探究了油茶皂素对沙门氏菌的抑菌机理,主要通过改变细菌的细胞壁和细胞膜的通透性,从而改变细菌的正常细胞形态,并且引起细胞内蛋白质、碱性磷酸酶及K+的泄露,影响细菌正常的生长繁殖。Zhao等[13]研究了油茶皂素对金黄色葡萄球菌的抑菌机理,得出油茶皂素可改变细胞形态;扭曲细胞体;破裂细胞膜;破坏细胞膜的完整性;泄露细胞质、核酸和蛋白质中的小分子;阻碍细菌的生长和再生产。同样,张文婷[32]研究得出油茶皂素能作用于大肠杆菌和金黄色葡萄球菌的细胞膜,增大细胞膜的通透性,破坏细胞的膜结构,使细胞破裂,内容物溶出,从而起到抑菌作用。上述机理研究重在深入探讨油茶皂素自身的抑菌作用,而本研究则侧重于通过横向对比其他皂素抑菌效果,得出油茶皂素具有良好的抑菌活性,并且油茶皂素资源量大,易于获取,更利于实际生产。因此,结合现有的基础研究,对油茶皂素开展更加系统而深入的抑菌研究,明确具体抑菌成分,为油茶皂素的广泛应用增添新途径,可为开发新型植物源食品防腐剂提供新方向。
