牡蛎抗菌肽Molluscidin的密码子优化、重组毕赤酵母表达及抑菌活性
2022-02-11谭强来杨彩娟陆馨敏卢艺玲罗家英陈馨雨
谭强来,曾 臻, ,许 莉,杨彩娟,陆馨敏,丰 艳,卢艺玲,罗家英,陈馨雨
(1.厦门医学院海洋生物医药资源福建省高校工程研究中心,福建厦门 361023;2.厦门医学院天然化妆品福建省高校工程研究中心,福建厦门 361023)
抗生素耐药性严重危害公众健康,被世界卫生组织列为二十一世纪三大最重要的公共卫生威胁之一[1]。据疾病控制和预防中心估计,美国每年有280多万例抗生素耐药性感染,超过3.5万人因此死亡[2]。采用抗菌肽(Antimicrobial peptides,AMPs)替代成为解决抗生素耐药性危机的一种可能方案[3]。抗菌肽是指生物体在抵御外来病原微生物侵染时,激活先天性免疫产生的一类小分子多肽,一般由12~50个氨基酸组成[4]。天然抗菌肽种类多、分布广,对细菌、真菌、病毒、寄生虫乃至癌细胞均可有效抑制或杀伤,故又被称为“自然抗生素”[5]。抗菌肽具有独特的抑菌机制,多数抗菌肽通过静电相互作用吸附并破坏细菌的细胞膜结构,从而既达到杀灭效果,又不易使细菌产生耐药性[5-8]。因此,抗菌肽在医药卫生、食品化妆品、饲料加工、禽畜水产养殖等行业中均有广阔的应用和市场前景。
从自然界各生物体中分离鉴定天然抗菌肽及其人工改造合成已成为该领域的研究热点,根据抗菌活性及多肽结构数据库(Database of Antimicrobial Activity and Structure of Peptides, DBAASP)统计,目前已有超过15700条天然的或人工合成的抗菌肽[9]。其中Molluscidin是SEO等[10]于2013年从太平洋牡蛎分离纯化到的一种新型抗菌肽,含55个氨基酸,分子量为5.5 kDa,对革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌、藤黄微球菌)和革兰氏阴性菌(大肠杆菌、沙门氏菌、副溶血弧菌)均具有较强的抑菌活性。然而,抗菌肽的天然提取产量低,采用化学合成成本昂贵,通过基因工程大量表达是满足大规模实际产业应用需要的最有前景途径[11]。目前常用的基因工程菌主要为毕赤酵母真核表达系统和大肠杆菌原核表达系统[12]。相较于大肠杆菌,毕赤酵母具有更好的表达后加工修饰能力,有助于保持重组蛋白的生物学活性[13]。如GUENGUEN等[14]通过大肠杆菌表达的重组太平洋牡蛎防御素,对革兰氏阴性菌无明显抑制作用,而崔旭等[15]改用毕赤酵母表达,对革兰氏阳性菌和革兰氏阴性菌均具有抑菌活性。在前期研究中,凌霄[16]曾利用大肠杆菌重组表达Molluscidin,无明显的抑菌活性。因此,本研究拟按照毕赤酵母密码子偏好性对Molluscidin进行核酸序列优化,构建其毕赤酵母真核表达系统,以期高效表达抑菌活性较好的重组Molluscidin,为其生产应用奠定基础,也为重组贝类来源抗菌肽的开发利用提供可资参考的技术途径。
1 材料与方法
1.1 材料与仪器
毕赤酵母X-33和表达载体pPICZαA 海南大学陈奇博士惠赠;大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌、枯草芽孢杆菌 本实验室保存;限制性内切酶(EcoRⅠ、NotⅠ、SacⅠ)、T4 DNA连接酶、TaqDNA聚合酶、RealBand 蛋白预染Marker(10~180 kDa)、小鼠抗6×His单克隆抗体(一抗)、辣根过氧化物酶标记的羊抗鼠IgG(二抗)、辣根过氧化氢酶DAB显色试剂盒 生工生物;博来霉素(Zeocin) 美国Invitrogen公司;BMGY/BMMY培养基 上海瑞楚;Tris-Tricine-SDS-PAGE凝胶制备试剂盒、彩虹245plus广谱蛋白Marker(5~245 kDa)、YPD培养基、无氨基酵母氮源(YNB)、生物素、山梨醇 北京索莱宝;Western blot分析试剂 康为世纪;其他常规化学试剂 均为国产分析纯。
Mini-PROTEAN Tetra cell聚丙烯酰胺凝胶电泳仪、S1000 PCR扩增仪、GelDoc XR+凝胶成像分析仪 美国Bio-Rad;Eporator电转化仪 德国Eppendorf;SW-CJ-1F超净工作台 苏净安泰;LRHS-400B恒温培养箱、SKY-2102恒温振荡器上海苏坤;游标卡尺 宁波长城精工。
1.2 实验方法
1.2.1 Molluscidin的生物信息学分析 参考生物信息学方法[17]分析Molluscidin的基本理化性质。利用ExPASy数据库中Compute pI/Mw工具(https://web.expasy.org/compute_pi/)计算其分子量和等电点,ProtParam工具(https://web.expasy.org/protparam/)计算其理化参数,ProtScale工具(https://web.expasy.org/protscale/)以Hphob./Kyte & Doolittle为标度计算其氨基酸亲疏水性。
1.2.2 牡蛎抗菌肽Molluscidin的核酸序列优化与合成 参考太平洋牡蛎Molluscidin的全长cDNA序列(GenBank登录号:JX549384),按照毕赤酵母密码子偏好性优化,并在序列的5‘端添加EcoR Ⅰ酶切位点,3‘端添加6×His标签、终止密码子和NotⅠ酶切位点,命名为“CgMoCo”,交由生工生物工程(上海)股份有限公司合成。
用EcoR Ⅰ和NotⅠ双酶切目的基因CgMoCo和表达载体pPICZαA,用T4 DNA连接酶于16 ℃连接2 h后,化转大肠杆菌感受态细胞DH5α,用含0.1 mg/mL博来霉素的LB固体平板及菌落PCR筛选阳性克隆,并通过双酶切和测序验证是否成功构建重组质粒pPICZαA-CgMoCo,构建策略见图1。
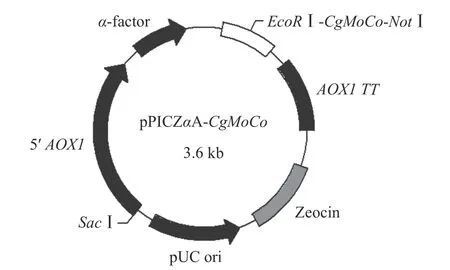
图1 重组质粒pPICZαA-CgMoCo构建示意图Fig.1 Schematic representation of the recombinant expression vector pPICZαA-CgMoCo
1.2.3 电转化毕赤酵母X-33及筛选阳性转化子经验证正确的重组质粒pPICZαA-CgMoCo用SacI酶于37 ℃酶切过夜后浓缩回收,用1%琼脂糖凝胶电泳检测线性化合格后,参考前期研究的电转化条件[18],与100 μL毕赤酵母X-33感受态细胞混合并转入预冷的0.2 cm电转杯,在1500 V、25 μF、400 Ω条件下电转化后,立即加入900 μL预冷的1 mol/L山梨醇,分别涂布在含0.1、0.2和0.3 mg/mL博来霉素的YPD固体平板上,30 ℃培养3 d至单菌落长出,以pPICZαA空载体同上处理作为阴性对照。
挑选若干个单菌落于YPD液体培养基中30 ℃、250 r/min培养过夜后,提取酵母基因组DNA,用pPICZαA载 体 通 用 引 物AOX 1(3-AOX1:5‘-GCAAATGGCATTCTGACATCC-3‘,5-AOX1:5‘-GACTGGTTCCAATTGACAAGC-3‘)进行PCR鉴定(PCR反应条件为:95 °C 10 min;95 °C 30 s,55 °C 30 s,72 °C 1 min,30个循环。PCR反应体系为:TaKaRa Ex Taq 0.25 μL,10×Ex Taq Buffer 5 μL,dNTP Mixture 4 μL,模板1 μL,上下游引物各1 μL,ddH2O补足至50 μL),以线性化的重组质粒pPICZαA-CgMoCo为阳性对照。
1.2.4 重组毕赤酵母的多肽诱导表达和检测 选取若干个鉴定为阳性的单菌落,参考Invitrogen毕赤酵母表达载体pPICZα表达手册推荐方法,按1%接种量转接于15 mL的BMGY培养基,30 ℃、250 r/min培养至菌液OD600为2~3,5000 r/min离心5 min收集菌体沉淀,用15 mL的BMMY培养基重悬,30 ℃、250 r/min连续培养5 d,每隔24 h补加甲醇至终浓度0.5%,最后8000 r/min离心5 min收集培养上清进行SDS-PAGE筛选,并进行Western blot验证。用含pPICZαA空载体的酵母转化子同上处理作为阴性对照。
PAGE胶用100 V电压转印经甲醇激活的0.22 μm的PVDF膜1 h,对膜封闭1.5 h后,用TBST缓冲液洗膜;加入小鼠抗6×His单克隆抗体(一抗),室温孵育2 h后,如上洗膜;加入辣根过氧化物酶标记的羊抗鼠IgG(二抗),室温孵育1 h后,如上洗膜;用辣根过氧化氢酶DAB显色试剂盒显色。
1.2.5 诱导表达条件的优化 选取1株初筛结果较好的重组毕赤酵母在1.2.4的基础上优化条件,甲醇终浓度设置3个对照,分别为0.5%、1%、1.5%,以确定最佳甲醇诱导浓度;在0、24、48、72、96、120 h分别取样,以确定最佳诱导表达时间。用含pPICZαA空载体的酵母转化子同上处理作为阴性对照。
1.2.6 抑菌活性的测定 参考滤纸片琼脂扩散法[19]进行抑菌活性测定。选用两株革兰氏阴性菌(大肠杆菌、肺炎克雷伯菌)和两株革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌)为指示菌,取对数生长期的指示菌的菌悬液10-3稀释后,取100 μL涂布于LB固体平板,再均匀贴入无菌滤纸片,加入重组毕赤酵母的培养上清30 μL,待稍干,37 ℃培养过夜后,观察并记录抑菌圈直径。用含pPICZαA空载体的酵母转化子的培养上清同上处理作为阴性对照。用无菌1×PBS同上处理作为空白对照。
1.3 数据处理
如无特别标注,实验平行测定三次,抑菌圈直径采用GraphPad Prism version 5.01进行数据分析及图形绘制,数据表示为均值±标准偏差(m±SD)。
2 结果与分析
2.1 Molluscidin的生物信息学分析
Molluscidin的理化参数分析如表1所示,预期分子量为6521.87 Da,等电点为11.28,在酵母体内半衰期>20 h,理化性质较为稳定。Molluscidin的氨基酸亲疏水性分析如图2所示,最大值为0.022,位于第5位氨基酸处;最小值为-2.878,位于第57位氨基酸处;亲水性较强。
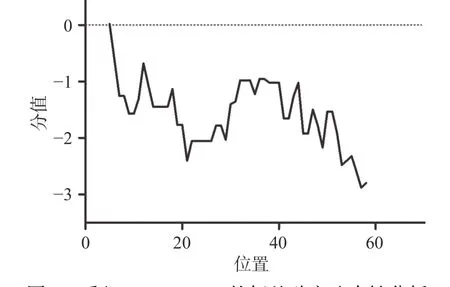
图2 重组Molluscidin的氨基酸亲疏水性分析Fig.2 Analysis of hydrophilicity and hydrophobicity of the recombinant Molluscidin

表1 重组Molluscidin的理化参数分析Table 1 Analysis of physicochemical parameters of the recombinant Molluscidin
于婷等[17]的研究指出,提高抗菌肽的正电荷数、亲疏水性等结构参数一般有利于增强其抑菌活性。因此,根据生物信息学分析结果,Molluscidin是有潜力的适用于毕赤酵母重组表达的抗菌肽。
2.2 牡蛎抗菌肽Molluscidin的核酸序列优化
牡蛎抗菌肽Molluscidin的核酸序列按照毕赤酵母密码子偏好性进行优化,优化前后的核酸序列及对应氨基酸序列比对如图3所示。

图3 牡蛎抗菌肽Molluscidin密码子优化前后的核酸序列及对应氨基酸序列比对Fig.3 Original and optimized nucleotide sequences and deduced amino acid sequences of Molluscidin from Crassostrea gigas
2.3 毕赤酵母的电转化及阳性转化子的筛选
阳性转化子的PCR鉴定结果如图4所示。预期扩增产物包括含酶切位点、6×His标签、终止密码子的目的基因片段为203 bp,加上载体上信号肽等序列546 bp,总计749 bp。除5号泳道外,其余泳道的条带与预期大小相符,表明成功获得阳性酵母转化子。
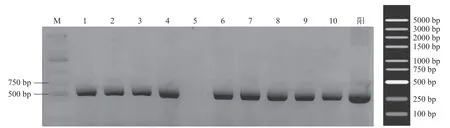
图4 重组毕赤酵母PCR鉴定Fig.4 Identification of the recombinant P. pastoris by PCR
2.4 重组毕赤酵母的诱导表达筛选
选取6株阳性酵母转化子在30 ℃、250 r/min、0.5%甲醇浓度的条件下进行诱导表达5 d后,离心收集培养上清进行SDS-PAGE分析,如图5所示。1号酵母转化子的培养上清在10~15 kDa处有一个较明显的条带(黑色箭头所示),而阴性对照的培养上清则无此条带,因此基本证明重组Molluscidin在1号酵母转化子中表达。
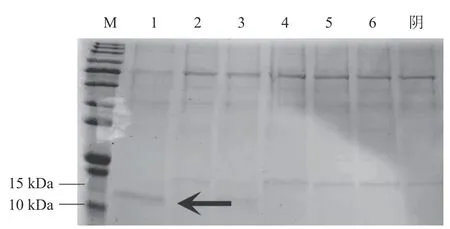
图5 重组毕赤酵母诱导表达筛选Fig.5 Induced expression of the recombinant P. pastoris
而如表1所示,重组Molluscidin的分子量预测为6.52 kDa,SDS-PAGE分析结果偏高,因此进一步利用His标签通过Western blot验证,如图6所示。1号酵母转化子的培养上清在10~15 kDa处有一条较明显的杂交条带(黑色箭头所示),而阴性对照的培养上清则未见任何条带,表明含6×His标签的重组Molluscidin与抗His一抗发生免疫反应,再与二抗结合,经DAB显色为杂交条带,因此验证重组Molluscidin在1号酵母转化子中成功表达。

图6 重组Molluscidin的Western blot验证Fig.6 Verification of the recombinant Molluscidin by Western blot
张亚莉等[20]在利用毕赤酵母重组表达厚壳贻贝Mytilin-1成熟肽时,也发现所表达的目的蛋白分子量明显高于理论分子量,推测存在两方面的原因:一是目的蛋白的分子量太小且带正电荷,导致其电荷不能被SDS完全屏蔽,所以在电泳时迁移速度变慢;二是所用蛋白分子量标准Marker与显色染料发生了共价偶联,导致在随后电泳时迁移速度变慢。此外,Compute pI/Mw和ProtParam工具在预测蛋白质基本理化性质时,无法考虑蛋白质翻译后的修饰、蛋白质多聚体等情况。
2.5 重组Molluscidin诱导表达条件的优化
在上述筛选实验的基础上,选取1号酵母转化子进行重组Molluscidin诱导表达条件的优化,考察不同甲醇浓度和培养时间对重组Molluscidin表达量的影响,如图7所示。在1.0%甲醇浓度下,1号酵母转化子的培养上清中目的蛋白较为清晰,且杂蛋白也较少,因此确定最佳甲醇诱导浓度为1.0%。在1.0%甲醇浓度下,1号酵母转化子培养时间从24 h开始,其培养上清出现目的蛋白,在48 h时已有较高的表达量,但随着培养时间的延长,重组Molluscidin的表达量并无明显增加。考虑到时间成本及目的蛋白的积聚可能影响酵母活力,也可能被体系中蛋白酶降解等问题,确定最佳诱导表达时间为48~72 h。
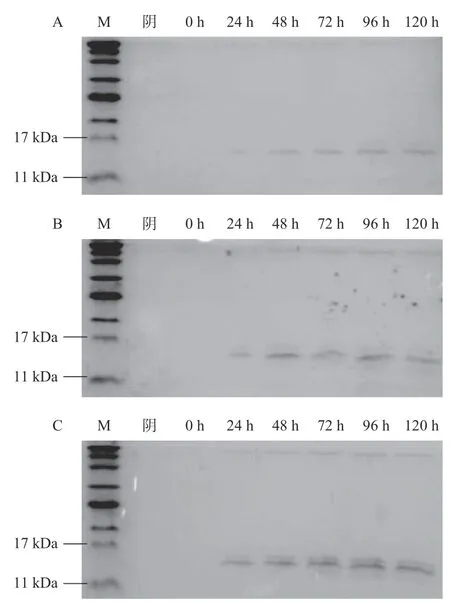
图7 重组Molluscidin诱导表达条件的优化Fig.7 Optimization of induced expression conditions of the recombinant Molluscidin
上述结果与崔旭等[15]利用毕赤酵母重组表达太平洋牡蛎防御素的优化条件较为一致。而赵震等[21]在重组表达青蛤Mytimacin时,选择了1.5%为最佳甲醇浓度,72 h为最佳培养时间。吕星星等[22]重组表达鳜鱼β-防御素时,以1.0%为最佳甲醇浓度,96 h为最佳培养时间。
2.6 重组Molluscidin抑菌活性的测定
重组Molluscidin对革兰氏阴性菌(大肠杆菌、肺炎克雷伯菌)和革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌)的抑菌圈直径如图8所示。含重组Molluscidin的培养上清对大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌圈直径分别为(1.77±0.20)cm、(1.49±0.11)cm、(1.90±0.09)cm、(1.64±0.06)cm,而阴性对照(含pPICZαA空载体的酵母转化子的培养上清)和空白对照(无菌1×PBS)对上述4种代表性细菌均无抑制作用,因此初步证明重组Molluscidin具有较好的抑菌活性。
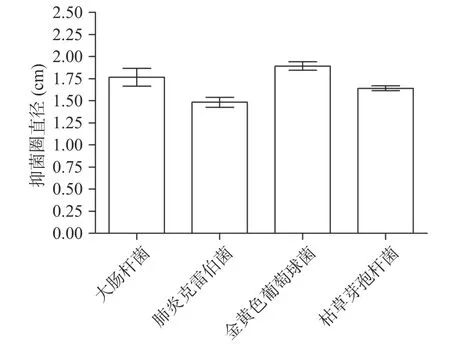
图8 重组Molluscidin的抑菌活性测定Fig.8 Antibacterial activity of the recombinant Molluscidin
而凌霄[16]利用大肠杆菌重组表达系统获得的重组Molluscidin,对革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌、李斯特氏菌)和革兰氏阴性菌(沙门氏菌、大肠杆菌、产气肠杆菌)均无明显的抑菌圈。因此利用重组毕赤酵母高效表达活性抗菌肽或是一个更合适的选择。
3 结论与讨论
抗菌肽是生物体初级免疫系统的重要效应分子,广泛存在于动物[23]、植物[24]以及微生物[25]中。海洋生物由于栖息环境复杂,更易遭受病原微生物的侵染,必须产生天然抗菌肽作为生存的必要防线,因此已成为新发现抗菌肽的丰富来源[26-27]。贝类等软体动物缺乏特异性免疫机制,却具有强大的抗逆能力,其抗菌肽发挥了关键作用,日渐受到科研工作者的关注[28]。如GUENGUEN等[14,29]从太平洋牡蛎中先后分离鉴定了两种抗菌肽Cg-def和Cg-prp。GRECO等[30]分析了贻贝科Mytilin样防御肽的分子多样性。YANG等[31]从菲律宾蛤仔中获得一种抗菌肽Macin。NAM等[32]在皱纹盘鲍中鉴定分析了一种兼具抗细菌和抗真菌活性的脂多糖-β-1,3-葡聚糖结合蛋白。然而,直接提取和人工合成抗菌肽或步骤繁琐、产量低,或成本高、无法普及;而大肠杆菌原核表达的抗菌肽易毒害表达宿主、丧失活性,因此,毕赤酵母作为应用最为广泛的真核表达系统,可成为更合适的选择。如LI等[33]为解决从鲎中提取天然鲎素Ⅰ产量低、大规模应用受限的问题,构建了其毕赤酵母真核表达系统,获得了能有效抑制大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌和金黄色葡萄球菌的重组鲎素Ⅰ。MENG等[34]的研究表明在大肠杆菌表达的菲律宾蛤仔防御素对金黄色葡萄球菌和革兰氏阴性菌均无有效的抑菌活性,而在毕赤酵母中表达的菲律宾蛤仔防御素具有广泛的抗菌谱,对革兰氏阳性菌和革兰氏阴性菌均有较好的抑菌活性。此外,本研究还按照毕赤酵母密码子偏好性优化核酸序列,并考察了甲醇诱导浓度和诱导表达时间的影响。董聪等[35]的研究表明,毕赤酵母密码子偏好性对目的蛋白的表达量影响很大。张亚莉等[20]结合前期研究,发现甲醇浓度和培养时间是毕赤酵母重组表达的两个重要影响因素,甲醇浓度低于1%易杂蛋白多,过高将抑制酵母生长进而影响其表达;培养时间过短,目的蛋白尚未高表达,过长将降低培养液pH从而影响蛋白活性。本研究结果与上述前期研究较为匹配。
本研究按照毕赤酵母密码子偏好性优化合成牡蛎抗菌肽Molluscidin,生物信息学分析其预期分子量为6521.87 Da,等电点为11.28,在酵母体内半衰期>20 h,理化性质较为稳定;成功筛选到1株重组毕赤酵母X-33/pPICZαA-CgMoCo,能高效表达抑菌活性较好的重组Molluscidin;优化表达条件为30 ℃、250 r/min、1.0%甲醇浓度诱导表达48~72 h;抑菌谱包括大肠杆菌、肺炎克雷伯菌等革兰氏阴性菌和金黄色葡萄球菌、枯草芽孢杆菌等革兰氏阳性菌。上述研究成果为其生产应用奠定了基础,也为重组贝类来源抗菌肽的开发利用提供了可供参考的技术途径。
