水开菲尔和水开菲尔粒细菌多样性分析及乳酸菌分离鉴定
2022-02-11高芫超肖爱波王天琪许云贺张莉力
高芫超,肖爱波,王 成,王天琪,于 冰,许云贺,张莉力
(锦州医科大学 食品科学与工程学院,辽宁 锦州 121000)
水开菲尔粒,由胞外多糖组成,是由乳酸菌、醋酸菌等共生微生物组成的稳定菌落,被限制在多醣体和蛋白质基质中,含具有保健功能的次级代谢产物[1]。水开菲尔,也叫作中国菌菇、缇比水晶和天山雪莲等,它是由有机糖溶液和水开菲尔粒自然发酵而成的一种发酵饮料,含多种益生菌。水开菲尔中微生物种类很多,主要含乳酸菌、醋酸菌和酵母菌,它们是由多种细菌和真菌组成的共生菌系[1],在细菌组成中能观察到乳酸菌的显著控制[2]。在水开菲尔发酵过程中,水开菲尔粒会“消化”掉糖,制作出富含益生性乳酸菌的水开菲尔[3]。水开菲尔中含多种酶,能水解多糖,产生果香。其发酵剂水开菲尔粒经发酵后,会得到粗纤维等不溶性沉淀成分,这些成分可以用于制作膳食纤维[4-5]。若经常喝水开菲尔,乳酸菌可以在人体内存活并生长繁殖,水开菲尔的保健功能包括:促进消化、增强肝脏功能、调节内分泌系统、调节血压、降低胆固醇、帮助减肥[1-2]。益生菌若想成功定植并作用于胃肠道,需要能够适应胃肠道的低 pH及高渗透压的胆盐环境[6]。因此,筛选耐酸、耐胆盐的益生菌株具有重要研究意义和应用价值。目前,国内外对水开菲尔的研究包括水开菲尔粒发酵时的微生物菌落动力学和代谢组学,研究表明水开菲尔发酵过程中的优势菌是乳酸菌,但是水开菲尔形成稳定结合体的分子背景尚不清楚,细菌区系的综合组成也尚未科学界定[7]。近年来,公众普遍开始关注食品营养及保健功效,以牛奶为基础的奶开菲尔现已被广泛研究并应用于各种发酵酸奶、益生性乳酸菌饮料中,可作为良好益生菌来源,具有许多潜在的健康益处。然而目前水开菲尔只限制于家庭小作坊式内部生产,其未得到广泛使用、未能投入工业化生产,主要是因为缺乏发酵水开菲尔的菌种。
所以,本实验利用高通量测序技术结合平板菌落计数法,分析水开菲尔和水开菲尔粒的细菌区系及优势菌属。然后以耐酸、耐胆盐能力做指标,从中筛选出具有潜在益生性的菌株。本研究为水开菲尔工业发酵提供备选菌株以及为水开菲尔产品的研发奠定基础。
1 材料与方法
1.1 实验材料
水开菲尔、水开菲尔粒:湛江市非歌食品店;MRS肉汤培养基、MRS培养基、营养琼脂培养基:北京陆桥有限公司;细菌基因组 DNA提取试剂盒:沈阳立信生物有限公司。
1.2 仪器与设备
压力蒸汽灭菌锅(DGL-50B)、紫外可见分光光度计(752N):常州鸿运实验仪器厂;恒温培养箱(303-4B):浙江尚诚仪器厂;超净工作台(JB-VS-1300):上海力辰仪器厂;精密 pH 计(PHS-25)、电子分析天平(M4-AL204):上海越平有限公司;生物显微镜(BM-500T):福建睿鸿光电科技有限公司。
1.3 实验方法
1.3.1 传统平板计数法测定细菌数量
对水开菲尔和水开菲尔粒中的细菌和乳酸菌计数,细菌参照 GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》,乳酸菌参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》,每种样品做三次平行实验,记录结果。
1.3.2 高通量测序分析细菌区系
主要步骤包括:对水开菲尔、水开菲尔粒中总DNA提取和16SrDNA的V3-V4可变区PCR扩增,利用的扩增引物为正向引物 520F: 5′-AYTGGGYDTAAAGNG-3′,反向引物 802R: 5′-TACNVGGGTATCTAATCC-3′,然后检测扩增序列,将合格序列进行文库扩建并上机进行高通量测序。测序平台为NovaSeq 6000[8]。得到高通量测序结果后,去除原始序列中的Barcode和引物序列,再拼接各样本序列获得Raw Tags,对其进行质量控制和过滤处理,去除不合格序列,用UCHIME软件识别并去除嵌合序列,最终获得有效数据[9]。选用Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)进行注释。
1.3.3 ASV聚类及物种组成分析
用Uparse软件对全部Effective Tags做ASVs聚类,参照相似性为100%,出现频数最高的序列作为代表序列,利用分类数据库分析其物种注释,得到从门至属的分类学信息,在门和属水平上统计样品的物种组成。
1.3.4 潜在益生性乳酸菌的筛选
对水开菲尔和水开菲尔粒取样后进行梯度稀释,取 10-5、10-6、10-7、10-8四个梯度各 1 mL用MRS固体培养基进行倾注,37 ℃培养48~72 h,挑取微白色、呈圆形或梭形的菌落,划线接种到MRS固体培养基上,37 ℃培养 48~72 h,划线2~3次,观察其个体形态,直至确定是单菌落后编号[10]。
1.3.4.1 初筛 编号菌株进行 H2O2酶及革兰氏染色实验,初步筛选出H2O2酶阴性及革兰氏染色阳性的菌株,对符合上述条件的菌株进行复筛。
1.3.4.2 复筛 以菌株的耐酸性,胆盐耐受力作为菌株的潜在益生性筛选指标[11-13]。将初筛所得菌株接种至 MRS肉汤培养基中,37 ℃培养24 h活化菌株,用于接种耐酸性和胆盐耐受力实验。
耐酸性:活化初筛所得菌株,用盐酸调节MRS肉汤培养基的pH值至3.0,4.0,5.0,以pH值为6.0的MRS肉汤培养基为对照组,分装于各试管中。接种5%(v/v)菌种至上述试管中,37 ℃培养3 h。以未接种的MRS肉汤培养基为参比,在波长 600 nm处利用紫外分光光度计测定不同培养基中的 OD值,每种样品做三次平行实验并取其平均值。按照下列公式计算菌株的耐酸性:菌株的耐酸性存活率(%)=(实验组的OD600 nm值/对照组的OD600 nm值)*100%。上述步骤中耐酸性好的菌株进行胆盐耐受力的测定。
胆盐耐受力:参考 Dunne[15]等的方法,配置含0%和0.3%(m/v)牛胆盐的两种MRS液体培养基,分装于各试管。接种 5%(v/v)菌种至上述试管,无牛胆盐为对照组,37 ℃培养24 h。在波长 600 nm处利用紫外分光光度计测定不同培养基中的OD值,每种样品做三次平行实验并取其平均值。按照下列公式计算菌株的胆盐耐受力:菌株的胆盐耐受力(%)=(实验组的OD600 nm值/对照组的OD600 nm值)*100%
1.3.5 个体、群体形态观察
对复筛所得菌株进行革兰氏染色,显微镜下观察菌体形态,记录结果。
1.3.6 生理生化实验
参照《伯杰细菌鉴定手册》中相关的乳酸菌实验方法[16]
1.3.7 菌种的16SrDNA鉴定
主要过程包括:提取菌种基因组DNA,PCR扩增16SrDNA序列,扩增引物为 27F及1492R通用引物。用1%琼脂糖凝胶电泳检测扩增及纯化后 PCR产物的 DNA序列。测序所得菌株的16SrDNA序列在NCBI的GeneBank中进行比对,得到相似度最高的菌株序列[17],通过MEGA-X软件绘制系统发育树[18]。
1.4 数据分析
数据采用SPSS 22.0版本,包括ANOVA单因素方差分析、LSD以及SNK检验,结果用x± sem表示。使用Origin绘制图形。
2 结果与分析
2.1 水开菲尔和水开菲尔粒中菌落总数
水开菲尔和水开菲尔粒细菌计数结果见表1。水开菲尔细菌总数为(7.32±0.01 lg) cfu/mL,乳酸菌总数为(7.08±0.02 lg) cfu/mL;水开菲尔粒细菌总数为(8.90±0.05 lg) cfu/mL,乳酸菌总数为(8.69±0.08 lg) cfu/mL。表明在水开菲尔和水开菲尔粒细菌区系中,乳酸菌为两种样品的优势菌,有利于后续乳酸菌筛选实验的进行。接下来结合高通量测序分析水开菲尔和水开菲尔粒的细菌区系。
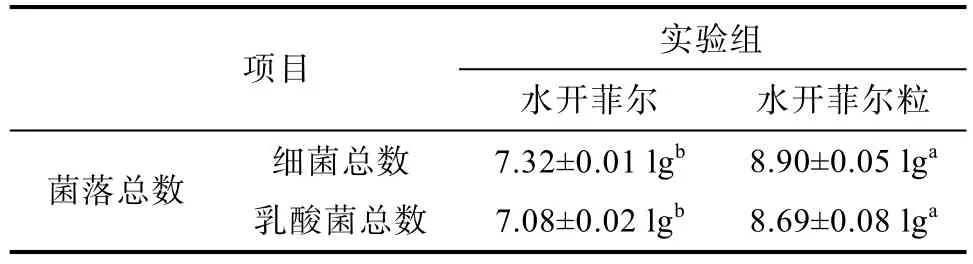
表1 水开菲尔和水开菲尔粒细菌计数结果Table 1 Results of bacterial counting of water kefir and water kefir granules cfu/mL
2.2 高通量测序技术分析水开菲尔和水开菲尔粒细菌区系及优势菌属
2.2.1 ASVs聚类
高通量测序分析水开菲尔和水开菲尔粒细菌区系,结果分别获得60 151和64 256条有效序列。有效序列按100%一致性进行ASVs聚类,出现频次多的序列为代表性序列,并注释其物种。其花瓣图如图1所示,结果共得到438个ASVs,水开菲尔中含 168个 ASVs,水开菲尔粒中含 270个ASVs,其中两组共有的 ASVs数为 93个,两组特有的ASVs分别为75和177个。
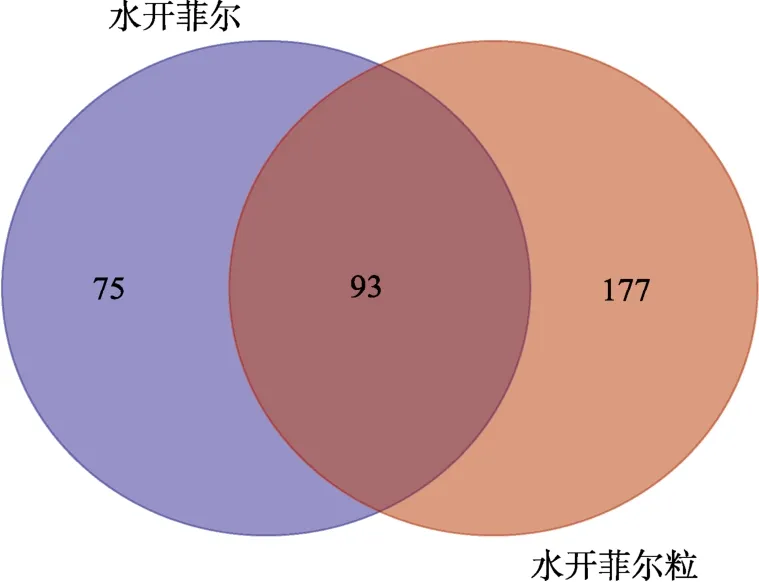
图1 水开菲尔和水开菲尔粒的ASVs聚类Fig.1 ASVs clustering of water kefir and water kefir granules
2.2.2 细菌α多样性分析
两种样品多样性指数分析见表2。如表所示,水开菲尔和水开菲尔粒的覆盖率均为0.999,表明测序深度能够代表样本的真实组成[19]。水开菲尔粒的Chao1、ACE、Shannon、Simpson指数显著(P<0.05)高于水开菲尔粒。上述结果表明,发酵剂水开菲尔粒的细菌丰富度及多样性更高。
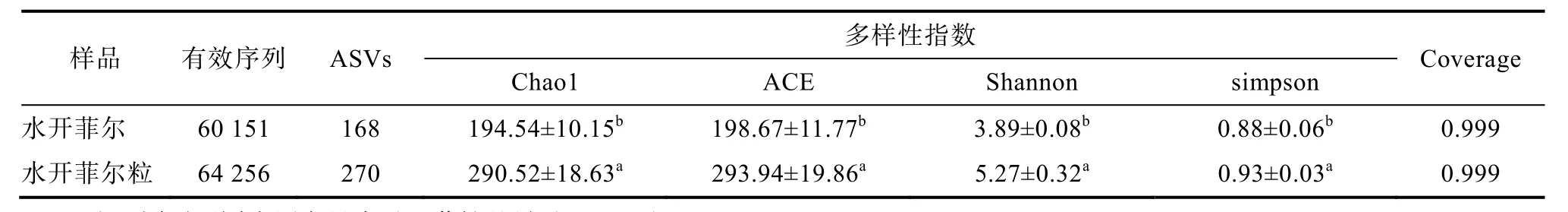
表2 两种样品多样性指数分析Table 2 Diversity index analysis of two samples
2.2.3 细菌的组成分布
基于门水平的细菌结构见图2,在门水平上,水开菲尔中厚壁菌门(79.58%)和变形菌门(19.88%)占总细菌的99.46%;水开菲尔粒中厚壁菌门(86.67%)和变形菌门(13.32%)占总细菌的99.99%。结果表明,水开菲尔与水开菲尔粒细菌区系相似,优势菌门均为厚壁菌门和变形菌门,其中厚壁菌门是最丰富的门,水开菲尔粒中厚壁菌门的含量高于水开菲尔。
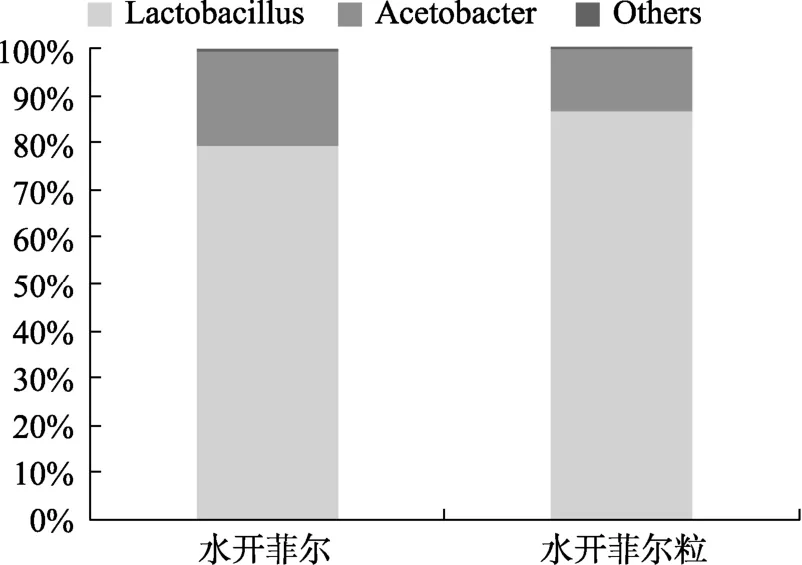
图2 基于门水平的细菌结构Fig.2 Bacterial structure based on gate level
两种样品的属水平结构组成见图3,水开菲尔中优势菌属是乳杆菌属和醋杆菌属,相对含量分别为79.42%、16.38%,上述两个属共占细菌群体的95.80%;水开菲尔粒中乳杆菌属(86.64%)和醋杆菌属(13.32%)占总细菌的99.96%。结果表明,水开菲尔与水开菲尔粒细菌区系相似,优势菌属均为乳杆菌属和醋杆菌属,其中乳杆菌属是最丰富的属,且其在水开菲尔粒中含量高于水开菲尔。有实验表明一些有害菌在pH<4.5环境中很难存活,但乳杆菌属耐酸性较强,能在较低pH值下正常生长繁殖,抑制有害菌生长,占据优势地位[20]。由此实验结果可知,样品中主要存在的菌为本实验后续筛选所需的乳酸菌,更进一步为本实验顺利进行奠定理论基础。
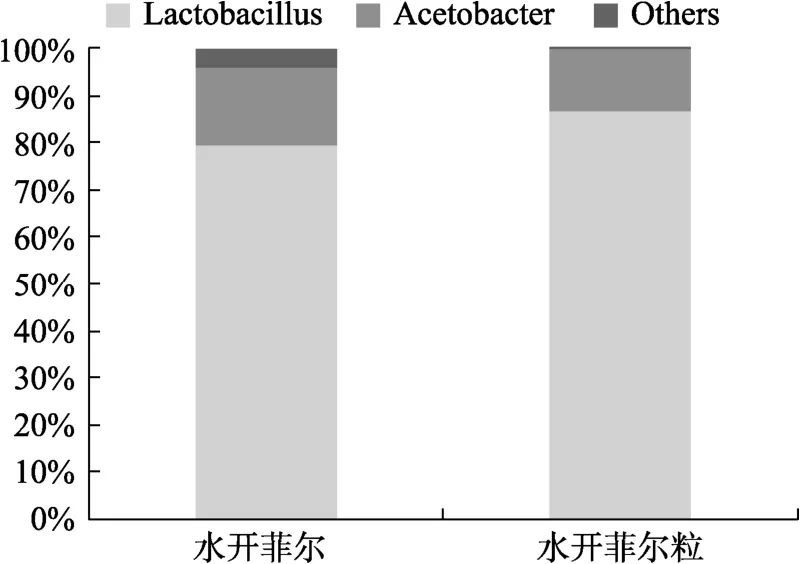
图3 基于属水平的细菌结构Fig.3 Bacterial structure based on genus level
2.3 水开菲尔和水开菲尔粒中潜在益生性乳酸菌的筛选
2.3.1 初筛
不同菌株的形态特征如表3所示,从水开菲尔和水开菲尔粒中共筛选出 30株革兰氏染色呈阳性,过氧化氢酶实验呈阴性,不含芽孢的菌株。通过油镜观察,多数菌株为杆状,少数为球形或卵圆形。

表3 初步筛选的不同菌株的形态特征Table 3 Morphological characteristics of different strainspreliminarily screened
2.3.2 复筛
初筛所得30株菌接种到MRS肉汤培养基中,37 ℃培养24 h,分别对其培养液进行耐酸性、胆盐耐受力的测定。
菌株耐酸性见表4,30株菌株菌体密度随pH值升高而不断上升,且存在差异。当pH值为3.0时,30株菌株均可以生长,但生长情况不同。王俊国[21]、Wang[22]等研究乳酸菌耐酸性,测定其活菌数时得到同样结论。一般认为,正常人在进食后,胃液pH值在3.0上下波动,消化时间需3 h,作为益生性乳酸菌需要有耐酸性而且可以在酸性环境中生长[23],所以这 30株菌可以随食物到达小肠。其中,cc9菌株的耐酸性最好,cc1、cc4、cc5、cc7、cc8、cc9、cc10、cc12、cc15、cc16、cc17、cc22、cc25、cc26、cc27的菌体密度均比较高,按大小依次排列。上述结果说明这15株菌株有很好的耐酸性,可以很好的存活在酸度低的环境中,对上述15株菌株做进一步的筛选。

表4 不同菌株的耐酸性Table 4 Acid tolerance of different strains
菌株胆盐耐受性:不同菌株的胆盐耐受能力存在差异[24-25],一般情况下,体内小肠胆盐浓度范围是0.03%~0.3%[23]。因此,作为益生性乳酸菌,必须能在0.3%胆盐浓度环境中存活并生长。菌株的胆盐耐受性见表5,同样培养24 h,15株菌的菌体密度在无胆盐培养基中很高,在含0.3%胆盐培养基中均下降。其中,cc1胆盐耐受性最强,为35.68%,高于郭均[23]等从水开菲尔中分离出的益生性乳酸杆菌,cc1>cc9>cc5>cc22>cc12>cc4>cc8,这7株菌株胆盐耐受性好,能够耐受消化道的高胆盐环境,顺利通过小肠到达大肠。
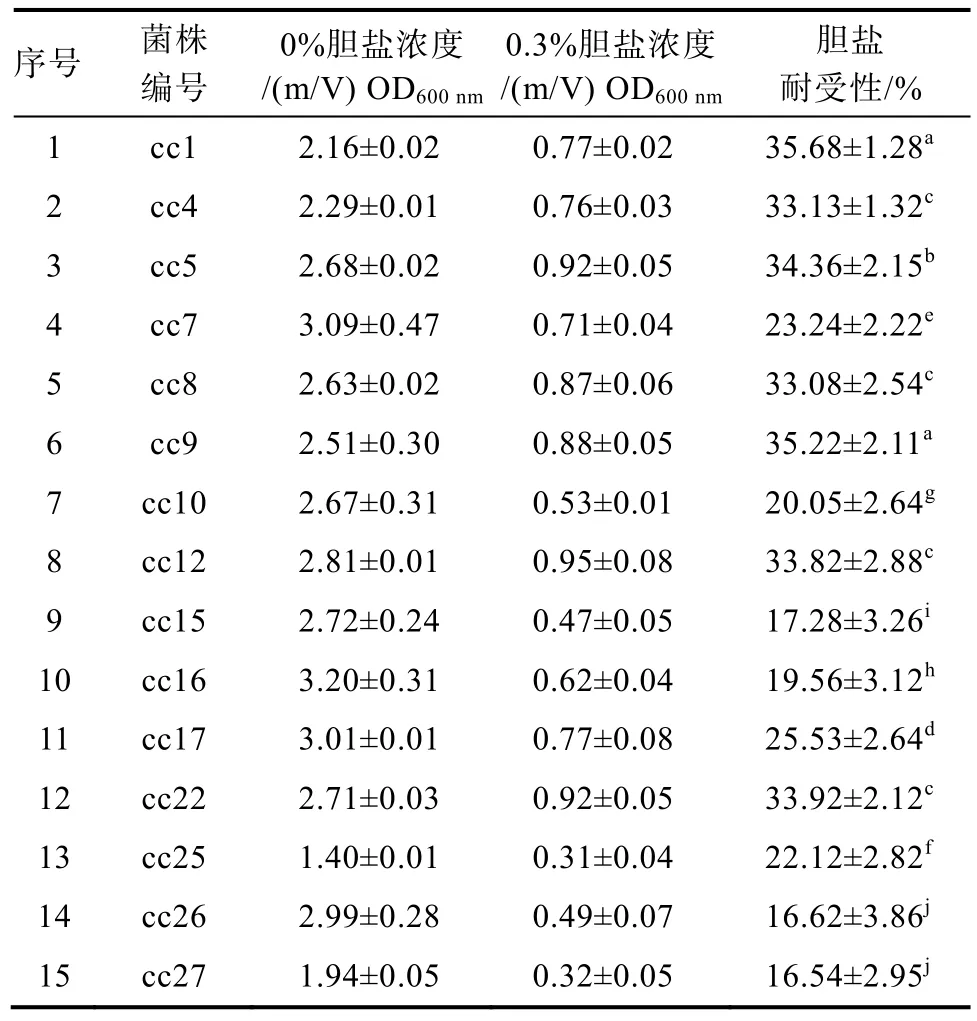
表5 不同菌株的胆盐耐受性Table 5 Bile salt tolerance of different strains
2.4 菌株的生理生化特征
2.4.1 个体、群体形态特征
通过油镜观察,7株菌株形态一致,呈杆状,菌落大小为1~3 mm,形态呈乳白色、圆形、边缘整齐、表面光滑,细胞分裂后排列方式为链状,革兰氏染色呈阳性,不含芽孢。
2.4.2 生理生化检测
生理生化结果见表6,其结果表明,这 7株菌不产吲哚、硫化氢,接触酶实验为阴性,硝酸盐实验呈阳性,不运动,具有一定耐酸耐盐性,将其初步归属为乳杆菌属。
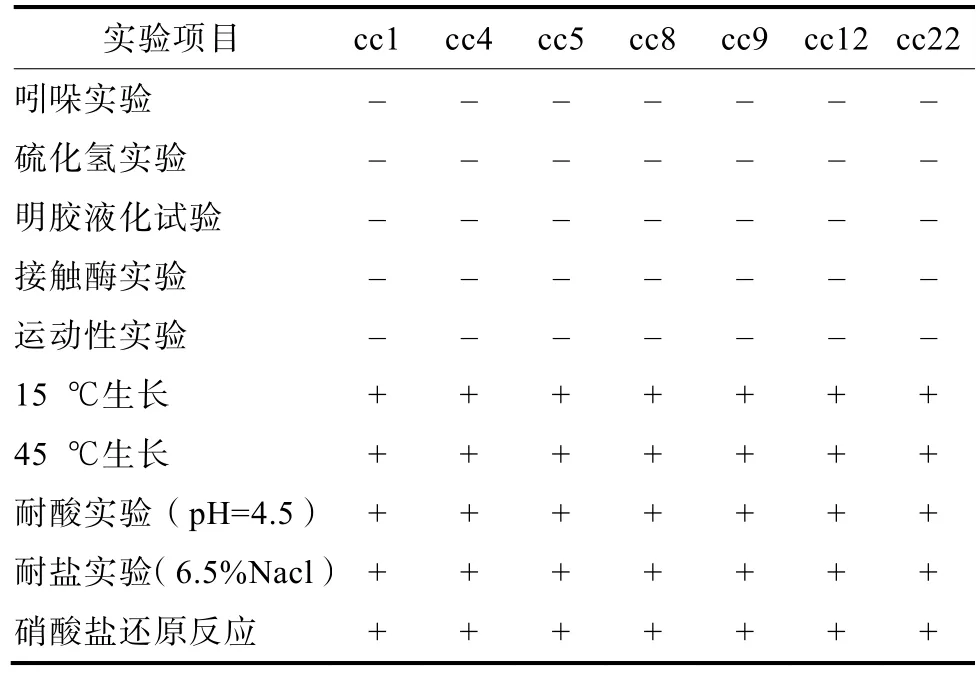
表6 菌株生理生化特性Table 6 Physiological and biochemical characteristics of strains
2.5 菌株的16SrDNA鉴定
筛选出7株乳酸菌cc1,cc4,cc5,cc8,cc9,cc12,cc22,其16SrDNA序列长度分别为1 454 bp,1 468 bp,1 457 bp,1 467 bp,1 467 bp,1 450 bp,1 439 bp。将其提交到Genbank经BLAST比对,系统发育树结果见图 4,cc1的亲缘性与Lactobacillus paracasei(MT613527.1)最接近,cc4的亲缘性与LimosiLactobacillus fermentum(MW405853.1)最接近,cc5的亲缘性与Lactobacillus harbinensis(MW405854.1)最接近,cc8的亲缘性与Lactobacillus fermentum(EU419595.1)最接近,cc9的亲缘性与Lactobacillus fermentum(MT611890.1)最接近,cc12的亲缘性与Lactobacillus satsumensis(MW405857.1)最接近,cc22的亲缘性与Lactobacillus fermentum(MT641196.1)最接近,相似度均>99%。结合个体和群体形态、生理生化实验及16S rDNA的分子测序结果,初步鉴定cc4、cc8、cc9、cc22为发酵乳杆菌,cc1为副干酪乳杆菌、cc5为哈尔滨乳杆菌、cc12为红条乳杆菌,GenBank号分别为MW405853、MW405855、MW405856、MW405858、MW405852、MW405854、MW405857,分别命名为Lactobacillus fermentumcc4、Lactobacillus fermentumcc8、Lactobacillus fermentumcc9、Lactobacillus fermentumcc22、Lactobacillus paracaseicc1、Lactobacillus harbinensiscc5、Lactobacillus satsumensiscc12。
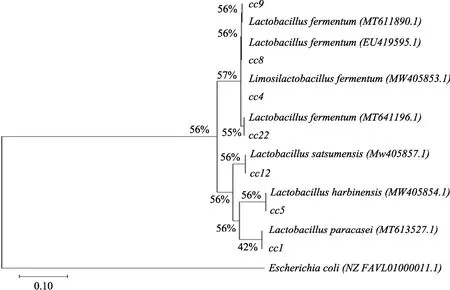
图4 菌株系统发育树Fig.4 Phylogenetic tree of strains
3 结论
采用高通量测序技术结合平板菌落计数法,检测分析了水开菲尔和其发酵剂水开菲尔粒两种样品的细菌组成中,优势门均为厚壁菌门和变形菌门,优势属均为乳杆菌属和醋杆菌属。为寻找具有潜在益生性的菌株,以耐酸性和胆盐耐受力为指标,从自然发酵水开菲尔和水开菲尔粒中筛选出 7株乳酸菌。经鉴定,4株为发酵乳杆菌:L. fermentumcc4、L. fermentumcc8、L. fermentumcc9、L. fermentumcc22,1株为副干酪乳杆菌:L. paracaseicc1,1株为哈尔滨乳杆菌:L.harbinensiscc5,1株为红条乳杆菌:L. satsumensiscc12。这些菌株可作为水开菲尔工业化发酵生产的备选菌株。
