猕猴桃褪绿环斑相关病毒RT-LAMP-LFD可视化检测方法的建立
2022-02-10邹佳伶彭期定王韵茹席德慧
邹佳伶, 彭期定, 王韵茹, 席德慧
(四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065)
1 引 言
猕猴桃是猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl.)的多年生落叶木质藤本经济林树种,其果实营养价值较高,含有丰富的维生素C和有机酸等,已成为我国重要的园艺农产品[1,2].四川省是我国猕猴桃的主要产区之一,其栽培面积和产量居全国前列,基本形成了秦巴山-龙门山脉的猕猴桃产业带[3-5].近年来,随着我国猕猴桃种植面积的增加,病毒病害在猕猴桃等园艺作物中发生普遍,对猕猴桃生长和产量的影响也逐渐凸显,已成为威胁猕猴桃产业发展的重要因素[6,7].目前,国内外约有19种感染猕猴桃的病毒被报道,其中,国内的猕猴桃主要种植区共检测到9种猕猴桃病毒[8,9],猕猴桃褪绿环斑相关病毒(Actinidiachloroticringspot associated virus,AcCRaV)是2013年从我国猕猴桃样品上首次被鉴定的负义单链RNA病毒,隶属于无花果花叶病毒科(Fimoviridae),欧洲山梣环斑病毒属(Emaravirus)[10,11].AcCRaV在我国猕猴桃上的分布范围较广,湖北、陕西、安徽和四川等地区均有报道,检出率为20%左右,症状大多表现为叶片褪绿、环斑和叶脉黄化等,潜在风险仍不明确[12,13].因此,建立高效和快捷的AcCRaV检测方法对病毒病害的防治和早期预警,具有十分重要的意义.
目前,针对AcCRaV的检测方法主要为反转录-聚合酶链式反应(Reverse transcription polymerase chain reaction,RT-PCR)[6],多重RT-PCR(Multiplex RT-PCR)和小RNA深度测序等[10-12],这些检测方法灵敏性和特异性较高,在一定程度上有助于病毒的检测和识别,但也存在着检测成本高,需要特定的仪器设备或者耗时费力等限制条件[14-16].近年来,一种在恒温条件下实现快速扩增的逆转录-环介导等温扩增技术(Reverse transcription loop-mediated isothermal amplification,RT-LAMP)已被广泛应用到植物RNA病毒的快速检测中[17,18].LAMP检测基于靶基因的6个区域设计4~6条特异引物,30~60 min即可完成扩增反应,同时,通过观察产物混浊程度或加入核酸染料后的颜色变化等可判定扩增效果,但肉眼评估颜色或浑浊度的变化存在一定的误差,影响检测结果的可靠性[19,20].近期,LAMP结合横向流动试纸条(Lateral flow dipstick,LFD)的检测方法在一定程度上能减少检测结果假阳性的现象,该方法已在水产微生物、食品微生物和植物病原菌的检测中得到广泛应用[20].LFD检测方法,利用生物素(Biotin,BIO)标记的LAMP扩增产物与异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的探针形成杂交产物,根据杂交产物和LFD中FITC抗体标记的胶体金形成复合物,通过抗体捕获和胶体金免疫层析技术,在试纸条上产生颜色变化来判断检测结果,具有快速、灵敏以及结果可视化等特点[21].
本研究将RT-LAMP与LFD检测方法结合,根据AcCRaV的外壳蛋白基因(Coat Protein,CP)序列设计了LAMP检测的特异性引物,通过扩增条件和反应体系的优化,建立了最佳扩增体系;同时,对LAMP引物进行BIO和FITC标记,建立了RT-LAMP-LFD的检测方法,使检测结果可视化,为AcCRaV的快速检测和猕猴桃病毒病害防控提供一种新的检测手段.
2 材料与方法
2.1 试验材料
2016年至2019年,本实验组分别从四川不同地区采集猕猴桃(Actinidiaspp.)疑似病毒感染叶片样品及健康叶片样品,所有样品均保存于-80 ℃冰箱备用.经RT-PCR鉴定含有柑橘叶斑驳病毒(Citrusleaf blotch virus,CLBV)、猕猴桃褪绿环斑相关病毒(Actinidiachloroticringspot-associated virus,AcCRaV)、猕猴桃病毒1(Actinidiavirus 1,AcV-1)以及猕猴桃病毒A(Actinidiavirus A,AcVA)的猕猴桃样品作为实验对照,由本实验室保存[12].
实验相关试剂包括:Bst DNA聚合酶,MgSO4(100 mmol/L)以及dNTPs(10 mmol/L)购自New England Biolabs公司;HybriDetect横向流动试纸条试剂盒(MGHD1)购自Milenia biotec公司;1000×SYBRGreen Ⅰ 核酸染液购自Solarbio公司.
2.2 方 法
2.2.1 RT-LAMP及RT-PCR引物的设计 根据GenBank中的AcCRaV的基因序列,以AcCRaV的外壳蛋白核苷酸序列为目标基因,通过DNAMAN V6进行多重序列比对,选择序列相对保守的区域作为引物设计的靶基因序列,如图1所示.利用在线引物设计软件Primer Explorer V5 (http://primer explorer.jp/e/)进行LAMP引物的设计,比较各组引物的GC含量和引物末端稳定性等因素,选择合适的LAMP扩增引物.为实现扩增产物结果的可视化,将引物FIP和BIP的5′末端分别用生物素(Biotin)和异硫氰酸荧光素(FITC)进行标记,同时,RaV-F/R引物用于常规RT-PCR检测,上述引物和修饰引物均由生工生物工程(上海)股份有限公司合成,LAMP引物序列信息如表1所示.
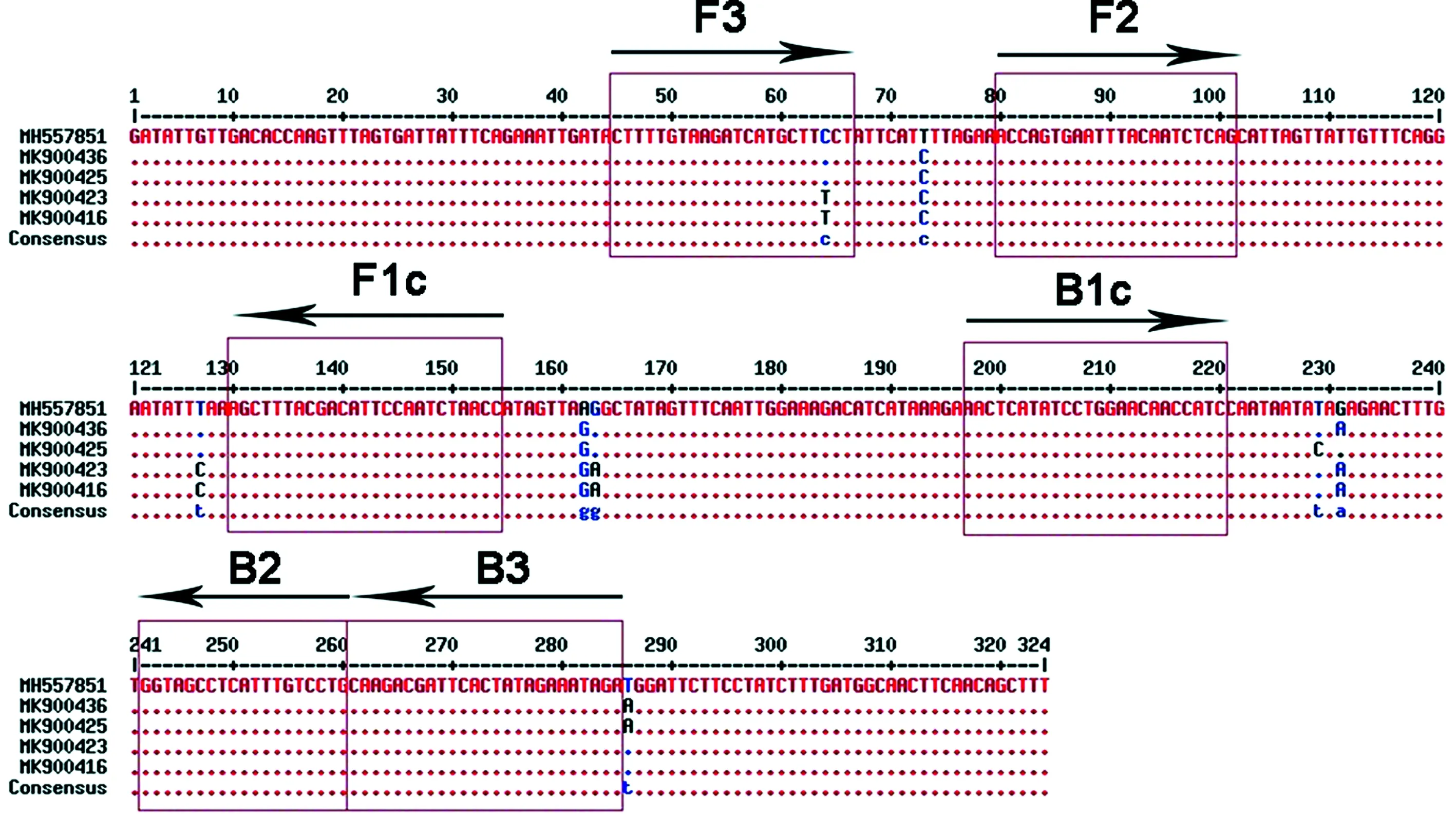
图1 AcCRaV的RT-LAMP引物在外壳蛋白基因序列的位置箭头表示外引物(F3, B3),正向内引物FIP (F1c + F2),反向内引物BIP (B1c + B2)的位置和方向Fig.1 Position of the designed RT-LAMP primers in coat protein gene of AcCRaV

表1 猕猴桃褪绿环斑相关病毒的RT-LAMP 和RT-PCR引物序列信息Tab.1 List of primers used for detection of AcCRaV by RT-LAMP and RT-PCR in this study
2.2.2 总RNA提取及cDNA合成 猕猴桃叶片样品经液氮研磨后,根据CTAB法用于提取猕猴桃样品总RNA[4,12],总RNA浓度和质量使用Nano Photometer P-330(Implen GmbH,Munich,Germany)测定,选择浓度大于0.1μg / μL的总RNA用于后续试验.以提取的总RNA为模板逆转录合成cDNA,反应体系为20 μL,参照PrimeScript Ⅱ 1st Strand cDNA合成试剂盒(TaKaRa, Dalian, China)完成cDNA的合成,并将产物存于-20 ℃备用.
PCR反应总体系为25 μL:含2×Taq Master Mix 12.5 μL,上、下游引物(10 μmol / μL)各1 μL,cDNA 2 μL和ddH2O 8.5 μL PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸45 s,循环34次;72 ℃延伸5 min.
2.2.3 RT-LAMP扩增反应条件优化 参照Bst2.0 WarmStart DNA聚合酶推荐的扩增反应进行扩增,反应体系为25 μL,包括WarmStart DNA聚合酶 2.5 μL、Mg2+(100 mmol/L) 1.5 μL、dNTPs(10 mmol/L) 2.5 μL、F3/B3(10 μmol/L)各0.5 μL、FIP/BIP(10 μmol/L)各4 μL、扩增模板2 μL,加水补足至25 μL,60 ℃下恒温反应1 h,扩增产物经浓度为2%的琼脂糖凝胶电泳检测.
为达到最佳的扩增效果,采用控制单一变量法,对LAMP扩增反应条件(Mg2+和dNTPs浓度,LAMP内外引物比例,扩增温度和扩增时间)进行优化.dNTPs浓度优化时,保持其他扩增条件不变,dNTPs反应终浓度设为0.2~1.0 mmol/L等5个浓度梯度, 以0.2 mmol/L依次递增;在最佳dNTPs浓度下,Mg2+浓度设定为2~10 mmol/L等5个浓度梯度,以2 mmol/L依次递增;内外引物比(FIP/BIP: F3/B3)优化时,使反应体系中外引物(F3和B3)终浓度保持0.2 μmol/L不变,内外引物比例分别为1∶1,2∶1,3∶1,4∶1,5∶1,6∶1,7∶1,8∶1.得到LAMP扩增的最佳反应体系后,将恒温扩增温度设为56,57,58,59,60,61,62和63 ℃等8个温度梯度,确定最佳反应温度;在最佳反应体系和扩增温度下,将扩增时间设为30,40,50,60,70和80 min等6个梯度,确定LAMP反应的最适扩增温度.
2.2.4 RT-LAMP扩增产物检测方法 RT-LAMP扩增产物可通过2%的琼脂糖凝胶电泳、加入核酸染料判断染色变化以及横向流动试纸条检测等3种方式对扩增结果进行分析[8].琼脂糖凝胶电泳检测利用凝胶成像系统观察结果,出现梯度条带则检测结果为阳性,没有条带产生则检测结果为阴性(图2a).核酸染料检测通过在反应产物中加入0.5 μL SYBR Green Ⅰ(10 000×)核酸染料,混匀后观察溶液颜色变化,有扩增产物生成则溶液颜色为绿色,没有产物生成溶液颜色为橙色(图2b).侧向流动试纸条(LFD)检测时,3 μL反应产物添加到装有100 μL的HybriDetect分析缓冲液的离心管中,放入横向流动试纸条,孵育5 min,若试纸条的检测线(Test line)和质控线(Control line)均出现明显条带,则有扩增产物生成;仅在质控线上有明显条带则检测结果为阴性,没有扩增产物生成(图2c).

图2 RT-LAMP产物的三种检测方法(a) 琼脂糖凝胶电泳检测结果;(b) 添加SYBR Green Ⅰ后的检测结果;(c) LFD检测结果; M:DNA marker DL 5000;1:阳性结果;2:阴性对照Fig.2 Three detection methods for the production of RT-LAMP
2.2.5 RT-LAMP-LFD特异性测定 在最佳RT-LAMP反应体系下,分别以本实验室保存的被CLBV、AcCRaV、AcVA和AcV-1的阳性猕猴桃样品为模板,进行RT-LAMP扩增,反应结束后,分别进行琼脂糖凝胶电泳,加入核算染料SYBR Green I和LFD三种方法来评价RT-LAMP的检测特异性.
2.2.6 RT-LAMP-LFD的灵敏性评价 为评价建立的RT-LAMP的检测灵敏性,提取感染了AcCRaV的猕猴桃叶片样品总RNA,经IMPLEN超微量分光光度计进行浓度测试,将反转录后的cDNA按10倍梯度稀释法稀释至10-8,以系列稀释的cDNA为模板,进行RT-PCR和RT-LAMP扩增反应.分别进行琼脂糖凝胶电泳,加入核算染料SYBR Green Ⅰ和LFD三种方法,评价RT-LAMP的检测的灵敏性.
2.2.7 RT-LAMP-LFD检测方法的应用 为评估建立的RT-LAMP-LFD检测方法在田间猕猴桃中的检测效果,分别对疑似病毒侵染的猕猴桃样品进行RT-LAMP和普通RT-PCR检测,普通RT-PCR 体系检测选用引物为RaV F/R.RT-LAMP反应完成后,分别以琼脂糖凝胶电泳和LFD检测方法对产物结果进行判断.
3 结果与分析
3.1 RT-LAMP检测AcCRaV最佳反应体系的建立
为获得最佳的检测效果,对扩增反应的dNTPs和Mg2+浓度,内引物(FIP/BIP)和外引物(F3/B3)浓度比以及反应温度和时间进行优化,结果如图3所示.在dNTPs浓度优化中,低浓度0.2 mmol/L下,扩增产物没有梯形条带产生,加入荧光染料后颜色为橙色;当dNTPs浓度在0.4~1.0 mmol/L时,扩增产物清晰且明显,加入荧光染料后颜色变为深绿色;当dNTPs浓度为0.8 mmol/L时,扩增产物形成的梯状电泳条带比其他浓度下更清晰,明亮,因此0.8 mmol/L的dNTPs为最佳浓度(图3a).对Mg2+浓度的优化中,随着Mg2+浓度的增加,电泳检测形成的梯形条带逐渐清晰,当浓度为6~8 mmol/L时,扩增产物条带清晰明亮,扩增效率较高,因此,选择Mg2+的反应浓度为6 mmol/L(图3b).在内外引物浓度比例(FIP/BIP: F3/B3)优化中,当内外引物浓度比为1∶1和2∶1时,扩增产物条带较弱,内外引物浓度比为5∶1时,扩增效果最佳,因此,最适内外引物浓度比例为5∶1(图3c).
相关的研究报道表明,适宜的扩增温度和反应时间与DNA聚合酶的活性和反应的稳定性相关[18],对扩增温度的优化结果表明:扩增温度为56~58 ℃时,电泳后没有梯形条带产生,且加入荧光染料后颜色为橙色;温度为59~61 ℃时,电泳中扩增产物条带逐渐清晰;扩增温度为62 ℃时,条带最清晰,明亮,因此,最佳扩增温度为62 ℃(图3d).为缩短检测时间,对RT-LAMP反应时间进行优化,结果如图3e所示,反应时间过短,没有梯形条带产生,当反应时间在60 min及其以上时,扩增产物的趋于稳定,电泳产生的梯形条带清晰且明亮,加入荧光染料后颜色均呈现绿色,因此,检测AcCRaV的最佳反应时间为60 min.

图3 RT-LAMP检测AcCRaV的反应条件优化(a):dNTPs浓度;(b):MgSO4浓度;(c):内外引物浓度比例(FIP/BIP: F3/B3);(d):反应温度;(e):反应时间;M:DNA marker DL 5000;N:阴性对照(无菌ddH2O为模板)Fig.3 Optimization of RT-LAMP reaction conditions in detection of AcCRaV
3.2 RT-LAMP检测AcCRaV的特异性
为评价RT-LAMP-LFD检测方法的特异性,以CLBV,AcCRaV,AcV-1和AcVA病毒感染样品的cDNA为模板,进行RT-LAMP扩增反应.结果如图4所示,以AcCRaV感染的猕猴桃样品cDNA为模板时,FITC标记的RT-LAMP扩增产物在LFD试纸条的检测线和质控线上均有明显条带,而其它样品及阴性对照仅在质控线上有条带产生(图4c).同样地,琼脂糖凝胶电泳结果与LFD试纸条结果一致,仅在AcCRaV感染样品的扩增产物中有梯形电泳条带生成,而阴性对照和CLBV,AcV-1和AcVA感染样品的扩增产物中均没有条带产生(图4a).并且,在扩增产物中加入SYBR Green I核酸染料后,发现AcCRaV感染样品的RT-LAMP产物颜色变为绿色,阴性对照和其它样品扩增产物颜色为橙色(图4b),这表明,建立的RT-LAMP-LFD检测方法对AcCRaV具有较好的特异性.

图4 RT-LAMP-LFD检测AcCRaV的特异性(a):琼脂糖凝胶电泳检测结果;(b):添加SYBR Green Ⅰ后的检测结果;(c):LFD检测结果;(d):反应温度;(e):反应时间; (m):DNA marker DL 5000;N:阴性对照(无菌ddH2O为模板);1:CLBV;2:AcCRaV;3:AcVA;4:AcV-1Fig.4 Specificity of RT-LAMP-LFD assays in detecting AcCRaV
3.3 RT-LAMP-LFD检测AcCRaV的灵敏度评价
为明确建立的RT-LAMP-LFD检测方法对AcCRaV检测的灵敏度,本实验将AcCRaV感染的猕猴桃样品cDNA进行10倍梯度稀释(100~ 10-8),以稀释后的cDNA为反应模板,分别进行RT-LAMP 和RT-PCR扩增反应,通过凝胶电泳,添加核酸染料和横向流动试纸条3种检测方法判断扩增结果.检测结果表明,随着模板稀释倍数的增加,电泳生成的梯形条带逐渐减弱,且在扩增产物中加入LFD试纸条后,检测线的条带也逐渐减弱,当稀释倍数为10-7时,梯形条带消失,LFD试纸条检测线条带消失(图5a,5c);在常规RT-PCR检测中,当稀释倍数为10-5时,无扩增条带产生(图5d).当稀释倍数大于10-6时,在RT-LAMP的扩增产物中,加入核酸染料后颜色均为橙色(图5b),在扩增产物中加入LFD试纸条后,仅在质控线上产生条带,这表明稀释倍数大于10-6均无扩增产物生成(图5c),以上结果表明,建立的RT-LAMP结合横向流动试纸条检测灵敏度比常规RT-PCR高100倍.

图5 RT-LAMP和RT-PCR检测AcCRaV的灵敏度比较(a)和(d)琼脂糖凝胶电泳检测结果;(b)添加SYBR Green Ⅰ后的检测结果;(c) LFD检测结果;1~9:cDNA的不同稀释倍数(100 ~10-8);M:DNA marker DL 5000;N:阴性对照(无菌ddH2O为模板)Fig.5 Comparation of the sensitivity between RT-LAMP and RT-PCR in detecting AcCRaV
3.4 RT-LAMP-LFD检测猕猴桃中AcCRaV的应用
为评估建立的RT-LAMP对田间猕猴桃样品中AcCRaV检测的可行性,利用建立的RT-LAMP-LFD检测方法对15份猕猴桃样品进行检测,并同时采用常规RT-PCR验证其准确性.结果如图6所示,在常规RT-PCR检测中,共有10份样品受到了AcCRaV的侵染,其中4号和9号样品条带较弱(图6c).在RT-LAMP检测中,通过凝胶电泳对扩增产物进行分析,有8份样品的扩增产物有明显的梯形条带,2份样品扩增产物的梯形条带较弱(图6a).通过LFD试纸条检测扩增产物时,有10份样品在试纸条中产生两条红色条带,其中,4号和9号样品与凝胶电泳检测结果相似,在试纸条中,控制线上的出现的条带较弱(图6b).以上结果表明,RT-LAMP结果与RT-PCR方法检测结果一致,因此,建立的RT-LAMP结合横向流动试纸条的检测方法准确度高,可实现检测结果的可视化.
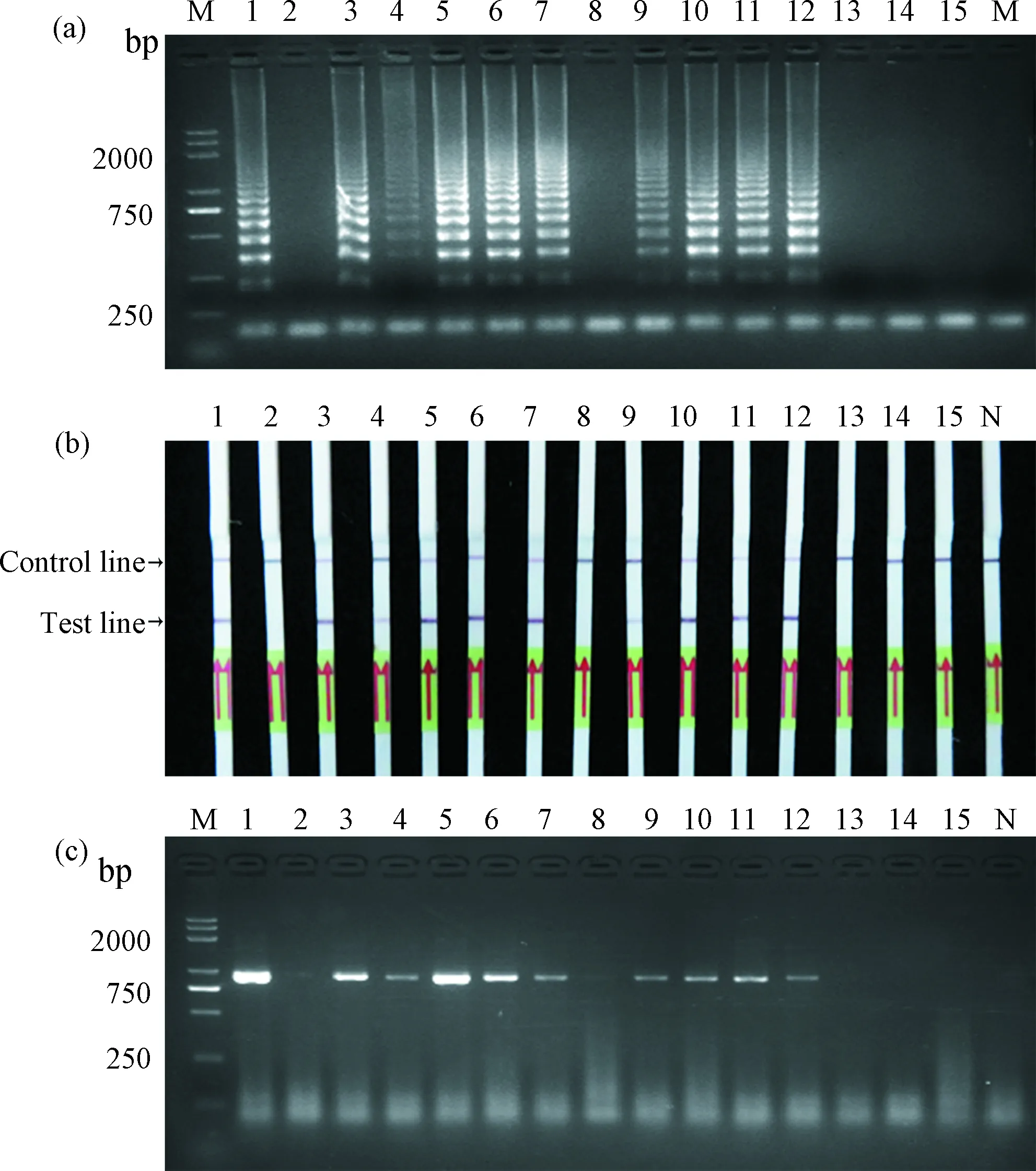
图6 RT-LAMP-LFD和RT-PCR检测田间猕猴桃样品(a)和(c):琼脂糖凝胶电泳检测结果;(b): LFD检测结果;1~15:田间猕猴桃样品;M:DNA marker DL 5000;N:阴性对照(无菌ddH2O为模板)Fig.6 RT-LAMP-LFD and RT-PCR detection of kiwifruit samples in the field
4 讨 论
猕猴桃是我国重要的园艺作物,其种植面积和年产量均超过世界其它地区猕猴桃种植面积和产量的总和[5].四川地区气候温和,种质资源丰富,已成为我国猕猴桃的主要栽培区[4,8].在猕猴桃病毒病的调查和种类鉴定中,相关研究表明病毒病害在猕猴桃中发生普遍,在中华猕猴桃(Actinidiachinensis)、美味猕猴桃(Actinidiadeliciosa)以及软枣猕猴桃(Actinidiaarguta)等多种猕猴桃栽培品种中均有病毒感染的现象[7,9,13].猕猴桃褪绿环斑相关病毒在我国主要猕猴桃种植区均有侵染猕猴桃的相关报道,本研究组在四川猕猴桃中也检测到了该病毒,且在田间存在着多种病毒复合感染猕猴桃的现象[6,10,12].目前,随着高精度检测仪器和高通量测序技术的应用,一些新的病毒已经在猕猴桃中被鉴定和报道,但这些检测方法成本相对较高、耗时较长.近年来,环介导等温扩增技术(LAMP)结合横向流动试纸条的检测方法因其具有特异性强,灵敏性高,检测结果可视化等优点,已广泛应用于食品和动植物检疫等方面[8,14,21].
本研究建立了针对AcCRaV的RT-LAMP-LFD检测方法,根据AcCRaV外壳蛋白基因序列,选择CP基因保守区域设计了特异性引物,通过特异性实验验证了RT-LAMP引物的特异性.由于LAMP扩增效率与LAMP反应条件密切相关[14],我们对RT-LAMP反应条件进行了优化.当dNTPs浓度为0.2 mmol/L时,RT-LAMP反应无扩增产物生成,dNTPs浓度在0.4~1.0 mmol/L时,扩增产物形成清晰且明显的梯形电泳条带,表明低浓度的dNTPs对等温扩增具有较大影响.扩增温度选择在60~62 ℃时,扩增效率相对较高,但在低温或高温下,扩增产物相对较少,这可能是由于等温扩增的DNA聚合酶在过低,过高的温度下引起的扩增反应不稳定或酶失活所引起;同时,不同反应温度下,RT-LAMP扩增引物和阳性样品cDNA模板结合能力的改变也可能影响扩增产物的生成[18,22].此外,Mg2+浓度的增加,在一定程度上能有利于增强RT-LAMP的扩增效果,Mg2+在4~10 mmol/L浓度范围内,均能实现对AcCRaV的有效扩增,表明Mg2+对RT-LAMP扩增是必要的,这与之前的相关报道结果一致[17].
本研究中,我们对建立的RT-LAMP-LFD检测灵敏度进行测定,发现该方法检测AcCRaV的灵敏性较常规RT-PCR高100倍,该方法在许多植物病毒检测中也表出更高的检测灵敏度[15,18],这可能是相对于普通RT-PCR只能识别目标基因的两个区域,LAMP引物能识别靶基因的6个不同区域有关[8,14].目前,LAMP检测结果可通过观察白色沉淀、凝胶电泳、SYBR Green Ⅰ或钙黄素染色可视化等方法进行判断[14,15],本研究将LAMP与LFD试纸条结合,利用生物素和FITC标记的LAMP杂交产物特异性结合到LFD试纸条进行结果判定,避免了琼脂糖凝胶电泳产生气溶胶,以及插入类似核酸染料可能形成非特异性结合dsDNA等假阳性结果,实现了检测结果的可视化[8,14,21].
综上所述,本研究建立了RT-LAMP结合LFD试纸条检测猕猴桃中AcCRaV的可视化检测方法.该方法可以成功从猕猴桃样品中检测到AcCRaV,同时,RT-LAMP-LFD检测方法相对于常规RT-PCR,对AcCRaV具有较高灵敏性.RT-LAMP-LFD检测方法在62 ℃ 恒温条件下,扩增60 min,进行5 min LFD试纸条孵育后即可完成检测反应,检测结果可通过试纸条肉眼判断,具有简便,快捷和结果可视化等优点,这将为猕猴桃病毒的检测提供了有力的手段,还可为其他植物病毒的检测提供参考.
