蒺藜苜蓿cation/H+exchanger基因家族鉴定及表达特征分析
2022-02-10吴彤刘云苗金军董伟峰才晓溪孙明哲贾博为孙晓丽
吴彤,刘云苗,金军,董伟峰,才晓溪,孙明哲,贾博为,孙晓丽
(黑龙江八一农垦大学作物逆境分子生物学实验室,黑龙江 大庆 163319)
苜蓿(Medicago truncatula)属于豆科模式植物,因其营养丰富、蛋白含量高、可生物固氮等优点,享有“牧草之王”的美称。除了作为重要的饲料作物外,也是生态环境建设中重要的植物材料,具有改良土壤、保持水土的功能[1]。苜蓿的种植水平在一定程度上反映了一个国家畜牧业的发展水平[2]。但是,随着环境问题的凸显,如土壤盐碱化、干旱、低温等逆境胁迫,苜蓿产业受到了严重的威胁。随着生物技术的飞速发展,通过分子设计育种培育抗逆苜蓿新品种是提高苜蓿产量的有效途径之一。然而,其关键在于挖掘抗逆关键调控基因。
由于植物的固定性、不可移动性以及与自然环境的统一性,在遭受外界不利因素的影响时,通过调控自身生理生化变化来缓解胁迫伤害。钾是植物重要的必需元素,在维持细胞电荷平衡、离子平衡、细胞膨压、酶活性调节等方面具有重要的功能[3]。CHX(cation/H+exchanger)家族是CPA超家族的一个亚家族,参与植物细胞K+转运[4]。CPA超家族分为CPA 1和CPA 2两个亚家族,CPA 1亚家族包括NHX家族,而CPA 2亚家族包括KEA和CHX家族[5]。研究发现CHX家族成员都包含约800个氨基酸,其中N端约有400个氨基酸组成了CHX家族的疏水性保守结构域cation/H+exchanger。目前多个物种的CHX家族已被鉴定,如拟南芥(Arabidopsis thaliana)CHX家族有28个成员,在K+稳态、渗透调节、花粉发育等方面起着重要作用[6]。AtCHX13和AtCHX14都作为钾离子内向转运体发挥功能[7—8]。AtCHX17也参与调控K+转运,缺K+时,atchx17突变体根部K+积累低[9]。AtCHX20调控K+转运在细胞渗透调节中扮演重要角色[10]。大豆(Glycine max)共有40个CHX基因,在花中高表达[11]。野生大豆(Glycine soja)包含有34个CHX成员,其中GsCHX19.3在花中高表达,并响应中性盐和苏打盐碱胁迫,GsCHX19.3超量表达能够显著提高过表达拟南芥钾离子含量[12]。水稻(Oryza sativa)CHX家族有17个成员,OsCHX14的表达受JA通路影响,调控水稻开花期钾离子稳态[13]。苹果(Malus pumila)中发现了33个CHX成员,在K+的转运过程中发挥重要作用,超过60%的成员在根中表达量高,这也说明了CHX家族成员对K+吸收的重要作用[14]。
现有研究表明CHX在对K+转运方面具有重要作用,但是目前苜蓿CHX基因家族的研究尚未见报道。本研究通过对蒺藜苜蓿(Medicago truncatula)CHX基因家族的生物信息分析,了解其发育、结构及表达特征,为后续苜蓿CHX基因抗逆功能研究及抗逆苜蓿新品种培育提供宝贵的基因资源。
1 材料与方法
1.1 蒺藜苜蓿CHX基因筛选与结构分析
根据已发表的拟南芥CPA家族蛋白序列,利用HMMER软件构建隐马尔可夫模型[5—6]。在Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)[15]数据库下载蒺藜苜蓿全基因组和蛋白组序列信息,通过命令提示符在HMM文件里输出蒺藜苜蓿CPA家族基因OUT文件。进一步通过拟南芥和蒺藜苜蓿CPA家族的系统发 生 分 析、Pfam(http://pfam.xfam.org)[16]、SMART(http://smart.embl-heidelberg.de/)[17]和 基于NCBI的CD search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)[18]核实保守结构域,去除冗杂基因,最终获得蒺藜苜蓿CHX家族成员。并利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)网站预测跨膜结构 域,综 合SoftBerry(http://linux1.softberry.com/all.htm)、PSORT(https://www.genscript.com/psort.html)[19]以及CELLO(http://cello.life.nctu.edu.tw/)网站预测蛋白亚细胞定位。利用ClustalX进行序列比对。
1.2 蒺藜苜蓿CHX基因染色体定位及同源性分析
从Phytozome数据库获取蒺藜苜蓿、拟南芥和水稻全基因组注释文件,通过TBtools[20]提取染色体位置信息。利用OrthoVenn2(https://orthovenn2.bioinfotoolkits.net/home)[21]分析CHX家族基因物种间及物种内的直系同源、旁系同源关系,结合染色体长度和基因位置信息,利用TBtools软件进行可视化[20]。
1.3 蒺藜苜蓿CHX基因进化关系分析
利用MEGA-X软件对47个蒺藜苜蓿,28个拟南芥CHX成员进行ClustalW多重序列比对,采用极大似然法(maximum likelihood,ML)构建蒺藜苜蓿和拟南芥CHX系统进化树,并采用自展法(bootstrap)进行检验,数值设置为1000[22]。
1.4 蒺藜苜蓿CHX基因结构分析
基于Phytozome获取的蒺藜苜蓿CHX序列信息,采用TBtools分析基因外显子—内含子结构。并利用NCBI的CD search分析47个蒺藜苜蓿CHX保守结构域,采用MEME(https://meme-suite.org/meme/)[23]分析保守基序,通过TBtools进行可视化[20]。
1.5 蒺藜苜蓿CHX基因顺式作用元件分析
通过TBtools软件提取47个蒺藜苜蓿CHX基因启动子序列,利用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[24]预测顺式作用元件,并将结果用TBtools可视化[20]。
1.6 蒺藜苜蓿CHX基因表达分析
基于ePlant(http://bar.utoronto.ca/eplant_medicago/)[25]获取蒺藜苜蓿CHX基因在不同组织器官的表达数据,基于测序数据获得胁迫下蒺藜苜蓿CHX基因胁迫表达,利用TBtools可视化[20]。
1.7 数据处理
采用Excel 2019对数据进行统计分析,并利用TBtools作图[20]。
2 结果与分析
2.1 蒺藜苜蓿CHX基因家族鉴定
利用已发表的拟南芥CPA成员(AtCHXs、AtKEAs、AtNHXs)蛋白序列信息[26—28],基于HMMER分析,构建隐马尔可夫模型,并以此来搜索蒺藜苜蓿蛋白数据,初步获得了62个蒺藜苜蓿CPA基因。进一步利用MEGA—X将其与拟南芥CPA成员构建系统发育进化树(图1),其中48个基因属于CHX亚家族,8个与AtNHXs属于同一分枝,其余6个与AtKEAs聚合在一起。进一步利用Pfam、SMART和基于NCBI的CD search对48个苜蓿CHX蛋白序列分析,核实其Na+/H+exchanger结构域的准确性和完整性。结果发现Medtr3g083860基因蛋白序列全长只有232个氨基酸,且序列上不存在任何结构域,最终共获得47个苜蓿CHX。
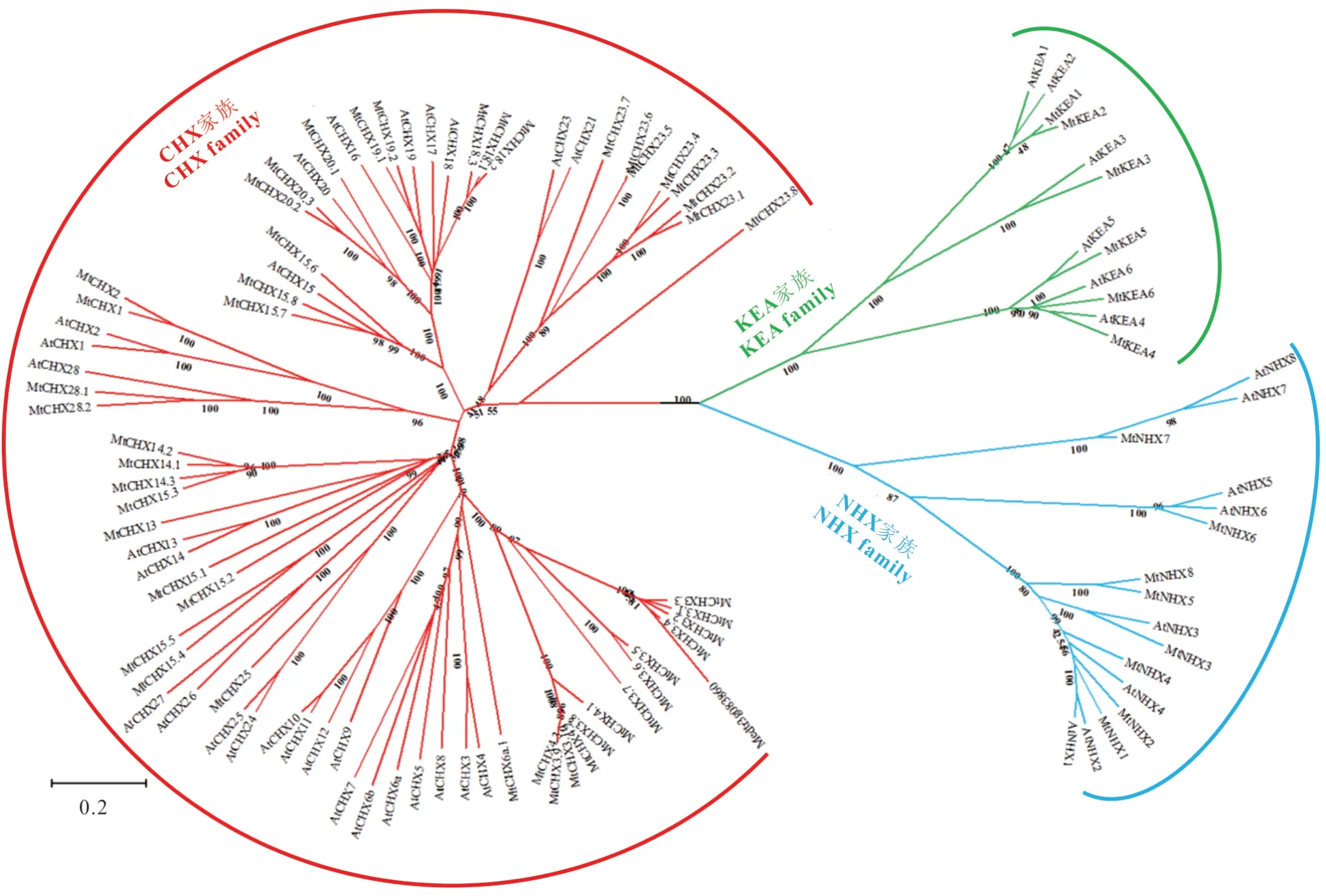
图1 蒺藜苜蓿与拟南芥CPA成员进化关系分析Fig.1 Evolutionary analysis of CPA family members between M.truncatula and A.thaliana
鉴于大豆和苹果CHX成员按照其与拟南芥CHX相似性命名[11,14],据此将蒺藜苜蓿CHX成员重新命名(MtCHX1-MtCHX28.2),具体信息见表1。氨基酸序列长度从729~920不等,其中MtCHX3.8、MtCHX3.10、MtCHX4.1、MtCHX4.2、MtCHX4.3和MtCHX15.5这6个基因的转录序列(transcript sequence)、编码序列(coding sequence,CDS)、蛋白序列长度完全一致。经过序列比对,发现6个基因序列相似度达到78.71%(图2)。尤其是MtCHX3.10、MtCHX4.2、MtCHX4.3基因序列只有几个碱基的差别,相似度高达99.31%。相似度较高暗示了这些基因间存在紧密的复制关系,新成员的产生可能来自基因组的大规模复制,继而形成了基因簇。进一步的蛋白亚细胞定位预测结果显示,MtCHXs作为质膜蛋白发挥功能。
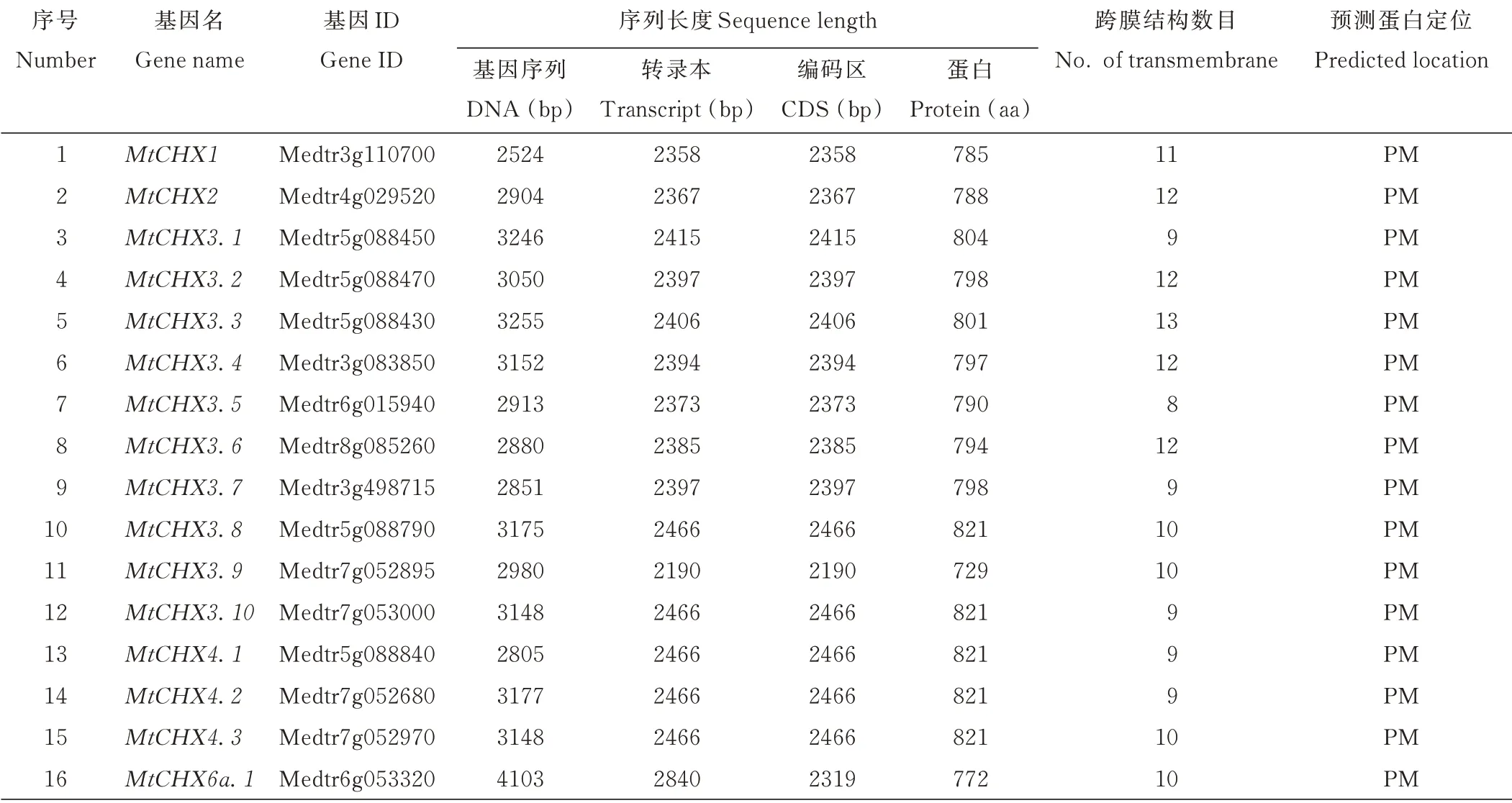
表1 蒺藜苜蓿CHX基因家族成员信息Table 1 Information of CHX family genes from M.truncatula
2.2 蒺藜苜蓿CHX基因家族同源性分析
进一步对47个MtCHXs染色体定位分析,通过图3可以看出,47个成员分布在8条染色体上。其中,3号和5号染色体上的基因数目均高达13个,7号染色体上也有8个成员,其余染色体上均有1~4个基因不等,而MtCHX23.4未定位在任何染色体上,未在图中展示。通过蒺藜苜蓿、拟南芥和水稻CHX成员同源性分析,在蒺藜苜蓿物种内获得108对旁系同源基因对。此外还发现蒺藜苜蓿和拟南芥中有16对直系同源基因,蒺藜苜蓿和水稻中检测出6对直系同源基因,水稻和拟南芥中检测出4对直系同源基因,由此可以看出,双子叶植物蒺藜苜蓿和拟南芥亲缘关系近,而与单子叶植物水稻的亲缘关系远。亲缘关系越近,直系同源基因相对多,也可能表现出更相似的功能。
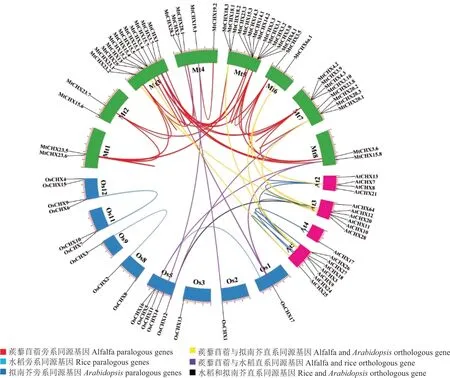
图3 蒺藜苜蓿CHX与拟南芥、水稻直系和旁系同源基因分布Fig.3 Paralogous and orthologous analysis of CHX family from alfalfa,Arabidopsis and rice
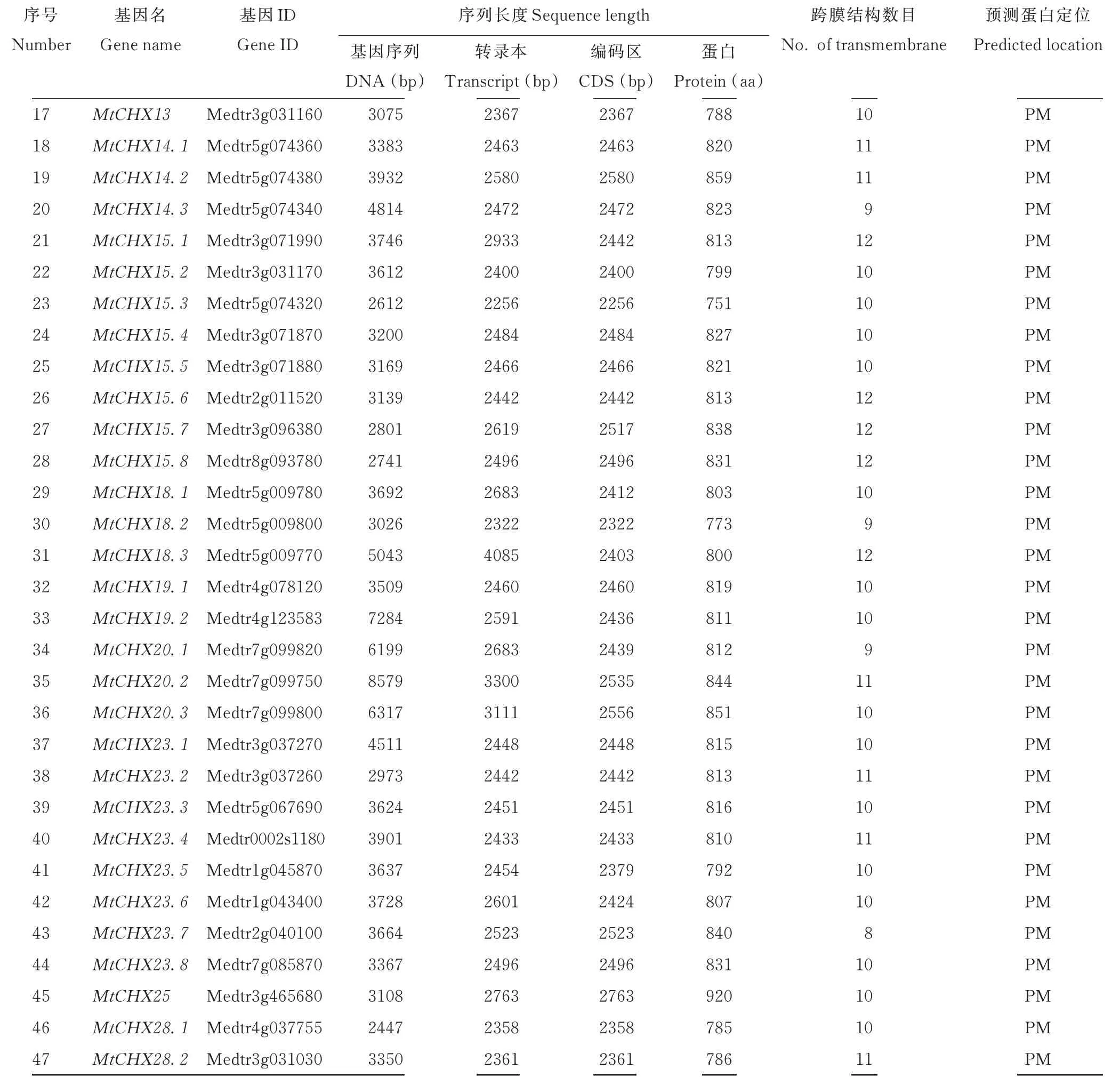
续表Continued Table
2.3 蒺藜苜蓿CHX基因家族系统发育分析
为进一步了解蒺藜苜蓿CHX基因进化关系,利用MtCHXs和AtCHXs蛋白序列,基于MEGA-X,采用极大似然法构建系统进化树。结果如图4所示,与已发表的AtCHXs分组一致,蒺藜苜蓿CHX家族也分为5组(GroupⅠ-Ⅴ)[28]。其中,GroupⅣ基因数量最多,高达19个,而GroupⅤ只有3个成员。与基因同源关系结果一致,MtCHXs与同源关系近的AtCHXs在同一组,暗示它们可能具有相似的功能。
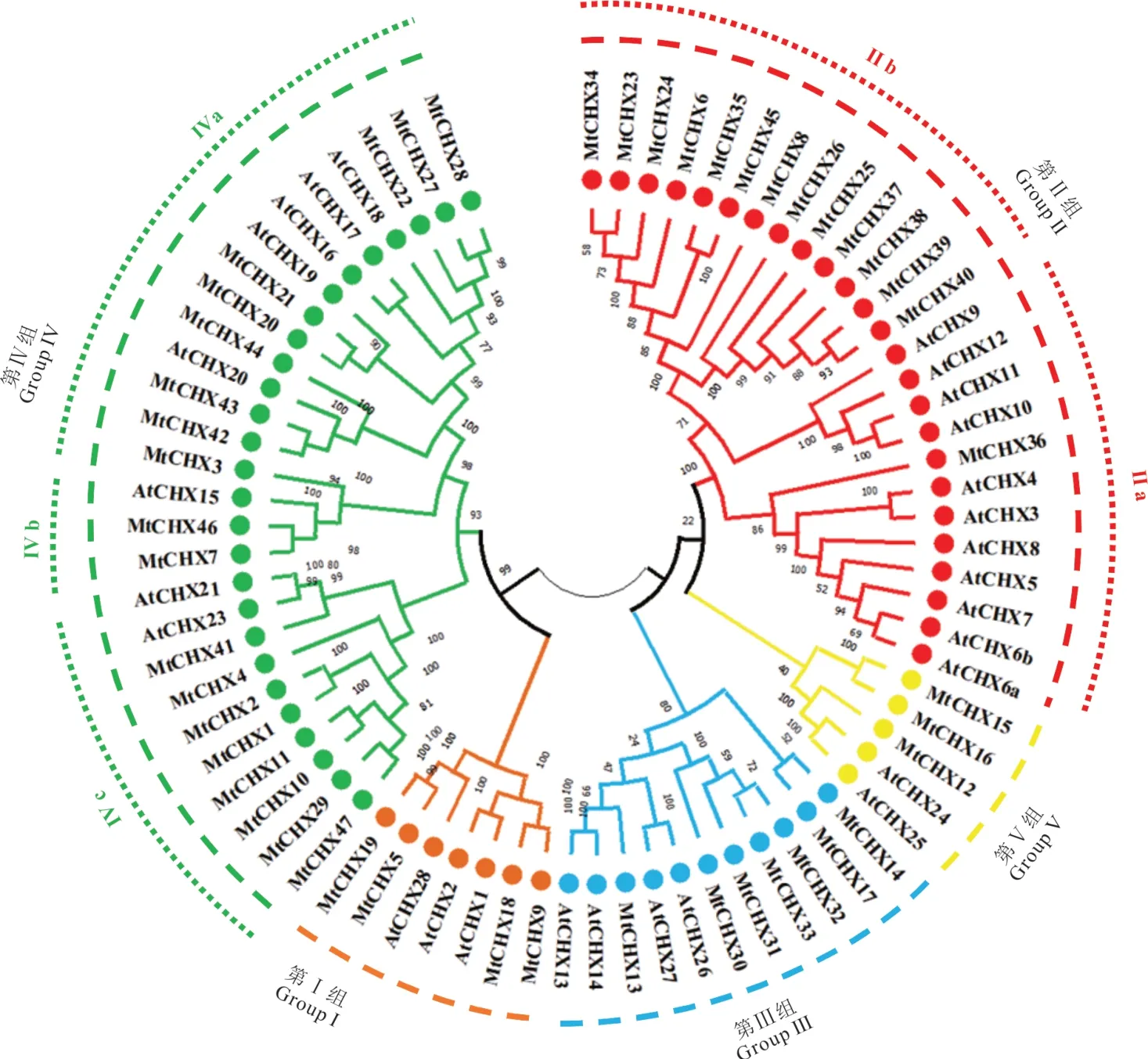
图4 蒺藜苜蓿CHX基因家族系统发育分析Fig.4 Phylogenetic analysis of MtCHXs
2.4 蒺藜苜蓿CHX基因结构和结构域分析
进一步对蒺藜苜蓿CHX基因结构分析(图5),各组内成员呈现相似的基因结构。特别是MtCHX3.8、MtCHX3.10、MtCHX4.2、MtCHX4.3的内含子—外显子结构几乎完全一样。整个蒺藜苜蓿CHX家族非编码区(untranslated region,UTR)只有7个成员包含3′-UTR区,9个成员有5′-UTR区。其中GroupⅣa成员基因内含子序列最长,多数基因都具有3′-UTR区和5′-UTR区。只有MtCHX18.2和MtCHX19.1没有UTR区。
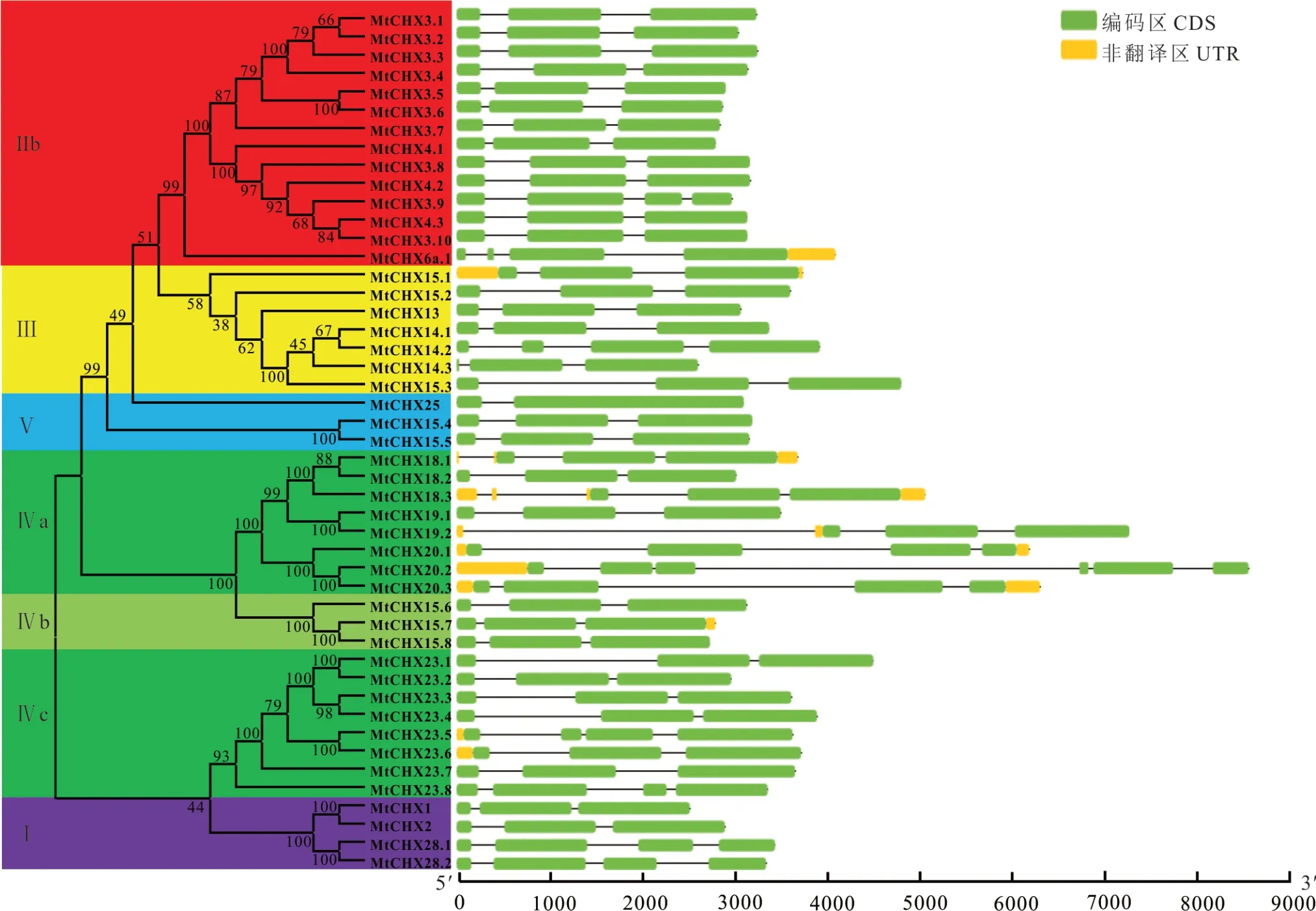
图5 蒺藜苜蓿CHX基因家族结构分析Fig.5 Gene str uctur e analysis of MtCHXs
保守的内含子—外显子结构可能会产生保守的蛋白序列,进一步对47个蒺藜苜蓿CHX的保守基序和保守结构域分析。保守结构域分析表明,47个蒺藜苜蓿CHX蛋白的N端均有完整Na+/H+exchanger结构域,约400~500个氨基酸(图6A)。结合蛋白保守基序可以看出,检测的15个保守基序中,N端的Motif 5、7、9、11、12、13和14构成了保守的Na+/H+exchanger结构域,紧邻Na+/H+exchanger结构域的C端还包含有保守的AANHlike结构域,由Motif 1、3、6、8、10构成(图6B)。此外,在蒺藜苜蓿CHX蛋白的C末端还包括保守的Motif 2、4和15,可能参与蛋白活性的调控。
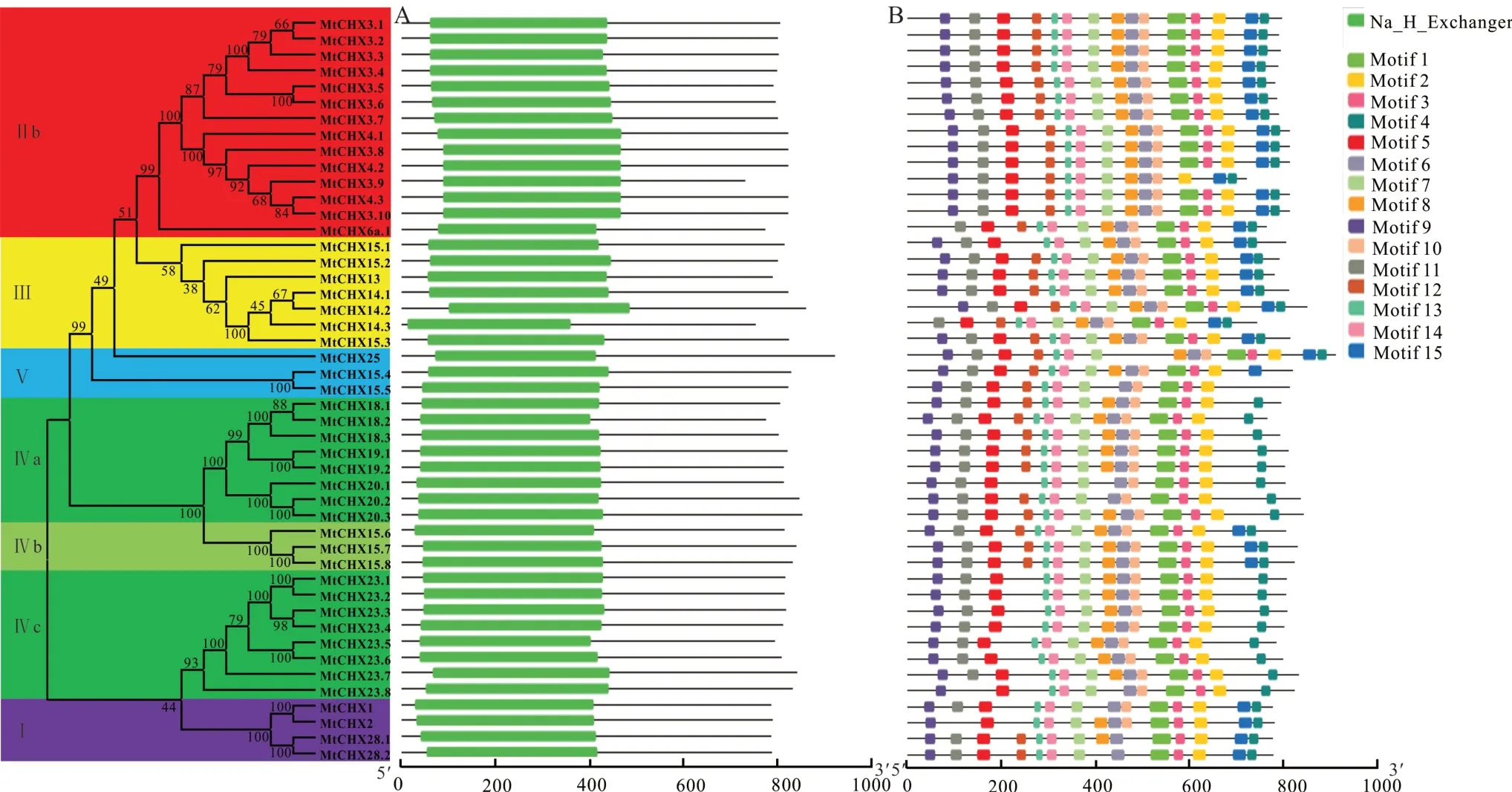
图6 蒺藜苜蓿CHX基因家族保守性分析Fig.6 Conservation analysis of MtCHXs
2.5 蒺藜苜蓿CHX基因家族顺式作用元件分析
为深入了解蒺藜苜蓿CHX的功能,对其上游启动子2000 bp序列进行顺式作用元件分析(图7和图8)。除了大量的核心元件TATA-box和CAAT-box,还包括较多的光响应和激素响应元件。其中光响应元件包含AE-box、G-box、TCT-motif、TCCC-motif、GATA-motif、GA-motif等23种。激素响应元件包括调控赤霉素、生长素、脱落酸、水杨酸和茉莉酸甲酯响应元件,以茉莉酸甲酯响应元件数量居多。同时,还包括调控细胞周期、昼夜节律、类黄酮生物基因合成、光敏色素表达在内的细胞活动调控元件,以及胚乳表达、分生组织表达、种子发育、栅栏叶肉细胞生长相关的植物组织表达响应元件。此外,厌氧、缺氧特异性诱导、低温响应元件LTR、干旱诱导元件MBS、创伤响应元件WUN-motif、防御与应激响应元件TC-rich repeats也存在于MtCHXs启动子区。其中,MtCHX19.2启动子区顺式作用元件数量最多,可能在生长发育和胁迫应答方面起到关键调控作用。
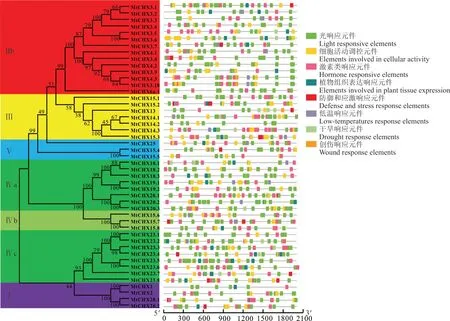
图7 蒺藜苜蓿CHX基因家族启动子顺式作用元件分布Fig.7 Distribution of the putative cis-acting elements predicted in promoters of MtCHXs
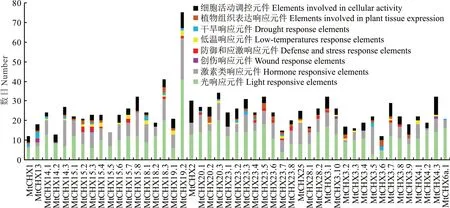
图8 蒺藜苜蓿CHX基因家族启动子顺式作用元件分析Fig.8 Analysis of the putative cis-acting elements in MtCHXs promoter regions
2.6 蒺藜苜蓿CHX基因家族表达特性分析
进一步基于公共数据库对47个MtCHX组织表达特性进行分析(图9)。结果发现,MtCHXs主要表达在花中,可能参与调控生殖生长。GroupⅢ整体上在花中都有较高的表达量。序列及基因结构都极度相似的同源基因MtCHX3.8、MtCHX3.10、MtCHX4.1、MtCHX4.2呈现的组织表达模式也有很高的相似度,在叶、根、根瘤和荚中表达量高于其他组织,而在营养芽和茎中表达量低。GroupⅣ中成员根据同源关系远近,呈现相似的表达模式,如MtCHX23.5和MtCHX 23.6这两个基因虽不是同源基因,却有相同的组织表达模式,主要在种子和根瘤中表达。
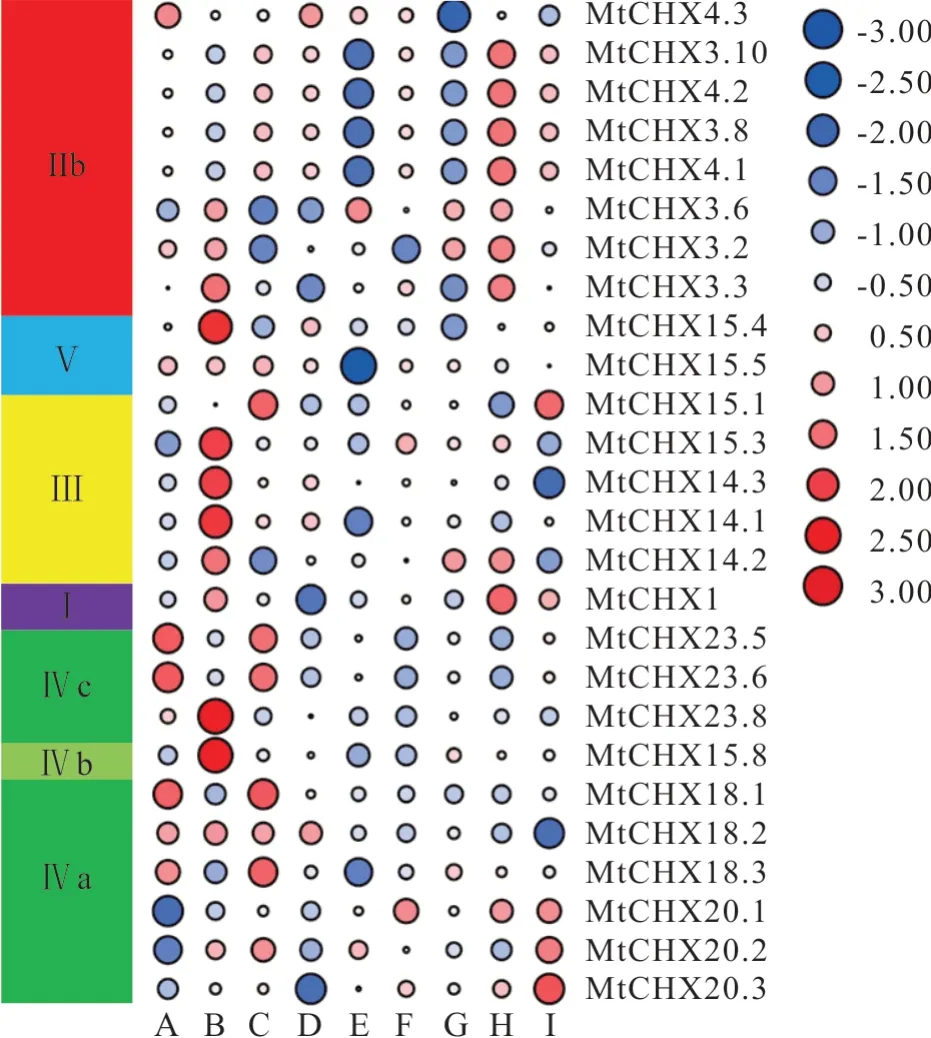
图9 蒺藜苜蓿CHX基因家族组织表达特性分析Fig.9 Expression profile of MtCHXs genes in different tissues
除去没有数据的成员,图10显示了14个蒺藜苜蓿CHX基因胁迫表达情况。GroupⅣa、GroupⅡb和GroupⅢ的大部分成员在遭受低温胁迫(包括冷害和冻害)时仍能保持较高表达量。在遭受冷害和冻害胁迫时,GroupⅢ、GroupⅡb以及大部分GroupⅣa成员(尤其是MtCHX18.1)均呈上调趋势,而GroupⅣ的MtCHX20.3/15.7/23.5均呈下调表达。干旱胁迫下,只有GroupⅣa的MtCHX20.1和MtCHX20.3呈上调表达,而GroupⅣb的MtCHX15.7表达量下降。盐胁迫下,GroupⅢ和GroupⅡb成员上调表达,而GroupⅣ均呈现下调表达。ABA处理后,除GroupⅣa的MtCHX18.3略有上调外,其余均是下调表达。综上,GroupⅣb的MtCHX15.7表达情况与其他成员有差异,其在受到ABA处理、盐、低温和干旱胁迫时表达量均呈下调表达趋势,而其他成员至少在遭受一种非生物胁迫时会呈现表达量上调。上述结果说明MtCHXs参与抗盐、抗寒、抗旱和应答ABA处理。
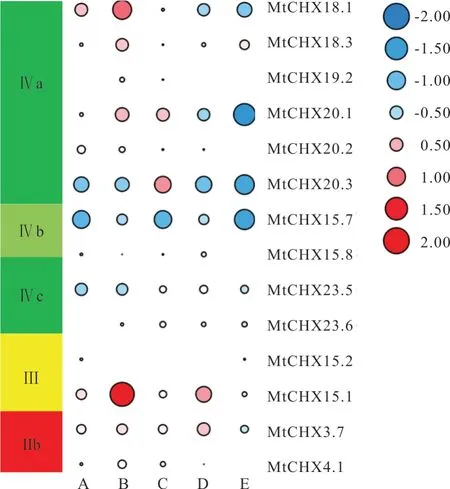
图10 蒺藜苜蓿CHX基因家族非生物胁迫表达模式分析Fig.10 Expression patter n of MtCHXs genes in r esponse to various abiotic stress
3 讨论
广义的农业是包括农、林、牧、副、渔和养殖[29]。我国疆域辽阔,农业的各个行业都发展得如火如荼,苜蓿享有“牧草之王”的美誉,在畜牧业发展中具有重要作用。随着环境问题日益严重,畜牧业面临的最大问题便是草原退化及牧草越冬艰难,改进牧草品种品质,培育抗寒抗旱牧草,对畜牧业的发展也相当重要。环境恶化加剧加上政府支持,通过苜蓿生物信息学分析挖掘抗逆关键调控基因,解析抗逆应答学分子机制,培育抗逆苜蓿新品种已刻不容缓[30]。
蒺藜苜蓿作为豆科作物的模式植物,早在1994年,其基因组序列已公布[31]。随着基因组学和生物信息学的蓬勃发展,越来越多的蒺藜苜蓿基因家族被鉴定分析,如蒺藜苜蓿MtCAO[32]、PYL[33]、TCP[34]、DUF221[35]等基因家族,为后续苜蓿抗逆关键调控基因的挖掘和功能解析提供理论依据。
本研究利用生物信息学,在全基因组范围内鉴定得到47个蒺藜苜蓿CHX基因家族成员。根据已有研究将其分为5组,为GroupⅠ至GroupⅤ。拟南芥CHX家族有28个成员,水稻CHX家族有17个成员,大豆CHX家族有40个成员,蒺藜苜蓿CHX家族成员数量几乎达到拟南芥与水稻的两倍,与大豆数目差不多,成员之间相似度特别高,其中有几个成员的序列相似度达到了99.31%,与拟南芥CHX成员相似度也较高。蒺藜苜蓿CHX基因家族成员在染色体上分布较为分散,说明了在进化过程中存在遗传变异[36]。在进行同源性分析时发现,苜蓿CHX基因内部存在大量旁系同源关系,物种内部的旁系同源是指物种分化后经基因复制产生新基因[37],说明苜蓿CHX内存在大量复制关系。几个成员之间存在互相复制关系,导致了多个基因簇的形成,在进化过程中,新成员的产生可能来自老成员的片段复制[11]。47个成员全部定位在质膜上,这有利于它们进行离子的转运,进而发挥功能。系统发育分析中发现苜蓿CHX家族与拟南芥和大豆的特性相同,GroupⅡ中成员分别是各物种所特有的,这也说明了CHX家族进化的保守性[38]。
在遭受外界刺激时,植物会调动元件启动各种响应来应对刺激[39]。蒺藜苜蓿CHX家族在启动子处有多种顺式作用元件,干旱和低温响应元件说明基因表达受非生物胁迫调控,激素响应元件说明基因表达受植物生长发育影响[40]。DNA位点的多样性使基因功能多样性,但也可能导致功能冗余[41]。刘佳佳等[42]研究发现,MYB(vmyb avian myeloblastosis viral oncogene homolog)转录因子可以特异性调控类黄酮合成,蒺藜苜蓿CHX家族成员的启动子处,MYB转录因子不止能特异性结合类黄酮生物合成基因调控MYB结合位点(MYB binding site consensus I,MBSI)参与类黄酮生物合成基因的调控,还能结合元件MYB结合位点(MYB binding site,MBS)特异性诱导干旱响应。水杨酸参与植物的抗病过程并发挥重要作用[43],21个成员中有参与水杨酸响应的元件TCA-element,这21个成员均匀的分布在5个分组中。MtCHX3.5启动子区含有大量的茉莉酸甲酯调控元件,可能这个基因的表达会受到茉莉酸甲酯(methyl jasmonate,MeJA)通路的影响。有研究发现,低浓度的MeJA可以通过提高植物的过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等酶活性来清除体内活性氧,进而增强植物的耐逆性[44]。在低温胁迫时,根系各氧化酶的活性不尽相同。苜蓿对低温胁迫的耐受程度,与其根颈部的超氧化物歧化酶(superoxide dismutase,SOD)活性与CAT酶活性呈正相关[45]。在受到非生物胁迫时,根系氧化物的酶活性根据环境改变有所变化,结合或释放离子,从而维持细胞膜上离子平衡[46]。蒺藜苜蓿CHX家族中有22个成员分别有1~3个参与低温响应的元件,其中遭受冷胁迫和在根中表达量较高的几个成员均有该元件。
在非生物胁迫下表达量仍旧与未处理相持平的几个基因,除MtCHX15.7只有3′-UTR区、MtCHX23.5只有5′-UTR区,其他基因都具有3′-UTR区和5′-UTR区。非编码区既然不能表达参与功能结构,便预测其起到占据空间保护表达元件的作用。GroupⅢ中成员整体上在各种条件下的表达量均高于其他分组,这与前人的研究一致。大豆CHX家族GroupⅣ中同源基因GmCHX18.1和GmCHX18.2有相似的组织表达模式[11],葡萄(Vitis vinifera)CHX家族GroupⅣ中同源基因Vv CHX16与VvCHX18有相似的表达模式,GroupⅠ中同源基因VvCHX4和VvCHX5也具有相似的表达模式[47]。蒺藜苜蓿CHX在GroupⅣ中也有一对基因表达模式相似,此外,在GroupⅡ中更是有4个同源基因有着相似的表达模式。特别是MtCHX4.3与MtCHX3.10在序列、结构、顺式作用元件组成分布上都极其相似。这些基因在非生物胁迫下的表达情况,说明CHX在响应盐、干旱及低温胁迫应答方面有重要作用。
4 结论
本研究基于生物信息学的方法,在全基因组水平下分析了蒺藜苜蓿CHX基因家族的序列、结构、系统发育、复制关系、顺式作用元件及表达水平。鉴定了蒺藜苜蓿CHX基因家族成员47个,分布在8条染色体上,其中有一个成员未定位在染色体上。将47个成员分为5组,其中GroupⅡb成员是苜蓿所特有的基因。蒺藜苜蓿CHX基因家族内旁系同源关系较多,存在大量复制关系,且与拟南芥亲缘关系较近,与水稻较远。有较多的参与光响应和激素响应的顺式作用元件,还有与干旱、低温等非生物胁迫相关的元件。GroupⅢ及GroupⅣa中成员整体上表达量均高于其他分组。低温胁迫下大多数成员表达量与未胁迫时相当,说明CHX家族在植物耐寒耐旱及耐盐中起着重要作用。蒺藜苜蓿CHX成员在花和荚中的表达量较高,说明可能参与植物生殖生长。
