全基因组水平紫花苜蓿TCP基因家族的鉴定及其在干旱胁迫下表达模式分析
2022-02-10魏娜李艳鹏马艺桐刘文献
魏娜,李艳鹏,马艺桐,刘文献
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心,兰州大学草地农业科技学院,甘肃 兰州 730020)
转录因子是一类具有特殊结构、行使调控功能的蛋白质分子,能够通过激活或抑制基因转录从而在植物发育和对外部环境的响应中起重要作用[1]。TCP转录因子家族的命名最初是在1999年根据4种已知蛋白而来[2]:玉米(Zea mays)的teosinte branched1(TB1),参 与 顶 端 优 势调控[3];金鱼草(Antirrhinum majus)的环花 青 素(cycloidea,CYC),可控制花不对称性[4];水稻(Oryza sativa)的增殖细胞因子(PCF1和PCF2),参与调控分生组织特异性表达[5]。该家族蛋白质序列包含由约59个氨基酸残基组成的非典型bHLH(basic-helix-loop-helix)保守域,是植物特有的一类调控生长发育和逆境胁迫的重要转录因子。根据TCP保守域的序列和系统发育关系,TCP基因家族成员可以分为两个大分支:TCP-P(由PCF亚家族组成)和TCP-C(由CIN和CYC/TB1亚家族组成)[6—7];这两个分支之间,结构上最大的区别是TCP-C比TCP-P在结构域上多4个氨基酸。迄今为止,TCP基因已经在多种植物物种中被鉴定。例如,在拟南芥(Arabidopsisthaliana)基因组中发现了24个TCP成员[8],在柳枝稷(Panicum virgatum)基因组鉴定有42个TCP成员[9],番茄(Solanum lycopersicum)基因组中有21个TCP成员[10]。
TCP蛋白在植物生长、发育以及对生物、非生物胁迫的响应中具有重要的调控作用[7]。TCP-P分支与激素信号转导途径中关键蛋白的互作,参与调节赤霉素、细胞分裂素、脱落酸、茉莉酸、生长素等激素信号;TCP-C分支调控植物细胞增殖、休眠、衰老以及与外侧器官的发育有关[4,9]。在拟南芥中,AtTCP14和AtTCP15在调节节间长度、叶片形状、种子发芽等方面具有一定功能[11]。AtTCP9、AtTCP19及AtTCP20能够通过调控茉莉酸传导信号途径调节叶片衰老[12]。另外,TCP家族在响应干旱胁迫过程中也具有重要生物学功能,例如,水稻OsTCP19基因在干旱和脱水条件下上调表达[13],并通过干扰生长素和茉莉酸途径以及操纵ABA信号传导网络,最终减少细胞死亡和水分流失[14]。水曲柳(Fraxinus mandshurica)FmTCP4基因参与非生物胁迫和植物激素ABA的响应,进而调控植物正常生长发育,并能作为干旱胁迫响应的节点而发挥作用[15]。木薯(Manihot esculenta)MeTCP4基因在响应抗旱胁迫过程中也发挥重要生物学功能[16]。
紫花苜蓿(Medicago sativa)是种植最广泛的豆科牧草,也是世界上最具经济价值的作物之一[17]。在中国,苜蓿种植区分布在北部地区的14个省,缺水和干旱是影响苜蓿生长并限制其在整个地区的生产力和生存的主要因素。因此,解析紫花苜蓿响应干旱胁迫的分子机制,进而培育较高抗旱性的苜蓿种质对中国北方畜牧业的发展具有重要意义。在紫花苜蓿响应干旱胁迫过程中,转录因子发挥着重要的调控作用。目前,在全基因组水平对紫花苜蓿WRKY、ERF、NAC等转录因子基因家族已进行了较为系统的鉴定及功能分析[18—20],但紫花苜蓿MsTCP基因家族尚未被鉴定,其响应干旱胁迫的功能仍不清楚。本研究利用生物信息学方法在全基因组水平对该紫花苜蓿TCP基因家族进行了鉴定,并对其系统进化、基因结构以及响应干旱胁迫的表达模式进行了系统分析。该研究结果可为后期深入解析紫花苜蓿响应干旱胁迫理论以及通过基因工程技术创制高抗旱紫花苜蓿新种质奠定基础。
1 材料与方法
1.1 MsTCP基因家族鉴定和系统进化分析
为了鉴定紫花苜蓿TCP基因家族,在植物全基因组数据库phytozome v12.1(https://phytozome.jgi.doe.gov/pz/portal.html)中通过搜索PF03634编号,下载模式植物拟南芥和水稻的TCP蛋白序列。本实验所用的紫花苜蓿基因组数据、蛋白核酸序列下载于紫花苜蓿基因组网站(https://figshare.com/projects/whole_genome_sequencing_and_assembly_of_Medicago_sativa/66380)[21],并用于紫花苜蓿本地数据库构建。以AtTCP家族和OsTCP家族的基因序列为参考序列,通过TBLASTn比对筛选紫花苜蓿同源序列,e-value值设置为0.00001。使用Expasy[22]在线数据库(https://web.expasy.org/decrease_redundancy)对获得的MsTCP蛋白序列进行去冗余,所有参数均为默认值。为了验证去除冗余后MsTCP蛋白的准确性,对MsTCP蛋白序列在Pfam网站(http://pfam.xfam.org/search#tabview=tab1)和NCBI-CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行TCP结构域的进一步鉴定[23]。利用在线网络ProtParam(https://web.expasy.org/protparam/)工具对MsTCP蛋白分子量(molecular weight,Mw),理论等电点(isoelectric point,pI)等理化性质进行分析。根据基因所对应的染色体上的位置信息,依次对预测的基因命名为MsTCP1~MsTCP40[9]。为了分析MsTCP蛋白之间的进化关系,利用MEGA 7.0[24]软件对MsTCP,AtTCP,OsTCP蛋白序列进行系统进化分析,并基于NJ(neighbor-joining)法构建系统进化树,bootstrapping重复算法设置为1000,其他参数默认。
1.2 多序列比对和Motif分析
利用Clustal W[25]对预测出的MsTCP家族蛋白序列进行多序列比对,比对过程参数设置为默认值;比对结果导入BioEdit软件[26]进行着色处理。使用在线工具MEME Suit 5.3.3(https://meme-suite.org/meme/tools/meme)对MsTCP蛋白保守基序进行鉴定,基序数目设置为10[27]。
1.3 基因复制和基因结构分析
利用TBtools[28]从紫花苜蓿基因组文件获得所有MsTCP基因所对应的CDS序列和基因序列,利用GSDS 2.0(gene structure display server)(http://gsds.gao-lab.org/)在线网址对MsTCP基因内含子和外显子结构进行预测分析。通过紫花苜蓿基因组GFF3数据,获得MsTCP基因在染色体上所对应的位置[21],利用MCScanX[29]和TBtools[28]完成基因在染色体上的定位及基因复制共线性分析内容。
1.4 MsTCP基因在干旱胁迫下的表达模式分析
为了研究MsTCP基因在干旱胁迫下的表达水平,参照紫花苜蓿转录组测序结果(SRR7160313)[30],将MsTCP基因与干旱转录组数据进行了BLASTn比对,获得的数据使用TBtools软件[28]进行聚类分析和表达量热图绘制,数据处理以log2 FPKM的计算结果来表示表达量的高低[31]。
1.5 植物材料的生长和胁迫处理
紫花苜蓿种子用砂纸打磨种皮后摆入培养皿中,于4℃冰箱黑暗条件下春化3 d后移入20℃组培间进行萌发。萌发的种子待两片子叶都展开时移入装有(1/2 MS,p H=5.8)营养液的塑料培养盒中进行水培生长,并定期对营养液进行更换。28 d后将长大的紫花苜蓿幼苗转入1/2 MS营养液(含有浓度为15%的PEG-6000)中进行干旱胁迫处理,设置处理时间点为0、3、6和12 h。为了避免昼夜节律对植物生长和植物基因表达的影响,在12 h后统一采样,样品经液氮冷冻处理后存放于—80℃冰箱备用。
1.6 MsTCP基因表达模式分析
使用UNIQ-10色谱柱Trizol裂解法对不同处理时间下的紫花苜蓿根和叶组织进行总RNA提取,利用cDNA合成试剂盒(FastKing gDNA Dispelling RT SuperMix,tiangen biotech)进行反转录,去除基因组后获得第一链cDNA,用NanoDrop 2000紫外分光光度计(ND-8000,西安)检测cDNA的浓度后统一稀释为100 ng·μL—1用于qRT—PCR反应模板。qRT—PCR分析的基因特异性引物用NCBI Primer-BLAST设计(表1)。使用7500快速实时PCR系统(applied biosystems,美国)对qRT—PCR分析,3次技术重复。qRT—PCR反应体系包括5μL 2 SG Fast qPCR Master Mix(B639271-0005,上海),0.5μL正向和反向引物,1μL DNF Buffer,1μL稀释的cDNA溶液和2μL dd H2O。qRT—PCR的反应体系如下:反应变性(95℃持续30 s);95℃持续5 s;60℃持续30 s下40个循环。Ms-Actin(AES78237.1)作为内参基因用于ΔCt方法计算相对倍数差异,基因表达水平使用FC=2—ΔΔCt[20]方法计算。
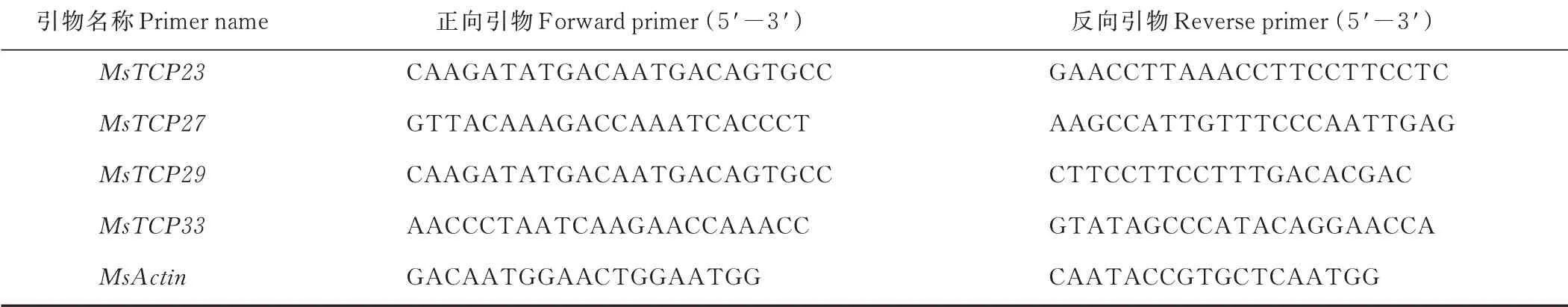
表1 引物信息及序列Table 1 The information of the primer and sequences used in this study
1.7 数据处理
实时荧光定量数据通过Excel 2003进行整理,借助R语言进行绘图,利用SPSS 11.0软件进行显著性分析。
2 结果与分析
2.1 MsTCP家族候选基因的鉴定
为了在全基因组水平系统鉴定MsTCP基因家族成员,通过使用该家族的隐马尔可夫模型(PF03634)从Phytozome v12.1数据库下载了十字花科模式植物拟南芥和禾本科模式植物水稻的TCP基因家族的蛋白序列。通过本地blast(BLASTn)同源序列比对的方法,在紫花苜蓿本地数据库中共筛选出50条潜在的MsTCP蛋白序列,去冗余后共保留了具有TCP结构域的40条MsTCP蛋白序列(图1)。
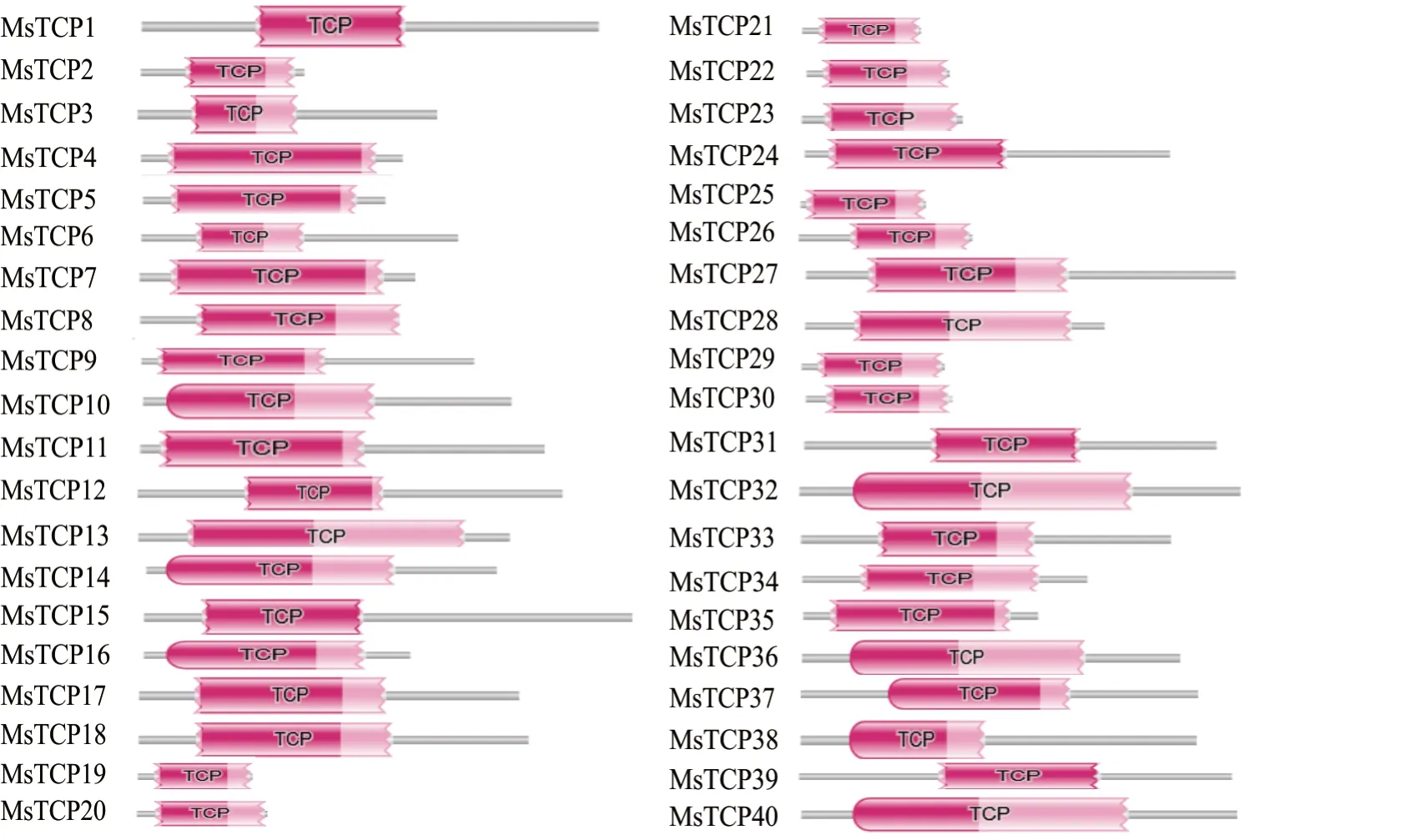
图1 MsTCP基因结构域鉴定Fig.1 MsTCP gene domain identification
2.2 MsTCP基因家族的系统进化和基本理化性质分析
选择水稻、拟南芥的TCP蛋白与本研究中鉴定到的紫花苜蓿MsTCP蛋白共同构建系统进化树,进一步研究紫花苜蓿MsTCP基因家族的进化关系。TCP基因家族明显被分为两个大的分支和3个亚家族,其中PCF亚家族包含了13个拟南芥基因、10个水稻基因和22个紫花苜蓿基因。CIN亚家族包含了8个拟南芥基因、8个水稻基因和14个紫花苜蓿基因。CYC/TB1亚家族包含了3个拟南芥基因、3个水稻基因和4个紫花苜蓿基因(图2)。
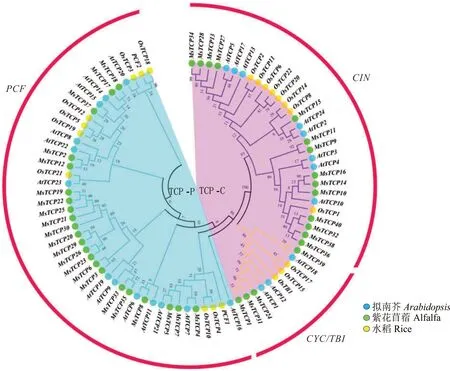
图2 基于紫花苜蓿、拟南芥和水稻TCP氨基酸序列构建系统进化树Fig.2 Construction of phylogenetic tree based on TCP amino acid sequences of alfalfa,Arabidopsis and rice
按照基因在染色体上相应的分布位置对40个MsTCP基因依次按照从小到大的顺序进行命名。根据序列信息进行理化性质分析,基因名称、基因ID号、氨基酸数目、分子量、等电点和亚组分类等特征见表2。结果表明,这些基因所具有的氨基酸数目、分子量和等电点之间存在较大的差异,MsTCP12含有520个氨基酸,是该家族中编码氨基酸数目最多的基因,分子量为55104.71 Da。MsTCP25是该家族中编码氨基酸数目最少的基因,编码107个氨基酸,分子量为11418.15 Da。其次为MsTCP19和MsTCP21,编码119个氨基酸,对应的分子量分别为12818.73 Da和12797.68 Da。MsTCP家族的理论等电点在4.84(MsTCP3)~11.55(MsTCP2)之间不等。40个MsTCP蛋白的亲水性变化范围为—1.135(MsTCP31)~—0.351(MsTCP3)。对该家族的基因进行亚细胞定位预测,除了MsTCP29和MsTCP35定位在细胞质,其余38个MsTCP基因均为细胞核定位的基因。
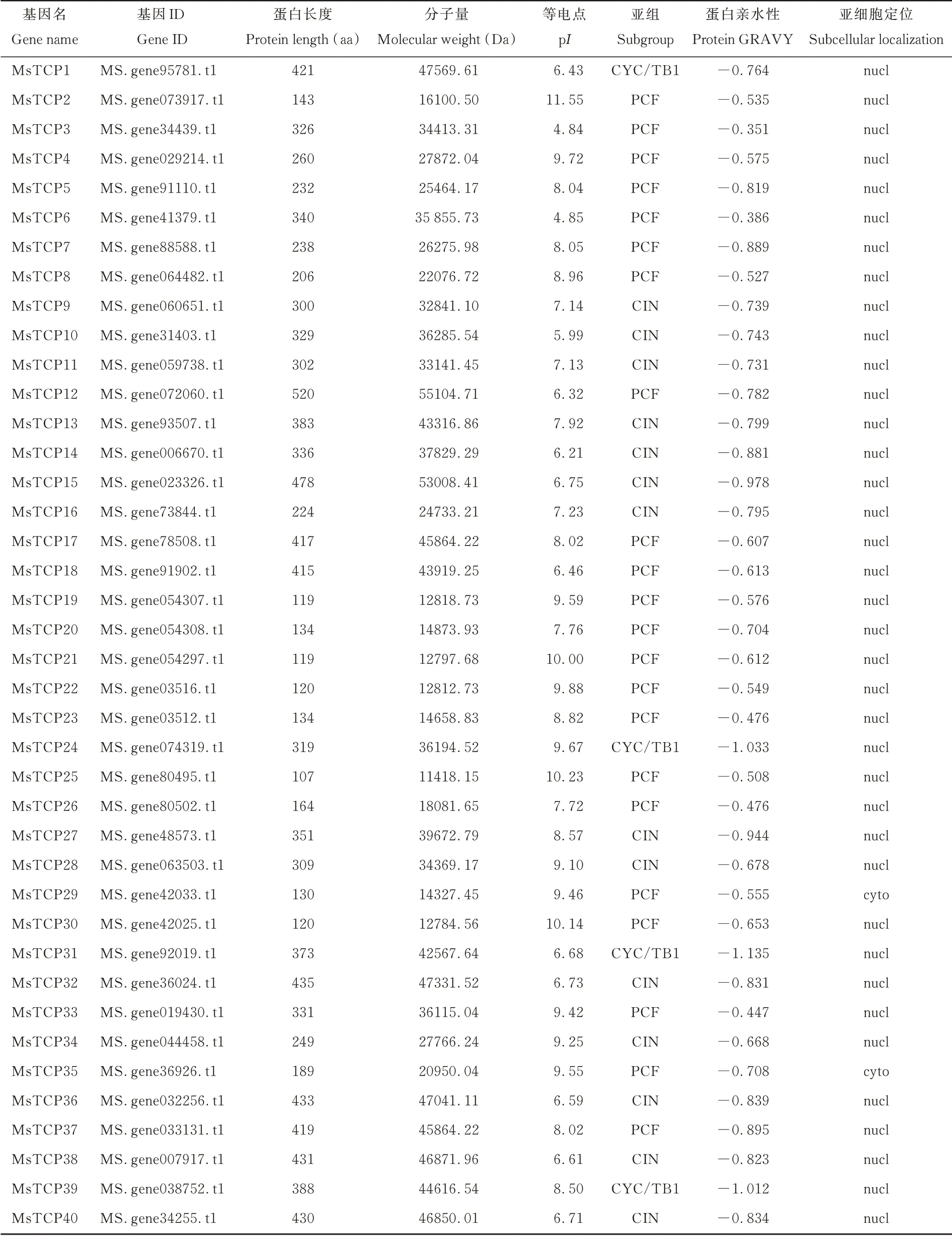
表2 紫花苜蓿TCP家族成员基本信息Table 2 Basic information of TCP family members in alfalfa
2.3 MsTCP家族保守结构及Motif分析
根据序列比对结果可以看出(图3),所有的MsTCP蛋白都包含了一个保守的基本螺旋—环螺旋(bHLH)结构域。40个MsTCP蛋白序列根据TCP结构域内部差异被区分为两个分支,含55个氨基酸的为TCP-P分支,总共有22个MsTCP基因;59个氨基酸组成的为TCP-C分支,包含18个MsTCP基因,和系统进化发育分类结果一致。对40个紫花苜蓿TCP基因编码氨基酸进行序列保守性分析发现(图4),CIN亚家族的MsTCP基因编码的氨基酸共有的Motif数量和种类最多,CYC/TB1亚家族最少。同时,Motif 3,Motif 6,Motif 9,Motif 10只存在于CIN亚家族中,而Motif 4只存在于TCP-C分支。相对于TCP-C分支,TCP-P分支中的MsTCP基因所包含的Motif数目和种类则相对保守。另外,所有的MsTCP基因都包含Motif 1基序,说明Motif 1是TCP家族中的重要结构,MsTCP基因家族内3个亚家族之间也具有一定保守性。
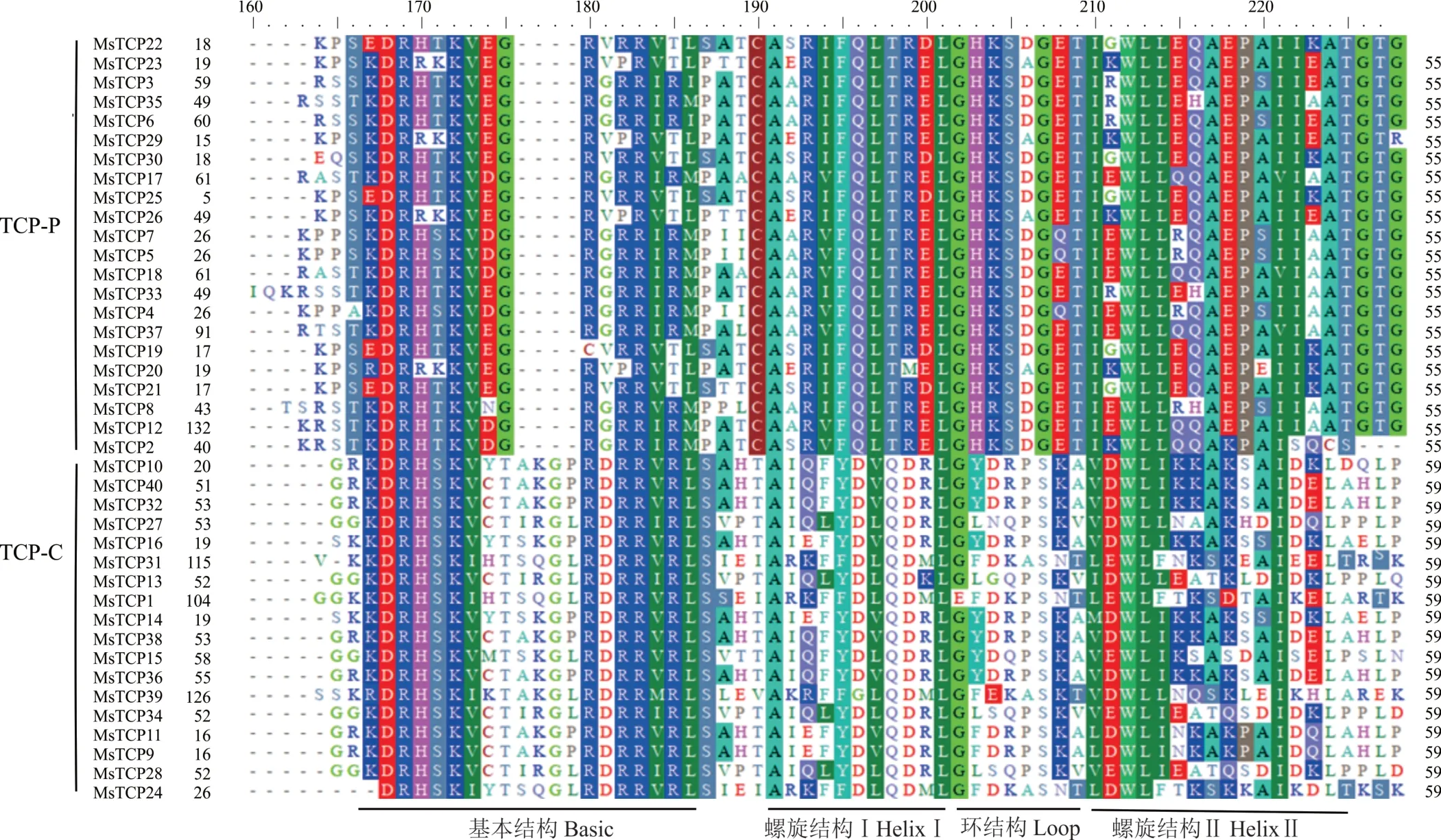
图3 紫花苜蓿40个MsTCPs保守TCP结构域氨基酸序列比对Fig.3 Amino acid sequence alignment results of 40 conserved TCP domains of MsTCPs in alfalfa
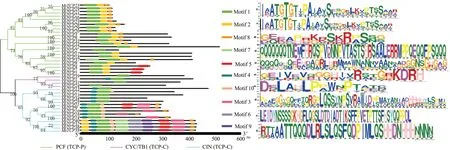
图4 MsTCPs保守Motif的分布及特征分析Fig.4 The distribution and characteristics of conserved Motifs in MsTCPs
2.4 MsTCP家族基因结构和染色体定位分析
为了进一步确定MsTCP基因间的结构差异,对MsTCP家族进行了基因结构分析。如图5显示,31个MsTCP基因不含内含子,9个基因(MsTCP1,MsTCP16,MsTCP24,MsTCP26,MsTCP31,MsTCP34,MsTCP37,MsTCP39,MsTCP35)含1~2个内含子。其中,TCP-C分支所有的基因都含有一个内含子,只有MsTCP29和MsTCP27两个基因包含UTR(untranslated region)结构。为进一步研究紫花苜蓿MsTCP基因之间是否存在旁系同源基因对关系,本研究对所有鉴定到的MsTCP基因染色体位置进行了鉴定并作图(图6)。结果显示,40个MsTCP基因不均匀的分布在20条染色体上。染色体6.3上定位4个基因,其中MsTCP25和MsTCP26形成基因簇,MsTCP27和MsTCP28单独分布,染色体2.4、6.2、8.1和8.2上各定位到3个基因,染色体6.1上定位的基因都形成基因簇,染色体6.2上的3个基因中有一个基因单独分布,其余两个形成基因簇。此外,为了鉴定MsTCP基因家族内是否存在基因复制现象[32],通过MCScanX共线性分析一共鉴定出17对发生基因复制事件的基因对,即图6中红色标注的基因对。其中,MsTCP3和MsTCP6、MsTCP5和MsTCP7、MsTCP9和MsTCP11、MsTCP28和MsTCP34、MsTCP33和MsTCP35发生的是两两基因片段复制,MsTCP20、MsTCP23、MsTCP26和MsTCP29;MsTCP32、MsTCP36、MsTCP38和MsTCP40发生的是4个基因之间的基因片段复制。
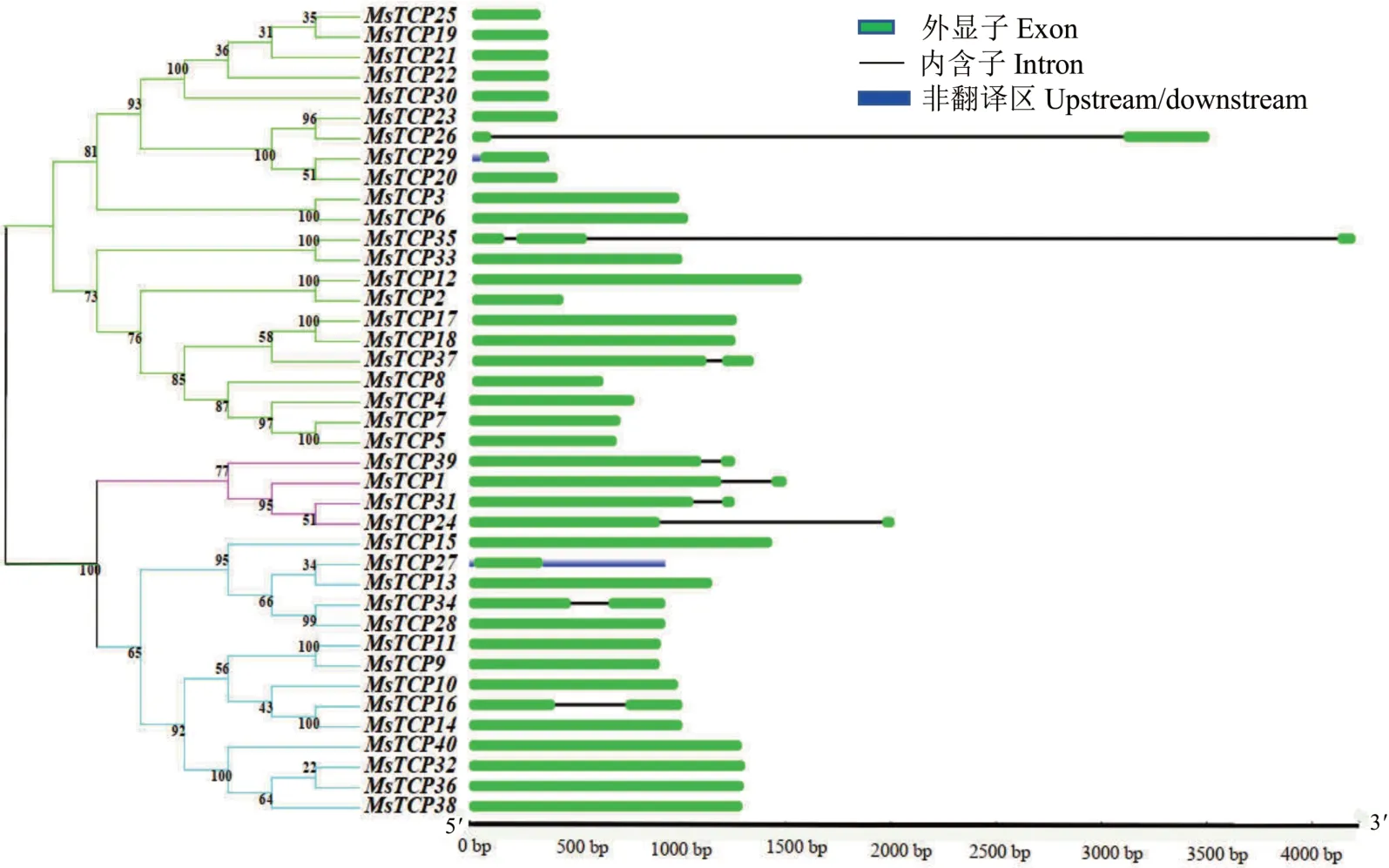
图5 MsTCP基因家族成员结构Fig.5 The gene structure of MsTCP gene family members
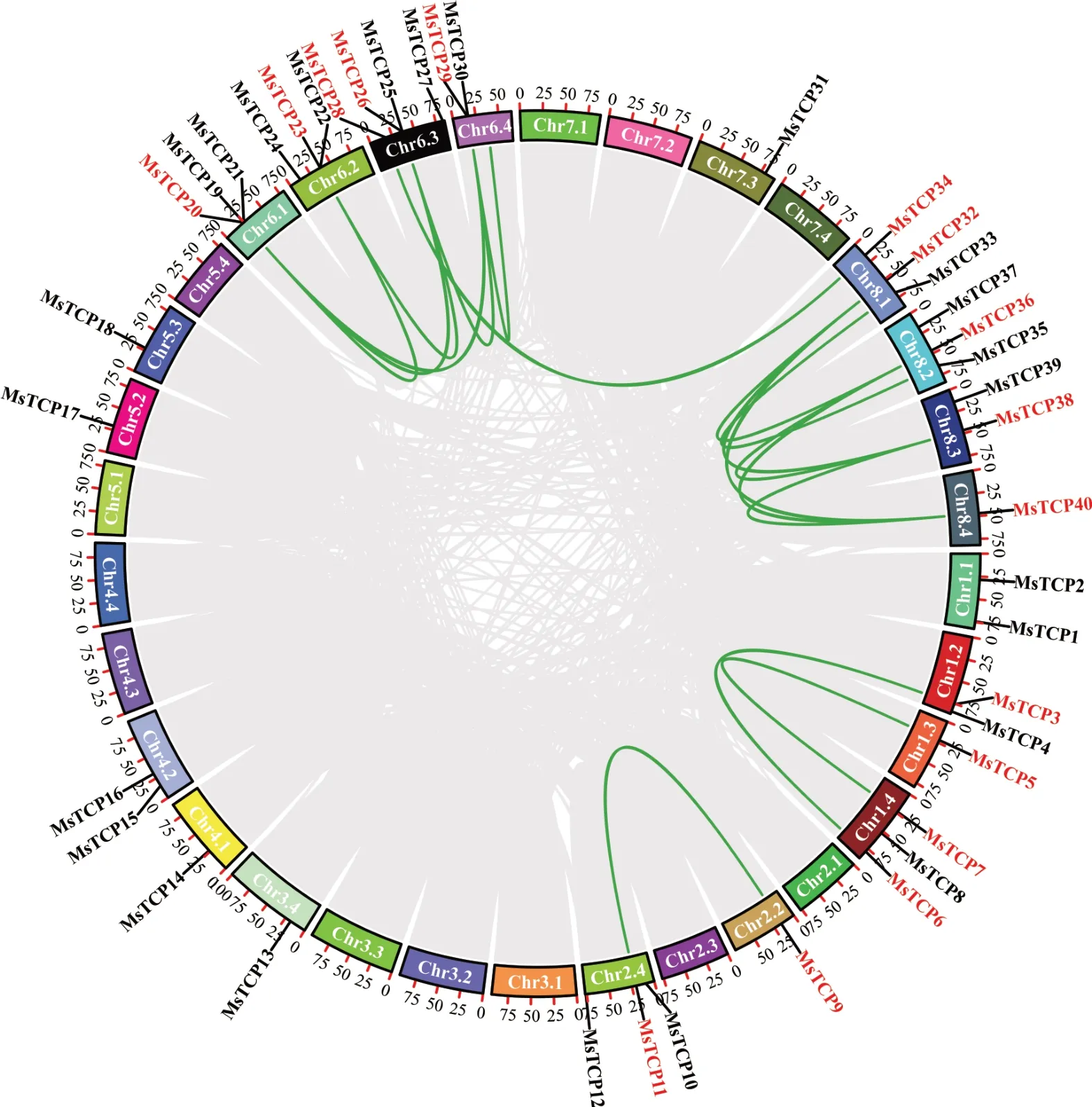
图6 MsTCP基因染色体定位及共线性分析Fig.6 The analysis of the chromosome location and collinearity of MsTCP genes
2.5 MsTCP基因家族对干旱胁迫的响应
为了鉴定干旱胁迫下40个MsTCP基因的表达模式,利用干旱转录组数据对40个MsTCP基因进行了BLASTN比对,获得不同基因的表达量。选择ABA和甘露醇处理0、3、6和12 h数据,以0 h处理为对照进行热图展示(图7)。其中,6个基因(MsTCP38,MsTCP33,MsTCP27,MsTCP26,MsTCP23,MsTCP35)在ABA处理下都被诱导上调表达,MsTCP29在ABA和甘露醇处理下都具有上调表达趋势,推测这些基因可能在紫花苜蓿响应干旱胁迫过程中发挥重要功能。
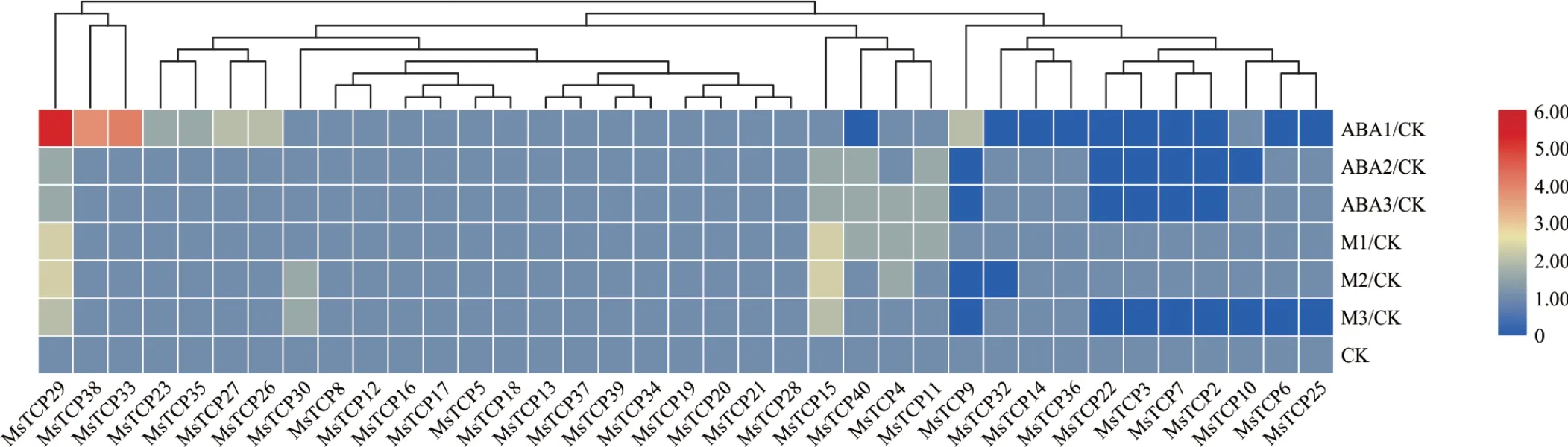
图7 MsTCP基因在ABA和甘露醇处理下的表达模式Fig.7 The expression patterns of MsTCP genes under ABA and mannitol treatment
2.6 MsTCP家族实时定量PCR分析
根据上一步分析结果,为了进一步确认MsTCP基因在干旱胁迫下的表达模式,选取4个MsTCP进行qRT—PCR实验验证。在叶片组织中(图8A),MsTCP27基因3 h时表达量开始上调,MsTCP23、MsTCP29、MsTCP33处理6 h表达量开始上调,MsTCP27在6 h的表达量与0 h比较上调达150倍。在根组织中(图8B),MsTCP33基因在处理3 h时表达量开始上调,MsTCP23、MsTCP27、MsTCP29处理6 h表达量开始上调并且3个基因之间表达趋势比较一致。比较分析发现,qRT—PCR试验结果与热图分析结果一致,进一步确定了这些基因响应干旱胁迫的表达模式。
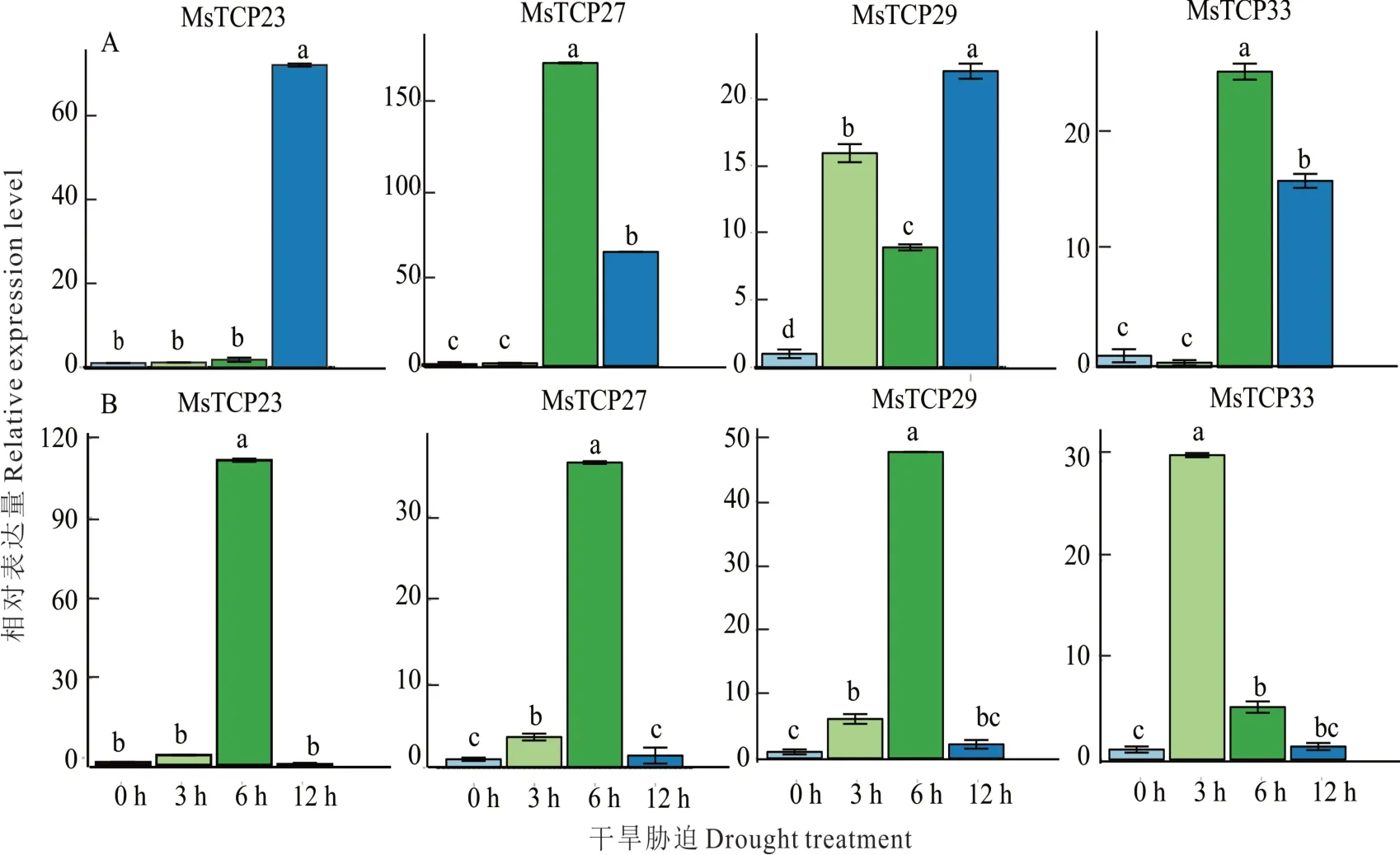
图8 MsTCP基因响应干旱胁迫的表达模式Fig.8 Expression patterns of MsTCP genes in response to drought stressA:叶片;B:根。数据是三个重复的平均值,不同小写字母表示0.05水平存在显著性差异。A:Leaf;B:Root.The data is the average of three repetitions,the differernt lowercase letters indicate significant differences at the 0.05 level.
3 讨论
TCP基因家族是一类植物特有的转录因子,在植物生长、发育和胁迫响应中起着关键作用。紫花苜蓿作为世界上最重要的豆科牧草之一,干旱和缺水已经成为影响其产量和地理分布的关键瓶颈。近年来,随着植物物种的基因组被大量测序,TCP基因家族全基因组水平下鉴定工作在许多植物物种中都相继展开,其中包括禾本科[33]、豆科[34]、十字花科[35]。关于TCP基因家族和植物非生物胁迫之间的关系已有相关报道:TCP转录因子在植物发育过程中与MYB,SAP11等多种参与植物激素信号转导途径的蛋白相互作用[36],暗示着TCP转录因子可能在植物抵抗生物和非生物胁迫等方面发挥着重要作用。
本研究利用紫花苜蓿全基因组数据完成了MsTCP基因家族的鉴定和分析工作。对鉴定出的40个MsTCP蛋白进行亲水性分析,结果表明(表2)该家族蛋白都具有良好的亲水性,推测与环状区域主要包含亲水氨基酸(甘氨酸)有关[37]。亚细胞预测结果表明,该家族基因定位大多数都位于细胞核,与芥菜(Brassica juncea)[35]、蒺藜苜蓿(Medicago truncatula)[12]以及其他物种中报道的亚细胞定位结果一致,推测TCP基因可能在细胞核中发挥调控基因表达的功能[38]。通过与水稻和拟南芥TCP家族基因的系统进化分析,40个MsTCP基因可以分为3个亚组,其中PCF亚组包含MsTCP基因数目最多,CYC/TB1亚组包含MsTCP基因数目最少(图2),该结果与水稻、拟南芥[8]TCP基因家族系统进化结果相类似。在多序列比对结果中(图3),可以看出MsTCP被分为两个大的分支,它们都具有螺旋—环螺旋(bHLH)保守域,不同的是TCP-P分支的TCP结构域存在4个氨基酸的缺失。根据大豆(Glycine max)基因家族分析报道,这两个分支中的基因分别在植物生长的不同时期发挥不同的功能:位于TCP-C分支的GmTCP基因主要分布在分生组织,与植物体的分裂密切相关,TCP-P分支的GmTCP基因大部分分布在根、茎、叶等营养器官中,少数分布在分生组织中[34]。此外,之前也有相关报道:AtTCP4是CIN亚组的成员,AtTCP4可以激活次级细胞壁生物合成和程序性细胞死亡,对拟南芥花器官至关重要[39];PCF1和PCF2参与DNA复制和修复,通过结合水稻启动子来维持染色质结构,染色体分离和细胞周期进程[3];TB1是调节玉米顶端优势的主要因素[3]。Motif分析结果(图4)表明3个亚家族之间所含的Motif种类数量之间存在明显差异,猜测这可能是决定3个亚族之间功能差异的主要原因[40]。MsTCP基因大多不含有内含子,少数基因含有1~2个内含子(图5),这与在构树(Broussonetia papyrifera)[41]、葡萄(Vitis vinifera)[42]中的报道一致,说明TCP家族的基因结构相对简单。基因复制被认为是一种在进化过程中扩展并获得功能多样性的重要手段[43],MsTCP基因家族中的基因重复分析显示片段重复对TCP基因的影响更大,这一结果与在水稻和拟南芥中观察到的结果一致[8],表明TCP家族在植物基因组中的复制事件可能是一种普遍的进化机制。
通过之前的研究,了解到TCP基因家族在多种植物响应干旱胁迫中具有重要调控功能,可作为优异基因资源用于分子抗旱育种[13—16]。因此,为了挖掘紫花苜蓿中具有响应及调控干旱胁迫相关功能的MsTCP基因,本研究在生物信息学分析技术的基础之上与转录组数据相结合,将已经鉴定出的MsTCP基因通过与已知的转录组数据进行比对,初步选出在ABA和甘露醇处理下表达量上调的基因(图7),将其作为响应干旱胁迫的TCP候选基因。随后对紫花苜蓿幼苗进行15%PEG-6000处理来模拟干旱,然后通过qRT—PCR对其表达模式进行实验验证。结果表明MsTCP23、MsTCP29、MsTCP33和MsTCP27的表达量都呈现上调趋势(图8)。叶组织中,MsTCP23基因在干旱胁迫12 h后表达量上升,其余基因则在干旱胁迫6 h左右表达量就已经上升。根组织中除MsTCP33基因在3 h胁迫时表达量上升外,其余基因的表达模式都比较相似,在6 h时表达量达到最高。在水稻中也有TCP家族类似的报道:OsTCP19基因在盐和干旱胁迫下显著上调[14],将OsTCP19基因在拟南芥中过表达后,显著提高了转基因拟南芥植物在非生物胁迫下的耐受性[3],进一步证实了TCP基因家族在响应干旱胁迫中具有重要作用。后续本研究也将对筛选出的MsTCP基因进行拟南芥的遗传转化和紫花苜蓿遗传转化,进一步确定这些基因的生物学功能。因此,基于本研究结果,在全基因组水平下研究紫花苜蓿TCP基因家族可为挖掘紫花苜蓿抗旱优异基因,进而为深入解析紫花苜蓿响应干旱胁迫理论以及通过基因工程技术创制高抗旱紫花苜蓿新种质奠定基础。
4 结论
在全基因组水平对紫花苜蓿TCP基因家族进行了鉴定,并对该家族内基因的基本理化性质进行了描述以及亚细胞定位进行了预测,研究了该家族基因之间的系统发育关系、基因结构、染色体定位、基因内部旁系同源基因以及响应干旱胁迫的表达模式进行了系统分析。共鉴定出40个MsTCP基因,这些基因在系统发育上分为两个分支3个亚家族,共包含了17对旁系同源基因对以及对它们之间发生的片段复制事件进行了分析。在此基础上与紫花苜蓿转录组数据比对筛选出具有一定潜在抗旱功能的基因作为候选基因,通过qRT—PCR对候选基因的表达模式进行分析,确定了MsTCP23、MsTCP27、MsTCP29、MsTCP33对于干旱胁迫具有一定的响应作用。后期本研究将对这4个基因展开拟南芥和紫花苜蓿的遗传转化进行功能验证和抗旱评价分析,研究结果可为后期深入解析紫花苜蓿响应干旱胁迫理论以及通过基因工程技术创制高抗旱紫花苜蓿新种质奠定基础。
