荒漠草原石生针茅光合特性对渐进式土壤干旱过程的响应及敏感性分析
2022-02-10尹作天王玉辉周广胜马全会刘晓迪贾丙瑞蒋延玲
尹作天,王玉辉,周广胜,马全会,刘晓迪,贾丙瑞,蒋延玲
(1.中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093;2.中国科学院大学,北京 100049;3.中国气象科学研究院,北京 100081)
陆地生态系统碳循环在全球碳平衡中扮演着重要作用,是驱动生态系统变化的关键过程,对生态系统的结构、功能和可持续发展起着直接或间接的作用[1—2]。同时,陆地生态系统碳循环对气候变化十分敏感[3]。全球变化的背景下,年平均气温和降水发生变化的同时,极端气候事件(如暴雨、干旱)亦不断增多增强[4]。伴随着强降水过程的短期补充,陆地生态系统可能会面临更长时间的土壤水分亏缺,土壤水分干湿变化幅度增强[5—6]。降水和土壤水分这一变化不可避免的将对陆地生态系统,特别是对受水分限制较为严重的干旱半干旱地区的荒漠草地生态系统产生深刻的影响。
以往研究表明,在干旱胁迫下,植物个体叶片内的叶绿素会受到破坏[7],光合作用和蒸腾作用减弱[8—9],植物生长受到抑制,甚至造成植物个体死亡。进而导致生态系统植被生产力[10—11]、生态系统呼吸[12—13]以及生态系统演替[14]等碳循环的关键过程受到影响,最终对生态系统的碳收支造成影响。来自野外控制实验[11,15]、碳通量数据观测[16]、遥感数据反演[17]、模型模拟[18]等多方面的研究探讨了干旱对各类生态系统的影响,多数结果表明干旱会削弱生态系统的碳汇功能,甚至使之变为碳源[9,19]。但以往相关研究还主要停留在极端干旱事件对生态系统影响结果的层面,如生产力增高或降低,碳收支是增多还是减少。而针对极端气候事件发生后,随着时间的推移或事件影响程度的加深,生态系统功能对极端气候事件的响应过程的系统认知和定量描述还十分匮乏。生态系统在经历强降水后,从无旱到干旱胁迫加重到极端干旱这一长期过程中,其碳收支关键指标的响应过程如何;碳汇功能开始明显减弱的时间节点;碳收支关键过程指标对干旱敏感性的差异以及它们之间的相互关系仍不明确,相关研究也较少。因此,探究生态系统碳收支对极端干旱发生过程的动态响应机制尤为重要。
草地作为全球分布最为广泛的一种植被类型,具有重要的生态服务功能[20—21]。中国是世界上草资源较丰富的国家,其中荒漠草原是主要的草地类型之一,同时也是最干旱的草地类型[22],其地处干旱区与半干旱区的交界地带,生态环境脆弱,年降水量稀少,水分条件成为其生存与发展的主要限制因素[23]。同时,荒漠草原极端气候事件发生的频率较高,对气候变化较为敏感[24]。其中以石生针茅(Stipa tianschanica)为建群种的石生针茅草原是蒙古高原荒漠草原最具代表性的群落类型,也是最耐干旱的一种针茅草原[25]。目前关于草原碳收支对干旱过程的响应研究大多为通过人工控水模拟不同程度土壤干旱的实验,且实验过程中通常会直接对生态系统施加几个固定水平的干旱胁迫[26—28],与自然状态下干旱的发生发展过程有一定的区别。缺乏对土壤水分渐进式下降这一连续过程的观测研究,制约着土壤干旱胁迫逐渐增强过程对陆地碳收支影响机制的理解。为此,本研究以荒漠草原石生针茅为研究对象,采用遮雨棚人工控水的方法隔断自然降水进行持续干旱模拟,形成在自然状态下土壤水分随时间的推移逐渐降低,最终形成极端干旱的连续过程,并高频次观测石生针茅对持续且逐渐增强的干旱胁迫动态响应变化。旨在:1)探讨石生针茅植株和生态系统的光合固碳过程对持续干旱过程的响应机制;2)对比各碳交换特征参数对土壤干旱过程的敏感性差异,以期提高极端气候事件对荒漠草原碳收支影响的理解。
1 材料与方法
控制试验于2019年在北京市中国科学院植物研究所育种基地进行。试验材料来自内蒙古自治区包头市达尔罕茂明安联合旗温带荒漠草原的天然草地(41°38′38.3″N,110°19′53.3″E,海拔约1409 m)。该草地具有典型大陆性气候特征。年均温4.2℃,生长季(5—8月)平均气温为18.2℃,全年最冷月(1月)和最热月(7月)的平均气温分别为—14.1和21.4℃;年均降水量255.8 mm,其中生长季平均降水量占72.4%。土壤类型为栗钙土,p H值为7.4,土壤密度为1.23 g·cm—3。优势植物主要有石生针茅、糙隐子草(Cleistogenessquarrosa)、阿尔泰狗娃花(Heteropappusaltaicus)、茵陈蒿(Artemisia capillaris)等[29]。
2019年5月返青期前,通过移栽的方式,将自然生长健康、长势一致的石生针茅植株和根系周围20 cm×20 cm×20 cm的原状土壤,以及地表下20~40 cm的土壤分别取出,装入纸箱运回实验样地,并分层装入40 cm×40 cm×40 cm的塑料种植箱,共36箱。种植箱箱体具有通气透水功能,确保植物根系的健康生长。种植箱置于35 cm深的沟槽内,箱体边沿比箱外地表略高,以防止地表径流有水进入。同时保持箱内表层土壤与箱外表层土壤齐平,以使箱内土壤温度与地温基本一致。为减小样方的边际效应,每排箱体间有0.5 m间隔(图1)。每个箱体内有石生针茅植株3~5株,并在实验期间定期对箱体内杂草进行清理。

图1 实验设计示意图Fig.1 Plots layout of experimental design
1.1 土壤水分控制与环境因子测定
实验采用完全随机设计,共36个小区(种植箱)。土壤水分由人工浇水控制,且通过搭建遮雨棚(7 m×10 m)隔断自然降水。遮雨棚顶部和四周距地面0.5 m以上均覆盖高透光的聚碳酸酯板。种植小区与遮雨棚边缘相距1 m,确保无自然降水进入。土壤水分控制于2019年8月10日—9月8日进行。试验第1天首先将石生针茅种植小区充分浇水,此后不再进行水分补充。自浇水第2天起,每天上午8:00—11:30对健康植株叶片及群体光合、呼吸进行连续观测,直至植物凋萎,连续3 d叶片净光合速率小于0为止。自移栽完成开始,利用HOBO便携式小型自动气象站对地表下0~10 cm处土壤含水量(体积含水量)、土壤温度,以及地上2 m处空气温度、湿度、太阳总辐射、光合有效辐射进行连续自动观测,观测频率为每次30 min。此外,田间持水量使用环刀法测得。
1.2 叶片光合生理参数测定
叶片光合生理参数的测定与土壤水分控制实验同步。随机选取3个植株生长旺盛的种植小区作为观测目标。因石生针茅为丛生禾草,自充分浇水后第1天起,每天在3个种植小区各随机选取1丛生长健壮的叶片进行相关光合生理指标观测,观测时间为上午8:00—11:30。观测仪器为LI—6400便携式光合测定系统(LI-COR,美国)。
1.2.1光响应曲线及A-Ci响应曲线 将CO2浓度控制在(400±10)μmol·mol—1进行光响应曲线测定。光合有效辐射(photosynthetically active radiation,PAR)梯度为1800、1500、1200、1000、800、600、400、200、100、50、20和0μmol·m—2·s—1。A-Ci响应曲线测定时,先在饱和光强(1500μmol·m—2·s—1)下诱导7 min,并维持饱和光强测定。CO2设置梯度为1400、1200、1000、800、600、400、300、200、100、50和400μmol·mol—1。每个设定维持120 s后读数,曲线测量完成后使CO2恢复至环境浓度。每条曲线重复测量3次,取平均值。光响应曲线和A-Ci曲线测定完成后,参考Sharkey等[30]提出的方法对其进行拟合,得到最大羧化速率(maximum carboxylation rate,Vcmax)、最大电子传递速率(maximum electron transfer rate,Jmax)和磷酸丙糖利用率(triose phosphate utilization rate,TPU)。同时在饱和光强下(1500μmol·m—2·s—1)下测定叶片饱和光强下的净光合速率(light-saturated net photosynthetic rate,Asat)、气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate,E)、胞间二氧化碳浓度(intercellular carbon dioxide concentration,Ci)等光合参数,并根据测定参数计算水分利用效率(water use efficiency,WUE):
1.2.2叶绿素荧光参数 利用LI-6400光合测定系统的荧光叶室(6400-40),将叶片在饱和光强下(1500μmol·m—2·s—1)活化7 min后,测定叶片的叶绿素荧光参数:初始荧光(minimal fluorescence,light,Fo′)、最大荧光(maximal fluorescence,light,Fm′)、实时荧光值(F),并计算出光系统Ⅱ(photosystemⅡ,PSⅡ)的有效光化学量子产量(photochemical efficiency of PSⅡin the light,Fv′/Fm′)、光系统Ⅱ的实际光化学效率(actual photochemical efficiency of PSⅡin the light,ΦPSII)[31—32]。测定时控制其他条件与光合参数的测定条件相同。

1.3 生态系统碳交换参数测定
利用LI-8100土壤碳通量测量系统(LI-COR,美国)进行生态系统光合速率和呼吸速率的测定。为减少对土壤的扰动,在控水实验开始前一周,在每个种植小区选取一丛相对独立的植株,使其嵌入内径为11 cm,高10 cm的土壤呼吸环中,土壤环有5 cm露出地表。插入土壤环时尽可能避免对根系的影响。每个土壤环中生长健康的石生针茅植株,与环内土壤、微生物等共同构成一个小的生态系统。开始控水处理后,每日上午进行生态系统净碳交换(net ecosystem CO2exchange,NEE)和生态系统呼吸速率(ecosystem respiration,Re)测定。观测时将一个内径为10 cm,高15 cm的亚克力透明叶室,套入预埋的土壤环中,并使植株能够全部无损伤地放置在透明叶室内。进行Re测定时使用同直径的PVC不透光叶室。NEE和Re的测定在与光合生理参数测定相同的3个重复中进行,每个种植小区进行3次观测,取其平均值进行分析。生态系统总初级生产力(gross ecosystem production,GEP)通过Re和NEE计算得出:

1.4 数据分析
本研究中实验数据处理在Excel 2016和SPSS 21.0(SPSS,美国)中完成,作图在Origin 9.4.0(OriginLab Corporation,美国)和Matlab2018a(MathWorks,美国)中完成。将光曲线和A-Ci曲线测得的数据点代入Sharkey等[30]的经验模型,拟合计算得到Vcmax、Jmax和TPU。将各特征参数的重复观测值分别求得平均值和方差,把各平均值与土壤含水量进行回归分析。本研究根据已有研究采用4种常用函数[33—36]:

对各碳交换特征参数与土壤含水量(soil water content,SWC)进行回归分析,并根据决定系数(R2)和赤池信息准则(akaike information criterion,AIC)进行对比,选取AIC值最小且R2极显著的模型为最佳模型(表1)。同时对数学模型求解,得到最值和零点。
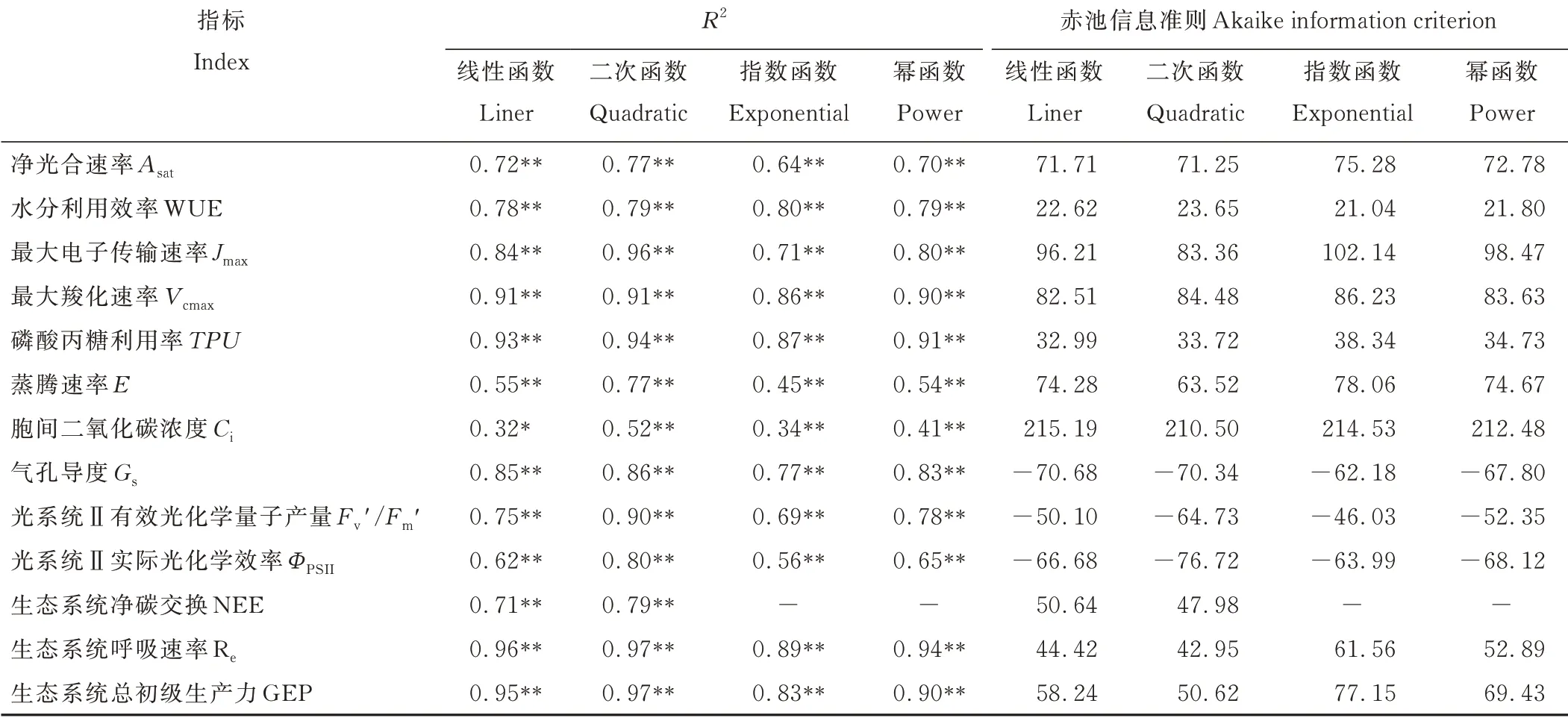
表1 常用回归模型比较Table 1 Comparison of common regression models
2 结果与分析
2.1 干旱过程
2.1.1土壤温湿度 控水日前,经过饱和灌溉,土壤含水量(soil water content,SWC)达到田间持水量20.88%(图2)。自控水日起,在环境和植物生长双重作用下,SWC逐渐降低,且随着时间延长,SWC下降的速度逐渐放缓,控水后期SWC在5%~7%内波动,不再发生明显下降(图2)。参照《气象干旱等级》(2006)的标准对干旱等级进行评定,认为土壤相对含水量(土壤含水量与土壤最大田间持水量之比,relative soil water content,RSWC)大于60%时无干旱胁迫;50%~60%为轻度干旱;40%~50%为中度干旱,小于40%为重度干旱胁迫。本研究中控水第8天RSWC已达到59.15%,为轻度干旱水平;第10天RSWC为48.28%,达到中度干旱水平;第15天RSWC为38.98%,达到重度干旱水平,此后持续干旱至第31天,SWC均维持在重度干旱水平(表2)。
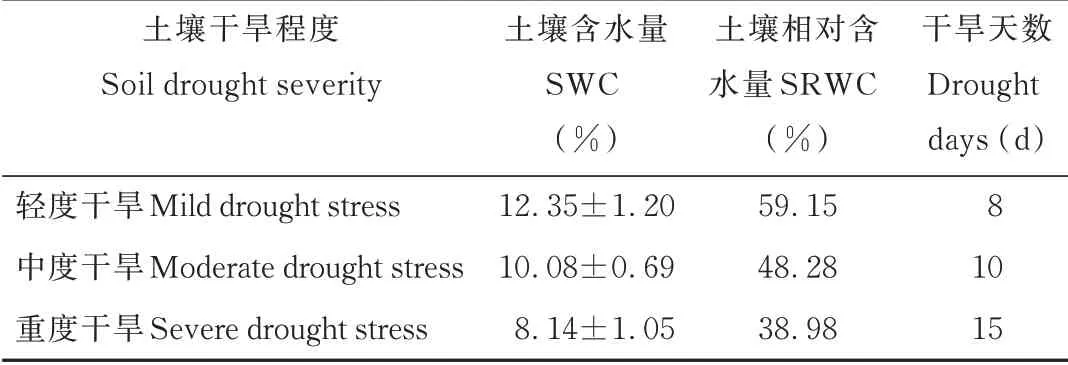
表2 土壤含水量随干旱程度的变化Table 2 Changes in soil moisture content with drought
控水期间,日平均土壤温度在22.7~30.2℃波动,无明显变化趋势;土壤日温差随时间推移呈小幅度增加(图2)。
2.1.2空气温湿度及光合有效辐射 控水期间,除土壤含水量外的各项环境参数均在一定范围内波动,并无显著变化。日平均空气温度和空气湿度分别在19.75~30.22℃和32.31%~92.72%波动;光合有效辐射日总量在2.71~32.88 mol·m—2·d—1波动。光合有效辐射通常在中午(11:00—14:30)达到最高值,夜晚(19:30—次日5:30)下降到0 mol·m—2·s—1左右;空气温度中午达到峰值,凌晨(3:00—6:00)达到最低点;空气湿度呈现出与空气温度相反的变化规律,凌晨达到峰值,中午达到最低点(图2)。
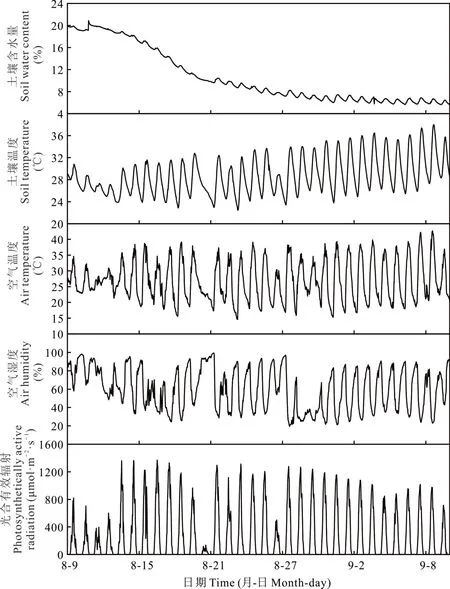
图2 环境气象数据Fig.2 Environmental meteorological data
2.2 叶片光合生理特征参数对土壤干旱过程的响应
2.2.1光合作用特征参数 控水期间,除SWC外的环境参数都在一定范围内波动,无显著变化,因此本研究认为实验期间石生针茅生长状况变化主要由SWC的变化引起。
石生针茅叶片光合作用特征参数中,WUE与SWC呈显著的指数关系,Gs、Vcmax和TPU与SWC呈显著的线性关系,其余特征参数与SWC均呈显著的二次曲线关系。随SWC降低,Asat、E和Jmax表现出先增加后降低的趋势,即存在最大值和最适SWC;Gs、WUE、Vcmax和TPU持续降低,不存在最值及最适SWC;Ci表现出先降低后增加的趋势,存在最小值(图3)。
根据图3的拟合曲线计算得知,Jmax、Asat和E分别在SWC为16.94%、19.60%和15.24%时达到最大值145.52μmol·m—2·s—1、12.05μmol CO2·m—2·s—1和25.63 mmol H2O·m—2·s—1。即在SWC下降到轻度干旱前Jmax、Asat和E已开始降低,而且Asat达到最大值时的SWC明显高于Jmax和E。随着土壤极端干旱过程的加剧,叶片的光合和蒸腾作用明显受到抑制,当SWC为6.13%时Jmax达到0;SWC达到5.96%时Asat达到0。可见石生针茅叶片Asat比Jmax达到最大值需要更好的水分条件,但是在极端干旱时,Jmax比Asat受到的抑制更严重。
Vcmax、TPU和Gs分别在SWC为6.03%、4.19%和4.88%时达到0,WUE未出现0值(图3)。表明石生针茅叶片的Vcmax、TPU、Gs和WUE在土壤极端干旱的过程中均逐渐受到抑制;在干旱胁迫发生时Gs就出现下降,气孔开始关闭;随后Vcmax、TPU开始下降,叶片细胞内与光合作用相关的部分活动也开始受到抑制;在极端干旱的情况下Vcmax、Gs和TPU相继降为0,而WUE的下降速度减慢。即在干旱胁迫下,石生针茅会通过抑制WUE的下降来提高抗旱能力。
Ci随SWC的降低先降低,并在SWC为14.73%时达到最低值258.49μmol CO2·mol—1,此后随着干旱程度的加剧逐渐增加(图3)。表明在干旱初期,石生针茅叶片的Ci受到抑制,但随着干旱程度的加剧,在土壤含水量接近轻度干旱时期有所回升。同时,根据公式(7)可计算出气孔限制值(stomatal limitation value,Ls),并由此判断不同条件下光合作用的主要限制因子。本研究中在光合生理参数的测定过程中Ca控制在(400±10)μmol·mol—1,将其变化忽略后Ls与Ci呈现完全相反的变化趋势。即当SWC较高时,随着SWC的降低Ci降低,Ls增高,此时气孔限制为光合速率降低的主要原因;当SWC下降到14.73%时,Ci转为升高,Ls转为降低,此时非气孔限制转变为光合速率降低的主要原因。
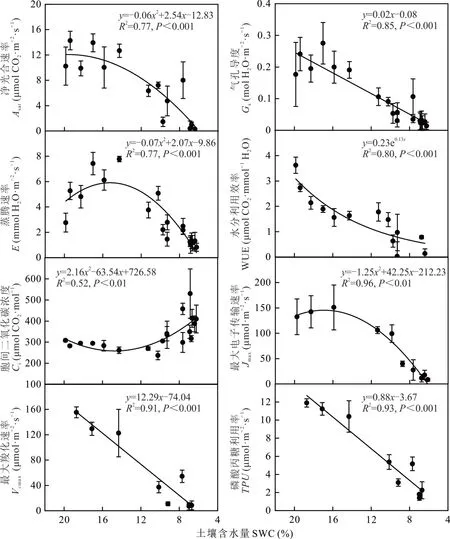
图3 石生针茅光合参数对土壤水分变化的响应Fig.3 Responses of leaf photosynthetic parameters of S.tianschanica to soil water content

式中:Ca(atmospheric carbon dioxide concentration)为大气CO2浓度。
2.2.2叶绿素荧光参数 多数光合过程的变化都会反馈给光系统Ⅱ,进而引起叶绿素a荧光的变化,因此光合作用过程的变化大多可通过叶绿素荧光反映出来[37]。石生针茅叶片的Fv′/Fm′和ΦPSII都随SWC的降低表现出先增加后降低趋势,两者与SWC呈显著的二次曲线关系(图4)。Fv′/Fm′和ΦPSII分别在SWC为16.41%和15.97%时达到最大值0.47和0.24,此后随SWC的降低持续降低。表明在干旱初期,土壤含水量达到轻度干旱前,PSII的光化学量子传递效率最大,随着干旱胁迫的加剧,石生针茅叶片的光能转换效率受到明显抑制,光系统甚至可能受到破坏。

图4 石生针茅叶绿素荧光参数对土壤水分变化的响应Fig.4 Responses of chlor ophyⅡfluorescence parameter s of S.tianschanica to soil water content
2.3 生态系统碳交换特征参数对土壤极端干旱过程的响应
石生针茅生态系统的碳交换量与SWC呈显著的二次曲线关系(图5)。NEE为负值表示生态系统从大气中吸收CO2,且负值越小吸收CO2越多,此时生态系统表现为碳汇;正值表示生态系统向大气中释放CO2,此时生态系统表现为碳源。根据拟合曲线计算得出,NEE在SWC为17.58%时碳吸收量达到最大值—3.60μmol CO2·m—2·s—1,在SWC为7.85%时达到0。表明在干旱初期以及轻度和中度干旱情况下,生态系统表现为碳汇,且碳吸收量随SWC的降低先增加后减少,在SWC为17.58%时碳吸收量最大;在SWC为7.85%时生态系统由碳汇转变为碳源,且碳排放量随SWC的继续降低逐渐增加。Re和GEP在土壤极端干旱过程中一直降低,并分别在SWC为5.64%和6.44%时达到0(图5)。

图5 石生针茅生态系统碳交换特征参数对土壤水分变化的响应Fig.5 Responses of ecosystem CO 2 exchange parameters in S.tianschanica to soil water content
2.4 生态系统碳交换特征参数的敏感性分析
石生针茅草原碳交换的不同特征参数对土壤干旱过程的敏感性不同,一方面随着SWC的降低,参数值发生反应的时间和趋势有差异;另一方面,SWC降低造成的不同参数的变化幅度也不同,即各参数的响应曲线形状、达到最大值时对应的SWC、参数值上升和下降速率都有一定差别。
在土壤水分逐渐降低的过程中,石生针茅的碳交换特征参数除Ci外均在SWC适宜、未发生干旱的情况下达到最大值,Ci在重度干旱的情况下达到最大值。各参数的最大值点分布相对分散,分3组分别聚集在SWC为20%、18%和16%附近,即各参数达到最大值时对应的SWC有差异(图6)。在SWC下降的过程中,Gs和WUE最先达到最大值,其次是Asat、Re、GEP,表明石生针茅叶片尺度上的参数及生态系统呼吸达到最大值需要较好的水分条件,且在SWC下降过程中最先出现下降响应。SWC下降到18%左右时Vcmax、TPU、Jmax、NEE达到最大值并开始下降;SWC下降到16%左右时Fv′/Fm′和ΦPSII开始下降;除Ci外,E最后达到最大值,即E最晚出现下降响应。随着SWC的继续下降,各参数除Ci外都在重度干旱的情况下达到最小值,Ci在SWC适宜的情况下达到最小值。且各参数的最小值点分布密集,都分布在SWC为6%~7%之间,说明各参数达到最小值时对应的SWC差异较小。
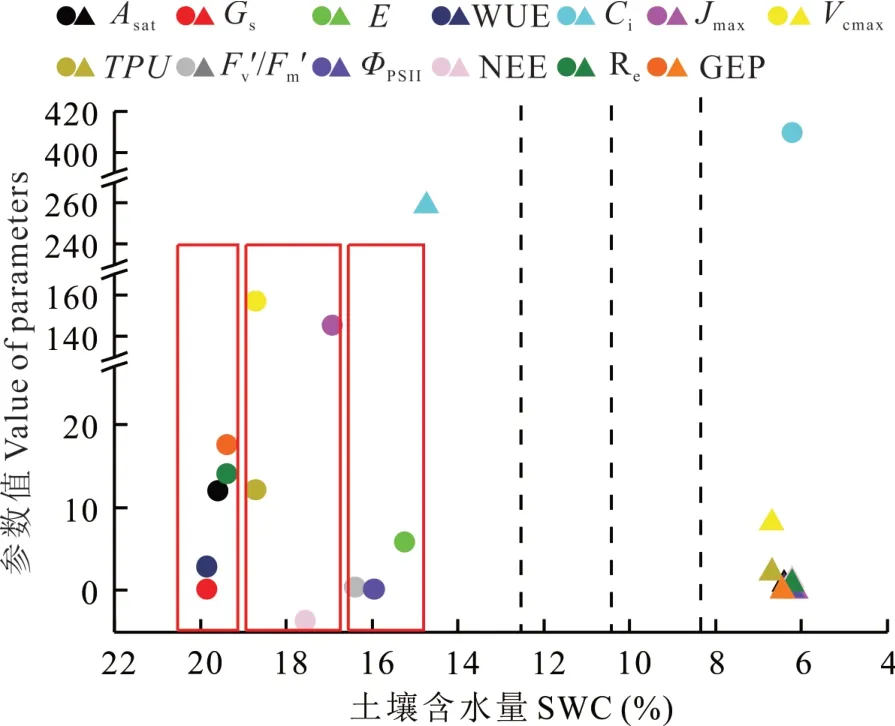
图6 石生针茅生态系统碳交换特征参数在土壤干旱过程中的最大值和最小值Fig.6 The maximum and the minimum of ecosystem CO 2 exchange parameters in S.tianschanica during soil drought process
将各参数的拟合曲线标准化(将SWC等于田间持水量时的参数值看作1,曲线上的其他点按相同比例缩放)后对比发现,不同参数的响应曲线形状和参数值的变化速率都有差异(图7)。各参数的响应曲线可分为先升高后降低的曲线和单调递减的曲线,有超出红色虚线部分的参数在SWC下降过程中参数值有所升高,即表现出水分阈值效应;未超出红色虚线的参数在SWC下降过程持续下降,即对土壤干旱较敏感。

图7 石生针茅生态系统碳交换特征参数对土壤含水量的响应曲线(标准化后)Fig.7 Response curves of ecosystem CO 2 exchange parameters in S.tianschanica to soil water content(standar dized)
参数值在不同干旱程度下的变化速率也有差异,在无干旱胁迫的情况下,随SWC的降低E发生的变化幅度最大,其次是WUE和Vcmax,Fv′/Fm′的变化速率最小;在轻度干旱的情况下,随SWC的降低NEE的变化速率最大,其次是E和Jmax,Ci的变化速率最小;在中度干旱的情况下,E、NEE和Jmax的变化速率较大,WUE的变化速率最小;在重度干旱的情况下,E、NEE和Jmax的变化速率较大,WUE的变化速率最小。总的来看,E达到最大值前上升速率最快,其他参数的上升速率相差不大;同时,E达到最大值后下降速率最快,NEE和Jmax的下降速率也较快;WUE整体下降速率最慢,TPU和Re的下降速率也较慢。
3 讨论
3.1 土壤极端干旱对不同尺度下碳收支过程的影响
干旱是影响植物生长和生态系统碳收支的一个主要胁迫因子。在土壤极端干旱的过程中,植物的细胞、器官、个体以及生态系统的活动都呈现出相应的变化,且对不同干旱程度的响应不同。在本研究中,相关参数的响应表明石生针茅叶片叶绿体内部的光合作用在干旱过程中受到显著影响。Vcmax和TPU都随SWC的降低而下降,这可能是因为叶绿体内Rubisco酶的数量和活化状态以及磷酸丙糖(triose phosphate,TP)运转速率都在干旱过程中持续下降[38]。植物叶片内的水分含量影响光合作用中电子的传输,限制了还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)和三磷酸腺苷(adenosine triphosphate,ATP)的合成,从而对1,5-二磷酸核酮糖(ribulose-1,5-bisphosphate,RuBP)再生产生影响[39],也就导致了Jmax随SWC先升高后降低,且其降低滞后于Vcmax和TPU。此外,Jmax降低,光合反应中心逐渐关闭,Fv′/Fm′和ΦPSII也降低。即随SWC的继续降低叶绿体的总光合能力开始下降,叶绿体结构和功能可能受到损伤[37]。
石生针茅叶片的Asat和E对SWC变化表现出明显的阈值,且Asat和E峰值的出现滞后于Gs和Ci。该结果与前人研究结果基本吻合[40—41],可能由于干旱胁迫发生时,植物叶片的气孔开始关闭,限制了CO2进入叶内,导致Ci发生下降,不能满足光合作用的需求,从而降低了光合速率。同时Gs的下降也导致了E的降低。此时叶绿体仍有较强的活性,导致光合作用降低的主要原因可能为气孔限制[42]。当SWC下降到14.73%时Ci由降低转为升高,Ls由升高转为降低,此时导致光合速率降低的主要原因由气孔限制转变为非气孔限制。明显发现在SWC下降到14.73%前,Jmax、Fv′/Fm′和ΦPSII已转为下降,即引起石生针茅光合作用能力降低的主要因素转变为非气孔限制前,植物叶片内的叶绿体总光合能力、Rubisco酶的活性以及RuBP的再生能力已发生下降。
干旱影响生态系统的光合作用和呼吸作用,从而影响生态系统的碳收支[43—45]。本研究结果表明石生针茅生态系统的NEE先升高后降低,即在SWC刚开始下降时,GEP吸收的CO2多于Re释放的CO2,且Re的下降速率高于GEP。随着SWC的持续下降,在SWC为17.58%时GEP的下降速率超过Re且一直持续到处理结束,造成了NEE的持续下降,此时GEP表现出更高的敏感性。前人研究也发现,在草原生态系统中,GEP常比Re对干旱的敏感程度更高,且两者间的敏感度差异常随干旱程度的加深而增加[46—47]。
总体而言,在SWC下降过程中,石生针茅叶片尺度的参数最先达到最大值,即参数值最先开始下降(图6),随后植物细胞内表征光合过程的各参数开始下降,最后与叶绿体光合能力相关的参数Fv′/Fm′和ΦPSII达到最大值并开始下降。这一结果可以说明面对干旱胁迫时,石生针茅个体叶片水平上的活动最先出现响应,同时生态系统的呼吸作用开始下降;随着干旱胁迫的加重,这一响应延伸到细胞水平,石生针茅叶片细胞内光合作用的各环节逐渐受到抑制,同时NEE达到最大值并开始下降;干旱胁迫继续加重,导致叶绿体功能逐渐受到抑制,其他结构随即受到损伤,最终导致石生针茅死亡。
3.2 不同特征参数的敏感性比较
在土壤干旱胁迫的过程中,随着SWC的下降,Gs、WUE、Vcmax、TPU、Re和GEP最先开始下降,且在干旱过程中持续下降,即这几项参数对土壤干旱最敏感;而E、NEE和Jmax在整个干旱过程中的变化速率较大。
Vcmax通常指植物单位时间内单位面积叶片能够固定的最大CO2摩尔数,而干旱会导致气孔导度下降,限制CO2进入细胞,从而导致Vcmax随Gs的下降迅速下降[48—49]。本研究中Vcmax随着SWC下降迅速下降的过程与之相吻合;同时持续干旱也会因导致Rubisco酶活性下降而造成Vcmax下降。TP是叶绿体产生的光合作用最初产物,其含量一般会维持在一个相对稳定的水平,不会过高或过低,否则都会对光合作用产生抑制[50];TP的生成与CO2固定密切相关,因此TPU会随干旱导致的CO2固定速率的下降而下降[38]。
本研究中SWC下降时,叶片尺度的参数中Gs先开始下降,表明Gs对土壤干旱较为敏感,干旱发生时最先出现响应。这与许多学者的研究结果一致,即气孔作为植物与外界气体交换的门户,能敏感感知外界干旱环境并先出现响应[51—52]。实验过程中空气湿度未发生明显变化,因此Gs的下降可能是SWC下降导致叶片水势变化而引起的气孔的反馈式反应[53];此外也有研究表明,根系受到干旱时会产生化学信号(如脱落酸)来调节气孔[54]。叶片水平的WUE可用Asat和E之比来反映,与植物自身生长特征和生存策略有关[55—56]。前人研究显示,多数植物在面对轻度干旱胁迫时WUE会先增加,干旱胁迫继续加重时下降;这是由于蒸腾作用通常比光合作用更先受到抑制,且受抑制程度更强[57—58]。而本研究结果与前人研究具有一定的差异:在整个干旱过程中WUE持续下降,但下降速度逐渐减缓。即石生针茅的Asat先于E受到抑制;但E开始下降后其下降速率较快,受抑制程度强于Asat,因此WUE的下降速度逐渐减缓。究其原因,一方面不同植物的生存适应策略各不相同,石生针茅受到干旱胁迫时可能选择减缓生长或缩短生长周期等方式适应干旱[58—59];另一方面石生针茅生长于荒漠草原的栗钙土,其田间持水量较低,可能其他植物WUE上升阶段对应的SWC对于石生针茅而言已超出其土壤田间持水量或还未达到干旱水平。
本研究中Re和GEP在整个干旱过程中持续下降,前人研究中也有相似的发现[36,60]。Re对土壤干旱较为敏感,土壤干旱会抑制植物根系和微生物的活动,可能导致土壤内碳含量的减少。此外,土壤干旱还会影响温度与Re的关系,从而对Re产生间接影响[61—62]。GEP对短期土壤干旱的响应可能不同于Re,如Reichstein等[36]对地中海常绿林的研究中发现可利用的丰富地下水会降低GEP对干旱的敏感性;但本研究中荒漠草原生态系统的植物根系大都较浅,因此GEP甚至表现出更高的敏感程度[47]。
3.3 石生针茅致灾机制探索
干旱是导致生态系统中植物死亡的一个重要生态因子[63—64],本研究中极端干旱最终导致了石生针茅的死亡。水力失衡假说和碳饥饿假说是现有的解释干旱导致树木死亡机制的两个主要假说[65],水力失衡假说认为干旱造成的土壤水分供应减少和高蒸发需求会导致植物木质部导管和根系出现气穴栓塞,植物体内水分运输受限,最终导致其缺水死亡[66]。而碳饥饿假说认为植物在受到干旱胁迫后气孔关闭,导致光合作用下降,当光合作用产生的非结构性碳水化合物(non-structural carbohydrates,NSC)不能满足植物呼吸、生长和防御所需时,会引起碳平衡失调,长期碳失衡将导致植物死亡[63]。实际上,在植物受到干旱胁迫并逐渐死亡的过程中,两个生理过程同时存在并紧密联系,都可能在植物死亡的过程中发生作用,多以哪个过程在植物干旱死亡期间起主导作用或先达到植物死亡阈值来判定植物主要致死机制[67]。但目前干旱致死的水力失衡阈值和碳饥饿阈值,以及两个过程对植物死亡的贡献程度都不十分明确。本研究中石生针茅的死亡机制可能是干旱导致的水力失衡。石生针茅类似于McDowell等[63]根据植物气孔行为划分的非等水势调节(anisohydric)植物,SWC刚开始下降时石生针茅的Gs下降速率较慢,E在干旱初期持续上升,且最晚出现下降响应;同时Asat也先上升后下降,更符合等水势植物牺牲叶片水势,维持光合作用的生长策略[68]。石生针茅接近死亡时,Asat和E达到0对应的SWC相近(分别为5.96%和5.91%),但能明显看出E下降速率更快,即干旱后期其蒸腾作用明显受限,可能由导管中出现的栓塞导致。此外,在短期严重的干旱胁迫下,植物更容易出现水分传输障碍,水力失衡在干旱致死的过程中有更高的贡献度[67—69],石生针茅在SWC持续下降最终导致极端干旱的过程中水力失衡致死的可能性更大。实际上,水力失衡假说和碳饥饿假说都多用于解释木本植物的干旱致死机制,关于草本植物的死亡机制研究较少。弄清石生针茅的详细死亡机制,还需对植物内部NSC的动态变化和各器官木质部的解剖结构等进行观测,并进一步探索干旱胁迫下植物的碳水代谢关系。
4 结论
内蒙古荒漠草原石生针茅生态系统的碳交换与土壤含水量密切相关,且土壤干旱程度越高碳交换过程受到的抑制越严重。石生针茅叶片尺度上的碳交换活动对土壤干旱最敏感,尤其是气孔最先感知到干旱胁迫开始关闭,随后细胞内的活动开始出现响应,生态系统尺度的呼吸作用对土壤干旱较敏感,光合作用的响应相对滞后。包括Asat、NEE在内的多项特征参数都对土壤含水量表现出临界效应,即土壤含水量过高时石生针茅的光合作用效率会受到抑制。持续干旱导致石生针茅光合速率下降的主要因素转变为非气孔限制,生态系统由碳汇转变为碳源,即极端干旱会对荒漠草原碳收支产生严重影响。本研究对土壤干旱过程中石生针茅生态系统碳收支特征参数的变化过程进行了定量描述和敏感性比较,这对于预测未来极端干旱多发情况下荒漠草原的碳收支和碳储量变化有一定的意义。
