极小种群野生植物白花兜兰ISSR遗传多样性分析*
2022-02-09秦惠珍唐凤鸾
秦惠珍,盘 波,赵 健,邹 蓉,韦 霄,唐凤鸾
(广西壮族自治区中国科学院广西植物研究所,广西植物功能物质与资源持续利用重点实验室,广西桂林 541006)
白花兜兰(Paphiopedilumemersonii)为兰科(Orchidaceae)兜兰属(Paphiopedilum)中极具观赏价值的濒危类群之一[1],是我国特有的兰科兜兰属物种,仅分布于广西和贵州南部极其狭窄的喀斯特地区,生于石灰岩山坡多石之地,海拔600-700 m,原生境条件严酷、复杂,气候存在特有性,属于极小种群野生植物。白花兜兰由于具有极高的观赏价值和科研价值等,近年来遭到掠夺性采挖,导致其种群数量迅速减少而濒临灭绝[2,3]。早在1997年,包括白花兜兰在内的所有兜兰属植物就被列入《濒危野生动植物种国际贸易公约》(CITES)附录Ⅰ中,禁止国际贸易[4]。在《中国物种红色名录》中,白花兜兰被列入极危种,属于国家Ⅰ级保护植物,具有极高的保护与研究价值。目前,关于白花兜兰的研究主要集中在叶表皮形态特征[5]、群落结构特征[6]、繁殖技术[7-9]、迁地保护[10]和回归研究[11]等方面。虽然组织培养技术使白花兜兰移栽成活率达到95%以上,但是种群数量少、结实困难、优良种质资源匮乏仍是限制白花兜兰快繁的重要因素。可见要从根本上缓解白花兜兰的濒危现状,重建白花兜兰种群,还需进一步研究白花兜兰现有野生种群的遗传多样性,对遗传多样性较高的种群进行迁地保护或就地保护,以及优良种质资源培育等。因此,研究白花兜兰的遗传多样性对白花兜兰的种质资源保护及分子辅助育种具有重要意义。
ISSR等DNA分子标记技术被广泛应用于植物的优良种质资源选育、新品种鉴定和遗传多样性研究等领域。ISSR分子标记技术具有成本低、多态性高、实验操作简便等优点[12],在兰科植物的种质资源鉴定、亲缘关系分析和遗传多样性研究等方面已得到广泛应用[13]。本研究拟采用ISSR分子标记技术对白花兜兰8个野生种群的122份样品进行遗传多样性及种群间亲缘关系分析,以期为白花兜兰的种质资源保护、优良种质资源培育等提供理论参考。
1 材料与方法
1.1 材料
于2020年8-9月采集白花兜兰野生种群样品,每个种群根据现存数量采集样品,剪取无病虫害的新鲜叶片,用变色硅胶快速干燥,用密封袋密封带回实验室存放于干燥处,并尽快提取其基因组DNA,样品采集信息详见表1。
1.2 方法
1.2.1 基因组总DNA的提取
白花兜兰总DNA用植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取,分别用1%琼脂糖凝胶和紫外分光光度计检测所得总DNA的浓度和纯度,浓度调整为40 ng/μL,-20℃贮存备用。
1.2.2 ISSR引物的合成与筛选
ISSR引物由生工生物工程(上海)股份有限公司根据加拿大哥伦比亚大学(University of British Columbia,UBC)公布的100条通用引物序列(http: //www.biotech.ubc.ca/services/naps/primers.html)合成。本试验以24份白花兜兰(8个野生种群,每个种群随机选3份)的基因组DNA为模板,用100条ISSR引物进行PCR预扩增,从中筛选出扩增产物条带清晰、多态性效果较好的引物,用于后续白花兜兰8个野生种群的遗传多样性分析。
1.2.3 ISSR-PCR反应体系及程序
结合Taq酶特性,参照兰科植物ISSR反应体系[13]加以改进:25 μL PCR体系中含2.5 μL 10×Taq Buffer,1.0 μL引物(10 μmol/L),0.4 μL dNTP(10 μmol/L),1.5 μL Mg2+(25 mmol/L),0.2 μL Taq酶(5 U/μL),1 μL 模板DNA (40 ng),用ddH2O补足至25 μL。PCR扩增程序:95℃预变性5 min,40个循环(95℃ 20 s,52℃ 20 s,72℃ 2 min);然后72℃延伸10 min,电泳结束后采用GONGDS 8000凝胶成像系统(美国UVP公司)拍照记录。
1.2.4 数据处理
ISSR-PCR扩增产物按条带的有无统计,有条带的记为1,无条带的记为0;利用POPGene 32软件计算遗传多样性指数,利用NTsys 2.10e软件计算遗传相似系数,利用NTSYS-pc软件计算遗传分化系数;采用非加权组平均法(Unweighted Pair-group Method with Arithmetic Means,UPGMA)进行聚类分析,构建树状聚类图[14,15]。
2 结果与分析
2.1 ISSR多态性分析
用初步筛选出的引物对24份白花兜兰样品进行复筛,最终筛选出6条多态性较高、扩增效果较为理想的引物(表2)。用这6条引物对122份白花兜兰样品进行PCR扩增,共扩增出总条带35条,其中多态性条带30条。平均每条引物总扩增条带数为5.83条,多态性百分数均值为87.70%,说明白花兜兰122份样品之间遗传多样性较为丰富。引物807和引物809的部分样品扩增结果如图1所示。

表2 6个ISSR引物的扩增结果

M:DL 2000 DNA:marker
2.2 遗传多样性分析
2.2.1 种群内的遗传多样性分析
6条引物对8个野生种群的122份样品进行ISSR-PCR反应,共扩增出35条谱带,种群间多态性位点数为15-29,种群水平的多态性位点百分率(PPB)为50%-96.67%,均值为78.33%;等位基因数(Na)为1.500 0-1.966 7,均值为1.783 3;有效等位基因数(Ne)为1.316 4-1.622 2,均值为1.481 7;Na与Ne在8个野生种群中差异不大,说明8个白花兜兰种群其等位基因在群体中分布均匀;Nei′s基因多样性指数(H)为0.187 0-0.352 1,均值为0.280 8;Shannon′s信息指数(I)为0.278 6-0.517 5,均值为0.419 1;8个野生种群的多态性位点百分率为50.00%-96.67%,均值为78.33%(表3)。说明8个白花兜兰种群的遗传多样性属于中等水平。

表3 种群内的遗传多样性
2.2.2 种群间遗传变异分析
对白花兜兰的8个野生种群的种群间遗传分化水平进行分析,种群内的遗传多样性(Hs)为0.280 8,种群间的遗传分化系数(Gst)为0.124 7,即总的遗传变异中有12.47%的变异来自种群间,87.53%的变异来自种群内,表明种群内遗传分化非常大。种群间每代个体的基因流(Nm)为3.509 3,表明种群间基因交流非常频繁。
2.3 种群遗传结构分析
2.3.1 遗传距离与遗传一致度分析
白花兜兰8个野生种群的遗传相似度为0.866 1-0.978 6,种群LH与种群HMD的种群遗传相似度最小,为0.866 1,种群LLG与种群LYZ的种群遗传相似度最大,为0.978 6,表明种群LH与种群HMD的遗传差异最大,遗传关系最远;种群LLG与种群LYZ差异最小,亲缘关系最近。8个野生种群的遗传距离为0.021 6-0.143 8,其中LLG与种群LYZ遗传距离最近,为0.021 6,种群LH与种群HMD遗传距离最远,为0.143 8 (表4)。

表4 遗传相似度(右上)与遗传距离(左下)
2.3.2 聚类分析
基于遗传一致性,采用UPGMA法将白花兜兰8个野生种群样本作聚类分析,结果如图2所示。从图2可以看出,8个白花兜兰野生种群分为两大类,第一大类包括HML和HMD两个种群(38份样品),第二大类包括LYZ、LLG、LH、YLD、YLY、LLJ 6个种群(84份样品)。第二大类再划分成3个亚类,第Ⅰ类包括YLD 1个种群(6份样品),第Ⅱ类包括YLY和LLJ 两个种群(38份样品),第Ⅲ类包括LYZ、LLG、LH 3个种群(40份样品)。
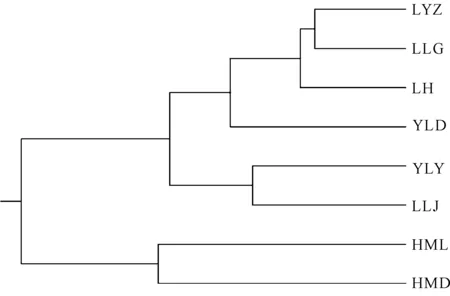
图2 白花兜兰8个野生种群的UPGMA树状聚类图
3 讨论
遗传多样性高低是评价种质资源优劣的重要内在因素之一,同时反映物种对环境的适应能力[16,17]。ISSR分子标记技术在植物的遗传多样性分析、优良种质资源鉴定及种群亲缘关系分析方面具有广泛应用。目前ISSR分子标记技术已应用于蝴蝶兰属(Phalaenopsis)、石斛属(Dendrobium)、兰属(Cymbidium)、开唇兰属(Anoectochilus)等兰科植物的遗传多样性、品种鉴定与亲缘关系分析研究[18-20]。李敏等[21]利用ISSR分子标记技术分析16个蝴蝶兰品种的亲缘关系,发现来源于日本和台湾的品种聚为一类,其他品种聚为另一类。李永清等[22]和鹿炎等[23]利用ISSR分子标记对铁皮石斛(Dendrobiumofficinale)的种质资源进行遗传多样性和亲缘关系分析,从100条ISSR引物中筛选出9条多态性引物,多态性比率为99.36%,Na均值为1.913 0,Ne均值为1.528 3,H均值为0.310 0,I均值为0.465 0。叶炜等[24]对金线兰(Anoectochilusroxburghii)及其近缘种植物进行ISSR遗传多样性研究,从100条ISSR引物中筛选出12条多态性引物,多态性比率为99.36%,Na均值为2.000 0,Ne均值为1.555 0,H均值为0.322 0,I均值为0.484 0。本研究首次采用ISSR分子标记对8个白花兜兰野生种群的遗传多样性进行研究,从100条ISSR引物中筛选出6条具有多态性且条带清晰的引物,PPB均值为78.33%,Na均值为1.783 3,Ne均值为1.481 7,H均值为0.280 8,I均值为0.419 1,表明白花兜兰的遗传多样性水平低于铁皮石斛和金线兰。
遗传相似度是判断种内及种间亲缘关系及遗传基础的标准之一[25],遗传相似度越大,亲缘关系越近。目前ISSR分子标记技术在兰科植物中已广泛应用于金线莲(A.formosanus)、春兰(C.goeringii)和蝴蝶兰属等植物的遗传多样性、品种鉴定与亲缘关系分析[23,24]。本研究中8个白花兜兰野生种群的遗传相似度为0.866 1-0.978 6,种群间的遗传相似度均值为0.937 0,且种群间遗传相似度均大于0.8,表明白花兜兰8个野生种群的亲缘关系较近。遗传距离反映不同种群及不同物种间的亲缘关系,遗传距离越小亲缘关系越近[26],8个白花兜兰野生种群两两间的遗传距离为0.021 6-0.143 8,遗传距离集中且较小,表明白花兜兰野生种群之间遗传分化程度较小,亲缘关系较近。本研究的聚类分析中,HMD和LYZ两个种群的地理距离(5.534 km)最近,但并没有严格按地理位置分布聚类,可能是种群间的基因交流较为频繁所致。
白花兜兰仅分布于广西和贵州喀斯特山坡的悬崖或断岩崖壁上,生存条件恶劣,分布范围狭窄,种群间地理距离近,导致种群间的基因交流频繁,但过大的基因流阻碍了由遗传漂变导致的遗传分化,不利于种群的长期进化与发展。白花兜兰的遗传多样性虽然低于铁皮石斛和金线兰等国家二级保护野生植物,但仍具有较高的遗传多样性,表明遗传多样性并不是白花兜兰致濒的根本原因,其可能原因,一是“兰花热”使得白花兜兰遭受毁灭性的采挖,加之采挖过程中对其生境的破坏使其不能在短时间内得以恢复;二是白花兜兰在自然状态下结实率非常低。根据聚类结果及种群间遗传多样性指数,可知HML和HMD两个种群遗传多样性最高,可作为良种选育的原材料。此外,要加大对白花兜兰野生种质资源及其生境的保护,严禁采挖,同时还要加强对白花兜兰野生种质资源的良种选育,通过组织培养等方式扩大人工培育,从而更好地保护极危植物白花兜兰的野生资源多样性。
