胶州湾女姑口海域大型底栖动物群落特征与生态健康评价*
2022-02-09刘欣禹齐衍萍沙婧婧徐子钧菅潇扬杜小媛温国义周瑞佳
刘欣禹,齐衍萍,沙婧婧,徐子钧,菅潇扬,杜小媛,温国义,周瑞佳**
(1.国家海洋局北海环境监测中心,山东青岛 266000;2.自然资源部渤海生态预警与保护修复重点实验室,山东青岛 266000;3.山东省海洋生态环境与防灾减灾重点实验室,山东青岛 266000)
大型底栖动物作为海洋生态结构的重要组成部分,通过摄食、掘穴等活动参与碳、氮、磷、硫等元素的循环,有助于加快底层生态系统的物质循环和能量传递[1,2]。由于活动能力弱、栖息地相对稳定和对海洋环境反应敏感等特点,所以大型底栖动物群落的物种组成通常会随着非生物条件和人类干扰的变化而变化,这使得大型底栖动物经常被用作评价底栖生境健康状况的生物指标[2,3],对海洋生态环境研究具有积极意义。
将底栖生物作为海洋生态环境监测和生态系统健康评价的生物指标已得到国内外科学家的广泛认可[4]。多样性指数、AZTI海洋生物指数(AMBI)、多变量AMBI (M-AMBI) 均能在一定程度上反映底栖动物受扰动状态,可用于评价底栖环境状态[5]。其中,AMBI和M-AMBI是Borja等[6]在海洋生物指数的基础上创建的。在我国及欧洲沿海,这3种指数已被用于港湾、近岸海域以及河口区的底栖生态环境质量评价[7-10]。
胶州湾位于山东半岛南部,属于相对独立的半封闭海湾,女姑口海域位于青岛市城阳区,在胶州湾的东北部,具有典型的泥质底质。20世纪80年代开始,胶州湾东部浅海海域的养殖业迅速崛起,90年代周边城区工业和旅游业等繁荣发展,近岸海域资源被快速开发利用[11]。胶州湾环海高速公路从女姑口上通过,附近滩涂上主要开展底栖型贝类如菲律宾蛤仔(Ruditapesphilippinarum)、缢蛏(Sinonovaculaconstricta)的养殖[12,13]。麻骜等[14]研究胶州湾养殖水域和自然水域的底栖状况发现,菲律宾蛤仔养殖活动压力已造成养殖区域及其邻近自然海域的大型底栖群落结构发生改变。崔正国等[15]对胶州湾底播菲律宾蛤仔的质量安全风险进行了评价。其他研究主要基于胶州湾大型底栖动物进行海洋健康状况评估[16],针对胶州湾女姑口附近海域调查相对较少。
本研究基于2018年11月和2019年4月两个航次胶州湾女姑口邻近海域的大型底栖动物调查和环境要素调查数据,对胶州湾女姑口邻近海域生物种类组成和生物群落结构进行研究,探讨群落结构与环境因子的相互关系,并对该海域进行生态系统健康评价,以了解胶州湾女姑口近海底栖生物资源现状及生态健康状况,为胶州湾整体生态保护与管理提供数据支持。
1 材料与方法
1.1 样品采集与处理
2018年11月、2019年4月在胶州湾女姑口近海设置12个站位进行采样监测,站位布设见图1。
大型底栖动物用0.1 m2抓斗式采泥器采集,每站采样4次,样品用网目为0.5 mm的过筛器分选,用5%福尔马林溶液固定后,带回实验室进行定量定性分析,物种鉴定及名录登记均通过WoRMS网站进行校对和复核。站位布设、生物密度及生物量分布图由ArcGIS 10.6软件绘制。
测定的环境参数包括海水水深(D)、水温(WT)、盐度(S)、pH值、溶解氧(DO)、化学需氧量(COD)、磷酸盐(DIP)、无机氮(DIN)、悬浮物(SS)、表层沉积物底质类型及中值粒径(MD)。
1.2 数据处理
1.2.1 群落结构及优势种计算
使用Shannon-Wiener多样性指数(H′)[17]、Pielous均匀度指数(J)[17]和Margalef物种丰富度指数(d)[17]分析生物群落结构。使用物种优势度指数(Dominance index,Y)判定优势种[18]。计算公式如下:
(1)
(2)
d=(S-1)/log2N,
(3)
Y=Pi×F,
(4)
式中,Pi=ni/N(ni是第i个物种的个体数,N是全部物种的个体数);S为种类数;F为该种的出现频率,当Y>0.02时[19],即为该海域底栖动物优势种。H′值等于0,说明无底栖生物,即严重污染;0-1为重污染;1-2为中度污染;2-3为轻度污染;大于3为清洁[17]。
1.2.2 环境因子相关分析
使用SPSS 18.0软件,进行单因素方差分析(One-way ANOVA),分析各季节环境要素的差异性;采用Canoco 5.0软件对大型底栖动物优势种生物密度和环境因子进行典范对应分析(CCA),物种矩阵经lg(x+1)转换[20],探究环境因子对大型底栖动物优势种生物密度变化的影响。
1.2.3 底栖生境质量评价
AMBI和M-AMBI采用AMBI V5.0软件计算,先除去非大型底栖无脊椎动物的种类,其余大型底栖动物的生态分组根据文献[10,21]规定执行。AMBI值为0.0-7.0,数值越低表示生态健康状况越好;M-AMBI值为0.00-1.00,数值越高表示生态健康状况越好。AMBI和M-AMBI的评价标准[10,22]详见表1。
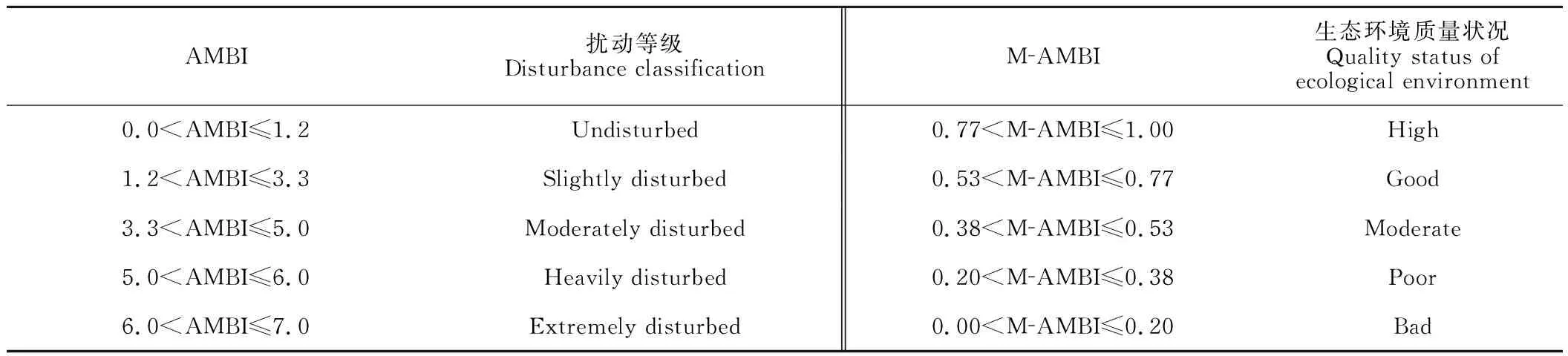
表1 AMBI和M-AMBI扰动等级、生态环境质量状况标准
2 结果与分析
2.1 群落结构
2.1.1 种类组成与优势种
调查共发现82种底栖生物,包括扁形动物、刺胞动物、纽形动物、环节动物、软体动物、节肢动物、棘皮动物、半索动物和脊索动物9个门类,其中环节动物多毛类29种、节肢动物甲壳类29种、软体动物18种,以上3个门类种数占总种数的92.68%,是女姑口邻近海域主要的大型底栖动物类群,其他各门类均1种。春季(4月)采集到的大型底栖动物种类较多,为67种,其中环节动物27种,软体动物15种,节肢动物21种,扁形动物、刺胞动物、纽形动物、棘皮动物各1种。秋季(11月)采集到大型底栖动物46种,其中环节动物21种,软体动物7种,节肢动物15种,纽形动物、尾索动物、脊索动物各1种。
优势种主要为环节动物多毛类和软体动物,两个季节均表现出明显优势的种为寡鳃齿吻沙蚕(Nephtysoligobranchia)、寡节甘吻沙蚕(Glycindegurjanovae)和菲律宾蛤仔。其他优势种均为环节动物多毛类及小型贝类,胶州湾女姑口邻近海域大型底栖动物有小型化趋势。节肢动物甲壳类在本调查中共发现29种,其中秋季15种,其密度占秋季总密度的12.03%,密度占比最高的种为长尾亮钩虾(Photislongicaudata)和极地蚤钩虾(Pontocratesaltamarinus),两种密度占比均为2.95%,站位出现率均为41.67%;春季21种,其密度占春季总密度的13.78%,密度占比最高的种类为东方长眼虾(Ogyridesorientalis)(密度占比2.23%,站位出现率33.33%)。虽然甲壳类是种类组成的主要类群,但是密度占比未超过14%,站位出现率未超过45%,优势度较低,并没有出现甲壳类优势种。调查海域大型底栖动物优势种及优势度指数见表2。
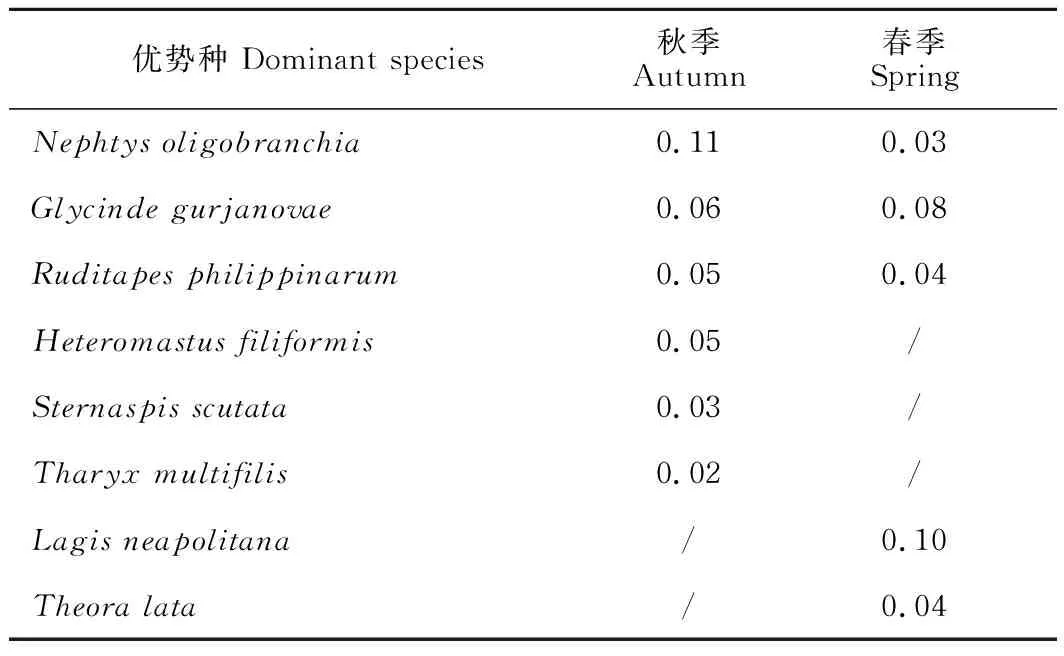
表2 秋季和春季调查海域大型底栖动物优势种及优势度指数
2.1.2 生物密度与生物量分布
调查海域大型底栖动物平均生物密度为665.83 ind./m2,平均生物量为358.65 g/m2。调查海域2018年秋季平均生物密度为485.00 ind./m2,平均生物量为235.80 g/m2;2019年春季平均生物密度为846.67 ind./m2,平均生物量为481.60 g/m2。由图2可知,秋季生物密度高值区主要位于红岛滩涂附近海域,生物量高值区位于红岛外侧海域;春季生物密度及生物量的高值区主要集中在墨水河口附近海域,墨水河口2号站春季调查发现大量菲律宾蛤仔,因此生物量生物密度高。在季节变化方面,春季生物密度、生物量较高,而且种类组成分析发现,春季软体动物和节肢动物种类数量明显增多。
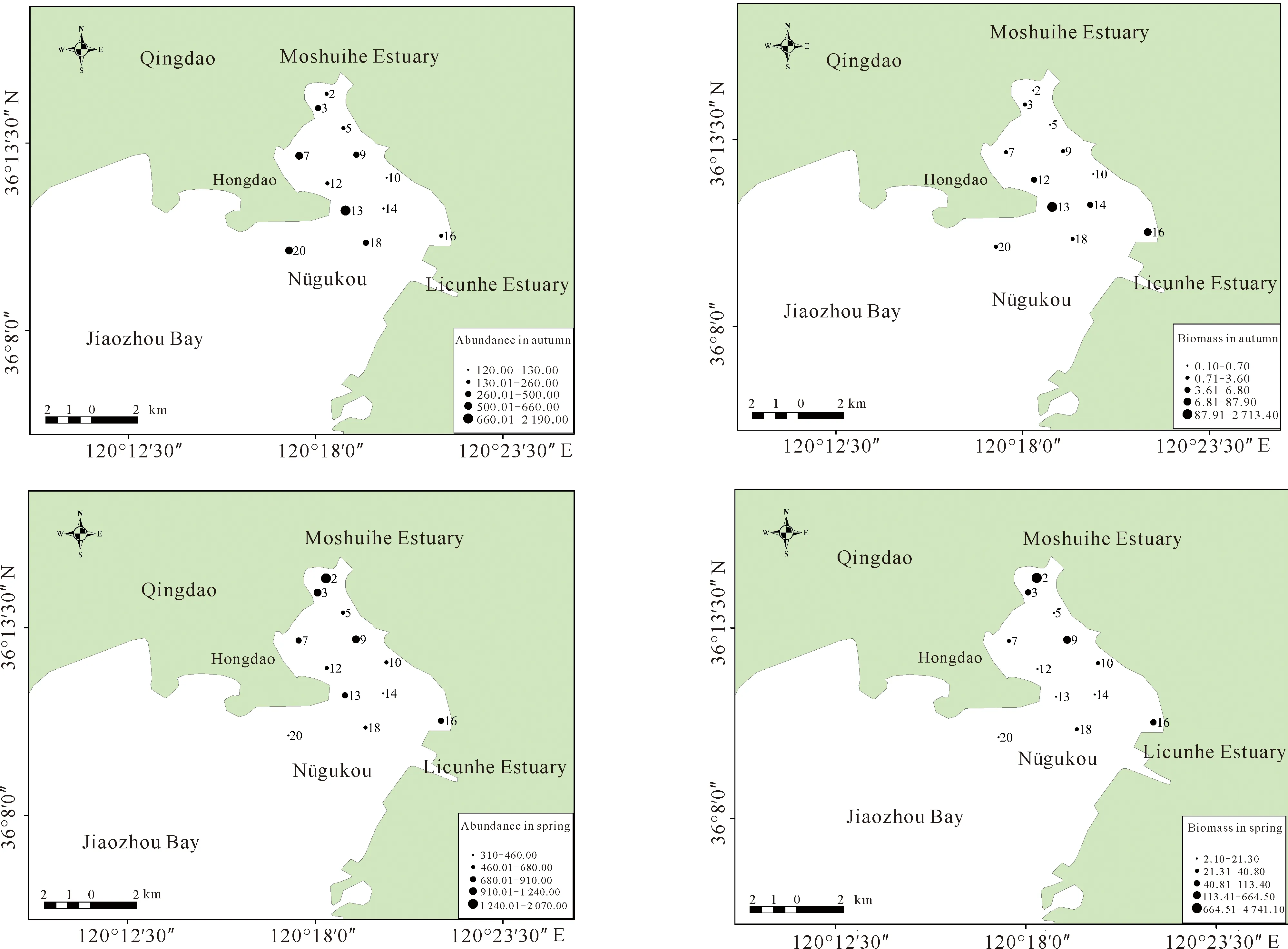
图2 秋季和春季调查海域大型底栖动物生物密度、生物量分布
2.1.3 群落多样性特征
由表3可知,调查海域大型底栖动物春季Shannon-Wiener多样性指数(H′)平均值高于秋季,两季节的平均多样性指数为2.77,说明调查海域大型底栖动物受到轻度污染;Pielous均匀度指数(J)略低于秋季,Margalef丰富度指数(d)高于秋季。
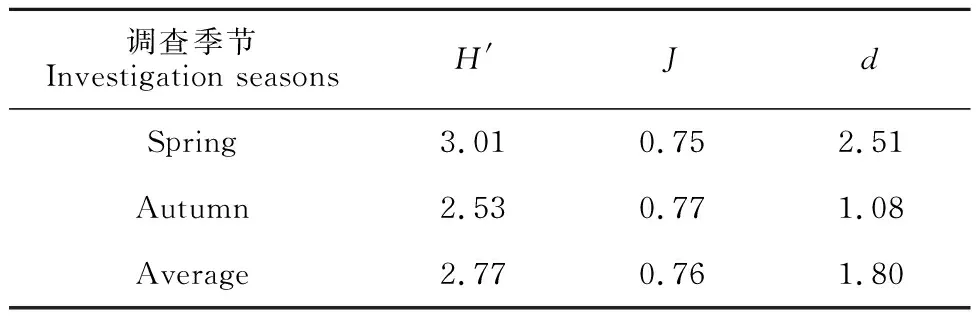
表3 秋季和春季调查海域大型底栖动物群落多样性指数
2.2 大型底栖动物与环境因子的相关性分析
调查海域水深为2.0-7.5 m,平均水深为4.17 m,呈现梯度递增趋势;12个调查站位的底质为黏土质粉砂;水温(WT)、盐度(S)、溶解氧(DO)、化学需氧量(COD)、磷酸盐(DIP)、悬浮物(SS)季节间呈极显著差异(P<0.01);无机氮(DIN)季节间呈显著差异(P<0.05);季节间pH值与中值粒径(MD)无显著差异。
采用《海水水质标准》[23]对调查海域水质进行评价。调查海域秋季和春季海水中pH值、溶解氧均满足一类海水水质标准要求,化学需氧量、磷酸盐、无机氮均超一类海水水质标准要求。其中,秋季和春季海水化学需氧量全部符合二类水质标准;秋季调查发现磷酸盐和无机氮都超四类水质标准,超标率均为75.0%;春季调查发现磷酸盐和无机氮都超四类水质标准,超标率分别为20.0%和50.0%。
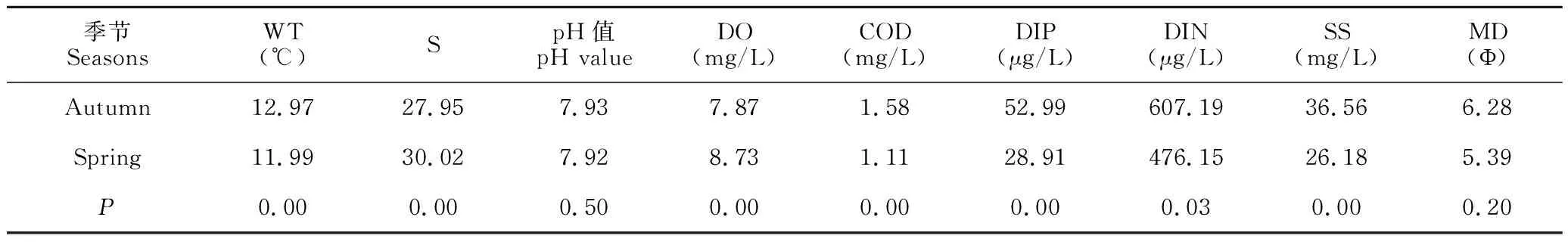
表4 秋季与春季调查海域各环境因子平均值
由图3可知,两个排序轴的特征值分别为0.58和0.17,种类与环境因子排序轴的相关系数为0.952和0.754,排序可以较好地反映底栖动物与环境因子间的关系。盐度(S)与第一排序轴呈最大正相关(0.717),水深(CD)与第一排序轴呈第二正相关(0.534),水温(WT)与第一排序轴呈最大负相关(-0.754)。说明影响胶州湾女姑口大型底栖动物分布的主要驱动因子有盐度、水温。
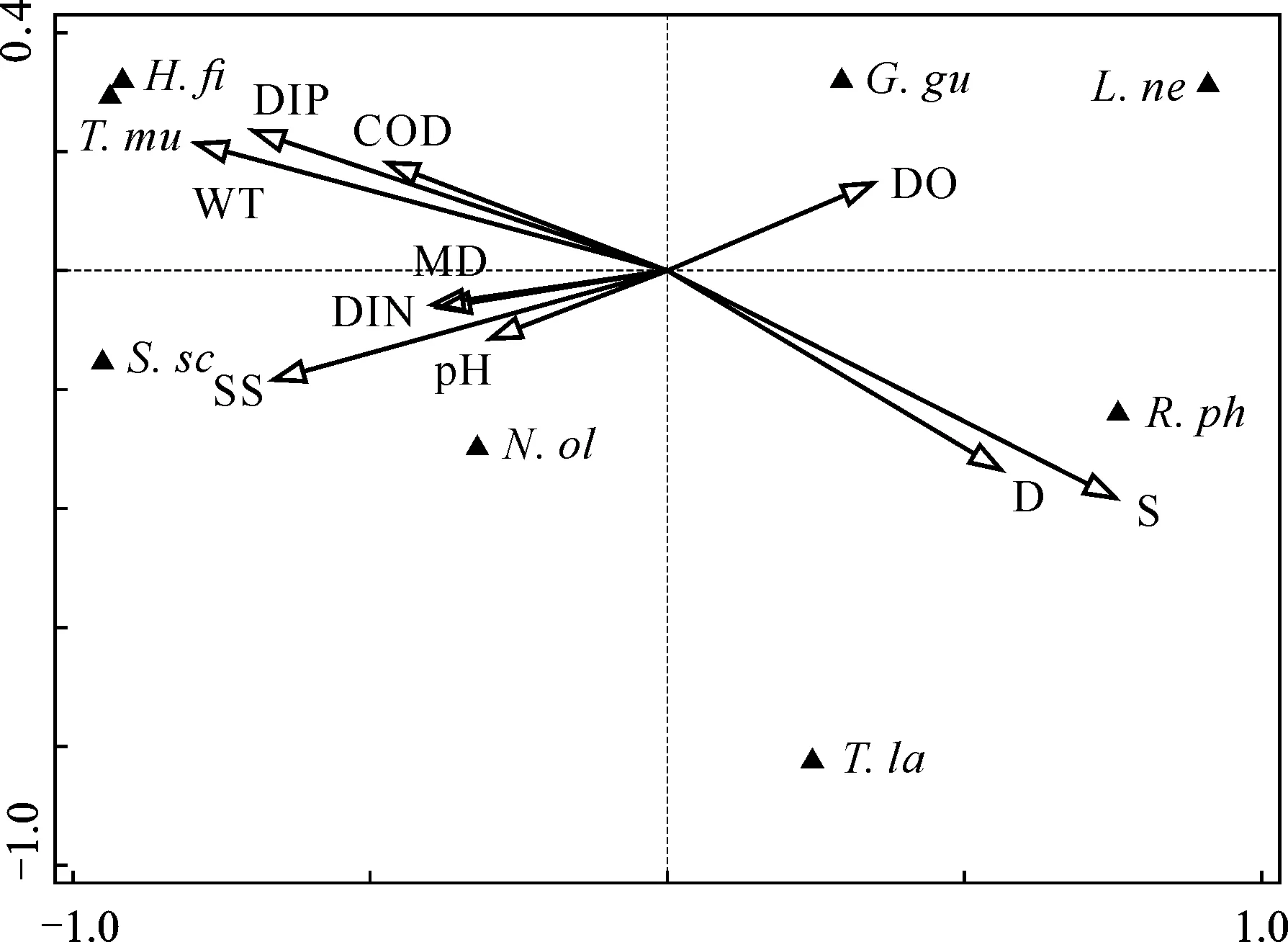
N.ol:Nephtys oligobranchia;G.gu:Glycinde gurjanovae;R.ph:Ruditapes philippinarum;H.fi:Heteromastus filiformis;S.sc:Sternaspis sculata;T.mu:Tharyx multifilis;L.ne:Lagis neapolitana;T.la:Theora lata
2.3 AMBI及M-AMBI结果
2018年秋季 12个调查站位AMBI为1.41-3.16,均为轻度扰动;M-AMBI为0.46-0.92,站位13生态环境质量处于中等级,其他站位为优或者良(表5)。2019年春季12个调查站位AMBI为1.58-3.70,10个调查站位为轻度扰动,2个站位(站位14、站位3)为中度扰动(表5)。站位14第二机会种(EG Ⅳ)占比为77.8%,站位3第二机会种(EG Ⅳ)占比为62.3%。M-AMBI为0.50-0.91,站位14底栖生态环境质量处于中等级,其他站位属于良或者优(表5)。
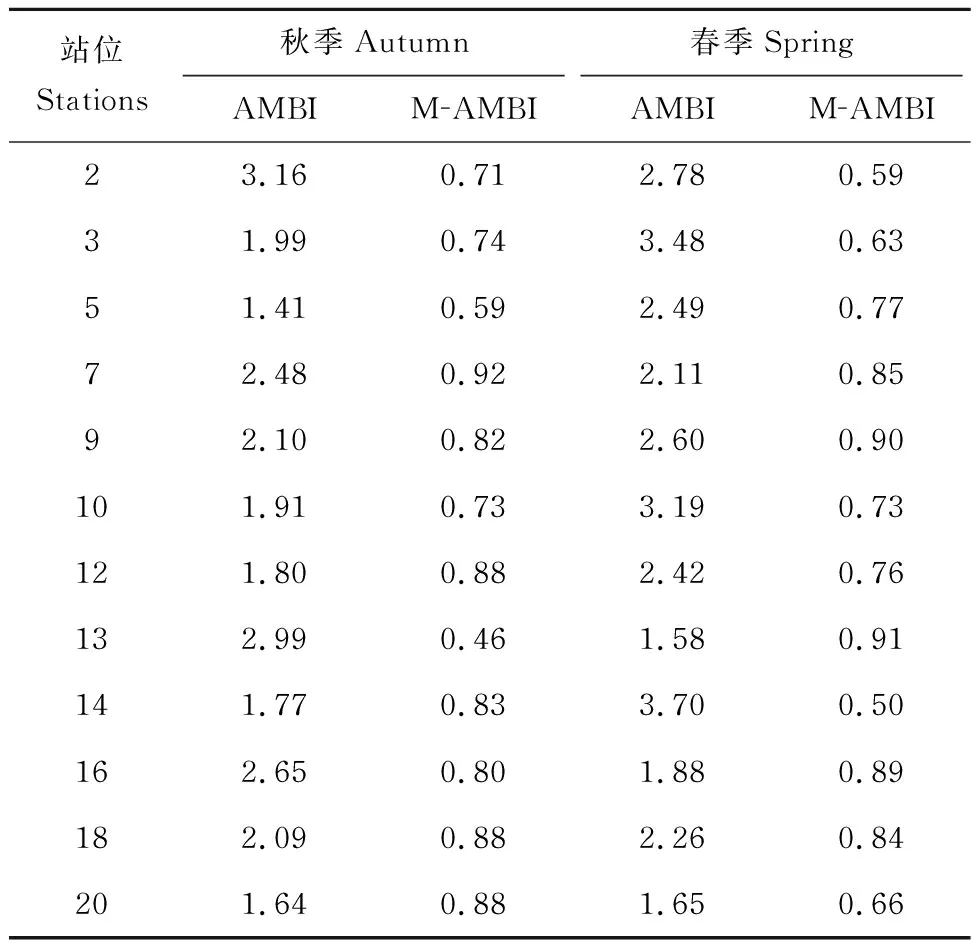
表5 秋季与春季调查海域AMBI及M-AMBI
3 讨论
3.1 大型底栖动物与环境要素的关系
本研究结果表明,对胶州湾女姑口附近海域大型底栖动物分布特征造成影响的主要环境因子为盐度和水温。这与陈晓娟等[24]和毕洪生[25]对胶州湾大型底栖动物的研究结论相似,即水温与盐度影响胶州湾大型底栖动物的生物密度分布。崔雯瑶等[26]对胶州湾2018年春季数据进行分析,其调查时间与本研究调查时间相近,同样发现水温与盐度会影响胶州湾大型底栖动物生物密度分布,而其他环境因子无显著相关关系。胶州湾属于暖温带水域,水深较浅,水温变化剧烈,水温影响底栖动物的生长和发育[27],从而影响生物的种类数量、生物量和分布范围[28]。以往调查中发现,盐度对底栖生物的影响主要集中在河口附近区域,该处因河流淡水的注入,尤其是在雨季,大量注入的淡水引起盐度发生较大的变化,从而影响该处的群落组成和生物密度[29,30]。
3.2 胶州湾女姑口附近海域底栖生态环境健康状况
胶州湾女姑口附近海域大型底栖动物秋季Shannon-Wiener多样性指数为2.53,春季Shannon-Wiener多样性指数为3.01。李新正等[31]2001年调查发现,胶州湾底栖动物的物种多样性指数春季、秋季平均值分别为4.59和4.76;王金宝等[32]2005-2009年胶州湾调查,春季Shannon-Wiener多样性指数为0.46-3.66,秋季Shannon-Wiener多样性指数0.86-3.61;隋吉星等[33]2010年对胶州湾中部海域调查显示,胶州湾大型底栖动物春季和秋季Shannon-Wiener多样性指数较低,平均值分别为2.59和2.50;全秋梅等[11]2016-2017年调查胶州湾大型底栖动物春季和秋季Shannon-Wiener多样性指数分别为2.61和2.34;丁敬坤等[16]2020年调查胶州湾发现,女姑口附近站位Shannon-Wiener多样性指数为1.67;近20年调查显示,胶州湾大型底栖动物的Shannon-Wiener多样性指数逐渐降低,从侧面说明该区域大型底栖动物受到轻度污染。
本次调查结果显示,胶州湾女姑口附近海域12个站位AMBI秋季为1.41-3.16,春季为1.58-3.70,说明调查海域皆受到不同程度的干扰,所有站次均处于轻度扰动以上;M-AMBI秋季为0.46-0.92,春季为0.50-0.91,说明调查海域部分站位的生态环境健康状况处于中等状态;Shannon-Wiener多样性指数(H′)、AMBI及M-AMBI评价结果基本一致。本调查结果与丁敬坤等[16]评价结果相似,即胶州湾海域底栖生态系统受到中等程度的干扰。
菲律宾蛤仔是胶州湾养殖的主要种类,在菲律宾蛤仔较多的站位,群落Shannon-Wiener多样性指数和Pielous均匀度指数降低,小个体的多毛类,如那不勒斯膜帽虫(L.neapolitana)、多丝独毛虫(T.multifilis)等,生物密度升高,此类生物多为机会种,因此导致AMBI变大、M-AMBI变小,王振钟[34]调查也得出相似结论。养殖过程中的营养盐排放、养殖生物的逃逸、疾病的传播等给海洋生态系统带来较大影响[35]。菲律宾蛤仔自身觅食及挖掘活动对养殖海域的环境造成一定的扰动,同时其捕获过程对表层的沉积环境造成剧烈的物理扰动,对大型底栖动物的生活环境造成一定的破坏[16]。本次调查受中度扰动的站位位于菲律宾蛤仔养殖用海附近,该海域的大型底栖动物的健康状况可能受到养殖活动干扰。
当群落受到中等程度的污染扰动时,个体较大的种的优势度被削弱,生物量占优势的大个体消失,因此在数量上占优势的种是个体较小的种[35],胶州湾历史调查中已发现存在大型底栖动物小型化现象[36-38],毕洪生等[36]曾在1991-1995年对胶州湾的底栖动物进行连续监测,发现20世纪90年代与80年代相比,小型底泥食性种类丰度上升,主要种类为丝异须虫(H.filiformis)和方格独鳃虫(Tharyxtesselata);王洪法等[37]2009年在胶州湾调查发现优势种为多毛类动物的不倒翁虫(S.scutata)和软体动物菲律宾蛤仔;全秋梅等[11]在胶州湾调查中发现优势种以多毛类为主,如丝异须虫、索沙蚕科(Lumbrineriiae)等。在渤海大型底栖动物调查中也发现小型化现象,莱州湾自20世纪90年代以来大型底栖动物群落结构已发生变化,总体呈现小型化趋势,主要是小型多毛类动物和甲壳类动物取代大个体的棘皮动物和软体动物[39]。本次胶州湾女姑口调查中,环节动物多毛类种类共29种,在秋季总密度中占比49.65%,在春季占比50.29%,优势种为菲律宾蛤仔、寡鳃齿吻沙蚕和寡节甘吻沙蚕,其他优势种均为环节动物多毛类及小型贝类,与历史调查结果相近,胶州湾女姑口附近种类组成与优势种呈小型化现象。
造成大型底栖动物小型化的原因主要有水体富营养化、过度捕捞及大型底拖网使用等[40,41]。由于近岸水域通常受到较严重的环境胁迫,近海污染、径流携带大量的有机质,以及水流和波浪对海底沉积物和底栖生物群落的影响较大,导致近岸的群落主要由一些小型多毛类耐受种组成,这些种多为机会种[27]。本次调查区域位于胶州湾东北部,常年平均水深4 m,水动力交换较弱,墨水河、白沙河及李村河入海口在本调查区域附近,调查发现重金属高值区主要位于东部李村河口[42,43]。青岛市生态环境状况公报显示,2018年青岛市胶州湾优良水质面积比例为73.7%,李村河、墨水河和大沽河入海口附近海域水质较差[44]。2019年胶州湾东北部海域水质较差,主要污染物为无机氮[45]。本次调查秋季磷酸盐和无机氮都超四类水质标准,超标率均为75.0%;春季磷酸盐和无机氮都超四类水质标准,超标率分别为20.0%和50.0%。磷酸盐和无机氮超标易导致水体富营养化,水体富营养化对大型底栖动物多样性产生显著的负面影响[11],富营养化加速大型底栖动物的种类更新频率,导致群落组成变化以及群落功能多样性降低[46]。本次调查优势种多丝独毛虫、丝异须虫、那不勒斯膜帽虫在AMBI生态组中为第二级机会种(EG Ⅳ),机会种的高生物密度和高出现率导致部分站位生态环境质量评价较差。大型底栖动物群落结构发生变动,出现小型化,在一定程度上反映了近年调查海域受到污染和扰动[39]。
综上所述,养殖和污染可能导致胶州湾女姑口附近海域大型底栖动物小型化,该海域的底栖生态环境健康状况受到一定扰动。对此,建议加强对胶州湾东北部近岸海域环境管理,探索有效的综合治理措施,使胶州湾海洋生态系统得以持续健康地发展。
4 结论
本次胶州湾女姑口邻近海域调查共获得大型底栖动物82种,以环节动物、软体动物、甲壳动物为主,棘皮动物等其他动物占比很小。两个调查季节中均表现出明显优势的种为寡鳃齿吻沙蚕、寡节甘吻沙蚕和菲律宾蛤仔,但是其他优势种均为环节动物多毛类及小型贝类,说明胶州湾女姑口邻近海域大型底栖动物有小型化趋势,高经济价值种在生物密度和生物量上也有一定程度的下降。典范对应分析的结果显示,盐度、水温是影响大型底栖动物分布特征的主要因子。综合大型底栖动物群落的Shannon-Wiener多样性指数、AMBI及M-AMBI分析结果,胶州湾女姑口邻近海域底栖生态系统受到轻度干扰,红岛滩涂附近海洋生态环境质量状况处于一般水平,其他地区处于优良或高等水平,养殖和污染可能导致胶州湾女姑口附近海域大型底栖动物群落结构呈小型化趋势,并导致该海域的底栖生态环境健康状况受到扰动。胶州湾东北部女姑口海域是人类活动及工业生活密集区域,加强该海域的生态环境保护具有重要意义。
