干旱风沙区植被重建初期对土壤微生物群落结构的影响
2022-02-09张力斌何明珠张克存安志山王金国惠迎新贾小龙
张力斌, 何明珠, 张克存, 安志山, 王金国, 惠迎新, 贾小龙
(1.中国科学院西北生态环境资源研究院,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.宁夏交投工程建设管理有限公司,宁夏 银川 750000;4.宁夏交通建设股份有限公司,宁夏 银川 750000)
干旱区约占中国陆地总面积的25%,自然环境十分恶劣,外加人类对其资源长期过度开发和全球气候变化的共同影响,导致干旱区土地荒漠化加剧,生态环境遭到严重破坏[1-2],因此,防止其进一步退化已变得刻不容缓。植被重建作为我国干旱区沙化土地生态修复的有效途径,能够改善土壤肥力,减少风沙危害,促使生态环境改善。植被恢复重建过程中,植被覆盖度的变化影响土壤微生物的丰富度及活性,进而改变土壤的理化性质,而养分条件的改善又促进植被的生长发育[3]。土壤微生物与理化性质、植被之间相辅相成,相互影响[4]。目前,土壤微生物已成为评价植被恢复重建过程的关键指标之一[5]。
土壤微生物作为土壤的重要组成部分,参与土壤有机质的矿化、腐殖质的形成和养分转化循环等过程,在土壤结构的稳定和理化性质的改善方面发挥重要作用[6]。土壤微生物对环境变化的响应比土壤理化性质变化更敏感,其群落结构和功能的改变能有效指示生态系统功能早期的变化[1,7-8]。研究表明植被恢复重建对土壤微生物有一定影响[9-10]。随着植被逐渐恢复,土壤结构和养分状况得到了不同程度的改善;微生物丰富度和多样性显著提高;微生物量随植被恢复年限增加而增加,随土层深度增加而减小[4-5,11-12]。吕星宇等[13]针对沙坡头固沙植被区土壤微生物三大类群(真菌、细菌及放线菌)数量的研究表明,微生物数量恢复曲线均呈现S型,恢复速率在18~24 a 后达到峰值,24~36 a 后微生物数量达到天然植被区的31.6%~83.7%,pH 是其限制因子。目前国内学者针对干旱半干旱区的荒漠、草地、湿地、森林等生态恢复开展了大量的理论与实践研究,包括植被重建与恢复对土壤生境及微生物群落结构与功能的影响;然而,由于气候、土壤、植被重建措施等的差异,需根据具体研究对象开展针对性的系统研究。因此,本研究以地处腾格里沙漠东南缘乌海至玛沁高速公路生态防护体系的植被重建区为研究区域,以相邻地区流动沙丘为对照,运用高通量测序的方法,对该地区植被重建初期土壤微生物群落结构组成及变化进行研究,探讨干旱风沙区植被重建对土壤微生物群落结构的影响,以期为该区干旱风沙区植被重建及生态修复提供科学依据。
1 研究区概况
研究区位于腾格里沙漠东南缘,乌海至玛沁高速(简称乌玛高速)公路中卫段的人工植被重建区(37°32′N,105°02′E)。作为第一条穿越腾格里沙漠腹地的高速公路,乌玛高速公路需穿越腾格里沙漠腹地约21 km,线路两侧风沙活动强烈,大于5 m·s-1的起沙风每年约有200 d,沙丘以流动沙丘为主,平均海拔1339 m,年均气温为9.6 ℃,最低气温-24.5 ℃,最高气温38.1 ℃,年均降水量约为186 mm,且80%的降水集中在7—9月[14]。为了确保乌玛高速的安全运营,乌玛高速公路两侧建立宽约300 m 生态防护体系,该区的主要人工固沙灌木包括柠条锦鸡儿(Caragana korshinskii)、细枝岩黄耆(Hedysarum scoparium)和杨柴(Hedysarum mongolicum)等。
2 研究方法
乌玛高速生态防护体系的植被重建区(试验路段)始建于2016年初,以柠条锦鸡儿为建群种,采用低密度栽植方式,即株间距为2 m×3 m。采样时间在2019年6月下旬,分别在乌玛高速人工植被重建区和相邻流沙区设置10 m×10 m 的样方各3 个,间隔20 m,每个样方中随机选取5个采样点,分别采集0~5 cm、5~10 cm、10~20 cm、20~50 cm 和50~100 cm层土壤样品。每一个样方同一土层样品混合成一个样品,采集的土样分为2 份,一份在室内自然风干,去除残留的枯枝落叶后过2 mm 筛,用于测定土壤理化性质,另一份置于-80 ℃冰箱,用于土壤微生物量检测与高通量测序。
土壤pH用pH计法测定;土壤电导率(EC)用电导仪测定;土壤微生物量碳(MBC)、氮(MBN)采用氯仿熏蒸-K2SO4浸提,全自动有机碳/氮分析仪(Elementar vario TOC/TNb Analyzer,德国)测定;土壤微生物量磷(MBP)采用氯仿熏蒸-碳酸氢钠浸提[15]。
DNA提取:土壤微生物群落结构总DNA采用E.Z.N.A.Soil DNA Kit 提取试剂盒(Omega Bio-tek,Norcross,GA,U.S.)提取。
PCR 扩增采用TransGen AP221-02:TransStart Fastpfu DNA 聚合酶,20 μL 反应体系的:2.0 μL 的2.5×10-3mol·L-1脱氧核苷酸(dNTPs),0.8 μL的0.5×10-5mol·L-1515F引物(5′-GTGCCAGCMGCCGCGG-3′),0.8 μL 的0.5×10-5mol·L-1907R 引物(5′-CCGTCAATTCMTTTRAGTTT-3′),4.0 μL 的5×FastPfu 缓冲液,10 ng模板以及0.4 μL的FastPfu 聚合酶,最后加双蒸水(ddH2O)到20 μL。
反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环;72 ℃延伸10 min。将收集到的PCR 产物进行琼脂糖凝胶电泳,使用AxyPrep DNA 凝胶回收试剂盒切胶回收PCR 产物,Tris-HCL 洗脱;使用QuantiFluorTM-ST 蓝色荧光定量系统进行检测。将取得的每一个样品进行等比例混合,最后依照Illumina MiSeq测序平台的标准实验流程来进行双端测序。
Illumina 测序:Paired-End Reads 通过Reads 之间的Overlap 关系拼接成长Reads 并对拼接后的Reads 进行质控,得到Clean Reads 根据97%的序列相似度对有效序列进行同源对比,并对操作分类单元(OTU)进行聚类,然后嵌合体过滤聚类后的序列,最后获取用于物种分类的操作分类单元。首先从各种OTU中挑选出一条序列作为代表性序列,然后将各种OTU代表性序列与参考数据库进行比对,从而对各种OTU进行物种注释,最后将每个OTU与对应的物种进行统计,结合物种组成信息结果,得到每个物种的相对丰度。计算各个样品的Alpha多样性指数[16]。
利用JMP 10.0 和SPSS 26.0 软件对土壤理化性质和细菌群落组成进行处理,应用CANOCO 5.0 进行冗余分析,应用Origin 19.0(Origin Lab Corp.,USA)拟合曲线并作图。
3 结果与分析
3.1 土壤微生物群落结构随植被重建的变化
从门分类水平上,研究区土壤微生物主要以放线菌门(Actinobacteria)、变形细菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、芽单胞菌门(Gemmatimonadetes)和螺旋体菌门(Saccharibacteria)为主(图1),其中植被重建区与流沙区的优势细菌门均为放线菌门(58.53%~67.85%)、变形细菌门(16.53%~19.68%),占总序列的78%以上。与流沙区相比,植被重建区的变形细菌门、绿弯菌门、酸杆菌门、厚壁菌门、拟杆菌门、蓝细菌门、芽单胞菌门和螺旋体菌门的相对丰度高于流沙区,放线菌门和异常球菌-栖热菌门的相对丰度低于流沙区。

图1 植被重建区与流沙区土壤微生物群落的组成差异(门水平)Fig.1 Difference of composition of microbial community in soil of vegetation reconstruction area and quicksand area(phylum level)
从属分类水平上(表1),相对丰度较高的属(相对丰度>1%)为异常球菌属(0.21%~2.44%)、烟草黄色土源菌属(0.44%~1.00%)、微红微球菌属(0.80%~1.02%)、甲基柔膜菌属(0.81%~1.24%)、壤霉菌属(0.41%~1.00%)、微枝型杆菌属(0.72%~1.32%)、大理石雕菌属(0.41%~1.27%)和诺卡氏菌属(1.33%~7.19%),占总序列的7.51%~13.28%。种类繁多,分类地位不明确的稀有细菌类群(相对丰度<1%)占总序列的比例较高。与流沙区相比,植被重建区的异常球菌属、栖水菌属、烟草黄色土源菌属均低于流沙区,其中栖水菌属只有流沙区的0.06 倍;植被重建区的微红微球菌属、甲基柔膜菌属、壤霉菌属、微枝型杆菌属、根瘤菌属、大理石雕菌属、诺卡氏菌属均高于流沙区,根瘤菌属达到流沙区的85倍。

表1 植被重建区与流沙区土壤微生物群落相对丰度(属水平)Tab.1 Relative abundance of microbial community in soil of vegetation reconstruction area and quicksand area(genus level)
3.2 微生物群落结构随土壤深度的变化特征
从门分类水平上,对流沙区而言,随着土层深度增加放线菌门相对丰度呈先升高后降低趋势,变形细菌门相对丰度表现为先降低后升高趋势;在植被重建区,放线菌门与变形细菌门相对丰度则无显著规律。与流沙区相比植被重建区随土壤深度呈波动性变化,放线菌门相对丰度在0~5 cm、5~10 cm相比流沙区增加10.70%、37.28%,而在10~20 cm、20~50 cm、50~100 cm 降低30.74%、4.55%、51.21%;变形细菌门相对丰度与放线菌门相对丰度变化趋势相反,在0~5 cm、5~10 cm 降低9.14%、56.13%,10~20 cm、20~50 cm、50~100 cm 升 高221.76%、93.88%、125.85%(图2a~e)。此外,植被恢复区蓝细菌门在0~5 cm 土层的相对丰度为5.61%,是流沙区的近12 倍,其他土层均不超过0.20%。相比流沙区,植被重建区各土层优势土壤微生物的相对丰度大部分高于流沙区。
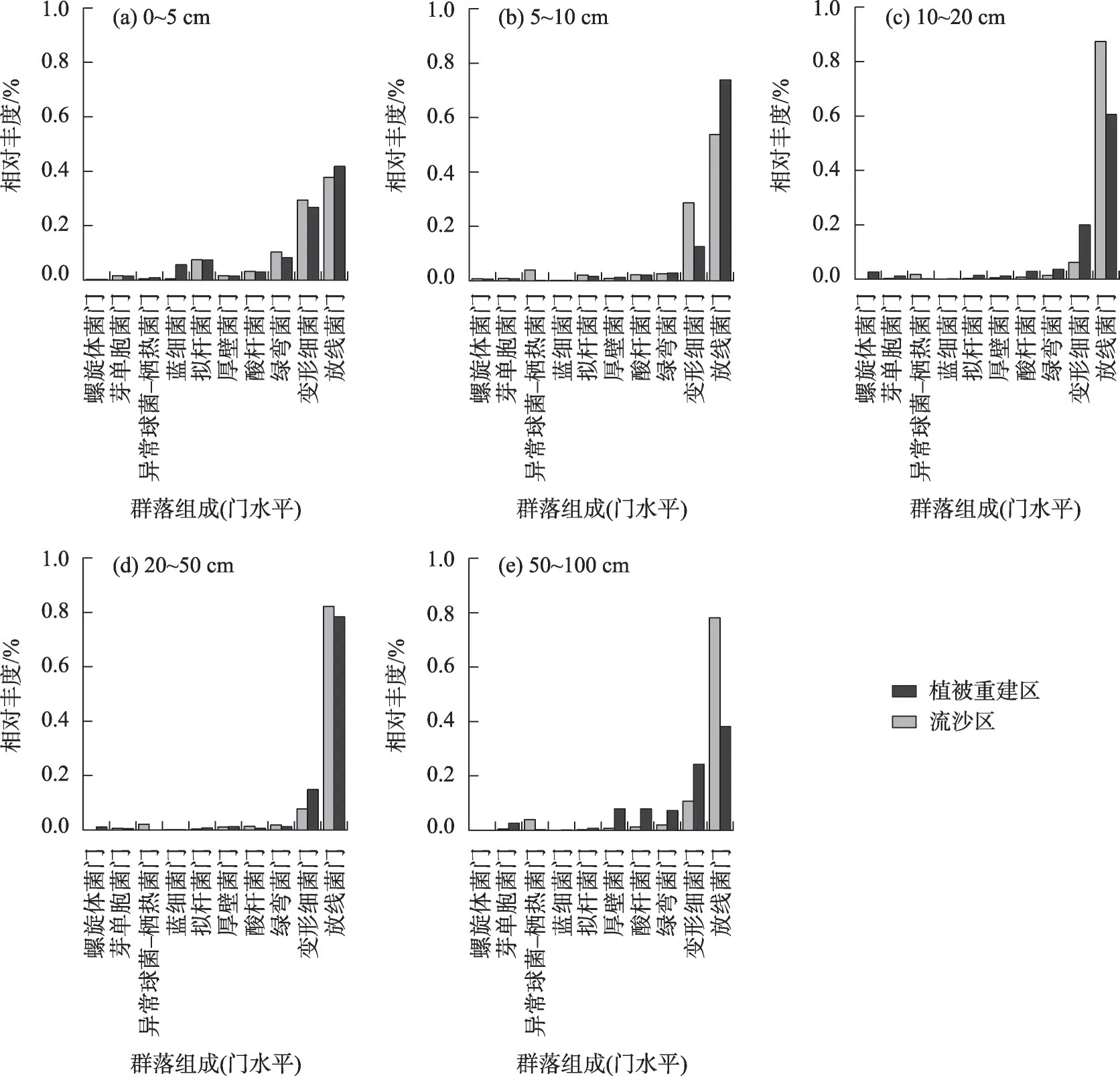
图2 植被重建区和流沙区各土层微生物群落的组成差异(门水平)Fig.2 Difference of microbial community composition in each soil layer of vegetation reconstruction area and quicksand area(phylum level)
在属分类水平上,与流沙区相比,植被重建区各种土壤微生物相对丰度平均为流沙区相同土层的0.26~329.17 倍(图3a~e),差异显著。植被重建后,土壤中大理石雕菌属、壤霉菌属、微红微球菌属和烟草黄色土源菌属在10~20 cm 土层分别是流沙区同土层的12.01、21.68、2.00 和2.31 倍;栖水菌属、异常球菌属和微枝型杆菌属在0~5 cm 土层分别是流沙区同土层的2.15、1627和2.55。

图3 植被重建区和流沙区各土层微生物群落的组成差异(属水平)Fig.3 Difference of microbial community composition in each soil layer of vegetation reconstruction area and quicksand area(genus level)
3.3 植被重建区与流沙区土壤微生物物种数差异
在物种水平上,同一区域不同土层之间土壤微生物物种存在差异(表2),流沙区各个土层(0~5 cm、5~10 cm、10~20 cm、20~50 cm、50~100 cm)种数分别为1908、1547、1164、1362、1398种,呈先下降后上升趋势;植被重建区与流沙区变化趋势相同,各个土层也呈先下降后上升趋势,各个土层(0~5 cm、5~10 cm、10~20 cm、20~50 cm、50~100 cm)微生物种数分别为1815、1576、1589、1073、1956 种。在OTU水平上与流沙区相比,植被重建区各个土层(0~5 cm、5~10 cm、10~20 cm、20~50 cm 和50~100 cm)特有的OTU数均高于相同土层流沙区,共有OTU数分别 为1365、1044、901、709、1079 种(图4a~b、图5a~e)。

图4 植被重建区和流沙区不同土层间的OTU的差异Fig.4 Difference of OTU between different soil layers in vegetation reconstruction area and quicksand area
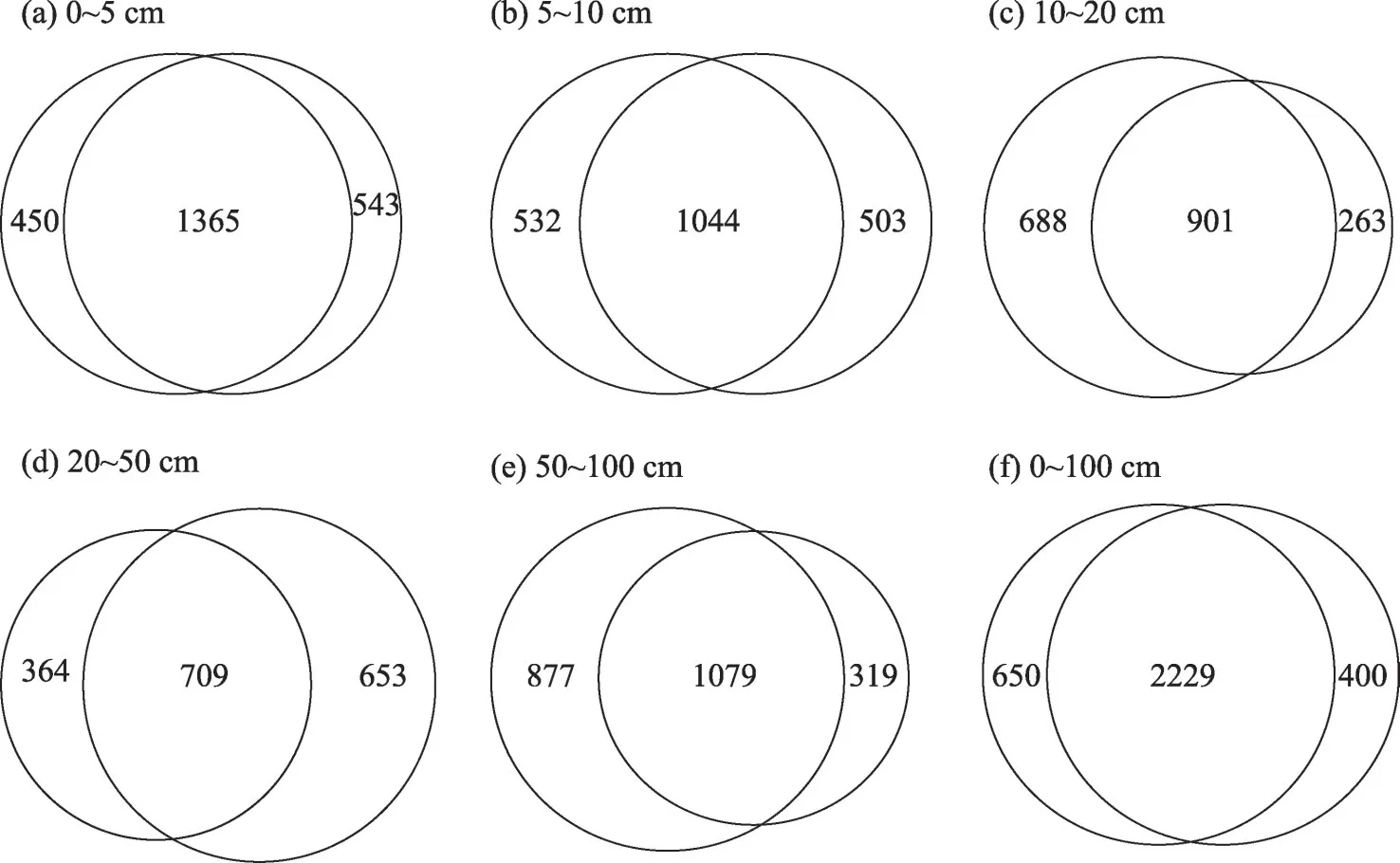
图5 植被重建区与流沙区相同土层的OTU的差异Fig.5 Difference of OTU between the same soil layer in vegetation reconstruction area and quicksand area
3.4 植被重建区与流沙区土壤微生物多样性差异
土壤微生物多样性指数[Chao1指数、Ace指数、辛普森多样性(Simpson)指数和香农多样性(Shannon)指数]表示生物群落中的物种多寡。由表2 可知,流沙区和植被重建区Chao1、Ace、Simpson 指数和Shannon指数均随土层深度增加呈先下降后上升趋势,表层(0~5 cm)最高。与流沙区相比,除了20~50 cm 土层,植被重建区其他土层的发现物种数、Chao1、Ace、Simpson 指数和Shannon 指数均高于流沙区。而就不同土壤深度而言,只有在50~100 cm土层,植被重建区发现物种数、Chao 1、Ace、Simpson指数和Shannon指数大于流沙区(表2)。

表2 植被重建区与流沙区微生物群落的丰度和多样性指数Tab.2 Abundance and diversity index of microbial communities in vegetation reconstruction area and quicksand area
3.5 植被重建对群落结构组成及理化性质的影响
从图6 可以看出,各个土层土壤样品间没有重叠,植被重建区和流沙区可分为2大类,流沙区不同样品之间分布较紧密,植被重建区不同样品之间分布较疏远,特别是20~50 cm和50~100 cm。

图6 不同样品的非度量多维尺度排序图Fig.6 Non-metric multidimensional scale ordering of different samples
植被重建后土壤理化性质及微生物量均存在显著变化,对土壤pH、EC及盐分含量(Salt)而言,与流沙区相比植被恢复重建后含量整体降低;EC 及Salt 只有流沙区的0.54、0.56 倍。植被重建区MBP在0~5 cm、5~10 cm 和10~20 cm 相比流沙区增加1.38、1.85和5.40倍,而在20~50 cm降低12.34倍;而对土壤MBC 而言,其在植被重建区0~5 cm、5~10 cm、10~20 cm、20~50 cm 和50~100 cm 分别为85.47 mg·kg-1、144.19 mg·kg-1、392.87 mg·kg-1、25.26 mg·kg-1和583.18 mg·kg-1,相比流沙区分别增加7.64、2.26、32.68、1.85 倍和6.48 倍;对土壤MBN 而言,其在流沙区随着土层深度增加含量逐渐减小,但在植被重建区则随着土壤深度增加含量逐渐升高,与流沙区相比,植被重建区MBN 分别增加0.35、0.40、0.59、0.92倍和1.71倍;植被重建区微生物量碳氮比(MBC:MBN)均高于流沙区。综上,与流沙区相比,植被重建后土壤pH、EC 及Salt 降低;MBP、MBC 与MBC:MBN 在表中层(0~5 cm、5~10 cm 和10~20 cm)高于流沙区(表3)。

表3 植被重建区和流沙区的土壤理化性质及微生物量Tab.3 Soil physicochemical properties and microorganisms in vegetation revegetation area and quicksand area
为揭示土壤理化性质及微生物生物量与微生物多样性的关系,以微生物多样性为响应变量,土壤理化性质及微生物量为解释变量进行冗余分析。由图7 可知,微生物多样性与土壤理化性质及微生物生物量密切相关,不同因子对微生物多样性的解释度有较大差异,流沙区第一轴和第二轴分别解释了87.40%和11.72%,其中pH、MBN、氧化还原电位(Eh)、Salt、MBP、MBC:MBN 和EC 对土壤微生物多样性影响较大,表现为pH>MBN>Eh>MBP>Salt>MBC:MBN>EC>MBC;植被重建区第一轴和第二轴分别解释了90.56%和7.49%,其中EC、pH、Eh、MBC、Salt、MBP、MBC:MBN和MBN对土壤微生物多样 性 影 响 较 大,表 现 为EC>pH>Eh>MBC>Salt>MBN>MBC:MBN>MBP。pH在植被重建区与生物多样性呈正相关,而流沙区则反之。

图7 植被重建区和流沙区土壤微生物多样性与土壤环境因子的冗余分析Fig.7 Redundancy analysis of soil microbial diversity and soil environmental factors in vegetation reconstruction area and quicksand area
4 讨论
本研究发现流沙区与植被重建区土壤微生物群落组成相似,主要有放线菌门、变形细菌门、绿弯菌门、酸杆菌门、厚壁菌门、拟杆菌门、蓝细菌门、异常球菌-栖热菌门、芽单胞菌门和螺旋体菌门10 类菌群;但相对丰度有所不同,植被重建区大部分土壤微生物菌门相对丰度高于流沙区。诸多研究表明放线菌门、变形菌门、厚壁菌门和拟杆菌门为荒漠土壤中的主要细菌类群[4]。放线菌通常在荒漠地区占据主导地位[17-18],作为一类耐热又喜弱碱性土壤的细菌,能降解植物残体中的纤维素及木质素,为土壤提供养分[19],并通过孢子丝状生长方式,耐受紫外辐射、干旱高温带来的损伤,进而适应严酷的风沙环境。变形菌门是多数土壤中的优势细菌类群,含量与土壤氮循环与植物光合作用强度呈正相关[18]。植被重建后,植物枯枝落叶等经过微生物不断分解进入土壤,增加土壤养分含量,变形菌利用有机氮提高土壤固氮能力,土壤有机碳及全氮含量的增加为变形菌的生长繁殖提供营养条件,使其丰度不断提高[8,20]。
沙漠环境干旱少雨,土壤微生物主要以植物残体为营养源,同时在植物的生长期间植物根系分泌各种离子及化合物,为微生物提供了丰富的养分,土壤微生物又通过对凋落物的进一步分解,增加土壤有机质等养分,土壤养分的增加又会促进土壤微生物的繁殖[21];而流沙区基本无植被覆盖,相比植被重建区缺乏根系分泌物及地上凋落物等营养源,从而限制了微生物的生长繁殖[22]。另一方面,植被重建恢复后通过影响土壤水分、养分与温度等进而对土壤微生物产生影响,土壤微生物数量与植物凋落物、植被盖度与有机质含量呈正相关关系[17]。许华等[15]的研究表明土壤微生物碳、氮含量在春季维持在较高水平,秋季维持在较低的水平。土壤微生物是受生物因素与非生物因素的综合影响,植被的恢复重建促进土壤微生物数量及活性增加。在土壤微生物属水平上,植被重建区的微红微球菌属、甲基柔膜菌属、壤霉菌属、微枝型杆菌属、根瘤菌属、大理石雕菌属、诺卡氏菌属高于流沙区,其中根瘤菌属更是达到85 倍。研究区种植的柠条锦鸡儿为豆科植物,可与根瘤菌形成共生固氮体系从而改善风沙土贫瘠的养分状况。
土壤微生物多样性和丰度是生态系统健康稳定的体现[23]。研究表明,微生物多样性受到生物因素与非生物因素的影响,植物不仅提供营养物质丰富的栖息地,还会影响土壤微生物的选择性[24]。戴雅婷等[25]以库布齐沙地土壤微生物为研究对象,发现植被重建恢复后土壤细菌多样性、丰度较流沙区显著增加,原因是流动沙丘土壤养分含量低,限制了微生物的发育,而在固沙植被建立后,植物体凋落物会归还土壤、植物根系的分泌物以及土壤细粒物质含量增多使土壤养分增加,促进了微生物量逐渐增加[26-27]。杨瑞红等[28]在古尔班通古特沙漠的研究表明沙漠植被不仅土壤细菌多样性丰富,且存在一定数量的微生物新种,植被类型、气候变化等因素对土壤微生物多样性均有影响。在本研究中,植被重建区的多样性指数均高于流沙区,且分类地位不明确的稀有细菌类群占总序列的比例较高,是因为重建初期土壤养分贫瘠,而细菌针对较简单、易分解的物质,通过氨化作用改善土壤氮限制;另外,干旱沙区昼夜温差大,细菌群落的变化在某种程度上对地理生态环境的响应以及对各种环境因素变化的承受能力不同所造成[20,22,25]。此外,土壤微生物多样性与植物群落多样性呈正相关,植被类型及数量是导致土壤微生物发生变化的重要因素[29]。植被恢复重建后,植被地上凋落物及根系分泌物的分解转化促进了土壤微生物对养分的吸收转化,为微生物的生长提供了了丰富的营养源及良好的生长环境,促进微生物的生长[30-31]。
土壤中微生物量在一定程度上能够反应生态系统的土壤肥力、植物生产力等,对环境变化响应十分敏感[15]。不同植被恢复方式、不同植被生长阶段等对土壤微生物碳氮磷具有不同程度的影响,不同的植被群落对微生物量碳氮磷影响非常显著[32]。土壤有机质、总氮是土壤微生物碳、氮的主要来源,温度、水分作为限制土壤微生物的重要因素,温度与水分的变化会影响有机质的分解转化,从而影响土壤微生物对有机质和氮的利用[15]。植物在正常的生长发育过程中,将代谢产物、凋落物等不断释放到环境当中,同时,根系分泌物也不断地在与土壤溶液进行离子交换,促进了根系与土壤生态系统的物质循环与能量流动[33]。本研究发现,与流沙区相比,植被恢复重建初期土壤pH、EC 及Salt 降低;MBP、MBC 与MBC:MBN 在表中层(0~5 cm、5~10 cm和10~20 cm)高于流沙区。土壤微生物具有垂直分布规律,植被恢复初期时间较短,表层土壤植被根系分布较为发达,加之有凋落物输入,土层透气性较高,能为土壤微生物提供相对丰富的营养物质与生长空间,使土壤微生物大量繁衍,而底层植被根系分布较少,无凋落物输入,加之土壤容重增加致使透气性降低,不利于土壤微生物生存与繁殖[28]。但随恢复年限的增加,植物根系向土壤深层发育,逐渐改善底层土壤的理化状态与营养环境,深层土壤的含水率和孔隙率逐渐增加,加强了土壤中的离子交换,改善养分状况,进而使微生物群落的分布向深层发展;并且,长期生态恢复结果表明,不同恢复阶段植被对于土壤环境微生物影响存在差异,例如,在植被恢复前期油蒿更利于氮元素循环的微生物(氨化细菌和硝化细菌数量)的恢复,而植被恢复后期柠条更有利于纤维素分解菌的改善[13,27]。
5 结论
植被重建区与流沙区土壤微生物群落组成相似,均以放线菌门、变形细菌门等为优势类群;优势菌属包括诺卡氏菌属、甲基柔膜菌属、微红微球菌属和微枝型杆菌属,分类地位不明确的稀有类群占总序列的较高。植被重建区大部分菌门丰度、多样性均显著高于流沙区。植被恢复重建后土壤化学性质和微生物量碳、氮、磷得到显著提高。土壤生境和微生物群落的恢复与改善是干旱风沙区生态恢复的关键表征,也是人工植被结构和功能稳定性评价的重要依据。
