激光气化治疗宫颈高级别鳞状上皮内病变的临床研究
2022-02-08廖丽韵谢俣龚滢欣张宏伟汪清隋龙陈丽梅
廖丽韵,谢俣,龚滢欣,张宏伟,汪清,隋龙,3,陈丽梅*
子宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)是目前公认的子宫颈癌前病变,根据2019年美国阴道镜和宫颈病理协会(American Society for Colposcopy and Cervical Pathology,ASCCP)基于风险的管理共识指南,子宫颈环形电极切除(loop electrosurgical excision procedure,LEEP)术是目前治疗HSIL的主要方式[1],但是LEEP术后存在宫颈缩短、再生育早产增加的风险[2-4]。随着宫颈筛查的普及,临床发现的宫颈HSIL患者逐渐年轻化,且随着人口出生率下降、生育政策放开和鼓励生育等,很多女性面临未来再生育的问题,也担心LEEP对未来生育的不良影响。对于鳞柱交界(squamous columnar junction,SCJ)完全暴露的患者,2019年ASCCP指南指出,总体上优先推荐锥切,消融治疗也可接受[1],该版指南特别提到,激光对于经验丰富的医师在某些特殊情况下更为适宜。但目前国内对于激光治疗宫颈HSIL的报道极少,本文通过本中心的回顾性分析,探索二氧化碳激光气化治疗宫颈HSIL的可行性和临床疗效,现报道如下。
1 资料和方法
1.1 一般资料
本研究是在复旦大学妇产科医院宫颈及阴道早期疾病诊治中心进行的一项回顾性研究,本研究经过医院伦理委员会的伦理批准(批号:201717)。收集2017年1月至2019年12月在复旦大学附属妇产科医院就诊,纳入标准:① 组织病理学活检为宫颈HSIL;② 高年资阴道镜医生评估宫颈SCJ为1或2型;③ 宫颈HSIL范围小于转化区的50%;④ 未来可能有再生育计划,经充分知情同意自愿接受激光治疗宫颈HSIL。排除标准:宫颈转化区3型,或HSIL范围大于50%,或合并阴道外阴上皮内病变,或任何可疑宫颈更重病变的患者。共有78例。平均(26.8±5.0)岁,平均随访(26.2±8.1)月。
所有纳入患者均通过登记本和电子病历系统记录以下信息:年龄、生育史和再生育计划、细胞学和高危人乳头瘤病毒(high risk human papilloma virus,HR-HPV)、阴道镜检查结果等病史信息、阴道镜引导下活检和/或宫颈管搔刮(endocervical curetage,ECC)病理学、术前及术后超声提示的宫颈长度、激光手术相关资料、术后随访信息。
1.2 方法
1.2.1 阴道镜检查 本研究纳入的患者阴道镜检查前的指征:液基细胞学异常和/或HR-HPV阳性。阴道镜(TR6000G,高清电子阴道镜,北京同人)检查由本院宫颈疾病诊治中心高年资阴道镜医师(副主任医生及以上)进行,操作方法如下:患者取膀胱截石位,先观察外阴是否有异常,再置入窥阴器,完全暴露宫颈,用纱布卷去宫颈及阴道内的分泌物,先用大头棉签蘸生理盐水涂抹宫颈阴道表面,再换3%~5%醋酸涂抹宫颈阴道,观察至少1 min,判断宫颈SCJ类型,1型为SCJ完全可见,2型在器械的辅助下,SCJ可完全暴露,3型为器械辅助也无法完全暴露SCJ。观察宫颈阴道上皮是否有醋酸白色或点状、镶嵌等病变,再用5%卢戈碘溶液涂抹阴道壁,观察阴道是否有碘不染上皮,阴道镜诊断为宫颈HSIL的患者,用阴道镜自带软件标注病灶范围和宫颈范围,软件自动计算病灶占转化区的百分比并记录。
1.2.2 激光治疗 78例患者均采用激光消融治疗,应用CO2激光(JC25,上海珏华)仪器,功率选择25W,以连续输出模式对宫颈表面的HSIL病灶区域进行激光气化治疗,气化深度约7~10 mm,见下页图1。

注:左侧为SCJ1型的宫颈HSIL,上唇近穹窿处局部厚醋白上皮活检证实为HSIL,右侧为二氧化碳激光气化病灶后即时所见。
1.2.3 随访方法 术后随访:激光术后3~4个月第一次复查。每次复查均行妇科检查、宫颈液基细胞学检测(LCT,美国BD公司)和HR-HPV(Combas 4800,Roche 或者HPV21分型,江苏硕世),并择期阴道镜检查。之后如果HR-HPV阳性或细胞学异常,每半年随访细胞学和HR-HPV,必要时阴道镜检查,如HPV转阴性,每年随访一次细胞学和HR-HPV。
1.2.4 疗效判断 治愈标准为激光术后3~4个月内第1次复查时,阴道镜检查下活检及ECC均未发现病灶。复发或残留组织均经阴道镜引导下活检和/或颈管搔刮确认,病灶残留定义为治疗后6个月内复查有HSIL,复发为激光治疗结束后6个月内复查无病变,6个月后复查发现HSIL。
1.3 统计学方法
资料以Excel表格录入,应用Stata 17.0统计学软件进行统计分析。分析激光治疗前后计量资料差异统计学意义比较采用t检验,治疗前后计数资料差异统计采用Fisher精确概率法。以双侧α=0.05为检验水准。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
本研究共纳入78例,术后3~4个月失访3例,随访到患者75例。激光治疗前46例患者从未生育,32例已生育过,但未来有再生育计划。所有患者主诉中白带异常16例,同房后出血4例,外阴不适1例,无症状体检发现者57例。
2.2 激光术前的细胞学、HR-HPV、阴道镜检查和组织病理学
78例患者在激光前的细胞学和HR-HPV报告为:69.2%(54/78)细胞学检查结果异常,包括意义不明的非典型鳞状细胞(ASCUS),LSIL、非典型鳞状细胞不能同时排除HSIL(ASC-H)、HSIL和HR-HPV阳性;29.5%(23/78)细胞学结果正常,HR-HPV阳性;1.3%(1/78)HR-HPV阴性,细胞学异常(ASC-H)。在所有的HR-HPV阳性中,HPV16阳性占57.7%(45/78),HPV18阳性占7.7%(6/78),其他1种或数种12型HR-HPV阳性占15.4%(12/78),17.9%是HPV16/18合并其他12型感染(14/78),具体详见表1。
阴道镜检查均为充分阴道镜检查,宫颈SCJ 1型67例,SCJ 2型11例。阴道镜检查宫颈HSIL病灶占宫颈转化区的比例平均为(21.6±6.4)%。激光术前宫颈长度(30.7±3.8)mm。
2.3 激光术后随访的细胞学、HR-HPV、阴道镜检查和组织病理学
二氧化碳激光气化宫颈均顺利,宫颈激光手术时间(4±2)min,术中出血少,均小于5 mL,无术中损伤、术后感染等并发症发生,有1例患者术后10 d出血多(约100 mL)就诊,纱布压迫止血后好转。激光术后3~4个月第一次随访,有3例患者失访,随访率(96%,75/78)。10.7%(8/75)细胞学检查结果异常,其中6例患者为ASCUS,2例患者为LSIL,余均为正常。激光术后3~4个月第一次随访HR-HPV阴性有68例(90.7%,68/75),2例患者在术前是混合HR-HPV感染,术后HR-HPV感染型别减少。激光术后3~4个月随访阴道镜下宫颈活检,仅1例宫颈HSIL,1例患者有宫颈LSIL,术后3~4个月HSIL的治愈率为98.7%(74/75)。术后更长时间的随访失访率有所增加,具体的细胞学、HR-HPV和阴道镜病理详见上页表1。HR-HPV的清除率见图2。
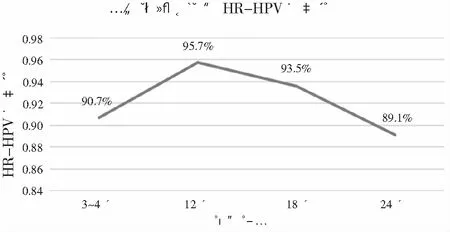
注:激光气化治疗SCJ1-2的宫颈HSIL后的HR-HPV转阴率上升后反而下降,可能跟再感染有关。
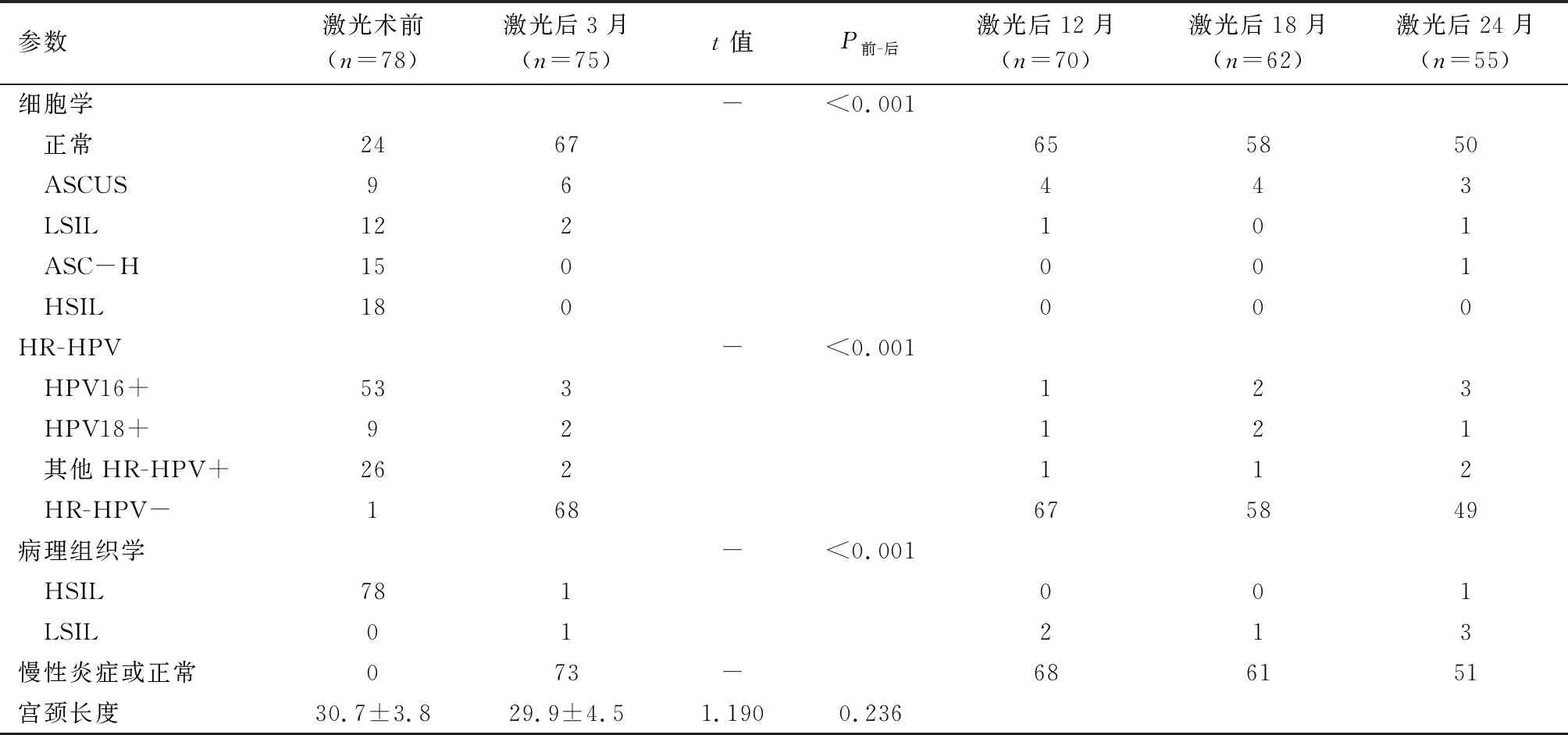
表1 HSIL患者激光前及激光后不同时间点的比较
2.4 激光术后生育随访情况
激光术前超声测量宫颈长度(30.7±3.8)mm,激光术后3~4个月宫颈长度(29.9±4.5)mm,激光术前术后差异无统计学意义(t=1.190,P=0.236)。术后至随访截止日期有备孕计划者26例,顺利怀孕并分娩者22例,均为足月分娩,顺产者15例,剖宫产7例(其中3例是因瘢痕子宫剖宫产,2例因胎儿宫内窘迫剖宫产,1例因产程异常剖宫产,1例社会原因剖宫产),剖宫产率31.8%(7/22)。
3 讨论
3.1 宫颈HSIL的临床治疗选择
2012年,美国病理学家学院和ASCCP提出了针对HR-HPV相关病变肛门生殖器鳞状上皮术语标准化项目[5],根据该术语,宫颈鳞状上皮内病变(squamous intraepithelial lesion,SIL)分为LSIL和HSIL,取代了原来的宫颈上皮内瘤变(cervical intraepithelial neoplasm,CIN)1、2、3。宫颈HSIL是真正的癌前病变,需要临床重视并积极干预,2012年 ASCCP的共识指南提出对于SCJ充分暴露的患者,宫颈锥切和消融治疗都可以,而对于SCJ不充分的患者建议宫颈锥切,孕期及特别年轻的患者除外[1]。2019年 ASCCP基于风险的异常宫颈癌筛查结果和癌前病变共识指南则提出,推荐所有CIN3非妊娠女性治疗,不接受观察,组织学HSIL治疗时首选切除性治疗,而激光因为数据较少,列为SCJ充分暴露时的可接受选择[6]。目前临床上宫颈锥切一般都选择LEEP术,术后的病理报告存在升级、降级可能。非绝经患者有5.3%在LEEP术后存在病理升级可能[7-8],且以3型转化区、绝经后患者为主,故对于活检提示宫颈癌不能完全排除、或者颈管搔刮提示HSIL、或细胞学/组织学提示腺上皮异常的患者,需要警惕隐匿性宫颈癌,应积极进行切除性治疗。LEEP术后病理未升级,半年内也存在3.6%的病灶残留风险[9],2年内1.3%复发和0.3%的进展风险[10]。另外12.1%~52.4%的患者在LEEP后出现病理降级的情况[11-12],且考虑到宫颈锥切术存在对未来生育影响的可能,尤其是切除范围比较大的患者,未来生育发生流产、早产的风险明显升高[13-17],故并非所有患者都适合LEEP,尤其是HSIL病灶位于宫颈表面甚至近穹窿、小于50%宫颈总面积、宫颈转化区为 1~2型的患者,特别是未来还有生育要求的患者,应在精准评估并充分有效的基础上采取对未来生育影响较小的措施。
3.2 二氧化碳激光治疗宫颈HSIL的优劣势
既往有数个文献报道了激光治疗宫颈HSIL的研究[18-20],但对于CIN1、2、3并未完全分开[19],对于单纯CIN3的激光治疗较少,Chisa S等[18]报道了激光气化治疗CIN3研究,术后5年失败率9.5%,甚至有1例进展为癌。值得注意的是,这些研究虽有包括部分激光治疗CIN3,但都没有标注SCJ类型,而SCJ类型对宫颈HSIL治疗方式的选择非常重要,因此认为这些激光治疗的高失败率跟激光前未限定SCJ的类型有关。本研究是首次精确针对SCJ1-2型HSIL患者进行局部病变的激光气化,不再对整个转化区进行气化,发现激光局部治疗不仅具有可行性,而且效果确切,激光后3个月治愈率达98.7%,术后HR-HPV的转阴率也高达90.7%,这个效果不管是与同期在本中心HSIL行LEEP术后6个月内残留率( 3.2%)、24个月的复发率(1.3%)相比[9-10],还是跟国内外其他研究相比[18-20],都展示了更好的效果。分析原因,认为在于本研究入选的患者都是SCJ1-2型,病灶位于宫颈表面,未延伸至颈管,且患者普遍年轻,免疫力强,治疗后预后比较好。在本研究中,HR-HPV的清除率在术后12个月达到高峰,之后反而有所提高,可能跟HR-HPV重复感染或复发有关,也提示术后的宣教和定期随访都非常重要。
另外本研究发现激光术前术后宫颈长度差异无统计学意义,且通过随访生育结局,本研究人群中未见流产及早产,剖宫产率为31.8%,与目前已发表的大规模数据显示的流产率(1.2%)、早产率(5.5%)、剖宫产率(40.4%)进行对比[21],虽然入组人群有限,但也可初步推断激光不仅对流产率、早产率没有明显影响,对于未来分娩方式也没有明显影响。传统的宫颈锥切治疗HSIL是针对宫颈整个转化区的切除,存在术后宫颈缩短、未来生育早产风险增加的可能,也容易导致术后SCJ为3型,需要进一步行ECC排除宫颈病变,ECC对患者身心都有创,而传统激光治疗为对整个宫颈转化区的消融,而本研究中均为高年资阴道镜医师进行操作,术前充分阴道镜评估定位病灶,点对点地激光治疗更为精准,无需完全破坏转化区,保留新SCJ,不仅有利于术后随访,也能减少对宫颈解剖的破坏,减少对未来生育的影响。
虽然本研究仅针对宫颈HSIL,但HR-HPV感染相关性疾病可累及整个下生殖道,故术前的阴道镜评估非常重要,包括宫颈、阴道、外阴评估,如果合并阴道、外阴上皮内病变,门诊激光治疗对于患者尤为便利,可考虑同步激光或分次激光气化治疗。但激光属于消融治疗,局限性是术后没有进一步的病理分析,故术前一定要精准阴道镜评估并活检,排除恶性病变,如ECC提示颈管内HSIL时不适合激光,宫颈表面大面积HSIL时,可能病理升级时不适合激光;当活检提示宫颈癌不能完全排除时不可以选择激光,而是应该选择切除性治疗。
本研究存在一定的局限性,因严格控制SCJ1-2型、病灶大小、患者生育需求和充分的患者知情同意,故纳入的例数有限,随访时间较短,虽然术后短期随访疗效显示安全有效,但更远期疗效有待于进一步持续随访。
综上所述,二氧化碳激光气化治疗宫颈SCJ 1-2型的HSIL是安全有效的,术后HR-HPV转阴率较高,基本对生育无影响,但临床需要阴道镜专科医生进行精准阴道镜评估,排除宫颈癌病变者方可进行。
