大鲵抗菌肽AdCath4对3种病原菌的响应
2022-02-08钟兰萍张先群田星双杨思思
王 慧,钟兰萍,张先群,黄 威,田星双,姜 梅,杨思思
(贵阳学院/贵州省大鲵可持续利用协同创新中心/贵州省山地珍稀动物与经济昆虫重点实验室,贵阳 550005)
【研究意义】中国大鲵(Andriasdavidianus)俗称“娃娃鱼”,隶属脊索动物门(Chordata),两栖纲(Amphibian),有尾目(Urodela),隐鳃鲵科(Cryptobranchidae),大鲵属(Andrias)。中国大鲵是我国独有的珍贵物种,也是世界上现存个体最大的有尾两栖动物[1]。近年来,由于野生大鲵资源急剧下降,人工养殖也逐渐兴起,但随着养殖规模的不断扩张,大鲵病害亦日益严重[2-5]。因此,探究大鲵被病原菌侵染后的免疫响应情况具有重要的科学意义。【前人研究进展】细菌性病害是引发大鲵疾病的主要因素,病原菌主要有嗜水气单胞菌、弗氏柠檬酸杆菌、荧光假单胞菌、迟钝爱德华氏菌和维氏气单胞菌等[6]。经生理生化及分子生物学鉴定发现,大鲵腐皮肤病由维氏气单胞菌、点状产气单胞菌和嗜水气单胞菌3种病原菌引起;败血病由弗氏柠檬酸杆菌感染引起;大鲵烂尾病由荧光假单胞菌引起[7-11]。大鲵体内淋巴系统不发达,不能通过适应性免疫抵抗病原微生物侵害,而抗菌肽是大鲵通过非特异性途径抵御病原微生物侵害的主要成分。抗菌肽具有抗G-细菌、G+细菌、真菌、肿瘤细胞和寄生虫等活性,具备广谱高效抗菌、增强机体免疫等特点,是机体天生免疫防御系统的重要组成部分[12-14]。抗菌肽分子可取代机体脂多糖与细菌表面的结合部位(Ca2+、Mg2+)反应,从而破坏细菌细胞膜的稳定性,使其发生溶解,形成孔洞[15-16]。从鱼类中分离获得的抗菌肽对单核细胞李斯特菌和一些导致食品腐败微生物具有抑菌的活性[17]。抗菌肽实现免疫调节可以通过调整信号通路来调控抗炎和促炎的反应,调节伤口的修复和细胞凋亡。与针对患病大鲵所使用的抗生素相比,由生物体产生抗菌肽不会产生耐药性。【本研究切入点】前人研究大都是观察大鲵感染病原菌后出现的症状,目前两栖无尾类动物蛙类是探究抗菌肽对细菌侵染响应的主要试验对象,而从分子层面分析大鲵感染病原菌后其组织对某个抗菌肽基因的响应情况研究少有报道[18-21]。【拟解决的关键问题】AdCath4为大鲵抗菌肽家族基因中的一员,探究大鲵感染病原菌后AdCath4基因对病原菌的免疫响应情况,为大鲵抗菌肽基因在病原菌侵染后的响应提供分子层面的理论依据,对其机体启动天然的免疫应答反应研究具有重要作用。
1 材料与方法
1.1 试验地点及材料
试验在贵州省山地珍稀动物与经济昆虫重点实验室进行。
供试大鲵幼苗60尾,规格为(270±30) g/尾,购自贵州省翔盛大鲵繁养有限责任公司。嗜水气单胞菌(Aeromonashydrophila)、弗氏柠檬酸杆菌(Citrobacterfreundii)和荧光假单胞菌(Pesudomonasfluorescent)均购自中国普通微生物菌种保藏管理中心。
1.2 方法
1.2.1 菌种菌液制备 将嗜水气单胞菌、弗氏柠檬酸杆菌以及荧光假单胞菌分别接种于LB固体培养基上,并置于37 ℃恒温的培养箱里培养24 h后,转接于LB液体培养基中,置于37 ℃摇床增菌培养24 h,分别用紫外分光光度计检测其OD值,直到OD600=0.6,将细菌悬液浓度配制为1×108CFU/mL备用。
1.2.2 大鲵病原菌接种 供试大鲵幼苗在相同条件下驯化1周,按15尾/组分为4组,以腹腔注射的方式分别注射0.5 mL/尾的嗜水气单胞菌悬液、弗氏柠檬酸杆菌悬液、荧光假单胞菌悬液和1倍的磷酸缓冲盐溶液(1×PBS)(CK)。在病原菌侵染的0、12、24、36和48 h后,各处理分别取3尾大鲵进行无菌解剖,取其皮肤和脾脏组织暂存于液氮中,用于提取总RNA。
1.2.3 RNA提取 按照TransZol试剂盒的试验步骤分别抽提处理组织的总RNA。使用Nanodrop 2000核酸蛋白浓度测定仪检测和琼脂糖凝胶电泳检测其浓度和质量,将合格的总RNA溶液置于-80 ℃冰箱储存备用。每个样品重复3次。
1.2.4 反转录合成第一链cDNA 进行第一链cDNA的反转录按20.0 μL体系配制混合溶液:Oligo dT Primer 1.0 μL,RI Enzyme Mix 1.0 μL,2×ES Reaction Mix 10.0 μL,RNA 4.0 μL,RNase-free Water 4.0 μL。PCR反应条件:37 ℃反应15 min,85 ℃ 5 s。保存于-20 ℃冰箱备用。每个样品重复3次。
1.2.5 qRT-PCR 按TransScript Top Green qPCR SuperMix试剂盒说明,qPCR反应体系20.0 μL:Top Green qPCR SuperMix 10.0 μL,RNase-free ddH2O 7.0 μL,上、下引物各1.0 μL,cDNA 1.0 μL。荧光定量PCR仪的反应程序:95 ℃预变性2 min,95 ℃变性15 s,55 ℃ 退火15 s,72 ℃延伸2 min,38个循环,72 ℃进行终延伸。每个样品重复3次。
1.3 数据分析
使用 Excel整理获得的数据,AdCath4基因在皮肤、脾脏组织中的相对表达量采用2-△△Ct法计算。数据结果以平均值±标准误表示,利用SPSS 19.0中的单因素方差分析(ANOVA),假设方差齐性(LSD、S-N-K)对数据进行差异显著性分析,运用Sigma Plot 12.5制图。
2 结果与分析
2.1 AdCath4基因的 CDS序列
转录组测序分析获得大鲵抗菌肽AdCath4基因的CDS全长序列,运用DNAMAN软件对测序结果(图1)分析表明,AdCath4基因的开放阅读框全长为549 bp,编码183个氨基酸,预测蛋白分子量为19 579 Da。使用SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测该序列的信号肽为1~19氨基酸MESLVRLTLVLGVITVANC。根据AdCath4基因序列,运用Primer Premier 5.0软件设计1对qPCR引物,其上、下游引物分别为20 bp,同时筛选出RPL43、EF2作为内参基因(表1),以便用于开展之后的不同组织基因表达量试验,筛选出相对表达量高的组织进行病原菌侵染试验。

起始密码子ATG和终止密码子TGA黑色加粗;*为终止密码子的推导结果Start codon ATG and stop codon TGA are bold in black; * is the derivation of the stop codon图1 大鲵抗菌肽基因AdCath4的核苷酸序列及推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of A. davidianus antimicrobial peptide gene AdCath 4
2.2 AdCath4基因在大鲵不同组织器官中的相对表达量
从图2看出,大鲵抗菌肽AdCath4基因在心脏、皮肤、肝脏、肠、胃、肺、脾脏组织器官中均有表达,在皮肤器官中的相对表达量显著高于其他器官,其次是在脾脏中的相对表达量。因此,选取皮肤和脾脏器官进行病原菌侵染试验。
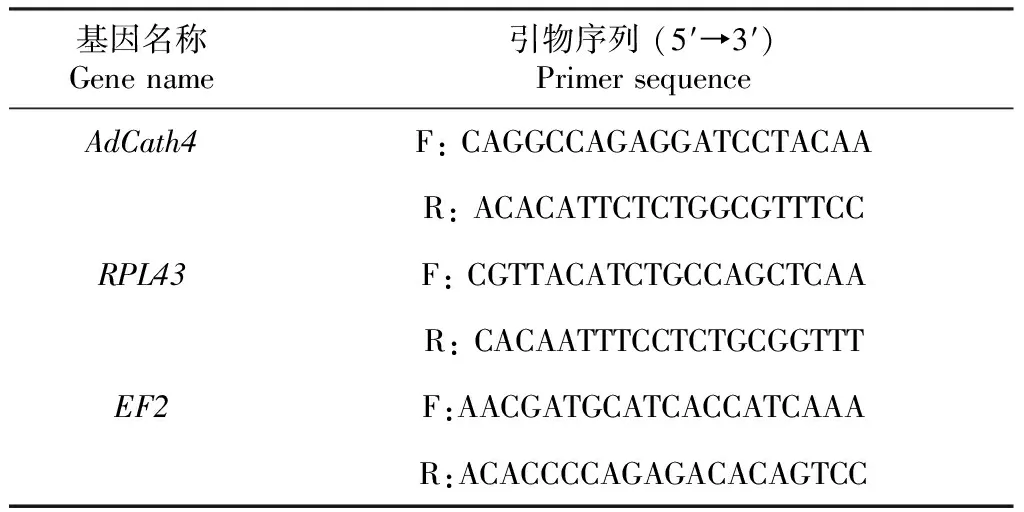
表1 目的基因和内参基因的qPCR引物序列
2.3 大鲵感染不同病原菌后AdCath4基因在皮肤和脾脏组织中的相对表达量
2.3.1 嗜水气单胞菌 从图3看出,感染嗜水气单胞菌的大鲵皮肤和脾脏组织中AdCath4基因在不同时间均有表达。在皮肤组织中,接种处理AdCath4基因的相对表达量在24~48 h高于对照,在接种48 h后的相对表达量达峰值且相对表达量较对照高7.21倍,表明AdCath4在感染嗜水气单胞菌大鲵皮肤组织中的表达调控响应积极。在脾脏组织中,接种和对照处理AdCath4基因的相对表达量均较低,接种处理低于对照;其中,24 h后接种处理的相对表达量为对照的20.85%,表明AdCath4在感染嗜水气单胞菌大鲵脾脏组织中的表达调控响应不积极。
2.3.2 弗氏柠檬酸杆菌 从图4看出,感染弗氏柠檬酸杆菌的大鲵皮肤和脾脏组织中AdCath4基因在不同时间均有表达。在皮肤组织中,接种处理AdCath4基因的相对表达量在36~48 h显著高于对照,在36 h时最高,是对照组的4.19倍。在脾脏组织中,接种处理组和对照AdCath4基因的相对表达量均较低,且接种处理均低于对照,24 h时相对表达量为对照的5.61%。
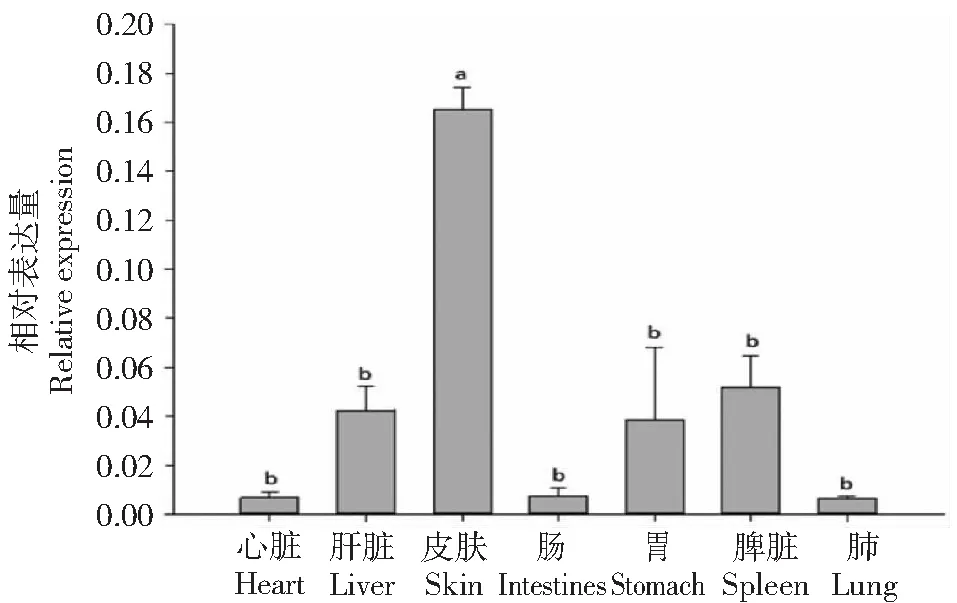
不同小写字母表示基因表达量在不同组织器官间差异显著(P<0.05)Different lowercase letters indicate significant differences in gene expression among different tissues图2 AdCath4基因在不同组织器官中的相对表达量Fig.2 Relative expression of AdCath4 in different tissues

同一时间不同小写字母表示差异显著(P<0.05),下同Different lowercase letters at the same time point represent significant difference,the same as below图3 大鲵接种嗜水气单胞菌后AdCath4基因在其皮肤和脾脏组织中的相对表达量Fig.3 Relative expression of AdCath4 in the skin and spleen of A.davidianus infected with A. hydrophila
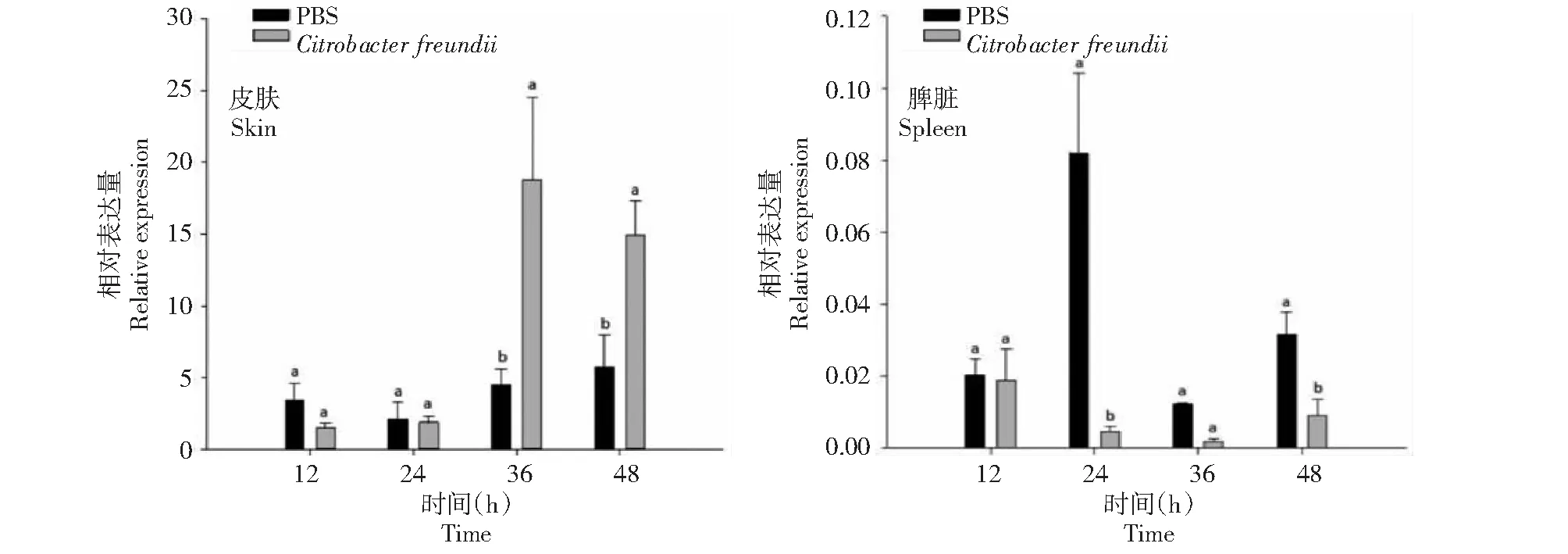
图4 大鲵接种弗氏柠檬酸杆菌后AdCath4基因在其皮肤和脾脏组织中的相对表达量Fig.4 Relative expression of AdCath4 in skin and spleen of A. davidianus infected with C. freundii
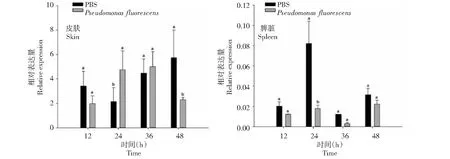
图5 大鲵接种荧光假单胞菌后AdCath4基因在其皮肤和脾脏组织中的相对表达量Fig.5 Relative expression of AdCath4 in skin and spleen of A. davidianus infected with P. fluorescens
2.3.3 荧光假单胞菌 从图5看出,在感染荧光假单胞菌后AdCath4基因在大鲵皮肤和脾脏组织中的不同时间均有表达。皮肤组织中,接种处理AdCath4基因的相对表达量在24~36 h高于对照,而在其他时间则低于对照。在脾脏组织中,接种处理组和对照AdCath4基因的相对表达量均较低,且各时间接种处理均低于对照,24 h时相对表达量为对照的21.71%。
3 讨 论
动物机体受到外界病原微生物侵染时自发产生用于抵御侵害、保证机体维持正常生理活动的免疫因子。抗菌肽是一种具有生物抗性成分、可抵抗病原物感染的生物活性多肽,且广泛分布于机体的各组织中。由于抗菌肽具有增强免疫和修复创伤的功能,因此在动物疾病的预防和治疗上被广泛运用[22-23]。嗜水气单胞菌、弗氏柠檬酸杆菌和荧光假单胞菌是常见的致病于人、畜及水生动物的病原菌。大鲵感染嗜水气单胞菌会引发腐皮病和烂脚病,感染弗氏柠檬酸杆菌引起败血病,感染荧光假单胞菌则引发腹水病和烂尾病等[7-10]。
抗菌肽的免疫活性主要表现在调节促炎和抗炎反应,促进细胞分化,直接影响适应性免疫,调节机体自噬等,而皮肤作为抵御微生物侵染的第一道屏障,在与病原微生物互作的过程中,抗菌肽基因参与免疫调节过程,表现出积极响应[24-25]。本研究结果表明:AdCath4基因在皮肤组织中的相对表达量最高,在脾脏组织中的相对表达量次之。大鲵在感染嗜水气单胞菌、弗氏柠檬酸杆菌和荧光假单胞菌后,皮肤组织中AdCath4基因在48、36~48和24 h相对表达量显著高于对照,脾脏组织中相对表达量则低于对照,且均在接种12 h后显著下降。说明AdCath4基因在大鲵皮肤组织中免疫响应积极,感染后皮肤免疫应答反应明显;而AdCath4在大鲵脾脏组织中免疫响应不积极。
4 结 论
大鲵抗菌肽AdCath4基因的开放阅读框全长为549 bp,编码183个氨基酸,预测蛋白分子量为19 579 Da。大鲵抗菌肽AdCath4基因在大鲵的心脏、皮肤、肝脏、肠、胃、肺、脾脏组织器官中均有表达,在皮肤器官中的相对表达量显著高于其他器官,在脾脏组织中的相对表达量次之。大鲵感染嗜水气单胞菌、弗氏柠檬酸杆菌和荧光假单胞菌后,AdCath4基因在大鲵皮肤组织中免疫响应积极,而AdCath4在大鲵脾脏组织中免疫响应不积极。
