知母栽培品和野生品的指纹图谱建立及差异性成分确认
2022-02-07常鑫鑫李倩薛紫鲸景松松赵艳云郑玉光宋军娜
常鑫鑫 李倩 薛紫鲸 景松松 赵艳云 郑玉光 宋军娜

中圖分类号 R282 文献标志码 A 文章编号 1001-0408(2022)02-0146-07
DOI 10.6039/j.issn.1001-0408.2022.02.04
摘 要 目的 建立知母栽培品和野生品的指纹图谱,确认两者的差异性成分。方法 采用蒸发光散射检测器,以高效液相色谱法结合《中药色谱指纹图谱相似度评价系统(2012版)》建立14批知母栽培品和14批知母野生品的指纹图谱,并进行相似度评价,通过与混合对照品色谱图比对指认共有峰。同法测定知母栽培品和野生品中指认共有峰对应成分的含量,通过主成分分析和正交偏最小二乘法-判别分析确认两者的差异性成分,并比较其含量。结果 在28批知母药材中共有10个共有峰,指认出新芒果苷(峰1)、芒果苷(峰2)、异芒果苷(峰3)、知母皂苷BⅡ(峰7)、知母皂苷BⅢ(峰8)、知母皂苷Ⅰ(峰9)、知母皂苷AⅢ(峰10)7个成分;各样品指纹图谱与对照指纹图谱的相似度均不低于0.963。知母栽培品与野生品中7个成分的平均总含量分别为74.18、84.72 mg/g,二者比较差异有统计学意义(P<0.05)。知母栽培品与野生品可被分为两类,差异性成分为新芒果苷、芒果苷、知母皂苷BⅡ、知母皂苷AⅢ(变量投影重要性值均大于1)。知母栽培品中新芒果苷含量明显高于野生品(P<0.05),芒果苷、知母皂苷BⅡ和知母皂苷AⅢ含量均明显低于野生品(P<0.05)。结论 成功建立了知母的指纹图谱,并初步确认了知母栽培品和野生品的差异性成分。
关键词 知母;野生品;栽培品;指纹图谱;多成分定量分析;差异性成分
Establishment of fingerprints and differential component identification of cultivated and wild Anemarrhena asphodeloides
CHANG Xinxin1,LI Qian1,XUE Zijing1,JING Songsong1,ZHAO Yanyun1,ZHENG Yuguang2,SONG Junna1(1. College of Pharmacy, Hebei University of Chinese Medicine/Hebei Traditional Chinese Medicine Processing Technology Innovation Center, Shijiazhuang 050200, China; 2. Hebei Chemical and Pharmaceutical College, Shijiazhuang 050200, China)
ABSTRACT OBJECTIVE To establish the fingerprints of cultivated and wild Anemarrhena asphodeloides, and to identify their differential components. METHODS Using an evaporative light-scattering detector, the high performance liquid chromatography combined with Similarity Evaluation System of TCM Chromatographic Fingerprint (2012 edition) were used to establish fingerprints of 14 batches of cultivated A. asphodeloides and 14 batches of wild medicinal materials, and evaluate their similarity. The common peaks were identified by comparison with the chromatogram of the mixed control. At the same time, the contents of components corresponding to common peaks in cultivated and wild A. asphodeloides were determined. The principal component analysis and orthogonal partial least squares discrimination analysis were adopted to identify differential components of them, and compare the contents of them. RESULTS Among 28 batches of A. asphodeloides, 10 common peaks were found, i.e. neomangiferin (peak 1), mangiferin (peak 2), isomangiferin (peak 3), timosaponin BⅡ (peak 7), timosaponin BⅢ (peak 8), timosaponin Ⅰ (peak 9), timosaponin AⅢ (peak 10). The similarities of fingerprints of samples with control fingerprint were no less than 0.963. The average total contents of seven components in cultivated and wild A. asphodeloides were 74.18 and 84.72 mg/g, respectively; there was statistical significance (P<0.05). The cultivated and wild A. asphodeloides could be divided into two categories. The differential components were neomangiferin, mangiferin, timosaponin BⅡ and timosaponin AⅢ (VIP values were all higher than 1). The content of neomangiferin in cultivated products was significantly higher than that in wild products (P<0.05), and the contents of mangiferin, timosaponin BⅡ and timosaponin AⅢ were significantly lower than those in wild products (P<0.05). CONCLUSIONS Fingerprint of A. asphodeloides is established, and differential components of cultivated and wild A. asphodeloides are identified primarily.
KEYWORDS Anemarrhenae asphodeloides; wild product; cultivated product; fingerprints; multi-component quantitative analysis; differential components
知母为百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎,味苦、甘,性寒,归肺、胃、肾经,具有清热泻火、滋阴润燥的作用,常用于中医临床治疗外感发热、内伤发热等热症[1-2]。现代研究发现,知母的主要化学成分包括双苯吡酮类、甾体皂苷类、多糖类、木脂素类等[3],具有治疗类风湿性关节炎、糖尿病、抑郁症等作用[4-6]。
根据繁殖生长方式的不同,知母分为栽培品和野生品两种类型,主要分布于我国河北、山西、内蒙古、陕西、吉林、河南、山东等地[7]。2020年版《中国药典》(一部)以芒果苷和知母皂苷BⅡ两个成分作为知母质量控制的指标性成分[1],但并不能全面地反映知母药材的整体质量,也不能体现知母栽培品与野生品的差异。
本研究采用高效液相色谱法对知母栽培品和野生品进行化学成分分析,建立知母栽培品和野生品的指纹图谱;同时在此基础上,建立知母中新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ共7个化学成分的含量测定方法,通过多成分含量测定和化学模式识别分析,比较知母栽培品与野生品的化学成分差异,以期为寻求更优质的知母资源提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260型高效液相色谱仪及其配套的G4260B型蒸发光散射检测器、G7111A型四元梯度泵、G7129A型自动进样器、OpenLab CDS2.3色谱工作站(美国Agilent公司),JP-060S型超声波清洗仪(深圳洁盟清洗設备有限公司),ME204E型十万分之一电子天平、BSA224S-CW型电子分析天平(德国Sartorius公司),Milli-Q型超纯水机(美国Millipore公司)等。
1.2 主要药品与试剂
新芒果苷对照品(批号19072315,纯度≥98%)、芒果苷对照品(批号19040123,纯度≥98%)、异芒果苷对照品(批号19072905,纯度≥98%)、知母皂苷BⅡ对照品(批号19052605,纯度≥98%)、知母皂苷BⅢ对照品(批号20052209,纯度≥96%)、知母皂苷Ⅰ对照品(批号20052405,纯度≥98%)、知母皂苷AⅢ对照品(批号19040108,纯度≥98%)均购自成都曼思特生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)均购自赛默飞世尔科技(中国)有限公司;其余试剂均为分析纯,水为超纯水。
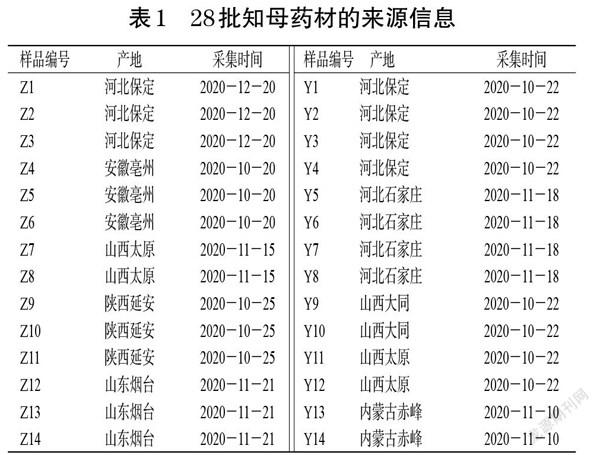
知母药材共28批(编号Z1~Z14、Y1~Y14),其中Z1~Z14为知母栽培品、Y1~Y14为知母野生品,经河北省药品检验所/孙宝惠全国名老中医药传承工作室孙宝惠教授鉴定,均为百合科植物知母A. asphodeloides Bge.的干燥根茎。药材样品保存于河北中医学院中药炮制技术创新中心。28批知母药材的来源信息见表1。
2 方法与结果
2.1 色谱条件
以InertSustain C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~5 min,5%A→7%A;5~12 min,7%A→15%A;12~20 min,15%A→20%A;20~23 min,20%A→23%A;23~36 min,23%A;36~40 min,23%A→29%A;40~43 min,29%A→35%A;43~51 min,35%A→46%A;51~60 min,46%A→95%A);流速为1.0 mL/min;柱温为20 ℃;漂移管温度为70 ℃;雾化温度为90 ℃;载气流速为1.6 mL/min;进样量为10 μL。
2.2 混合对照品溶液的制备
分别精密称取新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ对照品适量,置于同一5 mL量瓶中,加70%乙醇溶解、定容,制成上述成分质量浓度依次为0.428、0.395、0.023、0.583、0.073、0.063、0.104 mg/mL的混合对照品溶液。
2.3 供试品溶液的制备
精密称取知母栽培品或野生品药材粉末(粉碎,过60目筛,下同)0.50 g,置于具塞锥形瓶中,按照料液比1 ∶ 40(g/mL)精密加入70%乙醇,称定质量,超声(功率300 W,频率40 kHz)提取30 min,室温冷却,再次称定质量,用70%乙醇补足减失的质量,离心(转速13 000 r/min,时间10 min)两次,取上清液,过0.22 μm微孔滤膜,即得。
2.4 知母药材指纹图谱的建立与分析
2.4.1 精密度试验 精密称取知母药材粉末(编号Z1)适量,按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件连续进样分析6次,记录峰面积。以峰7(峰面积较大且保留时间适中,下同)为参照,计算各共有峰的相对峰面积和相对保留时间。结果显示,10个共有峰相对峰面积的RSD均不高于2.56%(n=6),相对保留时间的RSD均不高于0.07%(n=6),表明该方法精密度良好。
2.4.2 稳定性试验 取供试品溶液(编号Z1)适量,分别于室温下放置0、2、4、8、12、24 h时按照“2.1”项下色谱条件进样分析,记录峰面积。以峰7为参照,计算各共有峰的相对峰面积和相对保留时间。结果显示,10个共有峰相对峰面积的RSD均不高于2.36%(n=6),相对保留时间的RSD均不高于1.49%(n=6),表明供试品溶液在室温下放置24 h稳定性良好。
2.4.3 重复性试验 精密称取同一知母药材粉末(编号Z1)6份,按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件进样分析,记录峰面积。以峰7为参照,计算各共有峰的相对峰面积和相对保留时间。结果显示,10个共有峰相对峰面积的RSD均不高于2.56%(n=6),相对保留时间的RSD均不高于1.82%(n=6),表明所建方法重复性良好。
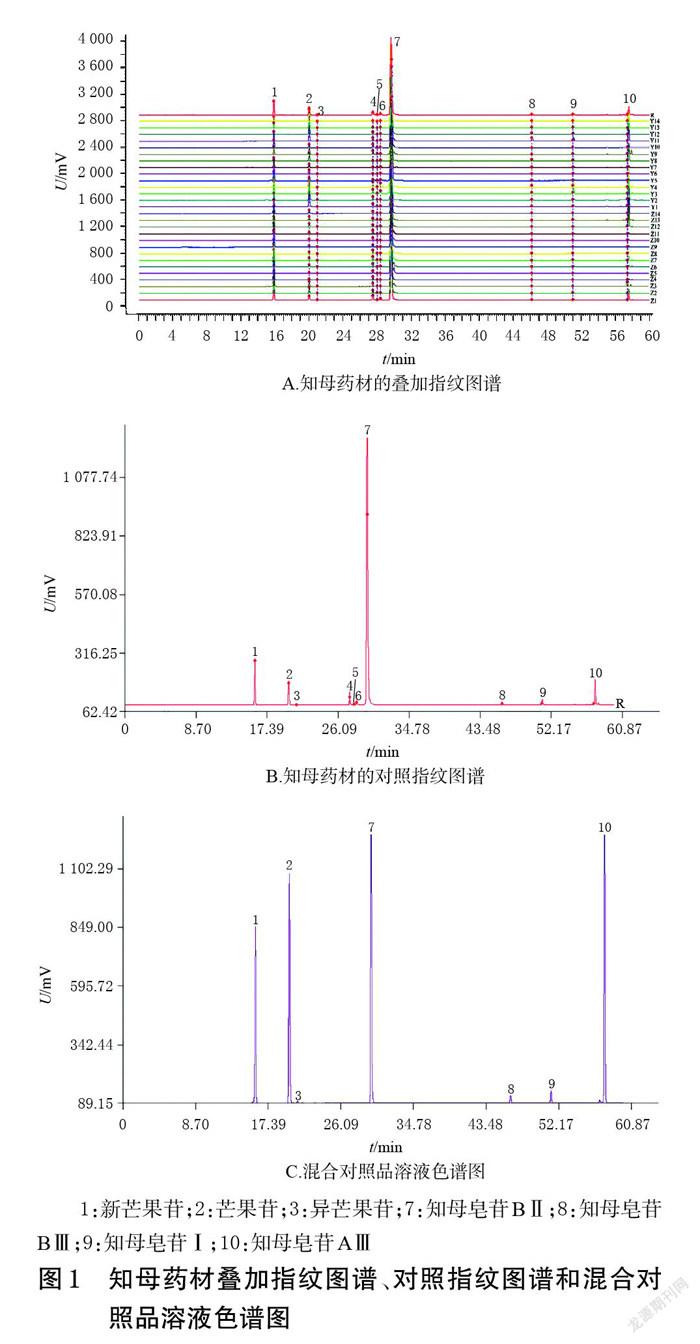
2.4.4 28批知母药材指纹图谱的建立 取28批知母药材的供试品溶液和混合对照品溶液,按照“2.1”项下色谱条件进样分析,记录色谱图。利用《中药色谱指纹图谱相似度评价系统(2012版)》分析28批知母药材的色谱数据,以Z1样品的色谱图作为参照图谱,利用中位数法,设时间窗宽度为0.2 min,经多点校正法生成知母药材叠加指纹图谱和对照指纹图谱。结果显示,28批知母药材指纹图谱中共有10个共有峰;通过与混合对照品比对,指认出其中7个峰,分别为新芒果苷(峰1)、芒果苷(峰2)、异芒果苷(峰3)、知母皂苷BⅡ(峰7)、知母皂苷BⅢ(峰8)、知母皂苷Ⅰ(峰9)、知母皂苷AⅢ(峰10)。28批知母药材叠加指纹图谱、对照指纹图谱和混合对照品溶液的色谱图见图1。
2.4.5 相似度评价 将28批知母药材指纹图谱与对照指纹图谱进行相似度评价,得各批知母药材的相似度均不低于0.963,说明知母栽培品和野生品的化学成分类似。结果见表2。
2.5 知母药材多成分含量的测定
对28批知母药材中7个指认共有峰对应成分进行含量测定,以明确知母栽培品和野生品中化学成分的含量差异。
2.5.1 专属性考察 取知母栽培品(编号Z1)和野生品(编号Y3)的供试品溶液、混合对照品溶液、空白溶剂(70%乙醇),按照“2.1”项下色谱条件进样分析,记录色谱图。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ的保留时间分别为15.93、20.09、21.04、29.72、46.22、51.04、57.44 min,各色谱峰与相邻色谱峰的分离度均大于1.5,空白溶剂不干扰测定。结果见图2(混合对照品溶液的色谱图见图1C,空白溶剂图略)。
2.5.2 线性关系考察 以70%乙醇为溶剂,制备不同质量浓度的系列混合对照品溶液,其中新芒果苷质量浓度分别为0.053、0.107、0.214、0.428、0.860、1.710 mg/mL,芒果苷质量浓度分别为0.049、0.099、0.198、0.395、0.790、1.580 mg/mL,异芒果苷质量浓度分别为0.003、0.006、0.011、0.023、0.045、0.090 mg/mL,知母皂苷BⅡ质量浓度分别为0.073、0.146、0.291、0.583、1.165、2.330 mg/mL,知母皂苷BⅢ质量浓度分别为0.009、0.018、0.036、0.073、0.145、0.290 mg/mL,知母皂苷Ⅰ质量浓度分别为0.008、0.016、0.032、0.064、0.125、0.250 mg/mL,知母皂苷AⅢ质量浓度分别为0.013、0.026、0.052、0.104、0.208、0.415 mg/mL,按照“2.1”项下色谱条件进样分析,记录色谱图。以待测成分峰面积(y)为纵坐标、质量浓度(x,mg/mL)为横坐标进行线性回归。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ在相应的定量范围内线性关系良好,详见表3。
2.5.3 精密度试验 取混合对照品溶液适量,按照“2.1”项下色谱条件连续进样分析6次,记录峰面积。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ峰面积的RSD分别为1.46%、1.14%、2.82%、2.14%、2.34%、2.32%、0.98%(n=6),表明仪器精密度良好。
2.5.4 稳定性试验 精密称取同一批知母药材粉末(编号Z1)6份,按照“2.3”项下方法制备供试品溶液,分别于室温下放置0、2、4、8、12、24 h时按照“2.1”项下色谱条件进样分析,记录峰面积。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ峰面积的RSD分别为2.58%、1.58%、2.99%、2.64%、2.84%、2.20%、1.68%(n=6),表明供试品溶液在室温下放置24 h稳定性良好。
2.5.5 重复性试验 精密称取知母药材粉末(编号Z1)6份,分别按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件进样分析,记录峰面积并代入回归方程计算含量。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ含量的RSD分别为2.83%、2.81%、2.63%、1.93%、2.39%、2.32%、1.29%(n=6),表明该方法重复性良好。
2.5.6 加样回收率试验 精密称取已知含量的知母药材粉末(编号Z1)6份,分别加入与知母药材中各成分质量相同的单一对照品溶液,按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件进样分析,记录峰面积,计算加样回收率。结果显示,新芒果苷、芒果苷、异芒果苷、知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ的平均加样回收率分别是99.06%、100.53%、98.30%、101.46%、100.17%、96.80%、98.58%,RSD分别为0.36%、0.28%、0.16%、0.82%、0.24%、1.29%、0.68%(n=6)。
2.5.7 样品含量测定 按照“2.3”项下方法制备28批知母药材的供试品溶液,按照“2.1”项下色谱条件进样分析(每个样品测定3次),记录峰面积并代入回归方程计算含量。采用GraphPad Prism 8.3.0软件进行t检验,检验水准α=0.05(统计学方法下同)。结果显示,知母栽培品与野生品中7个成分的平均总含量分别为74.18、84.72 mg/g,知母栽培品中7个成分的平均总含量明显低于野生品(P<0.05);知母栽培品与野生品中3个知母双苯吡酮类成分(新芒果苷、芒果苷、异芒果苷)的平均总含量分别为22.83、21.51 mg/g,二者比较差异无统计学意义(P>0.05);知母栽培品与野生品中4个知母皂苷类成分(知母皂苷BⅡ、知母皂苷BⅢ、知母皂苷Ⅰ、知母皂苷AⅢ)的平均總含量分别为51.35、63.21 mg/g,知母野生品中4个知母皂苷类成分的平均总含量明显高于栽培品(P<0.01)。结果见表4。
2.6 化学模式识别分析
2.6.1 主成分分析 将28批知母药材中10个共有峰峰面积的原始数据直接导入SIMCA 13.0软件进行主成分分析。结果显示,前2个主成分累积贡献率达到95%;从方差贡献率来看,所建模型解释能力参数R 2X为1.000,预测能力参数Q 2为0.994,说明该主成分分析模型有良好的区分度和预测度。由主成分分析得分图(图3)可知,知母栽培品和野生品可被分为两类。由共有峰峰面积变量载荷图(图4)可知,变量对主成分影响的权重大小依次为峰2(芒果苷)、峰9(知母皂苷Ⅰ)、峰6、峰5、峰4、峰7(知母皂苷BⅡ)、峰1(新芒果苷)、峰3(异芒果苷)、峰8(知母皂苷BⅢ)、峰10(知母皂苷AⅢ)(峰面积对主成分的影响权重由变量离原点的距离判断,距离原点越远,变量对主成分的影响权重越大[8])。
2.6.2 正交偏最小二乘法-判别分析 在进行了无监督的主成分分析后,进一步对28批知母药材中10个共有峰峰面积进行有监督的正交偏最小二乘法-判别分析,在95%置信区间内,选取变量投影重要性(variable importance in projection,VIP)值>1的成分作为差异性成分[9-10]。结果显示,所建模型对X和Y矩阵的解释能力参数R 2X和R 2Y分别为1.000、0.918,预测能力参数Q 2为0.691,说明该模型稳定性及预测能力均较好。由正交偏最小二乘法-判别分析得分图(图5)可知,知母栽培品和野生品可被分为两类。由VIP值结果(图6)可知,峰2、峰7、峰1、峰10的VIP值均大于1,初步确定其对应的芒果苷、知母皂苷BⅡ、新芒果苷、知母皂苷AⅢ可作为区分知母栽培品和野生品的差异性成分。
2.7 知母栽培品和野生品中差异性成分的含量比较
采用t检验比较28批知母药材中新芒果苷、芒果苷、知母皂苷BⅡ、知母皂苷AⅢ的含量差异。结果显示,知母栽培品中新芒果苷的含量明显高于知母野生品[(17.58±3.68)mg/g vs.(9.04±3.72)mg/g,P<0.05],芒果苷、知母皂苷BⅡ、知母皂苷AⅢ的含量均明显低于知母野生品[芒果苷:(4.76±1.55)mg/g vs.(11.60±1.65)mg/g,知母皂苷BⅡ:(44.03±1.31)mg/g vs.(46.67±3.86)mg/g,知母皂苷AⅢ:(4.37±2.91)mg/g vs.(8.88±2.28)mg/g,P<0.05],详见图7。
3 讨论
知母中富含甾体皂苷类成分,在200~800 nm波长内无吸收,因而紫外检测器不适用于知母甾体皂苷类成分的测定。蒸发光散射检测器是通用型检测器,可以同时检测知母中的双苯吡酮类和皂苷类成分。因此,本研究采用蒸发光散射检测器,以高效液相色谱法对28批知母药材进行定性、定量分析。笔者前期首先对蒸发光散射检测器的检测条件进行了优化,包括漂移管温度(70、80、90 ℃)、雾化温度(90、100 ℃)、载气流速(0.8、1.2、1.6、2 mL/min)。结果显示,当漂移管温度为70 ℃、雾化温度为90 ℃、载气流速为1.6 mL/min时,所得图谱基线平稳、灵敏度高、分离度好。其次对知母药材的提取方法进行了优化,以7个指认共有峰对应的成分总含量为指标,分别对料液比(1 ∶ 30、1 ∶ 40、1 ∶ 50,g/mL)、超声时间(20、30、40 min)、乙醇体积分数(100%、70%、50%、25%)进行了考察。结果显示,最优提取条件如下:料液比1 ∶ 40(g/mL)、超声时间30 min、乙醇体积分数为70%。
本研究收集了河北、安徽、山东、山西、陕西、内蒙古等6个省份的14批知母野生品和14批知母栽培品,建立了知母药材的指纹图谱。结果显示,28批知母药材的指纹图谱与对照指纹图谱的相似度均不低于0.963,所建立的指纹图谱可用于知母药材的鉴定和质量控制。但指纹图谱各共有峰的峰面积大小各异,表明两者成分含量存在一定差异性。
2020年版《中国药典》(一部)将芒果苷和知母皂苷BⅡ作为知母的质控指标[1],单以这两个成分难以全面反映知母的整体质量与品质。本研究对28批知母药材中7个指认共有峰对应成分进行含量测定,并结合主成分分析和正交偏最小二乘法-判别分析对知母栽培品和野生品进行比较与判别。结果显示,知母栽培品中7个成分的平均总含量明显低于野生品,知母栽培品与野生品中3个双苯吡酮类成分的平均总含量无明显差异,知母野生品中4个知母皂苷类成分的平均总含量明显高于栽培品。主成分分析及正交偏最小二乘法-判别分析结果表明,知母栽培品和野生品可被分为两类。初步筛选出影响知母栽培品和野生品药材质量的4个差异性成分,分别为新芒果苷、芒果苷、知母皂苷BⅡ和知母皂苷AⅢ。已有研究报道,新芒果苷具有改善结肠炎、非酒精性脂肪肝等药理作用[11-12],芒果苷具有抑制心肌纤维化、降血压、抗肿瘤、神经保护等作用[13-16],知母皂苷BⅡ具有抗氧化应激损伤、治疗帕金森、治疗老年痴呆等作用[13,17-18],知母皂苷AⅢ具有抗肿瘤、抗肝毒性等作用[19-21],可能是知母药材的活性成分。本研究依据这4个成分的含量对28批知母药材进行比较,发现知母栽培品中新芒果苷的含量明显高于野生品,芒果苷、知母皂苷BⅡ、知母皂苷AⅢ的含量均明显低于野生品。
本研究成功建立了知母药材的指纹图谱,可用于知母药材的鉴定和质量控制;初步确认了知母野生品和栽培品的差异性成分(新芒果苷、芒果苷、知母皂苷BⅡ、知母皂苷AⅢ),为区分知母野生品与栽培品提供了参考。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社:2020:222-223.
[ 2 ] 石秋杰.周耀庭教授治療发热性疾病经验总结[J].中国中医药现代远程教育,2021,19(6):57-60.
[ 3 ] 钟可,王文全,靳凤云,等.知母的HPLC-ELSD指纹图谱研究[J].中草药,2016,47(15):2747-2750.
[ 4 ] 陈震霖,张硕.加减桂枝芍药知母汤合益肾除湿丸治疗类风湿性关节炎的疗效观察[J].中成药,2017,39(7):1539-1541.
[ 5 ] 刘静,党院霞,高英,等.知母-黄柏药对有效部位群改善2型糖尿病大鼠认知功能障碍的药效及机制研究[J].中草药,2017,48(19):4037-4043.
[ 6 ] DU H L,ZHAO H X,LAI X L,et al. Metabolic profiles revealed synergistically antidepressant effects of lilies and Rhizoma Anemarrhenae in a rat model of depression[J]. Biomed Chromatogr,2017,31(7):e3923.
[ 7 ] 趙小勤,许莉,文永盛,等. UPLC-QQQ-MS/MS法同时测定不同产地知母中10种成分[J].中成药,2020,42(4):980-985.
[ 8 ] 王玉勤,范国荣.基于指纹图谱结合多模式化学计量学方法评价补骨脂药材质量[J].中草药,2021,52(4):1143- 1150.
[ 9 ] 林丽,李欢欢,谢辉,等.基于HPLC指纹图谱结合化学计量学的旋覆花药材质量评价研究[J].中草药,2021,52(6):1751-1758.
[10] 杨冰月,彭亮,颜永刚,等. HPLC指纹图谱结合化学模式识别分析不同产地款冬花生品与蜜炙品[J].中草药,2018,49(21):4991-4997.
[11] ZHOU C Y,ZHOU J J,HAN N,et al. Beneficial effects of neomangiferin on high fat diet-induced nonalcoholic fatty liver disease in rats[J]. Int Immunopharmacol,2015,25(1):218-228.
[12] LIM S M,KANG G D,JEONG J J,et al. Neomangiferin modulates the Th17/Treg balance and ameliorates colitis in mice[J]. Phytomedicine,2016,23(2):131-140.
[13] OU G,CHEN W Y,YANG M Y,et al. Preventive effect of nasal timosaponin BⅡ-loaded temperature-/ion-sensitive in situ hydrogels on Alzheimers disease[J]. J Tradit Chin Med Sci,2021,8(1):59-64.
[14] SONG J N,MENG Y X,WANG M,et al. Mangiferin activates Nrf2 to attenuate cardiac fibrosis via redistributing glutaminolysis-derived glutamate[J]. Pharmacol Res,2020,157:104845.
[15] 辛田田,廖承谱,蒙玉梅,等.芒果苷对自发性高血压大鼠T淋巴细胞亚群和炎性因子的影响[J].辽宁中医杂志,2020,47(3):194-197.
[16] 张蕾.芒果苷对人甲状腺乳头状癌TPC-1细胞的抑制作用及抗肿瘤机制研究[D].济南:山东大学,2019.
[17] XIE Q M,ZHAO H X,LI N,et al. Protective effects of timosaponin BⅡ on oxidative stress damage in PC12 cells based on metabolomics[J]. Biomed Chromatogr, 2018, 32(10): e4321.
[18] 张锦坤,周梦琪,马浩洁,等.知母皂苷B-Ⅱ对MPP+诱导的SH-SY5Y细胞帕金森病模型线粒体的保护作用[J].北京中医药大学学报,2020,43(12):1027-1033.
[19] 谭希,潘会君,吴伟达,等.知母皂苷AⅢ抑制人脑胶质瘤增殖生长的机制研究[J].中国中药杂志,2017,42(6):1160-1166.
[20] WU Z T,QI X M,SHENG J J,et al. Timosaponin A3 induces hepatotoxicity in rats through inducing oxidative stress and down-regulating bile acid transporters[J]. Acta Pharmacol Sin,2014,35(9):1188-1198.
[21] MARELIA C B,SHARP A E,SHEMWELL T A,et al. Anemarrhena asphodeloides Bunge and its constituent timosaponin-AⅢ induce cell cycle arrest and apoptosis in pancreatic cancer cells[J]. FEBS Open Bio,2018,8(7):1155-1166.
(收稿日期:2021-08-12 修回日期:2021-12-08)
(编辑:邹丽娟)
