miR-152在胃癌中的表达及意义
2022-02-07陈丽丽王震凯陈婉珍杨晓倩韦志琴沈蒙蒙汪芳裕
陈丽丽, 王震凯, 刘 翔, 陈婉珍, 杨晓倩, 韦志琴, 沈蒙蒙, 刘 丹, 汪芳裕
1.浙江省台州市路桥区蓬街镇卫生院,浙江 台州 318057; 2.南京中医药大学附属南京市中医院内镜中心; 3.东部战区南京总医院消化内科
虽然当今社会的物质和生活条件已有较大改善,但胃癌仍是影响人类生活质量和生命的恶性疾病之一。有许多患者在发现胃癌时已是晚期,甚至早期胃癌的患者也有30%~50%存在微转移。而胃癌的早发现、早诊断、早治疗则能明显改善患者的预后及生存质量,因此,寻找胃癌的敏感标志物及有效治疗靶点有助于胃癌的早诊早治。
近些年,基因表观遗传学的异常已经成为肿瘤病因研究的热点之一。DNA甲基化和微小RNA(microRNAs,miRNAs)对基因转录后调控作用为肿瘤的发生、发展及干预开辟了新的路径。miR-152在多种肿瘤中的表达水平均下降,如:前列腺癌[1]、卵巢癌[2]、宫颈癌[3]、乳腺癌[4]、结肠癌[5]等,而且miR-152与肿瘤的增殖能力、肿瘤大小及T分级明显相关。但有关miR-152在胃癌方面的表达和研究仍鲜有报道。本研究主要探讨miR-152在胃癌中的表达及其与胃癌预后之间的关系。
1 材料与方法
1.1 材料共收集2012年至2015年240对胃癌及癌旁正常组织(距离肿瘤组织3 cm左右),标本均来自原南京军区南京总医院。以上组织来源于外科手术切除或内镜下黏膜剥离术过程中获取。该研究内容获得原南京军区南京总医院伦理委员会同意(批准号:NJZYY2016039)及病患家属签字认可,操作符合临床试验伦理规范。不同分化程度的胃癌细胞株MKN-45(低分化)、AGS(高分化)、MKN-28(中分化)和HGC-27(未分化)和正常胃黏膜细胞株GES-1均购自中国科学院细胞库。
1.2 方法
1.2.1 原位杂交法:miR-152原位杂交检测试剂盒购自丹麦Exioqon公司,原位杂交封闭液和洗涤液均购自美国Roche公司。基本过程如下:组织芯片脱蜡,于37 ℃蛋白酶K消化15 min,漂洗后梯度乙醇脱水。55 ℃预杂交30 min后,地高辛标记的miR-152探针(100 nmol/L,Bis-QD355)恒温杂交1 h,碱性磷酸酶标记的羊抗地高辛抗体室温孵育1 h,NBT/BCIP黑暗处30 ℃显色,核固红复染。杂交过程选择U6探针(1 nmol/L)作为阳性对照,去除探针作为阴性对照。结果判定:miR-152表达以胞质出现棕褐色颗粒为阳性染色,阳性细胞数≥10%时为阳性。
1.2.2 实时荧光定量PCR(quantitative Real-time PCR,qRT-PCR):(1)RNA逆转录合成cDNA:10~25 ng 小RNA,1 μl 1×miRVana逆转录引物,2 μl miRVana 5×RT缓冲液。将DEPR处理过的双蒸水加入上述液体至10 μl。
步骤如下:将1×miRVana RT引物1 μl、抽提的小RNA液10~25 ng、miRVana 5×RT缓冲液2 μl、无核酸酶纯水(Nuclease-free Water)四种液体充分混匀,由无核酸酶纯水定容至10 μl后移入EP管,使用瞬时离心(常温下,6 000 r/min,10 s)进行沉淀,后在37 ℃条件下孵育30 min,再转为95 ℃条件性孵育10 min,最后在冰块中冷却。
(2)qRT-PCR:PCR引物序列及扩增长度如表1所示。实验步骤如下:将miRVana 5×PCR缓冲液5 μl、耐热DNA聚合酶1 U、50×ROXTM0.5 μl及以上PCR所用引物(见表1)混匀,由DEPC处理过的双蒸水加入上述液体至25 μl,使用瞬时离心(常温下,6 000 r/min,10 s)进行沉淀。在95 ℃条件下,经过3 min预变性处理后,开始40个PCR循环,每个循环条件分别在95 ℃进行15 s,在60 ℃进行30 s。

表1 PCR引物序列及扩增长度
使用计算公式Fold change=2-ΔΔCT来分析mRNA的相对含量。内参为U6,CT值代表“当荧光强度满足条件状态下总共的扩增次数”。
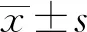
2 结果
2.1 原位杂交方法检测胃癌组织中miR-152的表达
原位杂交法检测miR-152在80对胃癌组织及癌旁正常组织中的表达情况。结果发现,miR-152在胃癌组织中的表达明显低于癌旁正常组织(见图1)。胃癌患者的临床病理特征与miR-152表达的关系如表2所示。240例胃癌病例中,192例(80.00%)miR-152呈低表达状态,且与患者的年龄、胃癌的分化程度、浸润深度和TNM分期明显相关。存在淋巴结转移的病例中,miR-152的表达水平显著低于无淋巴结转移的病例。miR-152表达与患者性别、肿瘤发病部位以及肿瘤大小无相关性。
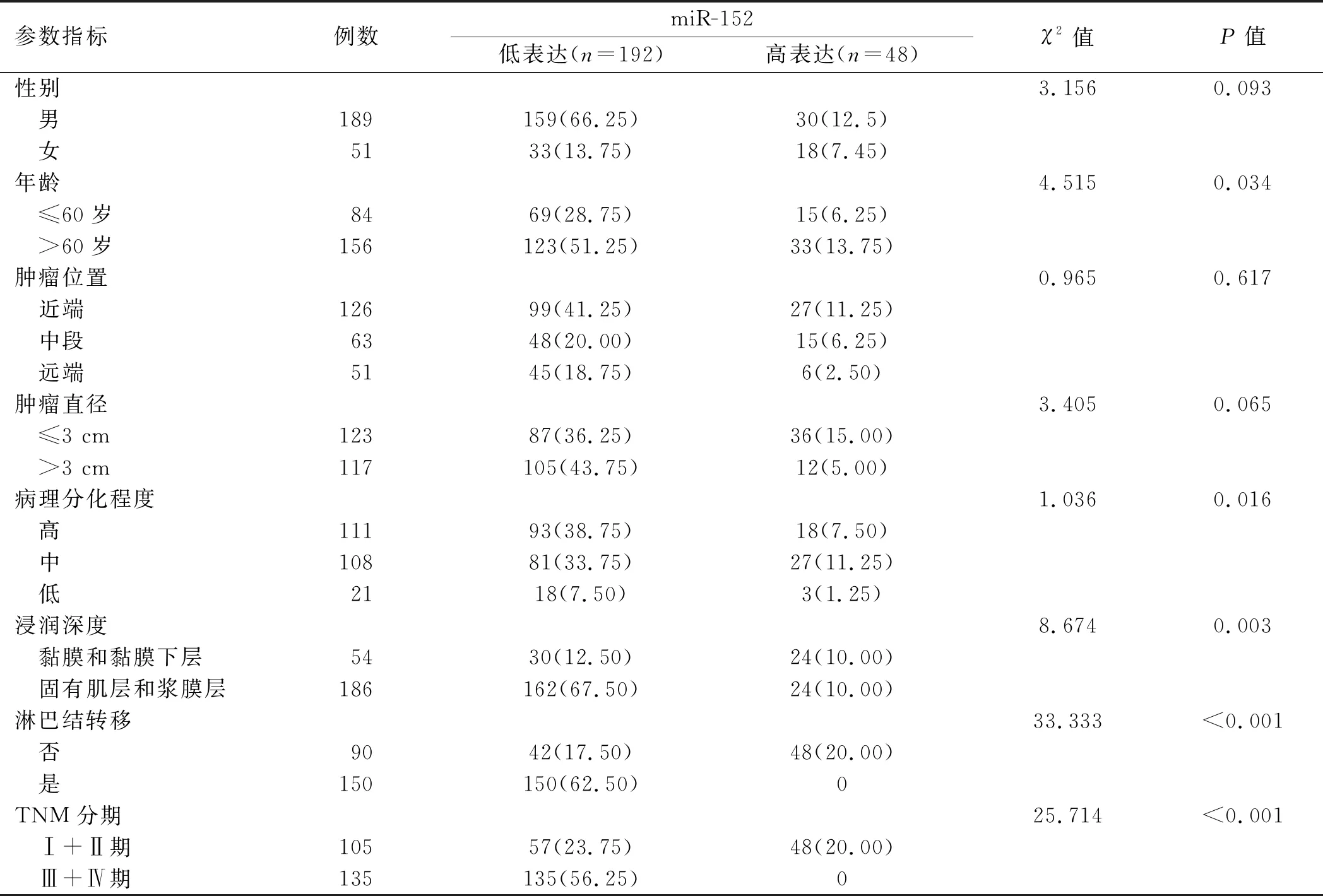
表2 miR-152表达与胃癌患者的临床特征[例数(%)]
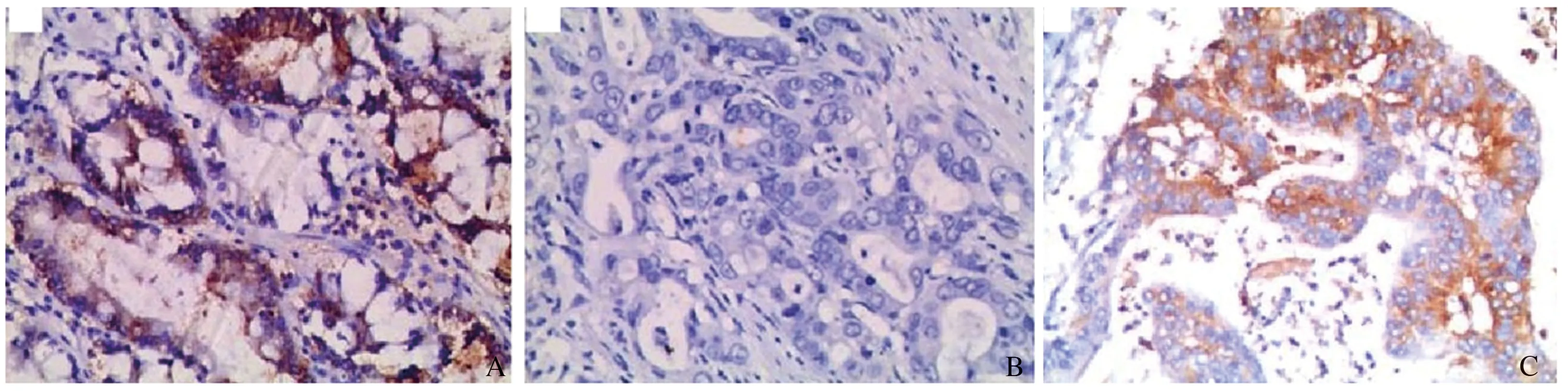
注:棕色染色代表miR-152的表达。A:癌旁正常组织中miR-152表达情况;B:胃癌组织中miR-152低表达;C:胃癌组织中miR-152高表达。放大100倍。
2.2 qRT-PCR检测胃癌组织中miR-152的表达使用Taqman探针法qRT-PCR定量检测胃癌组织及癌旁正常组织中miR-152的表达水平。miR-152在胃癌组织中的表达水平为1.39±1.02,而在癌旁正常组织中的表达水平为13.26±2.22(见图2),两者比较差异有统计学意义(P<0.05)。本试验根据肿瘤生物学行为特性及TNM分期情况,将Ⅰ~Ⅱ期归为早期,Ⅲ~Ⅳ期归为进展期。在早期胃癌组织中miR-152的表达水平为2.22±1.07,进展期胃癌组织中miR-152的表达水平为0.75±0.17(见图3)。因此,在进展期胃癌组织中miR-152的表达比早期胃癌组织中的表达显著减少,差异有统计学意义(P<0.01)。
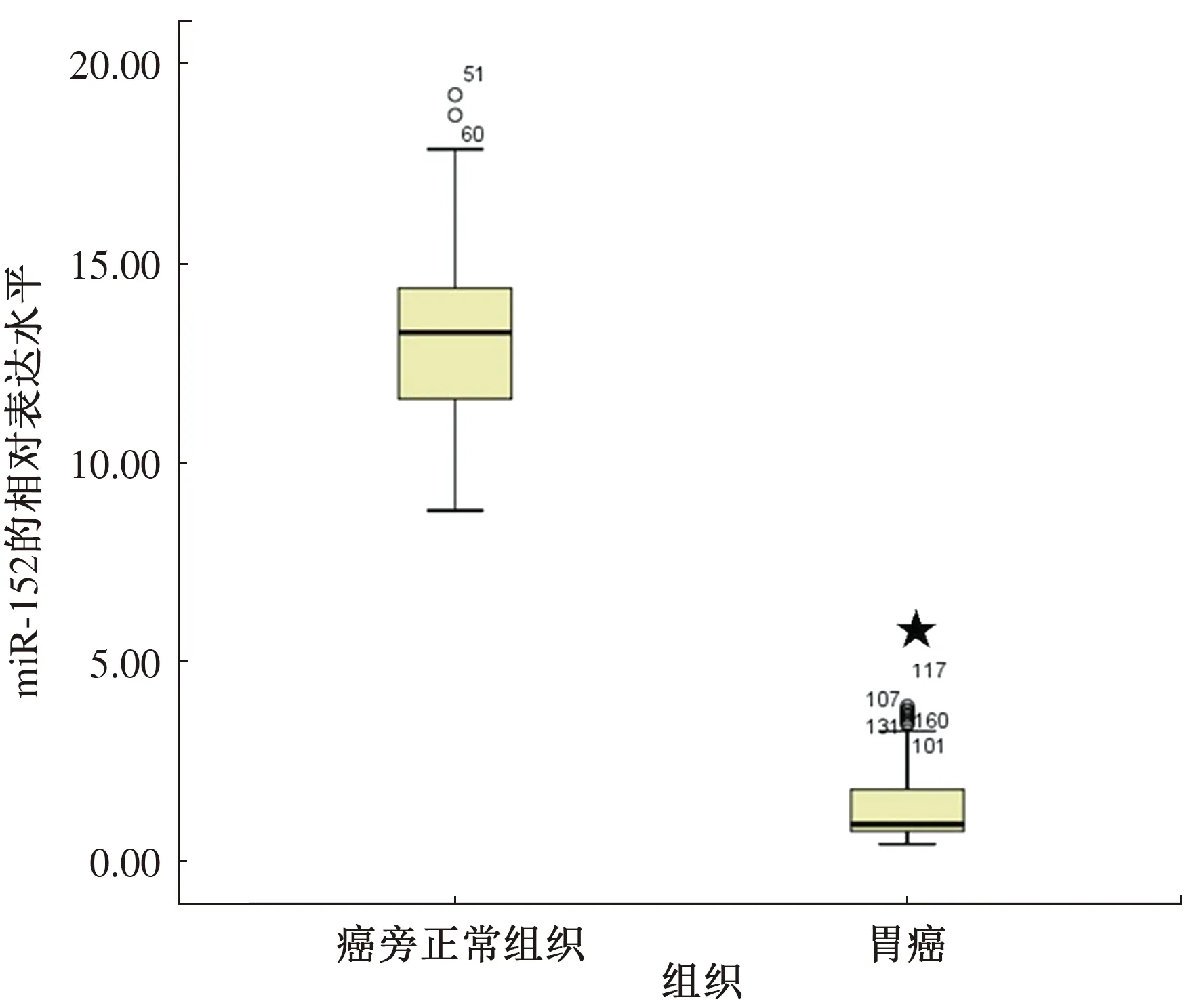
注:与癌旁正常组织比较,★P<0.001。
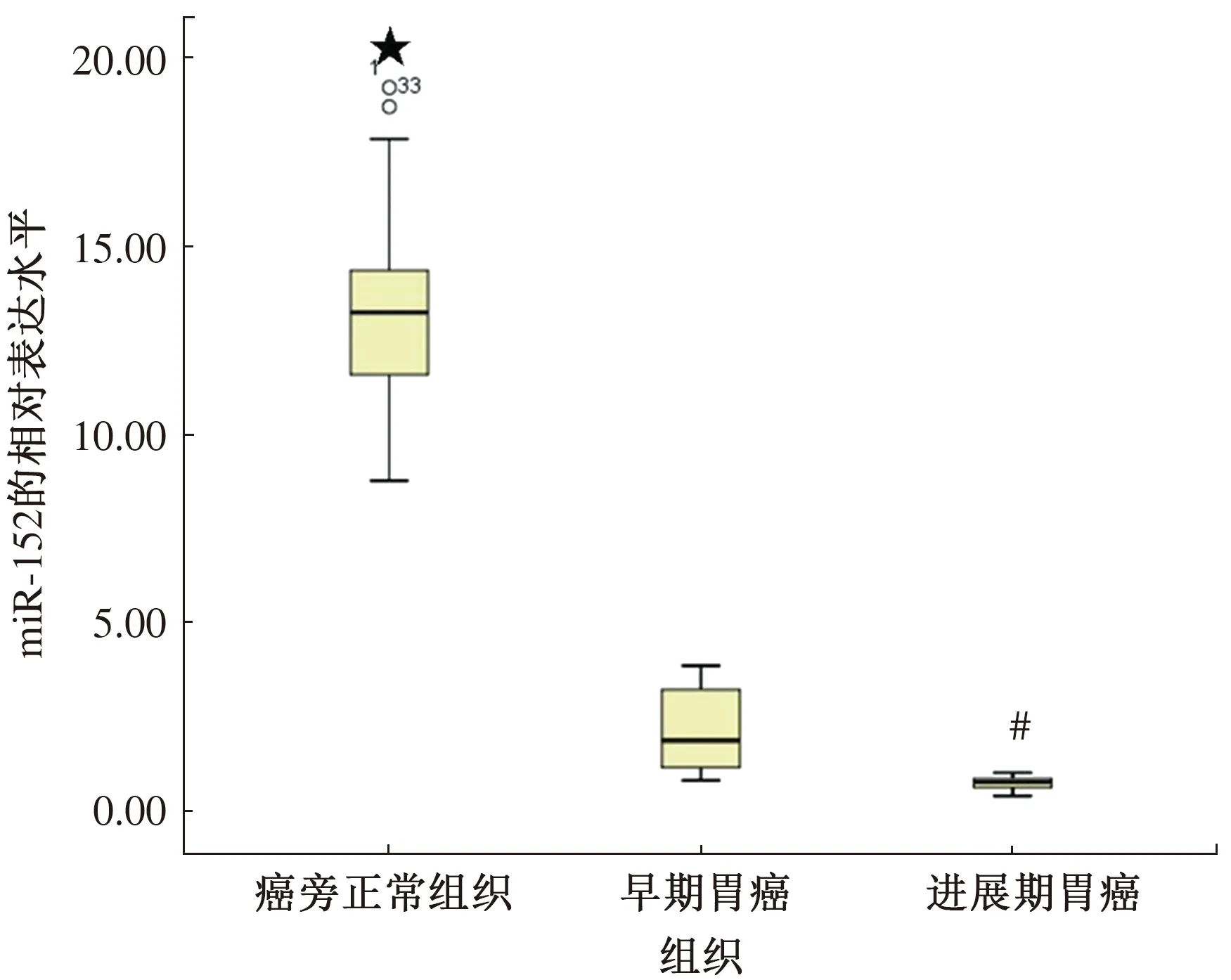
注:与早期比较,#P<0.01,★P<0.001。
2.3 不同分化程度的胃癌细胞株miR-152表达情况
虽然miR-152在胃癌组织中表达显著下调,但在不同分化程度的胃癌组织中,miR-152的表达仍存在显著性差异(P=0.016),初步提示miR-152与胃癌的细胞生物行为能力密切相关。为进一步明确miR-152表达水平与胃癌细胞生物行为能力的相关性,本试验选取了4种代表不同分化程度的人胃癌上皮细胞株进行miR-152的定量分析。测得的结果与人正常胃黏膜上皮细胞GES-1进行对照比较。结果发现,胃癌细胞株中的miR-152表达量较正常胃黏膜细胞株显著减少(见图4)。在MKN-45、AGS、MKN-28和HGC-27细胞中miR-152相对表达水平分别为GES-1细胞的23%、48%、52%和22%。在MKN-45和HGC-27差分化的胃癌上皮细胞株中,miR-152表达水平显著低于分化程度较好的AGS和MKN-28细胞株(P<0.001),该结果与临床胃癌组织标本的检测结果一致。上述数据表明,miR-152表达水平与胃癌细胞分化程度有关,而差分化的MKN-45和HGC-27细胞株中的miR-152的表达减少最显著。
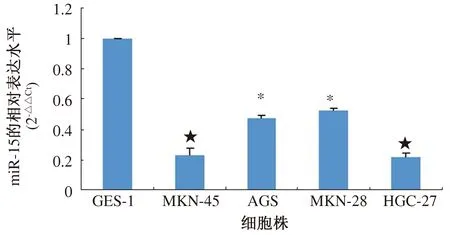
注:与GES-1比较,*P<0.05,★P<0.001。
3 讨论
miRNA是一类长度约为22 nt RNA序列的控制性非编码RNA,可以通过结合靶基因3′UTR上的互补区域来抑制基因的表达[6]。研究表明,有的miRNA同时能作用于多个靶基因,甚至达到上百个靶向基因。因此,自然界绝大部分生物基因可能是miRNA的靶向基因[7]。同时,miRNA在许多领域发挥着广泛的作用,例如:参与机体的神经形成、细胞的分化、增殖与凋亡、生物内分泌功能、干预脂肪代谢等方面。另一方面,miRNA自身可以作为癌基因或抑癌基因参与肿瘤的发生和发展,还能通过调控靶基因的转录后的表达引起靶基因沉默。
miR-152属于抑癌miRNA,在多种肿瘤组织中存在表达下降,导致癌基因的活化,在肿瘤的形成中发挥重要作用。Tang等[3]通过qRT-PCR检测宫颈癌组织中的miR-152的表达情况,发现宫颈癌组织及癌细胞株中的miR-152表达显著低于癌旁正常组织及正常宫颈上皮细胞。汪毅等[5]发现,在结直肠癌组织中miR-152的表达水平低于相应的癌旁组织,且miR-152表达水平与结直肠癌患者的淋巴结转移和TNM分期有关。Theodore等[1]证实,在不同人种中miR-152的不同表达水平决定了前列腺癌的发病率及预后,说明其在肿瘤发病前期的重要作用。本研究结果与上述研究相似,80.00%(192/240)胃癌患者的胃癌组织中miR-152表达比癌旁正常组织的表达明显减少,且与胃癌的浸润深度和TNM分期明显相关。而且在胃癌的不同阶段(早期癌vs进展期癌),miR-152的表达水平也存在显著性差异。虽然胃癌上皮细胞株(MKN-45、AGS、MKN-28和HGC-27)中miR-152的表达水平均较GES-1显著降低,但MKN-45与HGC-27细胞株中miR-152表达水平显著低于MKN-28和AGS。从体外细胞水平证实miR-152的低表达与胃癌细胞的生物功能具有相关性。上述试验结果表明,miR-152可能在胃癌发生发展过程中发挥重要作用,其低表达的程度可作为临床上判断胃癌预后以及病理评估的分级标志物。
目前的证据表明,具有表观遗传修饰作用的miRNA可能在不同的肿瘤中发挥重要的触发作用。据报道,miR-152能靶向DNMT1和诱导HBV相关肝细胞癌DNA异常甲基化[8]。但另有研究却得到相反的结果:在NiS细胞中恰恰是由于DNMT1诱导miR-152高甲基化而导致其低表达。这个研究揭示了NiS细胞诱导的恶性转化中,miR-152和DNMT1存在双向负反馈调控[9-10]。由于miR-152启动子区域存在经典的CpG岛,使DNMTs家族诱导miR-152高甲基化状态成为可能。因此,近来发现miR-152的高甲基化导致的低表达现象存在于一些胃肠道肿瘤和胆管癌[11-12]。也有研究发现子宫内膜癌的细胞株和原发肿瘤中存在DNA高甲基化和miR-152的下调相关[13]。另有研究认为,miR-152 CpG岛的异常甲基化与畸形白血病的临床预后密切相关[14]。我们前期的研究中,将miR-152模拟物和具有突变型3′UTR的DNMT1过表达载体共转染胃癌细胞株,虽然转染细胞中DNMT1蛋白表达明显增加,但并未出现miR-152表达的抑制或低表达[15]。因此,在胃癌机制研究中,miR-152低表达和DNMT1过表达孰因孰果尚未明确,两者间是如何被诱导产生对话交联、如何对两者进行有效调控仍需进一步阐释。
总之,miR-152在胃癌组织及胃癌细胞中表达明显下调,与胃癌的分化程度、肿瘤浸润深度及肿瘤分期密切相关,其可能成为胃癌诊断与评估的重要生物学标志物。
