MUC17抑制胃癌细胞的转移
2022-02-07袁涛,邢蕊
袁 涛, 邢 蕊
北京大学肿瘤医院暨北京市肿瘤防治研究所胃肠肿瘤生物学研究室,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
根据2020年全球癌症统计数据显示,我国胃癌的发病率和死亡率均高居第三位[1]。癌细胞转移是胃癌患者死亡的主要原因之一[2],以往研究发现,即便是在肿瘤早期,肿瘤细胞也会发生转移[3],因此,鉴定导致转移的关键基因是防治胃癌转移、延长患者生存期的关键[4-5]。
以往研究表明,胃黏膜屏障的破坏是胃癌发生发展的始动因素[6-7]。黏蛋白家族是一种高度糖基化修饰的高分子量蛋白家族,由上皮组织产生,具有组织润滑及细胞信号转导等多种功能,是胃黏膜保护屏障的主要组成成分[8]。近年来,黏蛋白作为肿瘤分子标志物倍受重视。如MUC1在胃癌组织中高表达,且与患者预后不良密切相关[9];MUC16在结直肠癌中高表达,且与患者预后呈负相关[10]。本实验室主要针对MUC17进行了系统研究。在前期研究中,我们发现MUC17在胃癌组织中高表达,且与患者预后呈正相关[11-12];进一步研究发现,MUC17可以通过抑制NF-κB通路抵御炎症因子促进肿瘤细胞增殖的作用,从而延长患者生存期[11]。肿瘤细胞的恶性行为不仅与炎症相关,更与癌细胞的转移密不可分,因此,在本研究中我们着重阐述MUC17的表达与胃癌细胞转移的关系。
1 材料与方法
1.1 实验材料
1.1.1 组织标本和胃癌细胞:本研究使用的103例胃癌组织来自于北京大学肿瘤医院手术样本,所有患者在取材前均未接受任何放化疗等治疗,术后病理诊断均为原发胃癌。本研究获得北京大学肿瘤医院伦理委员会批准(批号:2018KT14)。本研究所用胃癌细胞系AGS为贴壁细胞,购自ATCC(The Global Bioresource Center),使用含1%青霉素-链霉素、质量浓度为100 g/L胎牛血清的DMEM培养基,在37 ℃、体积分数为5%的CO2条件下培养。
1.1.2 主要试剂:FuGENE HD转染试剂(E2311,Promega,美国),兔抗人MUC17抗体(HPA031634,Sigma,美国)。
1.2 实验方法
1.2.1 免疫组化:胃癌组织样本经中性福尔马林溶液固定、石蜡包埋后制备白片,按如下步骤进行免疫组化实验:石蜡切片脱蜡至水,高压抗原热修复,3% H2O2室温孵育10 min清除内源性过氧化氢酶活性,质量浓度为50 g/L的脱脂奶粉室温孵育1 h封闭,滴加稀释后的MUC17抗体4 ℃过夜孵育,PBS冲洗5 min×3次,辣根过氧化物酶标记的二抗室温孵育30 min,PBS冲洗5 min×3次,DAB显色,苏木素复染,流水返蓝,封片。
1.2.2 细胞转染:参照文献设计出针对MUC17进行干扰的靶序列:ATACCAACCTCGACTCTTA[11]。根据靶序列,按照pSilencer质粒说明书人工合成一对互补并编码siRNA的寡核苷酸链。将1 μl 2 μmol/L的正、反义寡核苷酸链混合,加热至95 ℃并缓慢冷却至室温,形成双链。用BamHI与HindIII双酶切pSilencer载体质粒,琼脂糖电泳纯化回收后在T4连接酶催化下与退火形成的双链连接,并转化大肠杆菌DH5α。提取质粒,经测序对重组载体进行验证。细胞转染前1 d,将AGS细胞接种于培养皿中,待细胞融合度为60%~80%时,依据Promega FuGENE HD试剂说明书,将混匀后的转染试剂-质粒混合物加入细胞培养基中(转染试剂∶质粒=3∶1),在37 ℃、体积分数为5%的CO2条件下培养48 h。
1.2.3 Transwell实验:消化AGS细胞于含质量浓度为20 g/L胎牛血清的培养基,将含2×105个细胞的100 μl细胞悬液加入上室中,下室中加入800 μl含质量浓度为100 g/L胎牛血清的培养基,在37 ℃、体积分数为5%的CO2条件下培养24 h。取出Transwell小室,转移至预先加入PBS的孔中洗3次,4%多聚甲醛室温固定15 min,0.1%结晶紫室温染色15 min。
1.2.4 TCGA数据分析:我们用GEPIA2数据库(http://gepia2.cancer-pku.cn)[13]分析TCGA胃癌样本中MUC17和CDH1表达的相关性,使用Pearson相关性分析。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。MUC17的表达与胃癌患者转移相关性分析采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 MUC17的表达与胃癌转移呈负相关为了确定MUC17对胃癌细胞转移的影响,我们首先利用免疫组化实验在103例胃癌组织中检测了MUC17的表达与胃癌远端转移的相关性。如表1所示,MUC17的表达与胃癌转移呈负相关。如图1所示,相对于发生转移的原位癌,MUC17高表达于未发生转移的原位癌。

表1 MUC17的表达与远端转移的相关性

图1 用免疫组化在发生(A)/未发生(B)转移的原位癌中检测MUC17的表达(放大100倍)
2.2 MUC17抑制胃癌细胞的转移为了研究MUC17对胃癌细胞转移的影响,我们进行了Transwell实验。如图2所示,在胃癌细胞AGS中干扰MUC17的表达后,AGS细胞的转移能力明显增加。

注:A~B:在AGS细胞中用Transwell实验检测干扰MUC17的表达对胃癌细胞转移的影响,A为CTRL,B为sh-MUC17,放大200倍;C:Transwell实验中迁移AGS细胞数的直方图。n=3。
2.3 MUC17的表达与CDH1的表达呈正相关CDH1基因编码的E-钙黏蛋白是钙依赖性细胞黏附蛋白,参与调节细胞粘附、迁移,其功能缺失导致肿瘤细胞的侵袭与转移[14-15]。为了阐明MUC17抑制胃癌细胞转移的机制,我们利用TCGA数据分析MUC17与CDH1表达的相关性。如图3所示,MUC17的表达与CDH1的表达呈正相关(R=0.46,P<0.001)。
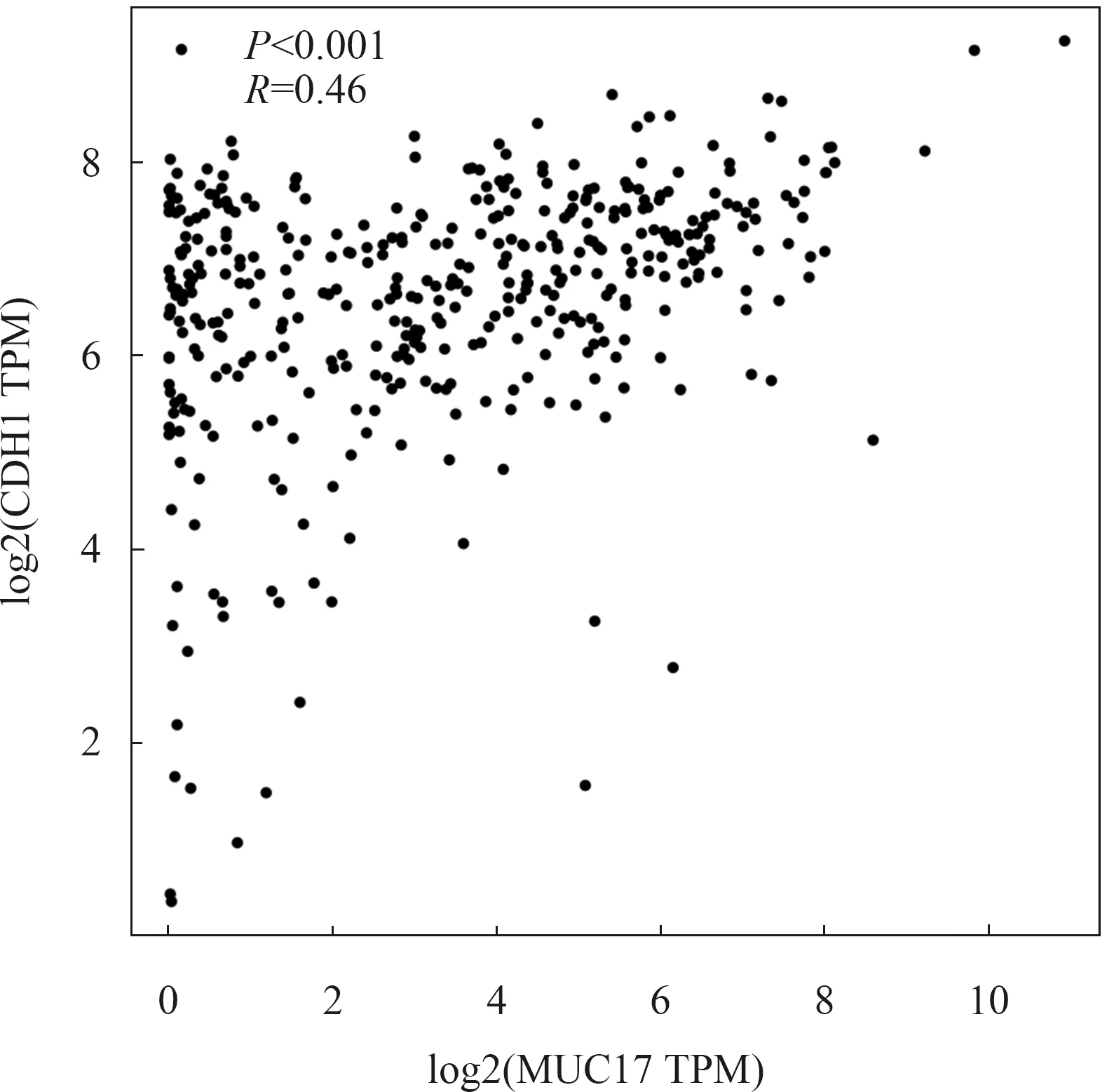
图3 利用TCGA数据分析MUC17与CDH1表达的相关性
3 讨论
我们前期的研究发现,MUC17具有抑制胃癌细胞增殖、抵御炎症因子促进肿瘤细胞增殖的作用,以及抑制幽门螺杆菌毒力蛋白CagA转运至上皮细胞的功能[11-12],本研究又发现该基因具有抑制肿瘤细胞迁移的能力。研究发现MUC17在胃癌组织中高表达,即便是在肿瘤早期也可以检测到MUC17的高表达,且其表达与患者预后呈正相关。综合MUC17的表达和功能,我们推测MUC17是机体的保护因素,其高表达可抑制肿瘤的恶性行为,延长患者生存期。
已有研究表明,CDH1基因所编码的E-cadherin具有抑制肿瘤转移的功能[16],其低表达是肿瘤细胞发生转移的重要事件[17]。利用TCGA数据,我们发现在胃癌组织中MUC17的表达与CDH1的表达呈正相关,提示MUC17可能通过调控E-cadherin的表达抑制胃癌的转移。在下一步研究中我们将阐释MUC17调控CDH1表达的机制,为揭示胃癌转移的机制提供新的思路。
