lncRNA在胃癌中作用及其机制的研究进展
2022-02-07袁玉刚李学良
袁玉刚, 李学良
1.南京医科大学,江苏 南京 211166; 2.南京医科大学第一附属医院消化内科
胃癌是世界上第五大恶性肿瘤,每年的新发病例超过100万,胃癌明确诊断时常常已发展至晚期,死亡率高,是全球第三大癌症死亡原因[1]。胃癌的诊断主要是通过内窥镜检查,确定肿瘤在胃内的部位及其宏观类型,并进行组织学活检以确诊[2]。早期胃癌一般可以通过内镜下治疗实现整块切除或完全切除[3],而进展期胃癌的临床治疗手段主要包括手术治疗、化学治疗、靶向治疗,但研究[4]表明,进展期胃癌即使经过手术治疗,5年生存率仅约20%。因此,我们需要寻找有效的血清生物标志物为进展期胃癌的治疗方案提供指导,现有的胃癌肿瘤标志物有CEA、CA19-9、CA72-4等,它们对胃癌诊断的特异度和灵敏度均不高[5],也不能指导临床医师选择治疗方案。近年的研究发现,长链非编码RNA(long non-coding RNA,lncRNA)、miRNA、循环肿瘤细胞(circulating tumor cell,CTC)等新的生物标志物在肿瘤的发生发展过程中可起到调节作用[6],这或许能为胃癌的诊断及治疗提供新的方向。
研究表明,人类基因组中编码RNA只占转录总量的很小一部分,其余均为非编码RNA(non-coding RNA,ncRNA)[7]。越来越多的研究发现ncRNA可能在细胞生长发育过程中发挥重要作用[8]。
1 lncRNA概述
ncRNA中长度大于200 nt的为lncRNA。lncRNA调控基因表达的机制较为复杂。据研究,lncRNA介导的基因表达可能发生在转录和/或转录后水平。在转录水平上,lncRNA可能通过与转录复合物或参与转录的DNA元件如启动子等相互作用发挥其生理功能;在转录后水平上,其调控主要涉及mRNA的稳定性[9]。已有研究发现,部分lncRNA的异常表达,包括H19、TUSC7、MEG3和MALAT1,均能调控胃癌细胞增殖、细胞周期、凋亡、侵袭、迁移、转移和致瘤性[10]。本文旨在介绍lncRNA在胃癌发生发展及靶向治疗中的研究进展(见表1)。
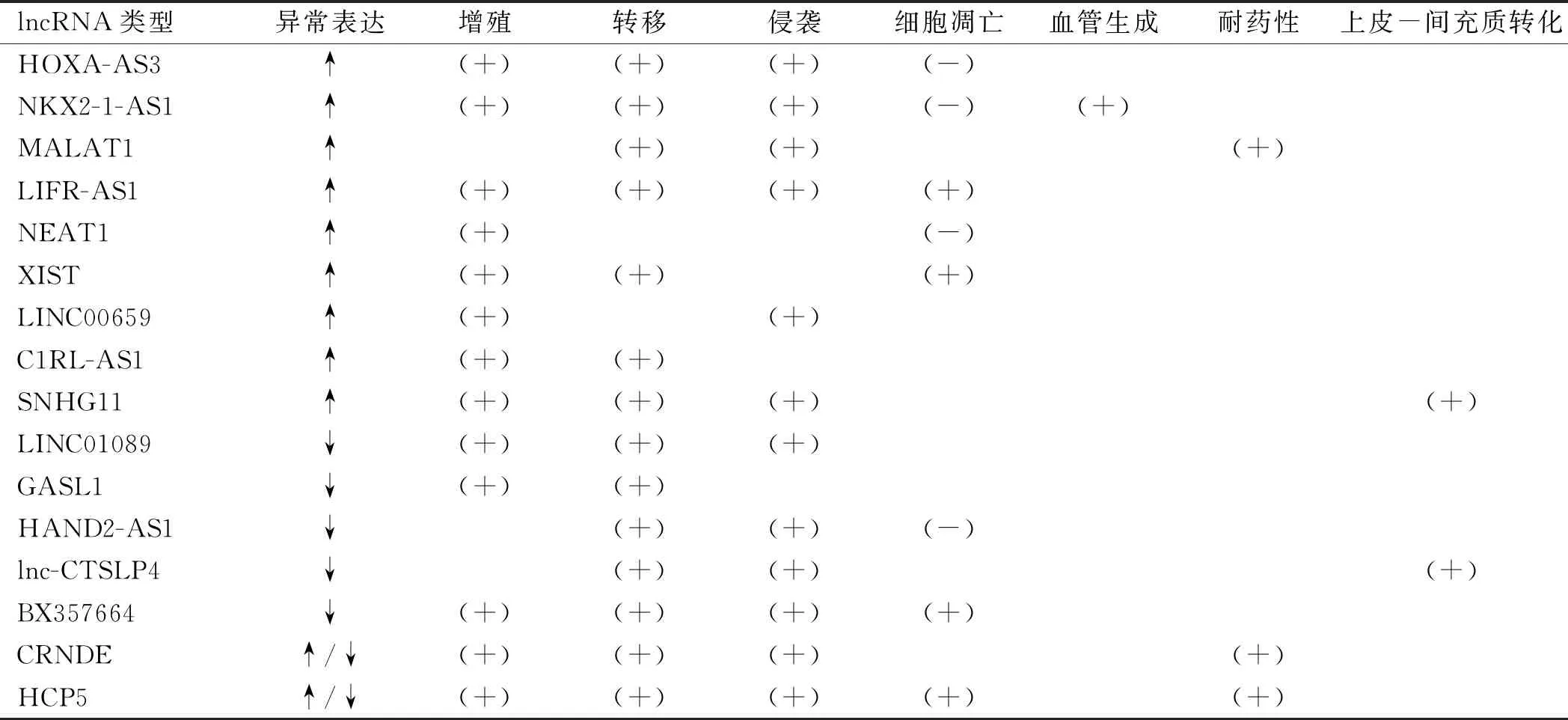
表1 本文所提及的lncRNA及其异常表达和调节的恶性行为
2 胃癌中上调的lncRNA
2.1 HOXA-AS3近期一项纳入了82对胃癌组织和配对癌旁正常组织的对照研究提示其在胃癌中起到调节作用,该研究发现胃癌细胞和组织中的HOXA-AS3表达显著上调,并且HOXA-AS3的水平与肿瘤大小、淋巴结转移、侵袭深度和幽门螺杆菌感染状态相关,而敲除HOXA-AS3抑制了胃癌细胞的体外增殖、迁移和侵袭以及体内肿瘤细胞转移。这一现象进一步肯定了HOXA-AS3的调节作用。他们还发现HOXA-AS3能够结合miR-29a-3p,从而调节LTβR的表达并调节胃癌中的NF-κB信号,从而为胃癌的治疗提供了新的靶向,也为早期胃癌的诊断提供了新的方向[11]。
2.2 NKX2-1-AS1Teng等[12]的研究通过对178例胃癌患者配对肿瘤/非肿瘤组织的qRT-PCR结果,发现NKX2-1-AS1在胃癌组织中上调,其下游靶点miR-145-5p表达下调,SERPINE1上调。对不同临床亚组的进一步分析表明,NKX2-1-AS1的过表达与肿瘤的TNM分期和淋巴结转移显著相关。此外SERPINE1高表达的患者表现出更短的总生存期(overall survival,OS)。而在NKX2-1-AS1敲除或过表达后,胃癌细胞的细胞周期和凋亡率无显著变化。这些临床数据分析均提示NKX2-1-AS1的过表达与胃癌相关,并可能在胃癌转移和肿瘤进展中起作用。NKX2-1-AS1和SERPINE1可能是胃癌患者的潜在预后预测因子。NKX2-1-AS1过表达可调节胃癌细胞的生长、迁移和侵袭;然而,它对胃癌细胞周期和凋亡可能无影响。此外,研究还发现NKX2-1-AS1在体内外均可促进胃癌细胞增殖和肿瘤血管生成,其机制可能是NKX2-1-AS1直接靶向下调miR-145-5p以上调SERPINE1,同时激活血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)信号通路,即NKX2-1-AS1/miR-145-5p/SERPINE1轴通过激活VEGFR-2信号通路调节胃癌的增殖、转移、侵袭和血管生成。这项研究表明,NKX2-1-AS1可能成为胃癌新的预后指标和潜在的治疗靶点。另有研究发现,NKX2-1AS1通过负向调节CD274/PD-L1和细胞-细胞相互作用来抑制癌细胞的迁移[13]。
2.3 MALAT1Dai等[14]的研究发现MALAT1高表达是胃癌患者OS的独立危险因素。MALAT1促进胃癌细胞迁移和侵袭。MALAT1可通过调节细胞周期中G1/S期的过渡促进胃癌增殖,影响细胞周期进程。机制水平上MALAT1可能通过PI3K/AKT通路参与胃癌的迁移和侵袭。进一步研究发现,MALAT1过表达可促进胃癌细胞对顺铂的耐药,提示其可能是预测胃癌化疗预后的生物标志物,但其导致顺铂耐药的机制在文中尚未明确。Zhu等[15]的研究发现,H2可显著抑制体内胃肿瘤的生长和胃癌细胞的增殖、迁移及lncRNA MALAT1和EZH2的表达,同时上调miR-124-3p的表达。MALAT1过表达消除了H2的所有上述影响。提示miR-124-3p可消除MALAT1促进EZH2的表达和胃癌细胞的增殖和迁移作用。Zhang等[16]的研究发现,敲除MALAT1可通过抑制ZFP91而上调miR-22-3p,从而抑制胃癌细胞生长和对奥沙利铂(Oxaliplatin,OXA)耐药,并诱导细胞凋亡,提示MALAT1/miR-22-3p/ZFP91轴在胃癌/OXA耐药过程中起重要调控作用。已有研究[17]发现,MALAT1有两个单核苷酸多态性(single nucleotide polymorphism,SNP),即rs619586和rs3200401。而Hong等[18]的研究发现,仅rs3200401与男性患者、分化型及肠型胃癌发生风险增加有关,而rs619586在任何按年龄、性别和临床特征分层的分析中均显示与胃癌风险无相关性。
2.4 LIFR-AS1LIFR-AS1在胃癌组织和细胞中的表达水平显著升高,miR-29a-3p的表达与LIFR-AS1的表达呈负相关。敲除LIFR-AS1可抑制胃癌细胞的增殖、侵袭和迁移,诱导胃癌细胞凋亡。其机制可能是LIFR-AS1通过下调miR-29a-3p促进了下游COL1A2的表达,进一步导致了胃癌的进展,可能成为胃癌的潜在治疗靶点[19]。Wang等[20]的研究提示,LIFR-AS1的高表达与肿瘤体积较大、淋巴结转移、较高TNM分期呈正相关。生存分析显示,LIFR-AS1表达升高与较短的OS和无病生存期(disease-free survival,DFS)相关。多因素分析进一步证实了高表达的LIFR-AS1是胃癌患者预后不良的独立预测指标。也进一步佐证了LIFR-AS1过表达促进胃癌的恶性行为这一观点。
2.5 NEAT1在胃癌中NEAT1的表达显著增加与较高的NEAT1水平提示预后不良。NEAT1沉默显著抑制体内和体外细胞增殖,并诱导细胞凋亡。NEAT1直接结合BRG1,调节GADD45A启动子中的H3K27me3和H3K4me3,以调节GADD45A依赖性G2/M细胞周期进程。BRG1在胃癌中显著上调并与预后呈负相关,提示NEAT1在促进胃癌发生中的重要作用,并表明NEAT1可能是胃癌的诊断和治疗靶点。其研究还发现NEAT1可能与BRG1和EZH2相互作用。其进一步研究则发现NEAT1不能影响BRG1的表达,说明NEAT1可能通过BRG1的协同作用促进胃癌增殖。其机制研究NEAT1可以通过直接与BRG1相互作用并将其招募到胃癌中GADD45A的启动子区来表观遗传地降低GADD45A的表达。调节GADD45A启动子的组蛋白甲基化,从而对胃癌进展发挥致癌作用。因此,NEAT1/BRG1/GADD45A轴可能成为有前途的胃癌治疗靶点[21]。Yang等[22]研究发现,miR-1224-5p在体外通过下调RSF1抑制胃癌细胞的恶性。NEAT1的表达水平与RSF1呈正相关,进一步研究发现NEAT1的调控功能是通过miR-1224-5p/RSF1轴来刺激胃癌细胞的进展。Ji等[23]的研究则发现,我国汉族人NEAT1的基因分型有四种SNP:rs550894、rs3825071、rs580933和rs7943779。其中仅rs3825071和rs7973779与胃癌风险增加相关。Gao等[24]的研究发现,NEAT1作为miR-365a-3p的分子海绵,抑制miR-365a-3p的表达,进一步通过上调ABCC4促进胃癌的疾病进展。
2.6 XISTLi等[25]的研究发现,在胃癌中降低XIST表达可抑制肿瘤形成能力、细胞增殖和迁移,促进细胞凋亡。过表达miR-132可在促进胃癌细胞凋亡的同时抑制肿瘤形成和细胞增殖,而沉默XIST可逆转miR-132对胃癌的抑制作用。进一步研究发现miR-132可以特异性地下调PXN表达。XIST可以竞争性地结合miR-132并上调PXN。已有研究发现过表达PXN可促进胃癌的成瘤能力、细胞增殖和迁移,但抑制细胞凋亡[26]。而XIST沉默则中和了PXN对细胞生长、迁移和致瘤性的促进作用以及对细胞凋亡的抑制作用。XIST的缺失可以通过上调miR-132和抑制PXN来抑制胃癌的进展。Li等[27]进一步研究发现,沉默的XIST在体外和体内均可抑制胃癌的进展。过表达的XIST和EPHA1对细胞增殖和侵袭有逆转作用。NF-κB通路抑制剂可抵消XIST介导的胃癌细胞增殖和侵袭作用。另外,此研究在机制层面揭示了XIST增加了HNF4A在EPHA1启动子区域的富集,从而促进了胃癌的恶化。Zheng等[28]的研究发现,敲除XIST可通过上调miR-337,进一步对JAK2的体外表达具有负调控作用,从而抑制胃癌细胞的增殖和迁移。
2.7 LINC00659有研究[29-30]发现,LINC00659可通过miR-342-3p/ANXA2轴促进结肠癌细胞。敲除LINC00659基因可通过抑制细胞周期进程和诱导细胞凋亡来显著抑制结肠癌生长而且可以加速奥沙利铂治疗后结肠癌细胞的凋亡。Sheng等[31]的研究发现,LINC00659在胃癌中高表达并与调控细胞增殖、促进细胞侵袭有关。相关性分析提示LINC00659表达水平与肿瘤分期、淋巴结转移呈正相关,而与年龄、性别和组织学分化无关。多因素回归分析显示,淋巴结转移、肿瘤分期、LINC00659表达水平是胃癌患者的独立预后预测指标。对细胞活力检测发现,si-LINC00659组细胞周期调控关键蛋白p21、Cyclin E、Cyclin D和CDK2的表达显著低于si阴性组。LINC00659可以通过促进SUZ12的表达来调控细胞周期和胃癌侵袭。实验发现,过表达SUZ12可以抵消LINC00659下调所造成的影响,细胞周期调控关键蛋白表达增加,且可激活PI3K信号。这些结果提示SUZ12可通过促进细胞周期蛋白表达和激活PI3K信号促进肿瘤的恶性行为,发现了LINC00659在胃癌中的作用机制。
2.8 C1RL-AS1Wu等[32]的研究发现,C1RL-AS1在胃癌组织中表达上调,进一步的体外功能检测表明,沉默C1RL-AS1可降低胃癌细胞的增殖和迁移能力,促进胃癌细胞的凋亡和衰老。随后对其机制研究表明Wnt/β-catenin参与了C1RL-AS1介导的信号转导。lncRNA C1RL-AS1可能通过AKT/β-catenin通路上调c-Myc发挥促进胃癌恶性表型作用。尽管有研究提示C1RL-AS1低表达组和高表达组的生存曲线有趋势差异[33],但差异无统计学意义。但此研究发现高表达C1RL-AS1的Ⅲ期胃癌患者比低表达的患者DFS和OS更短。临床病理特征分析显示,C1RL-AS1表达与pT分期和pN状态相关。这些均提示C1RL-AS1高表达与不良预后有关。
2.9 SNHG11已有研究发现,SNHG11在缺氧条件下通过上调HIF-1α靶基因如AK4、ENO1、HK2和Twist1的表达可促进结肠癌细胞迁移[34]。也可通过激活Wnt/β-catenin通路促进肺癌的生长及转移[35]。Wu等[36]的研究发现SNHG11在胃癌中的作用,其在胃癌中上调,且与患者预后不良有关。SNHG11在功能上促进了胃癌细胞的自噬,促进细胞增殖、干细胞分化、迁移、侵袭和上皮-间充质转化。SNHG11通过与Cullin4A(CUL4A)相互作用,诱导GSK-3β泛素化,进一步激活Wnt/β-catenin通路。另一方面,SNHG11以依赖ATG12的方式调节自噬,而SNHG11通过这两条途径参与胃癌细胞的恶性行为。因此,发现SNHG11是胃癌中的一种肿瘤相关lncRNA(onco-lncRNA),有可能成为胃癌的预后和治疗靶点。
3 在胃癌中下调的lncRNA
3.1 LINC01089Guo等[37]的研究发现,LINC01089在胃癌细胞中的表达明显下调,且LINC01089的低表达与肿瘤大小、T分期以及淋巴转移有相关性。过表达LINC01089显著阻碍了胃癌细胞的增殖、迁移和侵袭。这提示LINC01089在胃癌中是一种肿瘤抑制因子。其研究还发现胃癌组织中miR-27a-3p的高表达与较高的T分期显著相关,提示其可能促进了胃癌的进展。TET1在胃癌组织中的欠表达与肿瘤大小、淋巴转移和癌组织分化差显著相关。研究中发现其机制可能是LINC01089的下调导致了胃癌组织中miR-27a-3p的上调,而TET1是miR-27a-3p的下游靶点,进一步下调TET1的表达,这提示LINC01089/miR-27a-3p可能通过TET1调控胃癌进展。TET1在胃癌组织中的表达低于非肿瘤组织,敲除TET1可通过调控PTEN或p53-EZH2通路增强胃癌细胞的增殖、迁移和侵袭[38]。也有研究提示LINC01089作为miR-27a的ceRNA,可抑制SFRP1/Wnt/β-catenin信号通路,在细胞增殖和迁移中发挥重要作用[39]。这肯定了其作为非小细胞肺癌诊断和治疗的生物标志物的潜力。Wang等[40]的研究则提出LINC01089通过竞争性结合miR-145-5p来上调SOX9的表达,进一步促进了胃癌细胞的增殖。这些均肯定了LINC01089在肿瘤中的调节作用。
3.2 GASL1Liu等[41]的研究发现,GASL1可抑制胃癌细胞的增殖及转移,对其作用的机制研究发现GASL1可作为miR-106a的分子海绵,负向调控miR-106a的表达,并进一步抑制PI3K/AKT和ras/raf/MEK/ERK信号通路,发挥其作用。而其在胃癌中低表达,促进了胃癌细胞的增殖和转移。另有研究发现,GASL1通过抑制Wnt/β-catenin信号通路抑制胃癌生长,并通过ROC曲线分析评价血清GASL1在区分胃癌患者与正常对照者的诊断价值,发现低血清GASL1有作为胃癌诊断的生物标志物的潜在价值[42]。Wang等[43]的研究则提示,胃癌术后低表达的GASL1可减轻对TGF-β1的抑制作用,从而促进了胃癌的复发。
3.3 HAND2-AS1Yu等[44]的研究发现,HAND2-AS1在胃癌中低表达,可促进胃癌细胞迁移、侵袭,但抑制胃癌细胞凋亡。就其作用机制的研究发现miR-769-5p为HAND2-AS1的下游靶点,HAND2-AS1的低表达减轻了对miR-769-5p的抑制,从而进一步抑制miR-769-5p的下游靶点TCEAL7。TCEAL7是调控NF-κB通路的抑癌基因[45],为胃癌的治疗提供了新的靶点。
3.4 lnc-CTSLP4Pan等[46]通过43对胃癌组织与癌旁非肿瘤组织对比,发现胃癌组织中lnc-CTSLP4的表达明显降低,还发现其低表达与胃癌的EMT、迁移和侵袭相关。对其调节机制的研究提示lnc-CTSLP4与Hsp90a结合,通过募集ZFP91促进HNRNPAB蛋白的降解,进而抑制HNRNPAB介导的Snail及N-cadherin的蛋白表达来抑制胃癌细胞的EMT。多因素Cox分析提示lnc-CTSLP4是与OS相关的独立预后危险因素。lnc-CTSLP4是一种强大的EMT抑制因子,可能成为治疗转移性胃癌的替代靶点。
3.5 BX357664Liang等[47]检测50对胃癌患者癌组织和邻近非癌组织中BX357664的水平,发现胃癌标本中BX357664水平低于邻近的非癌组织,且与肿瘤大小和TNM分期相关。BX357664的上调抑制胃癌细胞的增殖、迁移和侵袭,但促进凋亡。BX357664作为miR-183-3p ceRNA来靶向和调节PTEN的表达并影响PI3K/AKT途径。这些结果表明BX357664可以通过miR-183-3p/PTEN/PI3K/AKT途径抑制胃癌的增殖和迁移,这可能成为未来胃癌治疗的潜在靶点。
4 表达尚有争议的lncRNA
4.1 CRNDEZhang等[48]的研究则发现,CRNDE在胃癌组织中低表达,且在自噬调节中起到关键作用,强调了CRNDE作为胃癌化疗耐药的潜在预后标志物和治疗靶点的意义。在基础化疗方案下,CRNDE高表达患者的预后明显优于CRNDE低表达患者的预后。CRNDE的表达与胃癌组织对化疗药物的敏感性呈正相关。而在机制水平上,CRNDE诱导蛋白酶体泛素化依赖的富含丝氨酸和精氨酸的剪接因子6(serine and arginine rich splicing factor 6,SRSF6)降解,SRSF6属于剪接因子SR家族,并有助于自噬诱导的胃癌细胞化疗耐药性。越来越多的证据表明,在化疗压力下,自噬可以促进癌细胞的存活,增加耐药性[49]。进一步研究表明,SRSF6的功能依赖于磷脂酰肌醇结合网格蛋白装配蛋白(phosphatidylinositol binding clathrin assembly protein,PICALM)的剪接。此外,此研究中对CRNDE功能和/或机制的研究表明,CRNDE可能通过与SRSF6结合并降低其蛋白质稳定性,从而减少PICALM mRNA的选择性剪接,在自噬介导的化学抗性中起关键作用。当胃癌患者在化疗过程中出现化疗耐药时,可以通过恢复CRNDE的表达来改善化疗效果。然而Du等[50]的研究发现,CRNDE高表达与浸润深度、TNM分期、淋巴结转移相关。CRNDE高表达促进胃癌细胞的增殖、侵袭和迁移,且预示胃癌患者显著预后不良。而机制上CRNDE可通过调控PI3K/Akt通路抑制细胞增殖、迁移和侵袭。已有研究发现miR-145通过下调人胃癌中的E2F3抑制肿瘤进展和转移,CRNDE通过抑制miR-145的作用,消除了miR-145诱导的E2F3抑制,参与调控胃癌细胞增殖、迁移和侵袭功能[51]。因此,CRNDE有望为胃癌的诊断和治疗提供新的治疗方法及靶点。
4.2 HCP5Chen等[52]通过qRT-PCR检测了62对胃癌组织及相应癌旁正常组织中HCP5的表达,发现与癌旁正常组织相比,胃癌组织中的HCP5明显下调。进一步研究发现HCP5表达与胃癌患者的OS呈负相关,并且明显抑制癌细胞侵袭。提示HCP5可以作为一种有前景的预后生物标志物。而对其作用机制研究则发现,HCP5可以与miR-106b-5p相互作用,部分阻断miR-106b-5p的作用,进而通过上调miR-106b-5p的靶基因p21抑制胃癌增殖、迁移和侵袭。因此,HCP5/miR-106b-5p/p21轴望成为临床应用于胃癌治疗的一个有前景的治疗靶点。Yin等[53]的研究发现,沉默HCP5可上调miR-299-3p,可进一步下调SMAD5,进而抑制胃癌细胞的增殖、侵袭、迁移,促进细胞凋亡。Zhang等[54]研究揭示了HCP5/miR-519d/HMGA1轴在调节胃癌进展和顺铂耐药中的作用。他们发现沉默HCP5可以通过在胃癌组织中减少对miR-519d的吸附,以降低HMGA1的表达,进而抑制了胃癌细胞的增殖,提高了对顺铂的敏感性。提示HCP5与胃癌的发展和化疗耐药性密切相关,为胃癌的治疗提供一种有前景的治疗选择。Wu等[55]的研究发现,HCP5过表达增强了胃癌细胞的增殖,而miR-3619-5p过表达则抑制了胃癌细胞的增殖,进一步研究发现miR-3619-5p与HCP5可相互作用,高表达的miR-3619-5p可抵消HCP5过表达对胃癌细胞化疗耐药的促进作用,说明miR-3619-5p在胃癌细胞中起化学增敏作用,HCP5通过miR-3619-5p调控胃癌细胞的化疗耐药。HCP5可减弱FOLFOX方案的抗肿瘤作用,提示靶向HCP5可能是提高胃癌化疗疗效,改善预后的一种新途径。
5 总结与展望
现阶段寻找新的具有高灵敏度和高特异度的生物标志物是筛查胃癌的又一方向,大量实验证实lncRNA的异常表达在肿瘤的发生发展过程中有其特有的调控机制,且在血液中可检测到其异常表达程度,这使得以一种lncRNA或几种lncRNA联合检测的结果实现诊断胃癌成为可能。然而lncRNA的异常表达在不同恶性肿瘤中是否具有特异性尚不能确定,所以仅仅依据其过表达或低表达也许并不能达到临床早期诊断的需求,在不同部位的肿瘤、同一部位不同病理类型及同一病理类型处于不同分期的肿瘤组织或血液中,lncRNA异常表达的程度是否不同,还有待进一步的研究证实。随着生物信息工程的发展与成熟的PCR等传统生物技术的结合,越来越多的lncRNA的作用机制已被发现,lncRNA的异常表达可影响肿瘤的恶性行为以及化疗耐药性,这提示通过对特定lncRNA表达的检测可以指导临床对胃癌的治疗方式,如放化疗方案、光动力治疗、内镜下切除或手术切除等,甚至以分子靶向药物逆转lncRNA的异常表达以改善胃癌的预后。部分lncRNA的异常表达程度在不同研究中提示不同结果,如HCP5,部分研究发现其在胃癌中过表达[55],另有报道[52]称其下调,这也提示了一种lncRNA以多种机制分别调节胃癌的侵袭、转移、耐药性等多种恶性行为,过表达与低表达也许可调节不同的恶性行为,也为接下来的研究提供了新的方向。
