长链非编码RNA与胆囊癌发生和发展以及化疗耐药的研究进展
2022-02-07胡小强
胡小强,陈 炜,
胆囊癌是胆囊上皮细胞来源的恶性肿瘤,位居消化系统恶性肿瘤发病率第6 位[1],全球胆囊癌发病率约为2/10 万[2],中国2014 年胆囊癌发病率为3.82/10 万[3]。虽然胆囊癌的发病率并非最高,但其恶性程度较高,5 年生存率仅为5%~15%[4]。手术切除仍是目前可治愈胆囊癌的唯一方法。大样本回顾性临床研究的结果显示,可手术切除胆囊癌患者的5 年生存率为39.6%,不可手术切除的晚期胆囊癌患者以及接受姑息性手术的胆囊癌患者的5 年生存率分别为5.4%和4.7%[4]。由于胆囊癌的早期症状不典型,因此不易被发现,常导致丧失最佳的手术时机。此外,针对中晚期胆囊癌的治疗方法有限,并且易发生远处转移和多药耐药[5]。因此,研究胆囊癌细胞的增殖、侵袭、转移和化疗耐药的机制尤为重要。
人类全基因组测序发现,在人类基因组中,仅有2%的序列是编码蛋白质的序列,其余98%的序列是不翻译蛋白质的非编码序列,而其中绝大多数可转录为长链非编码RNA(long noncoding RNA,lncRNA)。lncRNA 是指长度超过200 个核苷酸且不编码蛋白质的由RNA 聚合酶Ⅱ从独立启动子转录而来的RNA(尽管已经发现一些lncRNA 可以编码小分子肽)。与蛋白编码基因类似,lncRNA 的基因组位置以转录起始位点的H3K4 三甲基化富集以及整个基因体富集H3K36 三甲基化为特征。lncRNA 转录本由多个外显子组成,这些外显子通过典型机制剪接成熟,通常包括3’poly(A)和5’帽结构[6]。lncRNA 具有多种功能:(1)一些lncRNA 可与邻近基因相互作用,招募染色质修饰因子以增强或抑制转录,也可以影响其他染色体上基因的转录;(2)一些lncRNA 会形成亚核结构域,将某些蛋白质招募至这些位点,形成的结构域作为多功能基因调控结构,影响转录和转录后调控;(3)还有一些lncRNA 被输出至细胞质中,在细胞质中与特定的蛋白质相互作用,影响信号通路,调节特定mRNA 的翻译或充当“miRNA 海绵(miRNA spong)”,与miRNA 形成竞争性内源RNA(competing endogenous RNA,ceRNA)关系[7]。随着高通量测序和微阵列芯片等技术的发展,已发现肿瘤组织中存在大量异常表达的lncRNA,其中一些高表达且促进肿瘤发生和发展的lncRNA 被称为促癌lncRNA;相应地,低表达且抑制肿瘤发生和发展的lncRNA 被称为抑癌lncRNA。目前有关胆囊癌相关lncRNA 的功能学和机制学研究正不断深入,但仍有许多异常表达的lncRNA 的功能尚未厘清,有待进一步研究。本文围绕胆囊癌细胞增殖和转移相关lncRNA 以及化疗耐药相关lncRNA 的功能和作用机制进行综述,以期为临床诊治胆囊癌提供新的思路。
1 与胆囊癌细胞增殖和转移相关的lncRNA
逃避细胞凋亡、无限自我复制以及转移和浸润是恶性肿瘤的3 大基本特征[8]。随着研究的逐渐深入,越来越多的证据表明,多种lncRNA 在胆囊癌组织中表达异常,并且可以介导胆囊癌细胞的增殖、转移和侵袭等过程。多种lncRNA 与miRNA形成ceRNA 关系,共同调节癌基因或抑癌基因的表达,从而影响胆囊癌的发生和发展(图1)。
1.1 HOTAIR
HOTAIR 是首个被证明具有反转录调控作用的基因间区lncRNA,其在多种恶性肿瘤中高表达。TANG 等[9]通过应用shRNA 敲低胰腺癌细胞系中HOTAIR 的表达,可以抑制Wnt/β-cantein 信号通路,从而削弱上皮-间质转化,抑制胰腺癌细胞的转移和侵袭。DENG 等[10]研究证实,HOTAIR 可以通过抑制miR-34a 而激活JAK2/STAT3 信号通路,从而促进胰腺癌细胞的转移和侵袭。由此提示,HOTAIR 可能通过多种不同的机制影响胰腺癌的发生和发展。

Fig.1 Potential mechanism of kinds of long non-coding RNAs (lncRNAs) in gallbladder carcinoma (GBC).A: LncRNA,as a miRNA spong,regulates target gene expression via interacting with miRNA;B and C:Transcription factor binds to the promoter region of lncRNA gene and induces its transcription,and c-Myc and SP1 bind to the promoter region of HOTAIR and LINC00152 genes and induce their transcription respectively;D: FOXD2-AS1 could potentially recruit methyltransferase DNMT1 to the promoter region of the MLH1 gene and induce the resultant MLH1 transcription inhibition.CeRNA: Competing endogenous RNA.图1 胆囊癌相关lncRNA 的作用机制
通过检测65 例胆囊癌组织及其癌旁组织,MA 等[11]发现HOTAIR 在胆囊癌组织中高表达,并且与T 分期以及淋巴结转移均密切相关;通过在线转录因子预测软件发现HOTAIR 可能受转录因子c-Myc 的直接调节,在GBC-SD 细胞中敲低c-Myc 的表达或使其过表达,HOTAIR 在RNA 水平的表达与c-Myc 的表达呈正相关;进一步采用双荧光素酶报告基因实验和ChIP 实验,发现c-Myc 可以直接结合至HOTAIR 启动子区域,从而上调HOTAIR 的表达(图1B);此外,在下游机制方面,HOTAIR 的促胆囊癌活性是通过直接负性调节miR-103a 的表达而实现的。
1.2 LINC00152
LINC00152 又被称为细胞骨架调节RNA(cytoskeleton regulator RNA,CYTOR),其 在多种恶性肿瘤细胞中高表达,促进恶性肿瘤细胞的增殖和上皮-间质转化。在乳腺癌中,研究人员发现LINC00152 可以直接结合KLF5 并增强其稳定性;同时,KLF5 也可以直接结合至LINC00152 启动子区以激活后者转录,形成正反馈关系[12]。在胃癌中,LINC00152 通过结合EZH2 以调节CXCL9/CXCR3 轴介导的肿瘤组织中CD8+T 淋巴细胞的浸润[13]。在食管癌中,LINC00152 同样与EZH2 互相作用,通过提高ZEB1 的表达,增强食管癌上皮-间质转化以及对奥沙利铂的耐药[14]。
有研究发现,LINC00152 在胆囊癌中的表达水平显著升高,并且与肿瘤进展、淋巴结转移和TNM 分期相关。实验发现,LINC00152 能够明显促进胆囊癌细胞的增殖、转移和侵袭。机制研究发现,LINC00152 可以通过PI3K/AKT 通路以发挥促癌作用,并且转录因子SP1 可诱导其过表达[15](图1C)。
1.3 H19
H19 基因位于11 号染色体靠近胰岛素样生长因子2 基因的印迹区,在膀胱癌、乳腺癌和肺癌等多种恶性肿瘤中均为高表达,不仅与恶性肿瘤的生物学行为有关,还参与化疗耐药。H19 不仅与p53 以及基因组的稳定性有关,还与恶性肿瘤的上皮-间质转化有关[16]。LUO 等[17]发现H19 在膀胱癌组织中高表达,可与EZH2 相互作用,抑制E-钙黏蛋白的表达,激活Wnt/β-catenin 信号通路。乳腺癌研究发现,H19 在他莫昔芬耐药的乳腺癌细胞系和乳腺癌组织中均为高表达,敲低H19 的表达可以在体内外水平增强乳腺癌细胞对他莫昔芬的敏感性,并且证实H19是通过SAHH/DNMT3B 轴诱导自噬以增强乳腺癌细胞对他莫昔芬的耐药[18]。在三阴性乳腺癌中,H19 通过拮抗p53,提高肿瘤坏死因子α 诱导蛋白8 的表达水平,从而促进乳腺癌细胞的上皮-间质转化[19]。在获得性表皮生长因子受体-酪氨酸激酶抑制剂耐药的肺癌体外模型和组织标本中,研究人员发现H19 是一种表达显著下调的lncRNA,同时证实表达下调的H19 通过上调丙酮酸激酶M2 的表达且与之相互作用,促进AKT磷酸化,进而促进肺癌细胞对厄洛替尼的耐药[20]。
WANG 等[21]检测了35 例胆囊癌以及正常胆囊组织中H19 的表达水平,结果发现H19 的表达水平升高;进一步研究发现,H19 可以通过ceRNA 作用,负性调节miR-342-3p,共同作用于靶基因FOXM1 以促进胆囊癌细胞的增殖、转移和侵袭。
1.4 MINCR
MINCR 即Myc 诱导的lncRNA,最早于Myc 阳性淋巴瘤中被鉴定出来。研究人员利用Myc 诱导的细胞系以及有或无基因突变所致Myc 过表达的B 细胞淋巴瘤样本开展交叉RNAseq,结果发现13 种差异表达的lncRNA,其中一种在Myc 阳性淋巴瘤中与Myc 表达强烈相关的lncRNA 被命名为MINCR。敲低MINCR 的表达后,包括细胞因子调节激酶AURKA/B 和CDT1 等在内的细胞周期相关基因的表达均下调,因此MINCR 被认为是通过调节细胞周期相关基因的表达以调节细胞周期的进展[22]。在非小细胞肺癌中,MINCR 扮演着ceRNA 的作用,与miR-126 竞争性调节靶基因SLC7A5 的表达,从而促进非小细胞肺癌细胞的增殖和转移,并且抑制细胞凋亡[23]。在结肠癌中,MINCR 与miR-708-5p 构成ceRNA上调靶基因CTNNB1的表达,并且激活Wnt/β-catenin 信号通路,促进结肠癌的发展[24]。
研究人员发现,MINCR 在胆囊癌中同样为高表达,并且其表达水平与肿瘤大小、淋巴结转移和总生存率均密切相关;敲低MINCR 的表达可以显著抑制胆囊癌细胞的增殖、转移和侵袭,同时促进细胞凋亡。研究还发现,MINCR 与miR-26a-5p 可形成ceRNA 作用,调节EZH2 的表达,进而影响胆囊癌细胞的增殖和转移[25]。
1.5 PVT1
PVT1 在多种血液系统恶性肿瘤和实体瘤中均表现为过表达或拷贝数增加,是一种候选癌基因(candidate oncogene)。研究发现,PVT1 可以通过稳定核仁蛋白NOP2 以促进肝癌细胞的增殖,并且获得干细胞样特性[26]。在胃癌中,KONG 等[27]证实PVT1 与EZH2 相关,通过表观调节p15 和p16 基因的表达以促进胃癌细胞的生长。在胰腺癌中,研究人员发现PVT1 通过激活Wnt/β-catenin 信号通路和竞争miR-619-5p 以调节Pygo2 和ATG14 轴的自噬途径,从而促进胰腺癌对吉西他滨的耐药[28]。
通过对GEO(Gene Expression Omnibus)数据库和临床样本进行分析,发现PVT1 在胆囊癌中同样高表达,并且其表达水平与TNM 分期、远处转移和预后均密切相关。敲低PVT1 的表达后可以抑制胆囊癌细胞的增殖、转移和侵袭能力。进一步研究发现,PVT1 通过结合miR-143 并且抑制其表达,共同调节HK2 的表达,参与调节胆囊癌细胞的糖代谢[29]。还有研究发现,PVT1可以通过结合EZH2,将DNMT1 招募至miR-18b-5p 基因启动子区,通过DNA 甲基化抑制miR-18b-5p 基因转录;PVT1 与miR-18b-5p 相互竞争,共同调节HIF1α 的表达,进而调控胆囊癌细胞的增殖、转移和侵袭[30]。
1.6 FOXD2-AS1
FOXD2-AS1 是FOXD2 基因反义链形成的一个转录本。研究发现,在膀胱癌中,FOXD2-AS1 与AKT/E2F1 形成负反馈环。FOXD2-AS1与TRIB3 启动子区形成RNA-DNA 复合物,抑制TRIB3 基因的转录活性,促进E2F1 的表达,而E2F1 是细胞周期中G/S 期转变的重要转录因子。同时,E2F1 可与FOXD2-AS1 启动子区结合,增强FOXD2-AS1 的转录活性[31]。在结直肠癌中,FOXD2-AS1 通过与miR-185-5p 相互作用,促进结直肠癌的发生和发展[32]。
利用GEO 数据库进行分析,发现与癌旁正常组织相比,FOXD2-AS1 在胆囊癌组织中明显高表达,而敲减FOXD2-AS1 的表达后,可抑制胆囊癌细胞系GBC-SD 的增殖、转移和侵袭,促进细胞凋亡。机制研究发现,FOXD2-AS1 通过招募DNMT1 以促进MLH1 启动子区甲基化,从而抑制其表达,进而促进胆囊癌的进展[33](图1D)。
2 与胆囊癌化疗耐药相关的lncRNA
以吉西他滨为代表的一线化疗药物是局部进展期或转移性胆囊癌患者的主要治疗方法,但是往往化疗后不久即发生肿瘤迅速进展,或是出现复发和转移,与胆囊癌对吉西他滨耐药有关。肿瘤细胞耐药包括固有耐药和获得性耐药[34],涉及耐药基因突变、肿瘤细胞异质性和表观遗传学等机制[35]。研究发现,非编码RNA 在多种恶性肿瘤中介导肿瘤细胞的化疗耐药[36]。在胆囊癌中已发现与耐药相关的lncRNA,包括GBCDRlnc1 和SSTR5-AS1,其在胆囊癌的化疗耐药中扮演重要角色。
2.1 GBCDRlnc1
GBCDRlnc1 是一种新命名的lncRNA。研究人员首先构建了多柔比星耐药的胆囊癌细胞株,与多柔比星敏感细胞株同时进行测序,获得差异表达的lncRNA,其中GBCDRlnc1(ENST00000425894)是增强自噬活性以及与耐药潜能最相关的lncRNA,并且GBCDRlnc1 在胆囊癌中明显高表达,与预后显著相关。机制研究发现,GBCDRlnc1 与PGK1 直接相互作用,通过抑制PGK1 泛素化而上调其蛋白的表达水平,诱导细胞自噬以增强化疗耐药[37](图2A)。
2.2 SSTR5-AS1
SSTR5-AS1 是SSTR5 基因反义链的一个转录本。研究发现,SSTR5-AS1 在胆囊癌组织和细胞系中均表达升高,尤其是在吉西他滨耐药的胆囊癌细胞系中的表达显著升高,并且其表达水平与胆囊癌患者的生存率呈负相关。研究证实,SSTR5-AS1 通过抑制肿瘤细胞凋亡以促进吉西他滨耐药,而敲低SSTR5-AS1 的表达可以增强胆囊癌耐药细胞株对吉西他滨的敏感性。SSTR5-AS1 可与NONO 蛋白特异性结合,而NONO蛋白是一种参与转录调节和RNA 剪接的RNA 结合蛋白,可以通过蛋白酶体途径降解。SSTR5-AS1 通过与NONO 蛋白结合后抑制其降解,从而升高NONO 蛋白的水平,参与胆囊癌细胞的化疗耐药[38](图2B)。

Fig.2 The potential mechanism of chemoresistance-associated long non-coding RNAs (lncRNAs) in gallbladder carcinoma (GBC).A: GBCDRlnc1 promotes drug-resistance by interacting with PGK1 and inhibiting its ubiquitin-mediated degradation;B: SSTR5-AS1 enhances gemcitabine resistance via binding to NONO protein and inhibiting its degradation.图2 胆囊癌相关lncRNA 耐化疗机制
3 小结与展望
lncRNA 在恶性肿瘤的发生和发展中具有不可忽视的作用。越来越多的证据表明,lncRNA不仅在细胞的生长和分化以及胚胎发育等生理现象中扮演重要角色,也在恶性肿瘤的发生和发展中发挥关键作用。
lncRNA 在胆囊癌中的定位、表达、作用机制和功能的总结见表1。尽管数十年来的非编码基因研究已揭示出许多重要的lncRNA,但尚有大量潜在的lncRNA 有待发现和研究。胆囊癌是恶性程度极高的恶性肿瘤,目前治疗方法有限,治疗效果差。鉴于当前包括lncRNA 在内的非编码RNA 的高质量研究还较少,研究的深度和广度均不足,因此今后迫切需要开展更多高质量的研究以揭示胆囊癌的发生和发展机制以及转移、侵袭和耐药的机制,提高胆囊癌的治疗效果,延长患者的生存期。
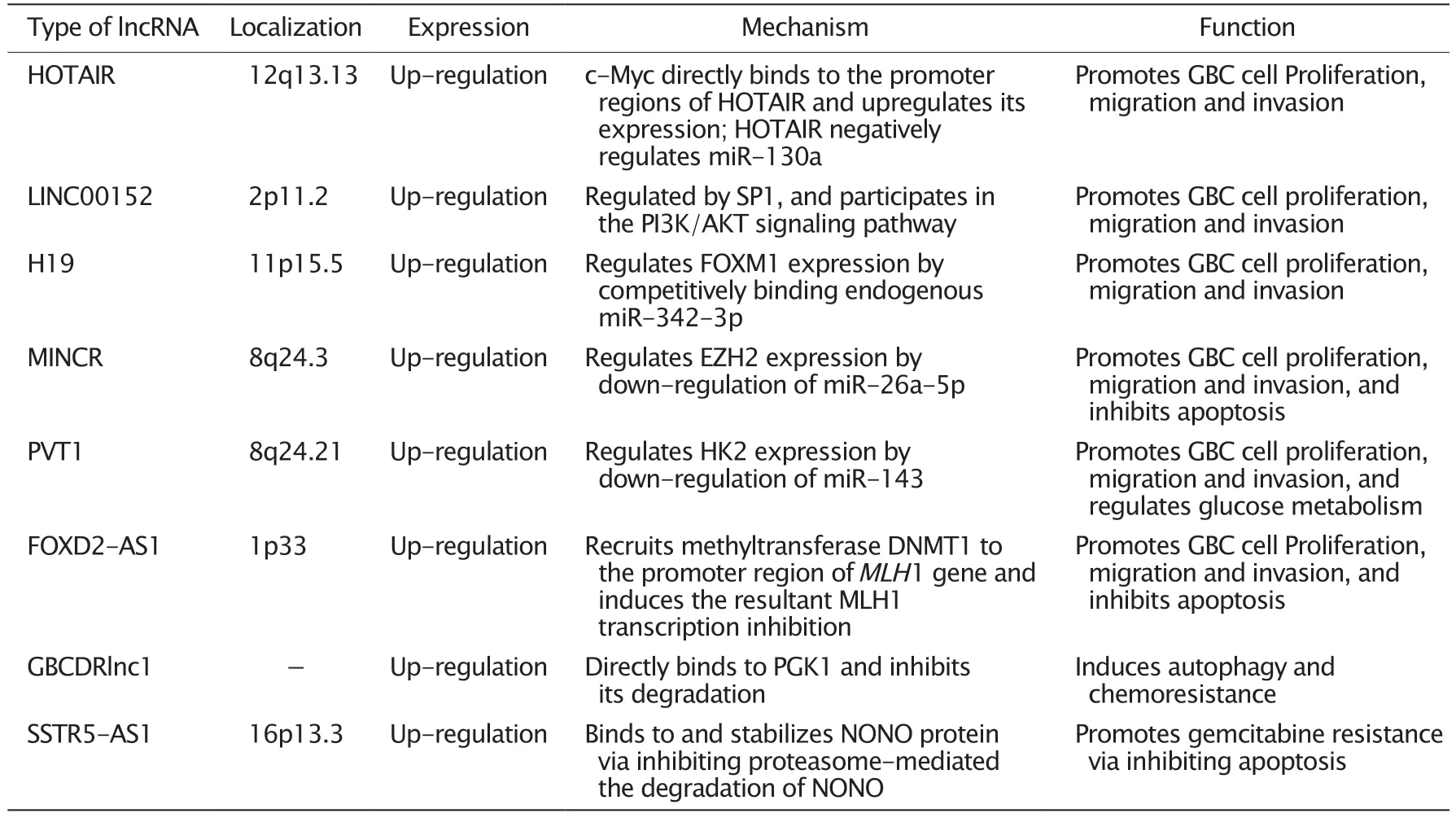
表1 lncRNA 在胆囊癌中的定位、表达、作用机制和功能Table 1 The localization,expression,mechanism and function of long non-coding RNAs (lncRNAs) in gallbladder carcinoma (GBC)
