中国恶性肿瘤整合诊治指南:胆囊癌
2022-02-07中国抗癌协会
中国抗癌协会
主 编:
李 强,姜小清
副主编:
彭承宏,刘颖斌,戴朝六,韩 风,胡 冰,罗 明,刘厚宝,李 斌
编 委(按姓名笔划为序):
邓侠兴(上海交通大学医学院附属瑞金医院)
王剑明(华中科技大学同济医学院附属同济医院)
王 鲁(复旦大学附属肿瘤医院)
左朝晖(湖南省肿瘤医院)
李升平(中山大学附属肿瘤医院)
刘厚宝(复旦大学附属中山医院)
李 强(天津医科大学肿瘤医院)
刘景丰(福建省肿瘤医院)
李 斌(海军军医大学第三附属医院)
刘颖斌(上海交通大学医学院附属仁济医院)
吴孝雄(上海中医药大学附属上海第七人民医院)
吴 泓(四川大学华西医院)
罗 明(上海中医药大学附属上海第七人民医院)
张 倜(复旦大学附属肿瘤医院)
周家华(东南大学附属中大医院)
罗祥基(海军军医大学第三附属医院)
易 滨(海军军医大学第三附属医院)
姜小清(海军军医大学第三附属医院)
胡 冰(海军军医大学第三附属医院)
殷晓煜(中山大学附属第一医院)
洪德飞(浙江大学医学院附属邵逸夫医院)
高 鹏(甘肃省人民医院)
崔云甫(哈尔滨医科大学附属第二医院)
曹 宏(吉林大学中日联谊医院)
黄建钊(贵州省人民医院)
韩 风(河南省肿瘤医院)
彭承宏(上海交通大学医学院附属瑞金医院)
曾 勇(四川大学华西医院)
戴朝六(中国医科大学附属盛京医院)
1 前言
胆囊癌(gallbladder cancer,GBC)可起源于胆囊底部、体部和颈部或胆囊管等多个部位,是严重威胁人类健康的恶性肿瘤。美国癌症联合会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union for International Cancer Control,UICC)对美国1989—1996 年10 705 例GBC 患者进行随访研究,结果发现随着肿瘤的进展,患者的总生存(overall survival,OS)呈显著下降趋势,5 年生存率由AJCC/UICC TNM 分期(第7 版)Ⅰ期患者的50%,下降至Ⅳa 期患者的4%以及Ⅳb 期患者的2%[1]。对中国10 个省市共15 家医院2010 年1 月—2017 年12 月共3 528 例GBC 患者的治疗结果进行汇总分析,结果显示总的5 年生存率仅为23.0%,可切除肿瘤占39.6%,晚期肿瘤未手术占5.4%,姑息性手术占4.7%[2]。随着整合医学理念的深入,对GBC 的诊治提出了更高的要求,不仅要从临床研究进展的角度进一步强调GBC 诊治的规范性,更要从整合肿瘤学的视角强调预防GBC 的重要性和迫切性,以及审视各种临床治疗措施对患者身心健康潜在的系统性影响[3]。
2 GBC 流行病学
GBC 约占胆道肿瘤的80%~95%,是最常见的胆道恶性肿瘤,其发病率存在显著的地域、人种和民族差异,全球范围内女性患者普遍多于男性患者[4-5]。
胆囊结石、胆囊腺瘤性息肉、胆管囊肿、胆管-胰管异常汇合、黄色肉芽肿性胆囊炎、瓷化胆囊和胆囊萎缩等胆囊慢性炎症[6-11]是已明确的GBC 危险因素。其他可能的危险因素还包括胆囊腺肌症、吸烟和代谢紊乱综合征(如糖尿病、高血脂和肥胖等)[12-14]。
祖国传统医学对GBC 的病因及发病机制的认识尚缺乏统一而完整的理论体系。癌邪理论认为恶性肿瘤存在特异性的独立致病因子的观点为认识恶性肿瘤的中医病因病机提供了新的视角,也为中医药治疗GBC 提供了理论依据[15]。
GBC 大体病理可见胆囊壁局部或全层增厚和硬化,局部腺瘤样占位病灶,或胆囊腔内有实性占位病变[16]。GBC 可起源于胆囊底部、体部和颈部或胆囊管等不同部位,并且不同起源部位和不同生长区域的GBC 显示出差异化的生物学特性[17-18]。肿瘤侵犯胆囊床肝组织,表现为肝组织内实性肿瘤灶。胆囊腺瘤性息肉及炎性疾病等良性疾病发生恶变时,胆囊良性及恶性病灶可共存于同一组织标本中,因此应尽可能多部位取材以免漏诊。显微镜下可见GBC 病灶主要起源于胆囊黏膜基底层[16],腺癌为其主要的组织学类型[16-18],包括非特指型腺癌、肠型腺癌、非特指型透明细胞腺癌和黏液腺癌[16],而其他组织学类型较少见,包括腺鳞癌、非特指型鳞状细胞癌、非特指型未分化癌、非特指型神经内分泌癌(大细胞性、小细胞性)、黏合性癌、黏液囊性肿瘤伴侵袭性癌和囊内乳头状瘤伴侵袭性癌[16]。细胞分化程度、侵犯层次以及周围组织和(或)淋巴侵犯和转移是影响GBC 患者预后的主要显微镜下因素[18-21]。研究发现,当肿瘤侵及肌层周围结缔组织而尚未侵透浆膜或进入肝脏时,肿瘤位于胆囊肝侧或腹膜侧在血管侵犯、神经侵犯和淋巴结转移等方面存在显著差异[22];胆囊颈和胆囊管的肿瘤与胆囊底和胆囊体的肿瘤的侵犯深度以及淋巴结转移也存在差异[23]。
随着GBC 基因组学研究的进展,发现HER2 等基因有望成为分子分型及精准治疗的靶分子[24-32],但是由于GBC 具有显著的异质性[33],分子分型尚难确立,因此仍需从染色体、基因组、转录组、蛋白表达和表观遗传学等多个层面及多个维度探索其发生和发展的机制以及其内在特性,从而区分不同亚型的特征,并且建立和完善GBC 的分子分型体系。近年来发展起来的肿瘤单细胞测序技术[34]和蛋白质基因组学[35]有望在揭示GBC 细胞异质性、肿瘤微环境以及基因型和表型间差异机制等方面提供更多的技术支持[36-37]。
3 GBC 的预防及筛查
各种原因导致胆囊的慢性炎症状态是GBC发生的明确原因和首要的风险因素。因此,避免、防范或根除胆囊慢性炎症是有效阻断胆囊炎-癌转化、预防GBC 发生最有效的措施。根据GBC发病机制和相关流行病学危险因素的研究进展,应对以下人群开展GBC 的影像学筛查以及开展积极的干预治疗。
3.1 胆囊结石
超声检查是胆囊结石最有效且最经济的影像学筛查手段。有研究揭示,中国城市20 岁以上人群胆囊结石筛查阳性率为4.6%,其中南方地区的胆囊结石筛查阳性率明显高于北方地区(6.1%vs3.8%)[38]。
对有症状的胆囊结石,无论是单发或多发胆囊结石,均建议行胆囊切除术。需要明确的是,部分胆囊结石或慢性胆囊炎患者的临床症状并非典型的“右上腹痛及(或)合并肩背部放射痛”,而往往主诉为“消化不良、定位不明的上腹不适”等。在排除可致此类症状的其他消化系统疾病之后,此种情况是胆囊切除术的适应证。
对无症状的胆囊结石,如果存在以下情况之一,建议进行胆囊切除。(1)单发结石直径超过3 cm;直径小于3 cm 的单发结石,影像学检查虽未见胆囊壁显著增厚(<3 mm),但是有胆囊结石家族史、年龄超过50 岁或合并多年的糖尿病,亦建议进行胆囊切除。(2)多发结石,具有结石脱落入胆总管下段引发胆源性胰腺炎的风险。(3)合并瓷化胆囊。(4)合并糖尿病。(5)影像学检查提示胆囊壁显著增厚,需要开展病理学检查以排除胆囊癌变,但基于肿瘤外科原则及穿刺活检的局限性,不宜进行术前胆囊穿刺活检,而需手术切除并行术中快速病理学检查以排除胆囊癌变。(6)影像学提示合并黄色肉芽肿性胆囊炎,虽无症状,但仍应立即进行手术切除和病理学检查以排除胆囊癌变。
基于以下原因,本指南不建议开展“保胆取石”术式。(1)胆囊结石的发病机制目前仍未明确。临床实践和荟萃分析的结果均表明“保胆取石”术后结石复发率较高[39-41],药物治疗亦无法避免结石复发,因此目前不建议开展。(2)结石复发以及反复进行“保胆取石”会增加患者痛苦以及医疗费用。(3)在胆囊结石的病因及疾病发展结局中,胆囊慢性炎症始终贯穿于疾病全过程,目前尚无证据表明“保胆取石”能够逆转术后结石复发以及胆囊慢性炎症病程。然而,“炎-癌转化”已被明确视为包括GBC 在内的多种肿瘤发生的重要机制。(4)胆囊结石是GBC 的首要危险因素[16,42-48]。鉴于GBC 的恶性程度极高、早期诊断困难、疾病进展迅速、辅助治疗手段匮乏以及预后极差的现实,微创切除患有结石的胆囊以避免癌变具有切实可行的现实意义和临床价值。
3.2 胆囊息肉样病变
超声检查也是胆囊息肉样病变的有效筛查手段,对部分超声检查难以明确息肉性质的人群,薄层增强CT 或MRI 检查能够提供更准确的诊断信息。
对有进食后右上腹饱胀不适和隐痛等临床症状的胆囊息肉样病变患者,通过有效的影像学检查排除息肉样病变为胆囊胆固醇结晶,或经利胆治疗后症状无明显缓解,则无论息肉样病变的大小,均建议行胆囊切除。
对于尚无症状的胆囊息肉样病变,如果存在以下情况,建议进行胆囊切除。(1)合并胆囊结石;(2)胆囊息肉样病变最大径超过10 mm(CT、MRI、超声内镜或超声造影检查)[49];(3)胆囊息肉样病变基底部宽大;(4)胆囊息肉样病变呈细蒂状囊内生长,血供较好,增强CT 检查可见息肉明显强化;(5)息肉样病变位于胆囊颈部或临近胆囊管开口。
此外,对尚不具备手术指征的无症状胆囊息肉样病变人群,应定期随访和复查。当存在以下情况时,建议进行胆囊切除。(1)年龄超过50 岁;(2)胆囊息肉样病变最大径小于8 mm,但对比1年内的影像学(CT 或MRI)复查结果,提示病变生长明显;(3)胆囊息肉样病变直径达6 mm,并且增强CT 检查可见明显强化,提示血供较好。
3.3 黄色肉芽肿性胆囊炎
黄色肉芽肿性胆囊炎本质上是一种具有特殊病理表现的胆囊慢性炎症。CT 检查可见胆囊壁内低密度结节影,大多合并胆囊床周围肝组织炎症[50],但常与侵犯肝脏的GBC 难以鉴别。病变位于胆囊壁内以及未破坏胆囊黏膜是其区别于GBC 的相对特征性影像学表现[51]。当合并高脂血症或糖尿病且影像学符合上述表现者,即使血清CA19-9 水平升高,仍不能排除黄色肉芽肿性胆囊炎的可能。如果体检怀疑黄色肉芽肿性胆囊炎,则应尽快实施胆囊切除,并根据术中快速病理学检查结果排除胆囊癌变[52]。由于同一胆囊的不同部位可能分别存在癌变组织和炎性组织,因此术中需要进行多部位取材以避免漏诊[53]。
3.4 瓷化胆囊
超声或CT 检查等发现瓷化胆囊时,即便尚无明确的临床争议,仍建议尽快实施胆囊切除,并据术中快速病理学检查结果以排除胆囊癌变。
3.5 萎缩胆囊
经超声、放射性核素和MRI 检查等明确胆囊已无功能,并且非急性炎症状态下胆囊壁增厚>1.0 cm,则建议实施胆囊切除,并且根据术中快速病理学检查结果以排除胆囊癌变。
3.6 胆胰管汇流异常和(或)先天性肝外胆管囊肿
如果未合并先天性胆管囊状扩张症,则超声筛查常难以发现或确诊胆胰管汇流异常,需经MRCP 或ERCP 等特殊检查方可确诊[54]。对确诊患者应实施手术治疗,特别是对合并胆囊腺瘤性息肉、胆囊结石、厚壁样慢性胆囊炎和瓷化胆囊等的患者,应尽快实施胆囊切除,并且通过胆肠端-侧吻合实现胆胰分流。如果无上述胆囊病变证据,则可据患者的年龄和身体状况,酌情实施手术治疗。
对于经影像学确诊的先天性肝外胆管囊肿,建议及早实施胆管囊肿切除和胆肠吻合,以杜绝胆囊或囊状扩张胆管癌变风险[55-56]。
4 GBC 的诊断
4.1 临床症状
GBC 患者早期多无明显的临床症状,合并胆囊结石或胆囊息肉的患者可有反复的右上腹饱胀不适等慢性胆囊炎的临床表现。中期或晚期GBC患者可表现为右上腹痛逐渐加剧。肿瘤转移至骨骼等其他部位时,可出现相应转移部位的疼痛和不适。如果肿瘤侵犯肝门部胆管,则可出现梗阻性黄疸。
4.2 实验室诊断
推荐开展血清CA19-9、CEA、CA125 和CA242 等多项肿瘤标志物的联合检测以提高诊断的特异度[57-59]。合并梗阻性黄疸时,可出现肝功能异常。
4.3 影像学诊断
包括超声、CT、MRI、内镜、PET-CT 和腹腔镜探查等在内的影像学检查是目前最有价值的GBC 临床诊断手段[60-61]。
超声检查作为体检筛查手段,能够尽早地发现胆囊壁增厚以及胆囊腔内软组织占位病灶和结石等。当合并胆管侵犯时,超声检查可显示胆道梗阻的水平。与肝门部胆管癌的胆囊空虚不同,GBC 侵犯肝外胆管时,胆囊多呈充盈状态,胆总管远端无扩张。超声检查还可用于评价肿瘤侵犯临近肝脏以及肝脏转移情况。超声检查对明确肿瘤是否合并胆道结石和胆管囊状扩张等也具有诊断价值。借助超声造影和超声内镜等诊断技术,能够有效提高良恶性胆囊疾病的鉴别诊断效能,对区域性淋巴结转移也具有一定的诊断价值[62-64]。
增强CT 可以提供肿瘤的位置和大小、是否合并肝脏侵犯、肝脏侵犯的层次、是否合并转移和血管侵犯、是否有区域淋巴结及远处器官转移等信息,对于鉴别胆囊腺瘤性息肉和GBC 具有一定的价值[65]。合并胆道梗阻时,CT 可以显示胆管的梗阻水平及范围。增强CT 评价肝动脉和门静脉侵犯的敏感度和特异度较高,对判断是否合并淋巴结转移有重要价值。利用薄层CT 图像进行三维可视化构建,对于了解肿瘤与血管和胆管的毗邻关系以及侵犯程度等解剖关系具有重要的价值。
相较于CT,MRI 对软组织的分辨率更高,并且能够通过特殊序列提供功能和代谢等影像学信息,在明确评估GBC 侵犯肝实质、转移和血管侵犯等方面等同于CT。当GBC 合并肝内或肝外胆管侵犯时,MRCP 对于了解胆道系统具有独特的价值,在胆道成像方面几乎可以替代PTC或ERCP,对于判断GBC 侵犯胆管系统的部位,进而设计手术方案,具有重要价值[66]。
PTC 造影或ERCP 适用于胆囊肿瘤侵犯肝门部或肝外胆管、合并梗阻性黄疸或胆管炎的情况,可酌情实施,但不建议单纯作为诊断手段。对于合并梗阻性黄疸的患者,可作为术前引流减黄的措施。由于PTC 导致胆道感染的概率低于ERCP,因此对于术前评估具有R0 切除机会的患者,建议优先选择PTC,可实现胆汁外引流和(或)内引流,并可进行胆道造影。对合并有胆管囊肿或胆胰管汇合异常危险因素的患者,ERCP 有助于明确诊断[67]。
FDG PET-CT 对于GBC 与胆囊腺瘤性息肉等良性疾病的鉴别诊断以及早期GBC 的确诊等,均具有重要价值[68]。在鉴别黄色肉芽肿性胆囊炎等炎性疾病与GBC 时,应警惕FDG PET-CT可能会出现假阳性结果[69-70]。由于GBC 极易发生淋巴结转移,因此正常大小的淋巴结可能已发生了转移,而增大的淋巴结也可能只是炎性增生,所以FDG PET-CT 对于诊断淋巴结或远隔器官的转移具有一定的价值。
对于因术前无法判断是否存在GBC 腹腔内广泛转移而无法确定根治性切除方案的患者,可考虑采用腹腔镜探查以明确相关情况。
4.4 术中病理学诊断
术中病理学诊断对于鉴别胆囊腺瘤性息肉和黄色肉芽肿性胆囊炎等胆囊良性疾病与GBC 具有重要价值[71-72],能够在术中明确有无超出区域淋巴结的转移或腹腔远隔部位的转移。胆囊颈部癌或胆囊管癌侵犯肝外胆管时,行肿瘤R0 切除联合肝外胆管切除时,需通过术中病理学诊断以排除胆管切缘阳性。
4.5 肿瘤分期
目前临床上常用的GBC 分期是按照AJCC/UICC TNM 分期[73],其基于病理组织学标准,术后评价局部和远处转移情况。肿瘤TNM 分期对于预后判断具有指导意义[74]。
4.5.1 原发肿瘤分期
根据肿瘤数目、血管侵犯以及肿瘤肝外直接侵犯等3 个主要因素进行肿瘤T 分期。TX:原发肿瘤无法评估;T0:无原发肿瘤证据;Tis:原位癌;T1:肿瘤侵及胆囊固有层或肌层;T1a:肿瘤侵及固有层;T1b:肿瘤侵及肌层;T2:肿瘤侵及肌肉周围结缔组织,尚未侵透浆膜或进入肝脏;T2a:肿瘤侵入胆囊脏腹膜侧肌周结缔组织,尚未侵透浆膜;T2b :肿瘤侵入胆囊肝侧肌周结缔组织,尚未侵及肝脏;T3 :肿瘤侵透浆膜(胆囊脏腹膜侧)和(或)直接侵及肝脏和(或)1 个其他的临近器官,如胃、十二指肠、结肠、胰腺、网膜和肝外胆管;T4 :肿瘤侵犯门静脉或肝动脉,或侵犯2 个或更多的肝外器官或组织。
4.5.2 淋巴分期
根据有无区域淋巴结转移进行肿瘤N 分期。区域淋巴结包括:肝门部淋巴结(包括沿胆囊管、胆总管、门静脉和肝动脉的淋巴结)、腹腔干旁淋巴结以及肠系膜上动脉旁淋巴结。NX:区域淋巴结无法评估;N0:区域淋巴结转移阴性;N1:1~3 枚区域淋巴结转移;N2:4 枚及以上的区域淋巴结转移。
4.5.3 M 分期
根据肿瘤是否发生除肝脏和十二指肠等邻近器官以外的远隔部位转移,对肿瘤进行M 分期。M0:无远隔器官转移;M1:存在其他远隔器官转移。
4.5.4 TNM 分期
结合T、N 和M 分期,形成CT 的TNM 分期[GBC AJCC/UICC TNM 分期(第8 版)],见表1。
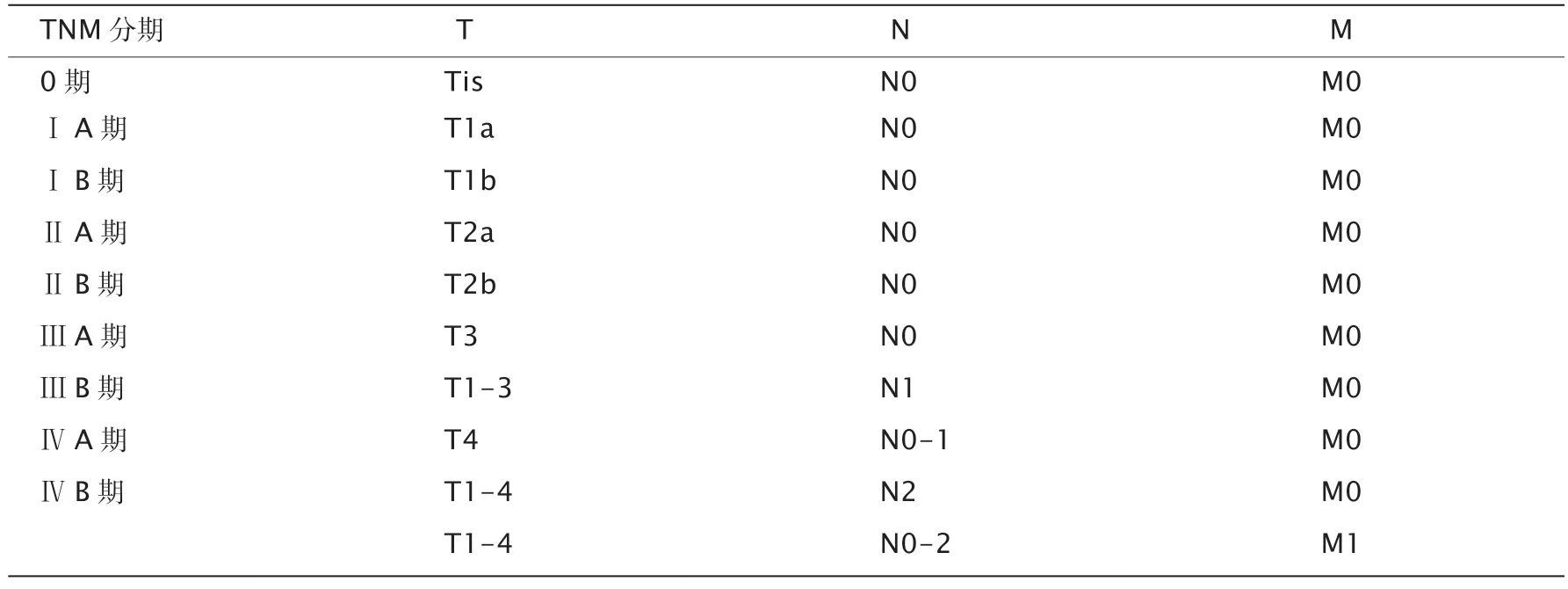
表1 GBC AJCC/UICC TNM 分期(第8 版)[74]
4.5.5 pTNM 病理学分期
pT 分期与T 分期对应。pN 分期与N 分期对应:pN0,区域淋巴结阴性(切除组织淋巴结检查至少需要达到6 个以上的淋巴结),如果区域淋巴结检查阴性,但检查的淋巴结数目没有达到要求,仍可归类为pN0;pN1,区域淋巴结切除标本阳性。pM 分期:pM1,镜下证实显示远处转移。
5 GBC 的治疗
5.1 外科治疗
5.1.1 术前特殊准备
5.1.1.1 胆道引流
当GBC 侵犯肝门部或肝外胆管以及合并梗阻性黄疸时,可行经PTBD 或ERCP 胆道引流,引流策略和方式应当根据所在医疗中心的条件进行选择,并且开展多学科整合诊治(MDT to HIM)讨论,按胆道引流原则共同制定方案。
鉴于GBC 恶性程度高以及易发生临近和远隔器官的转移,因此对于术前评估无需联合大部肝切除的患者,不建议常规实施术前胆道引流。在评估身体状况、营养状况以及肝肾功能等情况下,酌情尽快实施肿瘤规范化切除;如果上述状况不良,则可在胆道引流相关状况改善后,尽快实施肿瘤规范化切除。
对于梗阻性黄疸患者,如果手术方案拟行GBC 根治性切除联合大范围肝切除(≥4~5 个肝段)、术前血清总胆红素水平超过128.3~171 μmol/L(7.5~10 mg/dL)或有胆道感染且药物治疗无效,则建议进行术前胆道引流。根据血清总胆红素水平下降速率、肝功能恢复状况(各种肝脏代谢酶类、血清总蛋白、血清白蛋白和血清前白蛋白)以及患者是否合并肝炎或肝硬化等情况,进行肝储备功能等的综合评估,同时建议常规进行肝脏体积测定,了解拟切除肝段及残余肝体积,个体化地制订和实施肝切除术方案以及选择手术时机[75]。当血清总胆红素水平未能降至85 μmol/L(5 mg/dL)以下时,暂不建议实施手术。
采用PTBD 胆道引流方案时,如果GBC 侵犯肝总管或胆总管,可行肝左叶或肝右叶胆管穿刺置管引流,首选肝左叶胆管置管引流。如果GBC 侵犯右肝管,需要联合右半肝切除,而术前评估黄疸程度较严重且右肝体积较大,则直接行右半肝切除术后肝功能衰竭风险较高,术前仅进行选择性肝左叶胆管单侧胆道引流,肝功能恢复可能较为缓慢,应尽可能实施多根胆道穿刺引流以缩短减黄进程,尽快实施肿瘤根治性手术,以防止肿瘤转移。存在肝内多肝叶胆管炎时,应尽快实施多根胆道穿刺引流以缓解炎症,以期尽快实施肿瘤根治性手术以防止肿瘤转移。
尽管采用ERCP 进行胆道内引流[76]在舒适性以及恢复胆汁肠肝循环方面显示出优势,但是当GBC 侵犯肝门部胆管导致高位胆管梗阻时,进行ERCP 引起肝内胆道逆行感染的风险较高,并且在胆道内置管后难以评估受侵胆管段的范围,同时也因更易发生肝十二指肠韧带炎症,从而不利于术中开展区域淋巴结清扫,因此应根据所在医疗中心的技术实力,审慎决策。经内镜下肝内二级以上胆管分支的多根鼻胆管外引流能够降低高位胆管梗阻时ERCP 所致胆道逆行感染的发生风险,但是由于其对操作者的技术要求较高,因此建议根据所在医疗中心的技术实力,酌情实施。
5.1.1.2 营养支持治疗
当营养评估[77]GBC 患者存在明显的中至重度营养不良或其基础疾病和营养状况对重要器官的功能、免疫力、伤口愈合以及生存均存在显著影响时,应给予营养支持治疗。
营养支持治疗应以维持机体营养需求的最低量(预计为热卡和蛋白量的75%)为治疗目标,并根据营养评估状态、是否合并黄疸以及是否处于应激状态等,动态进行代谢状态和营养状况的监测评估,个体化制订营养治疗方案[78]。
5.1.1.3 术前新辅助治疗和转化治疗
术前放疗和化疗对于进展期GBC 患者并未显示出显著的生存获益,因此需要开展多中心的临床试验以明确GBC 术前新辅助和转化治疗的有效性及临床价值。
5.1.2 外科手术治疗
外科手术治疗是目前治疗GBC 最积极且最有效的手段,彻底清除癌组织能够为患者提供唯一治愈和长期生存的机会[2,22-23,74],应强调尽可能实施切缘阴性的GBC 根治术。
5.1.2.1 根治性切除的原则
基于胆囊解剖、临床相关研究和临床实践的结果,建议T1b 期以上的GBC 根治性切除应包括胆囊、临近胆囊床肝组织(肝切缘距胆囊2~3 cm 以上)和区域淋巴结[79]。对胆囊床肝侧生长的T2b 期以上的GBC,建议行肝脏Ⅳb段及Ⅴ段切除[80-90]。如果肿瘤侵犯至胆囊周围的肝外胆管、横结肠或大网膜等1 个临近器官,可扩大切除范围,并力求使各器官组织的切缘均为阴性[23,75,91-94]。如果肿瘤侵犯至胃、十二指肠和胰腺等1~2 个胆囊临近器官,或13a 组和8 组等转移淋巴结已深度侵犯胰腺段胆总管甚或胰头部,则虽然胰十二指肠等扩大切除范围的手术方案可能达到肿瘤R0 切除,但是鉴于GBC 高度恶性、辅助治疗效果不良以及预后极差的临床特点,扩大切除范围意味着需要承受更高的手术风险及术后并发症风险而不能显著改善预后,因此不建议常规实施[23,80]。血管侵犯不是手术的绝对禁忌证,可联合受侵的门静脉/肝动脉血管切除和重建。双侧门静脉支均被肿瘤侵犯或门静脉主干广泛的包绕或梗阻是R0 切除的禁忌证。联合受肿瘤侵犯的肝固有动脉主干或双侧肝动脉的切除并不是肿瘤切除的绝对禁忌证,但未重建肝动脉血流术后发生胆汁瘤和感染的风险较高,并且无明确证据显示可使患者的远期预后获益,因此建议慎重抉择。组织学证实的远处转移(腹腔、肺脏以及肝内多发转移等)和超出区域淋巴结(腹腔动脉、腹主动脉旁以及胰头后下淋巴结)的淋巴结转移,应视为R0 切除的绝对禁忌证。
5.1.2.2 腹腔区域淋巴结清扫
腹腔区域淋巴结清扫范围包括:肝十二指肠韧带淋巴结(12 组),根据与周围的关系可分为胆囊管旁(12c 组)、胆总管旁(12b 组)、门静脉后(12p 组)和肝固有动脉旁(12a 组)[94];沿肝总动脉旁淋巴结(8 组)[94]和胰腺后上(13a组)[95-96]。非区域淋巴结包括:腹主动脉(16 组)、腹腔干(9 组)、肠系膜(14 组)或胰前(17 组)和胰腺后下(13b 组)淋巴结。R0 切除须同时进行彻底的区域淋巴结清扫,有助于提供准确的肿瘤TNM 分期信息以指导后续治疗方案的制定以及预后的判断[97-100]。
当已确认存在非区域淋巴结转移时,进一步扩大淋巴结清扫范围对于预后改善的意义尚存争议[99-101],但更大范围的淋巴结清扫可提供更准确的分期信息。当实现区域淋巴结彻底清扫后,即肝十二指肠韧带和肝总管旁骨骼化清扫以及胰腺后上(13a 组)淋巴结切除,对于淋巴结的清扫数目不作强制要求。
进展期GBC 易侵犯毗邻脉管和神经并且发生转移,在进行脉管骨骼化区域淋巴结清扫时,联合切除动脉外鞘有助于减少肿瘤细胞残留,但需避免损伤动脉外膜,以防增加部分高龄或糖尿病患者术后发生假性动脉瘤和迟发性出血的风险。
5.1.2.3 经腹腔镜和机器人等腔镜外科GBC 切除术
由于存在腹膜转移[102-103]和窦道转移[104-106]风险、区域淋巴结清扫彻底性不及开放手术[107]以及缺乏前瞻性对照研究和大样本回顾性队列研究等高级别证据,早期阶段对于经腹腔镜和机器人等腔镜外科手术在GBC 治疗中的临床价值和适应证等,仍存在较大争议[106]。随着腔镜外科技术的发展,经腹腔镜GBC 切除术[108-109]和经机器人GBC 切除术[110-111]的安全性陆续得到证实,并且在手术时间、术中出血量和术后住院时间等方面显示出优势[112-113]。此外,单中心小样本研究报道,经腹腔镜GBC 手术的预后不劣于开放手术[109,114]。NCCN 2019 版将腔镜外科在GBC治疗中的作用仅归为明确切除前的手术分期[115]。2019 年,韩国专家共识建议对T1b~T3 GBC[GBC AJCC/UICC TNM 分期(第8 版)]实施切除应包括邻近肝实质整体切除的经腹腔镜根治性手术[116]。
虽然近年来腔镜外科技术已取得显著进步,但基于进展期GBC 极高的恶性生物学行为以及GBC 腔镜外科相关高级别证据尚不充分的现实,本指南建议经腔镜外科治疗GBC 应限于下述条件:治疗机构和团队具备较为丰富的经腔镜肝肿瘤和胰腺肿瘤切除的临床经验;肿瘤根治性原则应等同于开放手术遵循的原则;病例选择应避免肿瘤分期过晚的患者,对肿瘤已侵犯肝门区域高位胆管的病例尤需审慎;强调肿瘤整体切除及手术标本自腹腔完整取出原则,以避免术中气腹状态下因胆囊囊腔或瘤体破裂导致肿瘤细胞播散和转移。
5.1.2.4 意外GBC 的治疗策略
首先需要明确的是,诊断意外GBC 仅限于胆囊切除术前已行影像学和实验室检查且未获得GBC 诊断依据,但术中或术后病理证实为GBC。如果是因为术前肿瘤漏诊或误诊,则不能作出意外GBC 的诊断。对于意外胆囊底部或体部癌,病理学检查肿瘤分期为Tis 或T1a 期,如果术中未发生胆囊破裂及胆汁外溢,可定期复查随访;如果病理学检查发现肿瘤已侵犯至胆囊肌层(T1b期)或以上,则应再行肿瘤根治性切除术(临近胆囊床肝组织切除以及区域淋巴结清扫术)[106]。由于意外胆囊管癌的切缘往往为阳性,因此即便病理学检查显示肿瘤分期为T1a 期,仍具备再次手术指征。术中应联合肝外胆管切除和胆肠再吻合术。如果肝外胆管受肿瘤侵犯的范围有限,也可行受侵段肝外胆管切除和胆管对端吻合术。上述2 种方案均须行术中快速病理学检查以确保胆管切缘阴性[72,117]。
对于腹腔镜胆囊切除意外GBC,虽有报道指出再次根治术联合Trocar 窦道切除有助于延长无病生存期[118],但是更多的回顾性证据表明,与未联合窦道部位切除的人群相比,联合Trocar窦道切除的人群未见总体生存优势或无复发生存优势[119-120]。
再次根治术应在病理确诊后尽快实施,以初次术后1~4 周实施为宜[72]。术前应尽量获得前一次术中的具体信息(胆囊切除术中胆囊有无破损;是否保持胆囊完整并置入标本袋取出腹腔;肿瘤位于胆囊的位置,是否已侵及浆膜等)。
5.2 系统治疗
5.2.1 化疗
5.2.1.1 肿瘤R0 及R1 切除术后辅助性化疗方案
肿瘤R0 及R1 切除术后辅助性化疗的必要性和临床意义可参考BILCAP 研究和日本胆道外科学会相关研究的结果。
5.2.1.1.1 卡培他滨单药化疗方案
在BILCAP 研究中,对于肿瘤侵犯深度已达黏膜肌层及以上范围[GBC AJCC/UICC TNM分期(第8 版)T1b 期及以上)的R0 和R1 切除GBC 患者,术后给予卡培他滨单药化疗(1 250 mg/m2口服,2 次/d,第1~14 天,停用7 d;疗程间期为21 d,共治疗8 个疗程),结果显示化疗组患者的预后明显优于术后观察组[121]。
5.2.1.1.2 丝裂霉素C 联合5-氟尿嘧啶化疗方案
日本胆道外科学会的Ⅲ期胆管癌临床研究纳入GBC Ⅱ~Ⅳ期[即除T1(肿瘤侵犯深度未突破黏膜肌层)N0M0 之外的所有分期]的患者[122]。手术当日起,给予丝裂霉素C(6 mg/m2静脉输注)和5-氟尿嘧啶(310 mg/m2静脉输注)化疗,连续化疗5 d,第3 周重复上述化疗方案1 次;术后第5 周开始,给予5-氟尿嘧啶口服(100 mg/m2),连续治疗至肿瘤复发。结果显示,该方案可使实现R0 和R1 切除的GBC 患者的预后取得显著获益[123]。
5.2.1.2 晚期不可切除肿瘤或复发性肿瘤的治疗性化疗方案
晚期不可切除肿瘤或复发性肿瘤的治疗性化疗方案可参考ABC-02 Ⅲ期和JCOG1113 等研究的结果。
5.2.1.2.1 吉西他滨联合顺铂化疗方案(GC 方案)
基于ABC-02 Ⅲ期研究的结果,可采用吉西他滨(1 000 mg/m2静脉输注)联合顺铂(25 mg/m2静脉输注)化疗方案,1 次/周;每21 d为1 个疗程,最多化疗8 个疗程[124]。
5.2.1.2.2 吉西他滨联合S1 化疗方案(GS 方案)
基于JCOG1113 研究结果的GS 方案:吉西他滨1 000 mg/m2静脉输注d 1 和d 8,S-1 口服2 次/d(剂量根据体表面积确定:<1.25 m2,60 mg/d;1.25~1.49 m2,80 mg/d;≥1.50 m2,100 mg/d);每21 d 为1 个疗程,根据疾病进展及其程度或药物毒性以及患者意愿决定总疗程数[125-126]。
5.2.1.2.3 吉西他滨联合顺铂和白蛋白-紫杉醇化疗方案(GC+白蛋白-紫杉醇方案)
GC +白蛋白-紫杉醇方案:吉西他滨800~1 000 mg/m2静脉输注d 1 和d 8,顺铂25 mg/m2静脉输注d 1 和d 8,白蛋白-紫杉醇100~125 mg/m2静脉输注d 1 和d 8;疗程间期为21 d,直至疾病进展[127]。
5.2.1.2.4 伊立替康联合奥沙利铂、亚叶酸和5-氟尿嘧啶化疗方案(mFOLFIRINOX 方案)
mFOLFIRINOX 方案:第1 天,伊立替康180~150 mg/m2静脉输注,奥沙利铂85~65 mg/m2静脉输注,亚叶酸400 mg/m2静脉输注,5-氟尿嘧啶400 mg/m2静脉输注;其中,5-氟尿嘧啶自第1 天开始连续46 h 静脉输注,总剂量达2 400 mg/m2。疗程间期为14 d[128]。
5.2.1.3 进展期GBC 患者接受GC 方案或GS 方案治疗失败后的化疗方案
进展期GBC 患者接受GC 方案或GS 方案治疗失败后的化疗方案可参考ABC-06 研究的结果,即5-氟尿嘧啶联合亚叶酸钙和奥沙利铂化疗方案(FOLFOX 方案)。奥沙利铂85 mg/m2静脉输注d 1,L-亚叶酸175 mg 或亚叶酸350 mg 静脉输注d 1,5-氟尿嘧啶400 mg/m2静脉输注d 1;其中,5-氟尿嘧啶自第1 天开始连续静脉输注,2 d 内完成,总剂量达2 400 mg/m2。疗程间期为14 d[129]。
5.2.2 靶向治疗和免疫治疗
近期,有关GBC 表观遗传学的研究取得了较大进展,已陆续发现多个可能与GBC 靶向治疗和免疫治疗相关的靶基因及其信号通路[25,130-133]。MyPathway 篮子研究(多中心的开放2a 期临床研究)的结果证实,帕妥珠单抗联合曲妥珠单抗对已发生转移的HER2 阳性晚期GBC 患者有明显的生存获益[134]。
5.2.3 放疗
由于缺乏高级别证据,对于GBC 尤其是晚期GBC 患者仅进行放疗的价值尚未获得广泛共识,但GBC 和肝外胆管癌患者接受放疗联合卡培他滨或吉西他滨化疗的Ⅱ期临床研究已取得积极的结果[135]。对于存在非区域淋巴结、骨、腹壁和肝转移的GBC 患者,可实施个体化的姑息性辅助放疗。
5.2.4 姑息性介入治疗
对于晚期GBC 侵犯肝门部或肝外胆管的患者以及肿瘤切除术后肿瘤复发伴胆道梗阻的患者,经ERCP 或PTC 行胆道支架内引流可有效解除黄疸,改善患者的生活质量[76,136]。目前大多建议于肝外胆管内放置单根或多根金属覆膜支架以防止肿瘤过快生长而堵塞支架。然而,有研究证实GBC 因具有侵润性强和进展迅速的特点,采用金属支架置入的疗效并不优于塑料支架[137]。腹腔转移灶热灌注化疗对于控制肿瘤广泛转移以及恶性腹腔积液具有一定的治疗效果[138-140]。
5.2.5 中医药治疗
GBC 中医药治疗的总体原则为改善临床症状,提高机体抵抗力,减轻放化疗不良反应,提高生活质量。虽有观点支持中医药具有抗癌和延长生存期的作用,但是中医药对于GBC 的抗癌作用仅限于个案和经验报道,尚缺乏高级别证据的支持。
GBC 的中医证型复杂而多变,个体差异较大。不同的体质、阶段、并发症以及西医治疗方式均是影响证型及其变化的重要因素。总结临证经验,实证以肝郁气滞、湿热蕴结为主,虚证则以脾虚居多。
目前尚无代表性的针对GBC 的中药方剂。组方时,应遵循“君、臣、佐、使”原则,结合癌邪理论的组方思路,包括扶正组分、一般祛邪组分(常规的行气、活血、祛痰、化湿和清热等药物)和祛癌组分。祛癌药物根据不同证型,可选择白花蛇舌草和半枝莲等具有清热解毒、活血化瘀、消痰以及软坚散结之功的药物。此外,针灸、中医外治和中药注射液的辨证治疗可配合中药口服方剂进行补充或强化治疗。如果合并黄疸和肝功能不良时,应谨慎使用毒性较为明显的中药方剂。
6 康复治疗
GBC 患者在接受外科、介入或内镜等手术治疗后,可能存在与治疗方案对应的围手术期并发症发生风险。手术医师应在患者出院前对其进行相关康复知识的宣教;对已出院的患者进行密切随访和追踪;对住院期间已发生并发症或在院外发生并发症的患者,应及时给予专业性的指导和治疗方案建议。
对于GBC 侵犯肝门部胆管而实施胆道外引流的患者,应进行胆汁口服回输或改为胆道内引流,以防在院外因胆道外引流管护理不良而导致电解质丢失过多、体液紊乱以及肝肾功能障碍。
骨髓抑制和贫血是与几乎所有的化疗药物和免疫抑制剂相关的常见不良反应,康复干预对其具有重要的意义。化疗可导致血细胞减少、增加感染风险以及损害代谢功能,还会导致患者因疲乏不适等而放弃规范性治疗。临床医师应主动对接受化疗的GBC 患者进行用药指导和风险评判,并且根据随访结果,及时给予专业性的指导。
对于已接受根治性切除术的GBC 患者,根据中医“治未病”思想,应以预防肿瘤复发为目标。在放化疗期间,同时配合中医药治疗以减轻放化疗的不良反应。在靶向治疗和(或)免疫治疗期间,结合中医药治疗可以达到减毒增效的目的。在引流退黄期间,采用中医药治疗可以促进黄疸消退。在肿瘤终末期的对症支持治疗期间,中医药治疗能够改善患者的生活质量。
研究已经证实,低强度运动有利于血细胞计数的改善,适度运动不仅不会增加身体的负担,还能有效缓解肿瘤相关性疲劳。太极和瑜伽等相对舒缓的运动更有助于缓解肿瘤患者的焦虑和抑郁心态[141],因此应根据身体状况,鼓励患者尽快进行康复锻炼。
对于接受姑息性治疗或病程进展已至晚期的GBC 患者,采取营养支持联合运动(60 min/次,2 次/周)的多模式干预措施,虽然无法显著改善患者总的生活质量,但是能够减少恶心和呕吐等症状,增加蛋白质的摄入,从而改善患者的身心健康[142-143]。
