兰州百合多糖的酶解工艺及其体外抗氧化活性研究
2022-02-07惠和平张心驰李晓东李冠男刘颖楠
惠和平,王 萍,张心驰,蔡 伟,李晓东,李冠男,刘颖楠
(1.甘肃农业职业技术学院,甘肃 兰州 730020;2.甘肃中医药大学药学院,甘肃 兰州 730010;3.甘肃省中医院,甘肃省中医药研究院,甘肃 兰州 730050)
兰州百合(Lilium davidii var.unicolor Salisb.)为百合科(Liliaceae)百合属(Lilium)多年生草本球根植物[1],主要分布在我国甘肃省兰州市七里河地区。作为我国西部地区大面积种植的食用百合,其鳞茎硕大、鳞片丰满、口感甘甜,名列食用百合之首。兰州百合始载于《神农本草经》[2],具有较高的营养价值和药用价值,富含19种游离氨基酸和多种人体必需的微量元素,其蛋白含量是普通蔬菜的3~5倍,糖含量是普通蔬菜的10倍[3]。现代药理学研究表明,兰州百合多糖具有明显的增强免疫、抗疲劳、抗癌、提高耐缺氧等作用[4-7]。
近年来,天然源多糖因其生物活性丰富、无毒、生物可降解和生物相容性等而备受关注[8-10]。然而,大部分多糖的生物活性受到其理化性质和结构的影响,如分子量大、黏度高,水中溶解度低及结构复杂等问题,其开发和利用受到一定的限制。国内外报道[8,11-13]显示兰州百合多糖为杂多糖,含有β-1,4-葡糖糖、β-1,4-甘露糖和α-1,3-半乳糖等多种连接类型,结构复杂,分子量大(10万左右),黏度达81.698 cm3/g,这也导致兰州百合多糖的应用受限。有研究表明,多糖的活性中心可能是其中某几个多糖片段或寡糖[14-16],而降解多糖是目前获得分子量低、水溶性好、结构简单的高活性多糖片段或寡糖的主要手段。
酶解法,作为目前多糖降解的常用方法,具有专一性强、反应迅速、条件温和、得率高等优点,且能最大程度地保护反应底物的活性基团[17-19]。如李科等人[20]采用内切α-1,4-葡聚糖酶酶解黄芪多糖,获得了不同聚合度的寡糖组分,并且发现聚合度在10~18之间的寡糖活性强于多糖,可能为黄芪多糖的活性中心。Wu Q等人[21]运用响应面法优化了纤维素酶对黑木耳多糖的酶解,在获得最佳酶解工艺的条件下发现酶解后黑木耳多糖具有更好的抗氧化活性。杨玲[22]采用β-甘露聚糖酶酶解仙茅多糖,通过纯化得到仙茅寡糖XP1~XP5,并且发现三聚葡甘露寡糖XP3保留了仙茅寡糖的活性基团,其诱导巨噬细胞分泌IL-1的能力高于仙茅多糖X-2。β-甘露聚糖酶可以选择性降解1,4-连接的甘露葡聚糖和甘露聚糖等[22],而兰州百合多糖主要由1,4-β-D-吡喃甘露糖和葡萄糖组成。截至目前,没有关于酶降解兰州百合多糖的报道。因此,采用β-甘露聚糖酶降解兰州百合多糖,通过正交试验得到最佳酶解工艺,并对酶解前后兰州百合多糖的抗氧化活性进行了比较研究,以期为兰州百合多糖活性片段的制备及其高值化利用提供可行的技术路线和试验依据。
1 材料与方法
1.1 材料与试剂
百合,购自甘肃省兰州市七里河区上西园种植户,经兰州大学药学院马志刚教授鉴定为兰州百合(Lilium davidii var.unicolor Salisb.)。
β-甘露聚糖酶(6×104U/g),北京Solarbio生物科技有限公司提供;1,1-二苯基-2-苦基肼基(DPPH),(分析纯98%),上海源叶生物科技有限公司提供;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),(分析纯≥98%)、葡萄糖标准品,(分析纯≥99%),美国Sigma公司提供;3,5-二硝基水杨酸(DNS),(分析纯98%)、焦性没食子酸,(分析纯>99%),上海麦克林生化科技有限公司提供;过硫酸钠,(分析纯≥98%),天津市科密欧化学试剂有限公司提供;水杨酸、过氧化氢、七水硫酸亚铁,国药集团化学试剂有限公司提供,(分析纯≥99%)。
1.2 仪器与设备
DF-101S型集热式磁力加热搅拌器、DZF-6050型电热真空干燥箱、RE-2000A型旋转蒸发仪、DF-101S型恒温水浴锅,上海耀特仪器设备有限公司产品;SCIENTZ-10N型冷冻干燥机,宁波新芝生物科技股份有限公司产品;AnkeGL-16G-II型高速冷冻离心机,上海安亭科学仪器有限公司产品;UV-2800A型紫外可见分光光度计,尤尼柯(上海)仪器有限公司产品。
1.3 试验方法
1.3.1 兰州百合多糖的酶解工艺流程
兰州百合→捣碎→80%乙醇回流脱脂→滤渣抽干→热水提取→70%乙醇沉淀→离心取沉淀→冻干→兰州百合多糖→加水溶解→Sevag法脱蛋白→浓缩冻干→β-甘露聚糖酶酶解→灭酶→过滤取上清液浓缩→透析→冷冻干燥即得。
1.3.2 还原糖标准曲线的制作
精密称取葡萄糖标准品100 mg,加水定溶于100 mL容量瓶中。分别精密吸取葡萄糖溶液0,0.2,0.4,0.6,0.8,1.2 mL于25 mL容量瓶中,补蒸馏水至2 mL,分别加入3 mL DNS溶液,混合均匀后,90℃水浴加热7 min,取出后迅速冷却至室温,加蒸馏水定容至刻度,摇匀放置30 min,于波长540 nm处检测吸光度。以吸光度(Y)为纵坐标,葡萄糖质量浓度(X)为横坐标绘制还原糖的标准曲线,得出回归方程为Y=1.296 8X-0.049 5,相关系数R2=0.996 1。
1.3.3 单因素试验
取1.0 g兰州百合多糖为原料,在β-甘露聚糖酶的最适温度(50℃)和最适pH值(pH=4.8)条件下,考查底物质量分数、酶添加量和酶解时间对还原糖质量浓度的影响。
首先,固定酶添加量0.3%,酶解时间3 h,考查底物质量分数(0.05%,0.10%,0.15%,0.20%,0.25%)对还原糖生成量的影响,确定底物质量分数的试验水平;其次,固定底物质量分数0.15%,酶解时间3 h,考查酶添加量(0.1%,0.2%,0.3%,0.4%,0.5%)对还原糖生成量的影响,确定酶添加量的试验水平;接着,固定底物质量分数0.15%,酶加入量0.3%,考查酶解时间(1,2,3,4,5 h)对还原糖生成量的影响,确定酶解时间的试验水平。试验平行操作3次,通过统计软件分析确定底物质量分数、酶添加量和酶解时间3个因素的试验水平。
1.3.4 正交试验设计
兰州百合多糖酶解因素与水平设计见表1。

表1 兰州百合多糖酶解因素与水平设计
根据单因素试验结果,选择底物质量分数、酶添加量和酶解时间3个因素进行正交试验,每个因素分别选择3个水平(见表1),设计L9(34)正交试验(见表2),以还原糖质量浓度为考查指标,通过统计软件IBM SPSS Statistics 25分析确定兰州百合多糖酶解的最佳工艺。
1.3.5 还原糖生成量的测定
取冻干后酶解产物加蒸馏水配置成1 mg/mL的溶液,吸取0.1 mL,补蒸馏水至2 mL,依“1.3.2”方法下“分别加入3 mL DNS溶液,…”操作,按照公式(1)计算还原糖的质量浓度。

式中:X——样品溶液中多糖质量浓度,mg/mL;
V1——样品溶液浓缩后体积,mL;
N——稀释倍数;
V2——样品溶液浓缩前体积,mL。
1.3.6 体外抗氧化活性试验
(1)样品的制备。准确称取兰州百合多糖酶解产物和维C分别配制成质量浓度为4.00,2.00,1.00,0.50,0.25 mg/mL的溶液备用。
(2)DPPH自由基清除活性的测定。参考文献[23]测定DPPH自由基清除能力,按公式(2)计算清除率。

式中:A样——不同质量浓度的多糖溶液+DPPH储备液的吸光度;
A控——不同质量浓度的多糖溶液+50%乙醇的吸光度;
A空——蒸馏水+DPPH储备液的吸光度。
(3)ABTS自由基清除活性的测定。参考文献[24]测定ABTS自由基清除能力,按公式(3)计算清除率。

式中:A样——不同质量浓度的多糖溶液+ABTS储备液的吸光度;
A控——不同质量浓度的多糖溶液+蒸馏水的吸光度。
(4)羟自由基清除活性的测定。参考文献[25]测定羟自由基清除能力,按公式(4)计算清除率。

式中:A样——不同质量浓度的多糖溶液+FeSO4·7H2O溶液+水杨酸溶液的吸光度;
A控——不同质量浓度的多糖溶液+FeSO4·7H2O溶液+蒸馏水的吸光度;
A空——蒸馏水+FeSO4·7H2O溶液+水杨酸溶液的吸光度。
(5)超氧自由基清除活性的测定。参考文献[26]测定超氧自由基清除能力,按公式(5)计算清除率。
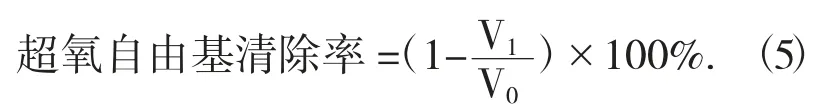
式中:V1——样品作用下邻苯三酚的自氧化速率,%;
V0——邻苯三酚的自氧化速率,%。
1.4 数据分析
所有数据均以“平均值±标准差”表示,采用Origin 2019b 64Bit绘图,IBM SPSS Statistics 25软件进行试验分析和方差分析,p<0.05或p<0.01表示差异具有统计学意义。
2 结果与分析
2.1 单因素试验结果
底物质量分数、酶添加量、酶解时间对兰州百合多糖酶解后还原糖质量浓度的影响见图1。
由图1(a)可知,随着底物质量分数的增加,还原糖质量浓度呈逐渐增加的趋势,在底物质量分数为0.2%时达最大,之后还原糖质量浓度随底物质量分数的增加反而降低。这可能是因为质量分数较低时,底物可以充分的溶解在溶液中,当质量分数再增加,底物的溶解趋于饱和。此时,增加底物质量分数还会导致溶液变黏稠。底物质量分数0.20%与0.25%对还原糖质量浓度的影响之间具有显著性差异(p<0.05),底物质量分数0.1%对应的还原糖质量浓度大于0.25%,且其对还原糖生成量的影响差异显著(p<0.05)。因此,选择底物质量分数为0.10%,0.15%,0.20%。

图1 底物质量分数、酶添加量、酶解时间对兰州百合多糖酶解后还原糖质量浓度的影响
由图1(b)可知,在酶解过程中,随着酶添加量的增大,还原糖质量浓度先增加后降低。当酶添加量增至0.4%后,还原糖质量浓度开始陡然下降。究其原因可能是在底物固定的情况下,随着酶的不断加入,起初底物在同一时间被分解得更充分,当酶添加量超过一定范围,就会达到饱和状态,底物的分解也就趋于完全。统计分析显示,酶添加量0.4%与0.3%之间对还原糖生成量的影响没有显著性差异(p>0.05),但其与酶添加量0.2%和0.5%之间对还原糖质量浓度的影响有显著性差异(p<0.05)。因此,选取酶添加量0.3%,0.4%,0.5%为宜。
由图1(c)可知,酶解时间为1~3 h时,还原糖质量浓度随着酶解时间的增加而增加。当酶解时间超过3 h,还原糖生成量反而下降。这可能是因为酶解的时间增加到3 h时,酶的活性达到最大,此后还原糖质量浓度因酶活性的下降而逐渐减小。相比其他酶解时间对还原糖质量浓度的影响,酶解时间3 h对还原糖质量浓度的影响显著(p<0.05)。综合考虑,选择酶解时间为2,3,4 h。
2.2 正交试验结果与分析
兰州百合多糖酶解正交试验设计与结果见表2。

表2 兰州百合多糖酶解正交试验设计与结果
由表2可知,各因素对还原糖质量浓度影响的次序为底物质量分数(A)>酶添加量(B)>酶解时间(C),说明影响还原糖质量浓度的主次顺序为底物质量分数、酶添加量、酶解时间。
方差分析结果见表3。
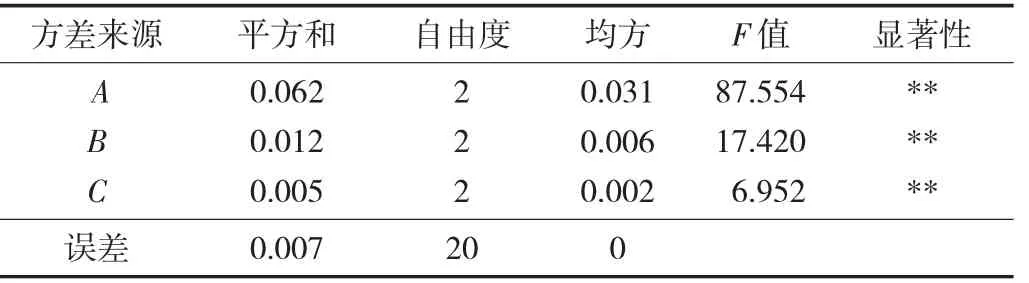
表3 方差分析结果
由表3可知,底物质量分数、酶添加量和酶解时间对还原糖质量浓度的影响均显著(p<0.01)。因此,3个因素A、B、C均选择还原糖质量浓度最大的水平,即A因素选择A3,B因素选择B3,C因素选择C3。故兰州百合多糖酶解的最佳工艺组合为A3B3C3,即底物质量分数为0.2%,酶添加量为0.5%,酶解时间4 h,以此条件进行3次验证试验,还原糖质量浓度为0.806 2±0.008 4 mg/mL。这说明优化后的酶解工艺稳定可靠,可以用来指导兰州百合多糖活性片段的工业化生产。
2.3 抗氧化活性试验结果
兰州百合多糖酶解产物清除DPPH自由基、ABTS自由基、羟自由基和超氧自由基能力结果图见图2。
由图2(a)可知,在试验浓度范围内,兰州百合多糖及其酶解产物对DPPH自由基的清除率随着质量浓度的增加而逐渐增加。当质量浓度为4.0 mg/mL时,酶解产物对DPPH自由基的清除率达39.75%,该值低于同质量浓度的维C(89.56%),但高于同质量浓度下兰州百合多糖对DPPH自由基的清除率(30.17%),这表明酶解还是提高了兰州百合多糖对DPPH自由基的抑制活性。由图2(b)可知,当质量浓度为0~4.0 mg/mL时,兰州百合多及其糖酶解产物对ABTS自由基清除率,表现出缓慢增加的趋势;在质量浓度为4.0 mg/mL时,兰州百合多糖及其酶解产物对ABTS自由基的清除率分别为18.39%和16.43%,它们的清除能力远弱于维C。但是,兰州百合多糖及其酶解产物对羟自由基的清除能力均很强,且随着质量浓度的增加,酶解产物对羟自由基的清除能力逐渐接近于维C,结果见图2(c)。当质量浓度为0.25 mg/mL时,酶解产物对羟自由基的清除率已超过50%,高于同质量浓度下维C和兰州百合多糖对羟自由基的清除率。当质量浓度增加至4 mg/mL时,酶解产物对羟基自由基的清除率达92.18%,明显高于兰州百合多糖对羟自由基的清除率(69.16%)。兰州百合多糖酶解产物对超氧自由基的清除能力低于维C但远高于兰州百合多糖的清除能力,尤其是低浓度时,结果见图2(d)。从清除曲线看,酶解提高了兰州百合多糖对4种自由基的清除能力,尤其是对羟自由基和超氧自由基的清除能力(p<0.05),这与Wu Q等人[21]的研究结果相似。

图2 兰州百合多糖酶解产物清除DPPH自由基、ABTS自由基、羟自由基和超氧自由基能力结果图
3 结论
研究采用β-甘露聚糖酶对兰州百合多糖进行酶解,在底物质量分数、酶添加量、酶解时间3个单因素试验考查的基础上,利用L9(33)正交试验优化兰州百合多糖的酶解工艺,以期获得兰州百合多糖的活性片段。结果表明,3个因素对还原糖质量浓度的影响顺序为底物质量分数>酶添加量>酶解时间,底物质量分数、酶添加量和酶解时间的适当增加均能显著增加还原糖质量浓度(p<0.05),兰州百合多糖酶解的最佳工艺为底物质量分数0.2%,酶添加量0.5%,酶解时间4 h,酶解温度50℃,酶解pH值4.8。在此条件下,兰州百合多糖酶解后还原糖质量浓度为0.806 2±0.008 4 mg/mL,结果稳定、可靠,可用于指导兰州百合多糖活性片段的制备。体外抗氧化活性评价表明,兰州百合多糖酶解产物对DPPH自由基、ABTS自由基、超氧自由基和羟自由基均具有较强的清除能力,且呈质量浓度依赖关系。尤其是对羟自由基,酶解产物对其清除能力明显高于未经酶解的兰州百合多糖的清除能力;随着质量浓度的增加,酶解产物对羟自由基的清除能力更趋近于维C的清除能力。这可能是因为酶解不但减小了多糖的分子量,降低了其黏度,增加了其水溶性,而且使多糖的活性中心得到了充分的释放[16,27],具体原因有待进一步研究。研究结果为兰州百合多糖在食品、医药和化妆品等领域的再开发利用及工艺化生产提供一定的理论指导。
