电针对睡眠剥夺模型大鼠学习记忆能力和Beclin1、LC3B、PI3K及Akt的影响❋
2022-02-06游明灿陈新旺游言文
游明灿, 陈新旺, 游言文, 郝 莉
(1.郑州大学第一附属医院, 郑州 450052;2.河南中医药大学第三附属医院, 郑州 450003;3.河南中医药大学医学院, 郑州 450046)
睡眠剥夺(sleep deprivation,SD)是指由多种原因引起的个体睡眠时间减少。SD是现代社会普遍存在的问题,影响着全世界数百万人的生活[1]。研究表明,SD可引起人的学习记忆能力下降[2-5]。海马是与学习记忆相关的重要脑区[6]。SD可通过神经炎症、氧化应激、细胞凋亡和自噬等病理机制引起海马神经元的损伤[7],进而影响学习记忆。目前,尚未有改善SD的有效药物。因此,寻找安全、有效治疗SD的方法成为当务之急。
自噬是一种细胞内受损细胞器和蛋白质降解并回收利用的过程,它有助于维持细胞正常结构和生理功能[8],但过度自噬又可导致细胞损伤。已有实验证实,SD能使神经元发生过度自噬,继而引起细胞凋亡和死亡。抑制神经元过度自噬和凋亡,可改善SD小鼠的认知障碍[9]。有学者提出,调节磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信号通路,可减少海马神经元过度自噬和凋亡,减轻神经损伤,从而改善SD相关的学习记忆障碍[10,11]。另外,抑制小鼠海马神经元过度自噬,同时激活PI3K/Akt信号通路,可改善SD小鼠的学习记忆障碍[12]。
针灸作为一种传统的中医疗法,已成为世界上应用较广泛的替代医学疗法之一,而且具有并发症少、安全性高和费用较低等优势。近年来,针灸已用于SD的临床治疗,可改善患者的认知功能,减轻临床症状[13]。但是其中具体的分子作用机制尚未阐明。因此,本研究拟通过体内实验观察电针百会和大椎穴对改良多平台水环境法,诱导建立SD模型大鼠学习记忆能力的改善作用和对肌球蛋白样BCL2结合蛋白(myosin-like BCL2 interacting protein,Beclin 1)、微管相关蛋白1轻链3 B(microtubule-associated protein 1 light chain 3 Beta,LC3B)、PI3K和Akt的影响,以期为电针临床应用于治疗SD奠定相应的理论和实验基础。本研究通过河南中医药大学第三附属医院医学伦理委员会批准(批号LLBH-20210309)。
1 材料与方法
1.1 动物
SPF级雄性Sprague Dawley大鼠27只2月龄,体质量(260±20)g,由河南省实验动物中心提供,实验动物许可证号SCXK豫2017-0001。动物饲养于河南中医药大学东明路校区动物房中,环境温度为(22±2)℃,相对湿度50%~60%,昼夜12 h光照/12 h黑暗,动物可自由进食和进水。
1.2 主要试剂及仪器
一抗Beclin 1(货号ab207612)、LC3B(货号ab48394)、PI3K(货号ab139307)、Akt(ab179463)、磷酸化Akt(phosphorylated Akt,p-Akt)(货号ab81283)、二抗(货号ab6721),英国Abcam公司;内参(货号BA0056),武汉博士德生物工程公司;TRIzol试剂(货号15596026),美国Thermo公司;逆转录试剂盒(货号RR037)、RNA扩增试剂盒(货号RR420),大连Takara公司;蛋白定量试剂盒(货号PC0020、凝胶试剂盒(货号P1200),北京索莱宝科技有限公司;转印膜(货号IPVH00010),美国Millipore公司;超敏化学发光液(货号KE0101),北京密码子生物公司。
G6805型电针仪,苏州医疗用品厂有限公司;0.30×25 mm型针灸针,苏州医卫材料公司;63031型Morris水迷宫、F6774型Y迷宫,深圳瑞沃德生命科技有限公司;SMART3.0型行为学视频追踪软件,美国Harvard Apparatus公司;Minilys型组织研磨仪,法国BT公司;1510型酶标仪、ES-A01-NanoDrop 2000/2000c型紫外分光光度计,美国Thermo公司;ABI7500型实时荧光定量PCR仪,美国Applied Biosystems公司;GL-150型恒温加热仪,海门其林贝尔仪器制造有限公司;HM325型石蜡切片机,美国Thermo公司;BX53型显微镜,日本奥林巴斯公司;VE-180型垂直电泳槽、VE-186型转移电泳槽,上海天能科技有限公司;Universal Hood Ⅲ型蛋白印迹检测系统,美国Bio-Rad公司。
1.3 分组与模型制备
将27只2月龄雄性Sprague Dawley大鼠按照随机分配原则分为对照组、模型组和电针组每组各9只,采用改良多平台水环境法诱导建立SD大鼠模型[14]。此方法是指大鼠进入快速眼动睡眠时肌张力下降,可落入水中。由于大鼠恐水,落水后会尽全力爬上平台,所以可达到睡眠剥夺。设备包括一个110 cm × 60 cm ×40 cm鼠箱,内置15个直径6 cm、高8 cm的圆形平台,平台间隔15 cm。每天实验开始前,向箱内注清水至平台下约1 cm处,水温(23±2)℃。实验开始前3 d,每天把大鼠放于平台上适应2 h。实验时让大鼠每天在平台上停留20 h(前一天下午2∶00—第二天上午10∶00)[15,16]持续7 d。大鼠可在平台间穿梭和停留,并可自由摄食和饮水。对照组大鼠在直径18 cm的大平台水环境中饲养(由于平台大,大鼠通常不会落入水中),其余条件同改良多平台水环境法。
1.4 干预方法
本研究中选穴定位依据中国中医药出版社出版、郭义主编的《实验针灸学》(新世纪第四版)。百会位于顶骨中点,大椎属督脉,位于第七颈椎棘突与第一胸椎棘突之间。电针组治疗于每天同一时间进行,选用直径0.30 mm、长25 mm的毫针,直刺或斜刺进针后针柄连接电针仪输出端,刺激参数选用连续波、频率2Hz、电流1 mA,刺激强度以大鼠四肢轻微抖动为度,每次15 min,每日1次,连续7 d。对照组使用大平台水环境,模型组使用改良多平台水环境法造模,电针非穴位即在百会和大椎穴旁4 mm处,连接电针仪但不通电。
1.5 检测指标和取材
1.5.1 Morris水迷宫测试 Morris水迷宫是通过强迫大鼠游泳,让其学习寻找隐藏在水中的平台。本研究用于评价电针对大鼠海马依赖性空间学习记忆能力的影响。该系统由圆形水池、自动录像记录系统及分析软件三部分组成。圆形水池的直径和高分别为120 cm和50 cm,水池分4个象限,其中一象限中放置一直径和高分别为12 cm和32 cm的平台。实验第2天开始水迷宫测试,每天在固定时间进行。测试前向水池注入清水,水面高于平台1 cm,温度(23±2)℃,并加入奶粉搅拌至平台不可见。采用SMART 3.0行为学视频追踪软件记录大鼠逃避潜伏期。
第1天到第5天进行定位航行实验,用于检测大鼠空间学习能力。实验开始前把大鼠放入水中熟悉环境5 min,实验时将大鼠分别从4个象限面向池壁放入水中,记录其找到平台的时间即逃避潜伏期。若能找到平台,让大鼠在平台停留15 s。若未能在1 min内找到平台,则将其引导至平台并停留15 s,逃避潜伏期记为60 s。平台在定位航行实验结束后移走。
第6天进行的空间探索实验用于检测大鼠空间记忆能力。将大鼠于原平台所在象限的对面象限面向池壁放入水中,记录分析大鼠穿越平台次数和目标象限停留时间百分比。
1.5.2 Y迷宫测试 Y迷宫用于评价每组大鼠工作记忆能力。Y迷宫由三个长度相等的臂组成,相邻臂之间的夹角为120°。将动物放在Y迷宫中心,让其在安静环境下探索5 min。大鼠连续进入3个不同的臂即为1次准确交替,自发交替准确率=[准确交替次数/(进臂总次数-2)]/100%,使用SMART 3.0软件记录和分析数据。
1.5.3 组织取材 行为学测试结束后,分别用20%(质量/体积)乌拉坦进行腹腔注射麻醉,每组6只大鼠冰上快速取脑,用眼科镊分离两侧海马组织。分别置于离心管中冻存-80 ℃,用于实时荧光定量PCR和免疫印迹法检测。
另外每组剩余3只大鼠麻醉后打开胸腔,暴露心脏及右心耳。沿心尖注入预冷生理盐水,并迅速剪开右心耳进行灌注。肝脏颜色逐渐苍白,更换预冷4%多聚甲醛,由快到慢直至大鼠四肢抖动僵直、尾巴翘起即停止灌注。断头取全脑,将脑组织放入固定液中,常温下4%多聚甲醛固定24 min,用于免疫组织化学法检测。
1.5.4 实时荧光定量PCR检测大鼠海马Beclin1、LC3B、PI3K和Akt 的mRNA表达 冰冻海马组织加入1 mL总RNA抽提试剂TRIzol研磨,低温离心取上清并提取RNA,采用紫外分光光度计测量总RNA浓度,接着进行逆转录。表1示,引物设计均由上海生工合成。按照试剂盒说明书进行扩增,反应条件为95 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s,35个循环,72 ℃延伸10 min。每个样品均做3个平行孔,以GAPDH为内参,采用2-ΔΔCt法分别计算Beclin1、LC3B、PI3K和Akt的mRNA相对表达量。

表1 实时荧光定量PCR引物序列
1.5.5 免疫组化法检测大鼠海马Beclin1和LC3B的表达 将组织从固定液中取出,依次进行梯度酒精脱水,将浸好蜡的组织进行包埋,修整包埋后的蜡块并切片厚度4 μm,切片放入二甲苯和酒精中脱蜡至水。用3%过氧化氢封闭以灭活内源性过氧化物酶。然后将组织切片置于修复盒中,微波炉进行抗原修复。切片上滴加配好的一抗Beclin 1(1∶200)和 LC3B (1∶200),湿盒内4℃过夜。清洗后加入二抗(1∶400),室温孵育1 h。显微镜下观察并采集图像,采用Image-Pro Plus 6.0软件分析平均光密度。
1.5.6 免疫印迹法检测大鼠海马PI3K、Akt和p-Akt蛋白表达 取冰冻海马组织加入裂解液、蛋白酶抑制剂和磷酸酶抑制剂中,研磨至裂解液中无明显块状组织。4℃离心10 min收集上清液检测浓度,并将蛋白100℃电加热5 min使其完全变性。每个泳道分别取20 μg蛋白加入聚丙烯酰胺凝胶上进行电泳。取出凝胶,与PVDF膜和滤纸进行转膜。
转膜后使用脱脂奶粉封闭1 min,清洗后加入使用5%脱脂奶配制的一抗PI3K(1∶1000)、Akt(1∶1000)、p-Akt(1∶1000)和β-actin(1∶2000),4℃下孵育过夜,加入二抗室温孵育1 min。加ECL超敏化学发光液进行曝光成像,使用Image J软件和β-actin作为内参分析比较。
1.6 统计学方法

2 结果
2.1 电针对SD大鼠空间学习记忆能力的影响
在定位航行实验的第5天,与对照组比较,模型组大鼠逃避潜伏期延长(P<0.05);电针治疗可使SD模型大鼠逃避潜伏期缩短(P<0.05)。空间探索实验结果表明,与对照组比较,模型组大鼠穿越平台次数和目标象限停留时间百分比下降(P<0.05);电针治疗可使SD模型大鼠穿越平台次数和目标象限停留时间百分比上升(P<0.05)(见表2)。

表2 各组大鼠Morris水迷宫实验结果比较
2.2 电针对SD大鼠工作记忆能力的影响
各组大鼠总进臂次数无明显差异(P>0.05)。与对照组比较,模型组大鼠自发交替准确率明显降低(P<0.05),电针治疗可使SD大鼠自发交替准确率增加(P<0.05)(见表3)。

表3 各组大鼠Y迷宫实验结果比较
2.3 电针对各组大鼠海马Beclin1、LC3B、PI3K和Akt mRNA表达的影响
与对照组比较,模型组大鼠海马组织中Beclin1和LC3B的mRNA表达水平升高(P<0.05),PI3K mRNA表达降低(P<0.05);与模型组比较,电针组大鼠海马组织中Beclin1和PI3K的mRNA表达分别下降和增加(P<0.05),而LC3B mRNA水平有下降趋势(P>0.05)。另外,各组间Akt mRNA表达差异无统计学意义(P>0.05)(见表4)。

表4 各组大鼠海马Beclin1、LC3B、PI3K和Akt mRNA表达比较
2.4 电针对各组大鼠海马CA1区Beclin1和LC3B蛋白表达的影响
自噬主要相关蛋白Beclin-1和LC3B主要位于海马CA1区神经元细胞质中,阳性表达呈现深黄色或褐色(图中红色箭头所指)。免疫组化结果显示,与对照组比较,模型组大鼠海马CA1区神经元胞质着色呈现深黄色或褐色,有大量阳性细胞;电针治疗可使SD大鼠海马CA1区神经元胞质中的Beclin-1平均光密度减少(P<0. 05),而 LC3B平均光密度有减少的趋势(P>0. 05),这与Beclin1和LC3B的mRNA结果基本一致(见表5图1)。

表5 各组大鼠海马CA1区Beclin1、LC3B平均光密度比较
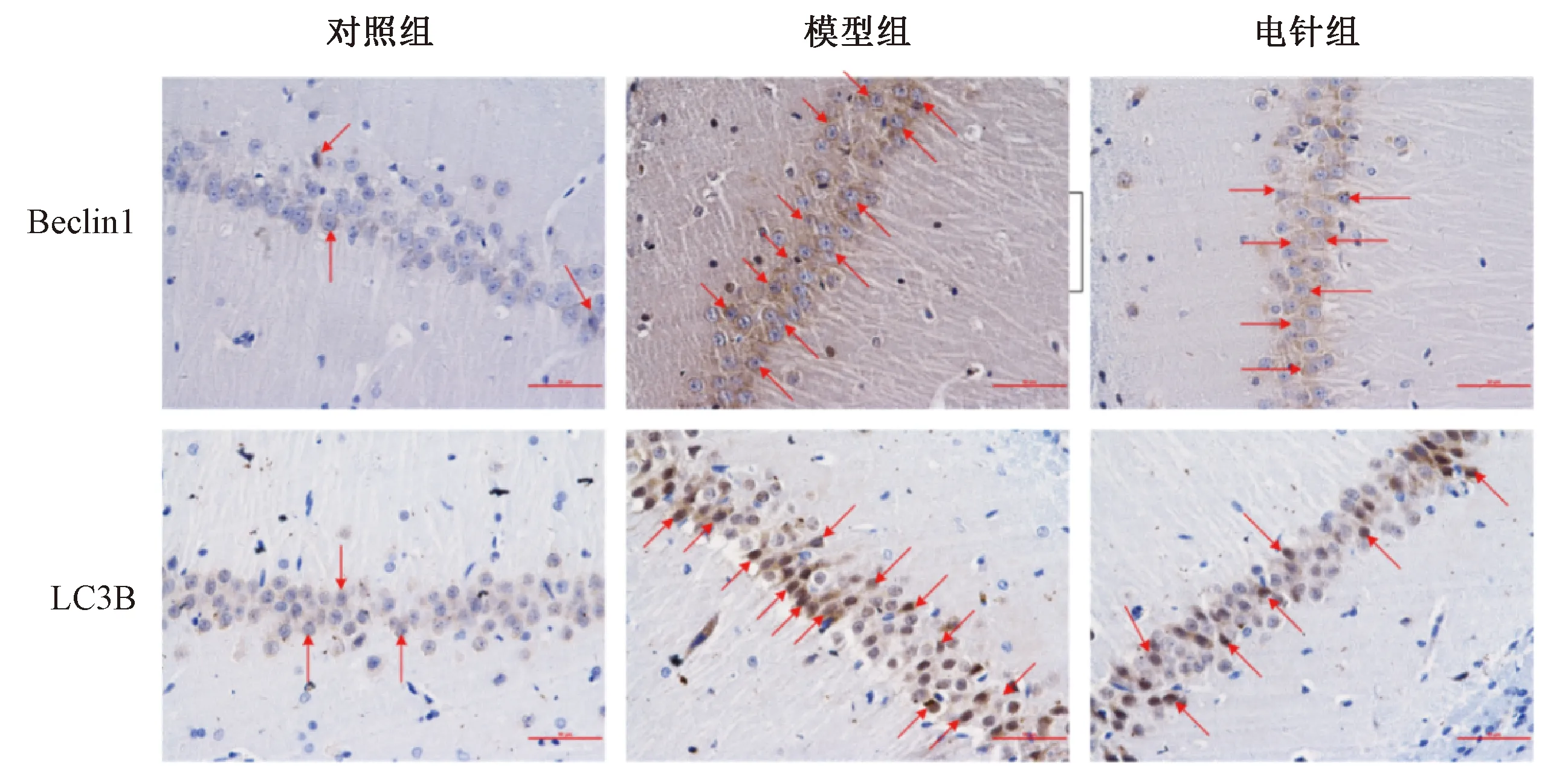
图1 各组大鼠海马CA1区Beclin1和LC3B蛋白表达比较(50 μm)
2.5 电针对大鼠海马PI3K、Akt和p-Akt蛋白表达的影响
与对照组比较,模型组大鼠海马组织内PI3K和p-Akt /Akt表达水平降低(P<0.05);与模型组比较,电针组大鼠海马组织PI3K和p-Akt /Akt水平增加(P<0.05)(见表6图2)。
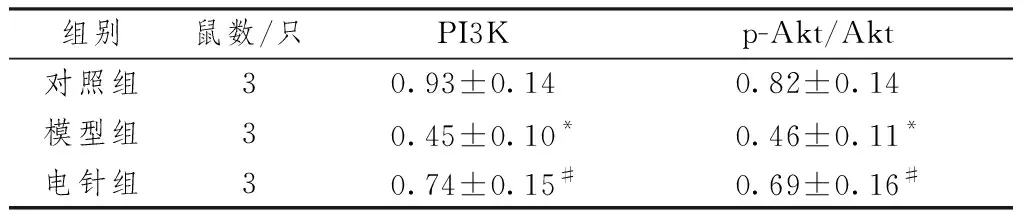
表6 各组大鼠海马PI3K、p-Akt/Akt比较

图2 各组大鼠海马PI3K、Akt和p-Akt蛋白表达
3 讨论
SD属于中医学失眠和不寐等范畴[17],其引起的学习记忆障碍属于中医学善忘和呆症等范畴。百会属督脉,督脉是诸阳经之汇,对整个经脉系统有统帅作用。百会穴可振奋阳气、安神定志和醒脑开窍[18,19]。大椎穴又名百劳穴,汇聚手足三阳的阳热之气与督脉的阳气上行头颈[20]。本研究选用电针百会和大椎穴干预SD模型大鼠,观察到电针百会和大椎穴可增强改良多平台水环境法诱导建立的SD大鼠模型学习记忆能力,而且这种改善作用可能与激活PI3K/Akt信号通路,降低自噬相关基因Beclin-1表达水平相关。
Morris水迷宫和Y迷宫是检测学习记忆的重要行为学方法[21,22]。结果显示,电针治疗可缩短SD模型大鼠在Morris水迷宫中的逃避潜伏期,增加穿越平台次数和目标象限停留时间百分比,提高Y迷宫中自发交替准确率,这说明电针百会和大椎穴可改善改良多平台水环境法诱导建立的SD模型大鼠的学习记忆能力。
Beclin-1和LC3是自噬的关键标志物,常用于评价自噬水平,其中Beclin1主要募集蛋白质与PI3K形成复合物,并引导其他自噬相关蛋白定位于自噬体膜,促进自噬体膜的形成[23]。而LC3位于自噬体表面,是自噬体的关键标志物[24]。LC3包括A、B和C 3个亚基,常通过检测LC3B来衡量LC3的表达。SD病理改变与细胞过度自噬密切相关。SD相关的学习记忆能力被认为是海马依赖性的。因此,研究假设电针增强改良多平台水环境法诱导建立的SD大鼠模型学习记忆能力与降低海马神经元自噬水平相关。为验证这一假设,分别采用实时荧光定量PCR和免疫印迹法检测海马Beclin-1与LC3B的mRNA和蛋白表达。结果显示,电针治疗可降低海马Beclin-1的mRNA和蛋白水平,同时有下调LC3B mRNA和蛋白表达的趋势,提示电针改善SD大鼠学习记忆可能与降低海马神经元自噬水平相关。
已有研究发现,PI3K/Akt信号通路参与调节神经元自噬,其活性下降可导致SD细胞自噬过度和细胞凋亡[10,11]。激活PI3K/Akt信号通路能够防止SD中神经元凋亡和丢失,具有神经保护作用[25,26]。为进一步探讨PI3K/Akt信号通路在电针改善SD模型大鼠认知障碍,降低海马神经元自噬水平中的作用,本研究又通过实时荧光定量PCR和免疫印迹法,分别检测PI3K和Akt的mRNA和蛋白表达。结果表明,与对照组比较,改良多平台水环境法诱导能够降低SD大鼠海马PI3K和Akt的mRNA与蛋白水平,说明SD中PI3K/Akt通路活性降低,这与文献结果一致[27,28]。另外,Akt有2个主要的磷酸化位点Thr308和Ser473,激活Akt主要依赖于Ser473的磷酸化[29]。本研究中,磷酸化位点为Ser473的p-Akt在SD大鼠海马表达降低,而电针逆转了这种降低;然而,Akt的表达没有明显改变,表明Akt是通过磷酸化发挥作用的。本研究观察到,电针可使SD大鼠模型海马中的PI3K mRNA和蛋白表达以及p-Akt/Akt水平上升,这些提示电针可增加PI3K/Akt信号通路活性,降低神经元自噬,进而改善SD相关的认知障碍。
睡眠是由2个交替出现的不同时相组成,即快速眼动睡眠和非快速眼动睡眠,这2种睡眠时相的数量决定了睡眠的质量[30]。失眠模型大鼠的非快速眼动睡眠和快速眼动睡眠的数量均减少,觉醒时间延长,而且非快速眼动睡眠转换为快速眼动睡眠的次数减少[31]。电针治疗对SD大鼠各睡眠时相的影响如何,电针治疗在改善SD大鼠认知障碍的同时是否能增加各睡眠时相的数量和转换次数,这些内容需在后续的研究中探讨。
综上所述,电针百会和大椎穴改善多平台水环境诱导建立的SD模型大鼠的学习记忆能力,可能与电针通过增强PI3K/Akt信号通路活性、减轻海马神经元自噬相关,这些结果为电针应用于临床治疗睡眠剥夺奠定了理论与实验基础。
