马铃薯bZIP家族的鉴定与表达分析
2022-02-06冯建英鲁黎明李立芹
李 想, 冯建英, 鲁黎明, 李立芹
(四川农业大学农学院,四川成都611130)
转录因子作为一类特殊的蛋白质,可以直接或间接地与顺式作用元件发生特异性相互作用,从而响应外界环境刺激,调控细胞的增殖、分化及生长,进而应对病虫害、激素、高温等生物与非生物胁迫[1-3]。碱性亮氨酸拉链(Basic region/leucine zipper motif,bZIP)类转录因子是植物中重要的转录因子家族之一,广泛参与植物的生长发育及逆境响应机制[2,4-5]。马铃薯是中国主要的粮食作物之一,在实际生产中,干旱、高温、高盐、水涝等非生物胁迫严重影响着马铃薯的产量和品质的形成,进而造成巨大的经济损失[6]。因此,鉴定bZIP家族并分析其各个亚族在非生物胁迫下的表达情况,对马铃薯应答非生物逆境胁迫的分子机制研究及提高非生物逆境条件下马铃薯的产量、品质具有较为重要的意义。
植物bZIP类转录因子一般有3个区域,即保守结构域、碱性结构域和亮氨酸拉链区,其中亮氨酸拉链区是一种α螺旋,通常由亮氨酸重复或其他疏水氨基酸组成,易通过环形成二聚体,并以此形式调节下游基因的表达[2,7]。保守的结构域包括1个特定的氮-X7-R/K基序以及18个用于核定位和DNA结合的氨基酸。在植物中,bZIP蛋白能够结合具有ACGT核心序列的顺式调节元件,如在应激反应基因的启动子中发现的G-盒基序(CACGTG)[2,8-10]。目前,很多植物的bZIP转录因子已经被鉴定出来[8,10-11],其中拟南芥中有71个bZIP家族成员[8],辣椒中有54个bZIP家族成员[12],番茄中有76个bZIP家族成员[13],棉花中有86个bZIP家族成员[14],苹果中有112个bZIP家族成员[15],烟草中有105个bZIP家族成员[2],黄花蒿中有78个bZIP家族成员[16]等。植物的bZIP转录因子家族可以分为若干个亚家族,如Jakoby等[8]根据拟南芥bZIP家族成员的保守结构域将其分为A~I和S等10个亚族,亚族之间的结构与功能较为相似,如A亚族大多含有ABF/AREB,它们参与了脱落酸(ABA)的信号传导以及部分非生物胁迫信号传导;D亚族主要包含许多TGA,通常与抗病性相关[1]。在功能上,bZIP基因家族成员广泛参与植物对非生物胁迫的响应,如番茄的SiAREB参与了对干旱、盐胁迫的反应[17];刚毛柽柳ThbZIP1基因的表达受到NaCl、聚乙二醇(PEG)、NaHCO3和CdCl2的胁迫诱导[18];葡萄的VvbZIP23基因对热胁迫有一定的应答反应[19-20];拟南芥的AtbZIP17能直接或间接调控盐胁迫应答基因[21-22];干旱和外源ABA处理会诱导水稻OsbZIP16的表达[23];苹果的MdbZIP26通过ABA介导的信号转导途径来提高植物对干旱、盐胁迫的抗性[24];玉米的bZIP转录因子ABP9可以提高棉花对干旱、盐胁迫的抵抗能力[25]。
马铃薯原产于南美安第斯山区,其栽培历史已经超过7 000年[26]。目前,马铃薯已经是全球的第四大主粮作物[12-16,27]。然而,目前关于马铃薯bZIP家族成员的功能研究尚不够深入。本研究采用生物信息学方法,以拟南芥bZIP成员的蛋白质氨基酸序列作为参考序列,在马铃薯全基因组蛋白质数据库中进行马铃薯bZIP家族成员的检索与鉴定,分析其结构、染色体定位及其编码的蛋白质理化性质,并构建进化树,并分析其在非生物胁迫下的表达模式,以期为马铃薯bZIP转录因子的功能研究提供参考。
1 材料与方法
1.1 试验材料
本研究所用材料为马铃薯组培苗,品种为川芋十号,由四川农业大学马铃薯研究中心提供。
1.2 材料的非生物胁迫处理
选取优质马铃薯组培苗进行胁迫处理。试验设1个对照组、5个胁迫处理组,对照组无非生物胁迫,处理组分别用如下试剂进行处理:10 μmol/L KCl(低钾)、1 μmol/L ABA、5% PEG-6000 (模拟干旱)、200 mmol/L NaCl(模拟高盐)、10 mmol/L H2O2。每组处理设置3次生物学重复,每个重复均包含5株马铃薯组培苗。
采用水培方式进行胁迫处理,在处理当天与处理后3 h、6 h、12 h进行整株取样,并将马铃薯组培苗在液氮中速冻,以备后续进行基因表达分析。
组培苗的培养、胁迫处理均在培养室中进行,培养条件:温度25 ℃,光照度2 000 μmol/(m2·s),光照时间14 h/d,暗处理时间10 h/d。
1.3 马铃薯bZIP基因碱基序列的获得
以与bZIP结构域相关的HMM文件作为检索条件,利用Hmmer 3.0软件在马铃薯全基因组相关的蛋白质数据库中检索同时包含bZIP1结构域、bZIP2结构域的蛋白质氨基酸序列,并去除包含HLH结构域的蛋白质氨基酸序列[2]。然后,利用NCBI网站的CDD软件去除不完整序列、错报序列。
1.4 马铃薯bZIP蛋白理化性质和亚细胞定位的预测
利用在线网站ExPASy对鉴定得到的马铃薯bZIP蛋白氨基酸序列进行理化性质(等电点、相对分子质量等)的预测。利用软件ProtComp 9.0进行蛋白质的亚细胞定位分析。
1.5 马铃薯bZIP家族系统进化树的构建
用MEGA 7.0软件对71个拟南芥的bZIP、104个马铃薯的bZIP对应的氨基酸序列及保守结构域进行多序列比对,并用邻接法构建系统进化树。采用Pairwise Deletion处理缺失数据以及用P-distance模型、Bootstrap检验1 000次的数据。
1.6 马铃薯bZIP基因结构和蛋白质结构的预测
用TBtools对马铃薯bZIP基因结构进行可视化展示,用MEME对候选基因编码的蛋白质保守结构域进行预测、分析,设置保守基序长度为6~50,数量为20个。
1.7 马铃薯bZIP基因的表达模式分析
从马铃薯转录组数据库中下载马铃薯根、茎、叶3个组织及非生物胁迫下叶片中的转录组数据[27],其中非生物胁迫包括260 μmol/L甘露醇处理、50 μmol/L ABA处理、50 mmol/L NaCl处理,提取bZIP家族对应转录本的RPKM值,进行标准化后,用Tbtools进行绘图。
1.8 马铃薯bZIP基因的表达验证
根据所绘制的聚类热图,挑选PGSC0003DMT400020670等12个对非生物胁迫具有高度响应的基因,根据其编码序列(CDS)设计引物(表1),预测的PCR产物包含基因外显子,PCR产物长度为150~200 bp,用StACTIN作为内参基因进行荧光定量PCR分析,用2-△△Ct法计算基因的相对表达量。
样品总RNA的提取采用TRIzol法,cDNA的合成用Servicebio反转录试剂盒法。
qPCR反应程序:94 ℃预变性2 min;94 ℃变性5 s,60 ℃退火30 s,95 ℃延伸5 s,39个循环。qPCR反应体系为20 μl,包括2.0 μl模板、10.0 μl SYBR GREEN Realtime PCR Master mix、各0.6 μl引物、6.8 μl ddH2O。
2 结果与分析
2.1 马铃薯bZIP基因家族成员的鉴定及其编码蛋白质的理化性质分析
利用Hmmer软件鉴定bZIP基因家族成员,最终筛选出104个马铃薯bZIP基因。由表2可以看出,104个bZIP蛋白的保守结构域的长度为21~79 aa,相对分子质量差异较大,为13 088.03~88 180.52,等电点为5.02~9.96,均属于亲水蛋白质,大部分为非稳定蛋白质。104个bZIP成员中,54个定位于细胞核,50个定位于细胞间隙。

表1 马铃薯bZIP基因家族的荧光定量PCR引物
2.2 马铃薯bZIP基因家族系统进化树的构建
利用邻接法构建了马铃薯bZIP基因家族的系统进化树。由图1可以看出,104个马铃薯bZIP基因被划分成10个亚族(A~I和S);各亚族中马铃薯基因数为4~22个,差别较大,其中除了B、F、I这3个亚族外,大部分亚族(A、C~E、G、H、S)中的马铃薯bZIP编码蛋白质数量明显多于拟南芥。此外,拟南芥bZIP分组结果与Jakoby等[8]的研究结果基本一致。
2.3 马铃薯bZIP转录因子的蛋白质结构
用MEME对bZIP蛋白的全长氨基酸序列进行结构分析,通过Tbtools软件对结果进行可视化分析,并按照结构相似性聚类,共得到20个Motif。由图2可以看出,其Motif组成、位置和数量在不同亚族内存在一定共性,但亚族之间存在较大差异,其中Motif1共存于98个成员中。
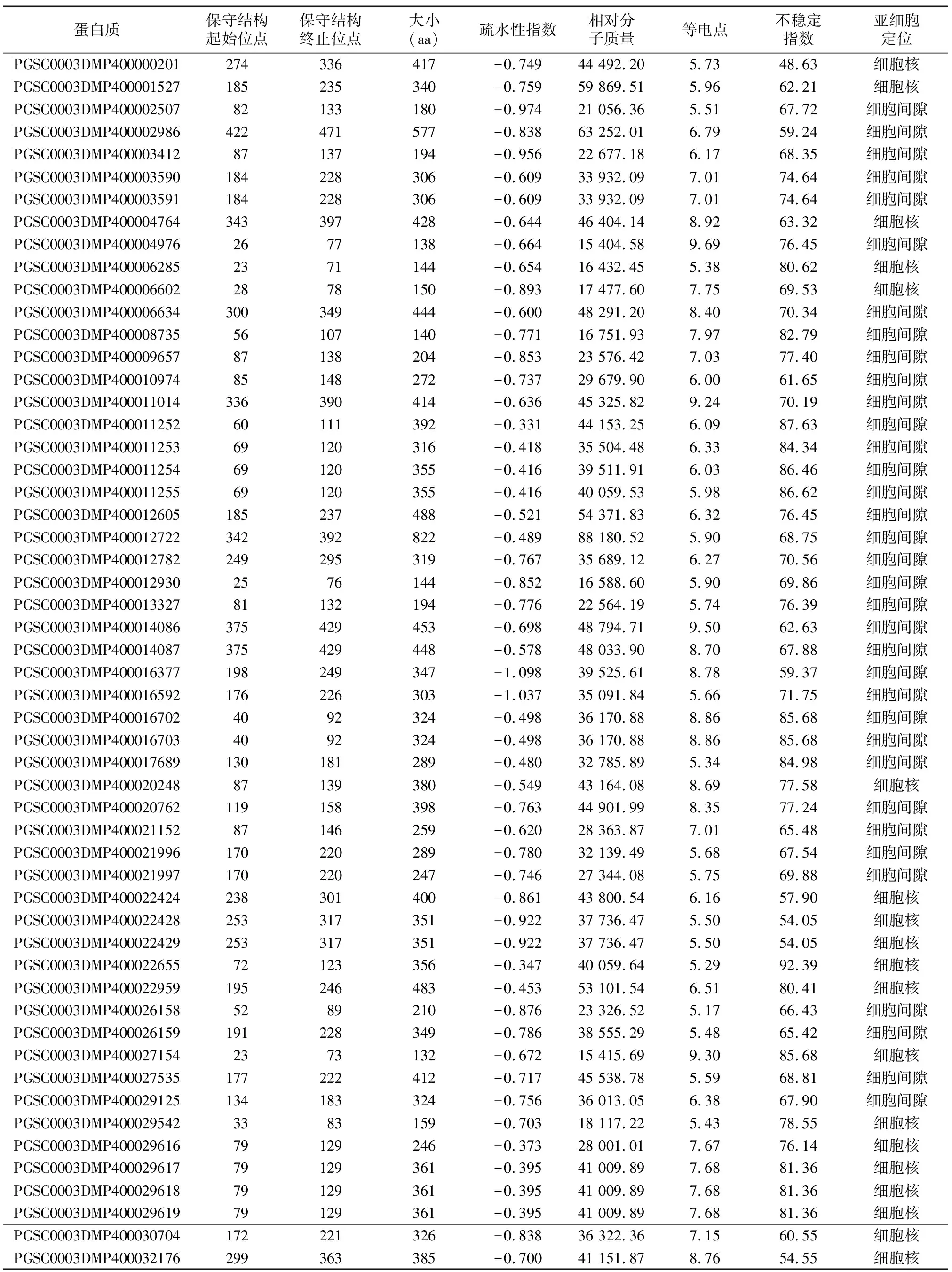
表2 马铃薯bZIP家族保守氨基酸序列位置及其蛋白质的理化性质

图1 马铃薯和拟南芥bZIP基因家族编码蛋白质的系统进化树Fig.1 Phylogenetic tree of bZIP gene family encoded protein in potato and Arabidopsis

图2 马铃薯bZIP家族转录因子的模体(Motif)分布Fig.2 Motif distribution of bZIP family transcription factors in potato
2.4 马铃薯bZIP基因家族的染色体定位
根据马铃薯基因组的染色体位置信息,对104个bZIP基因进行染色体定位。结果表明,马铃薯中的104个bZIP基因不均等地分布在61条染色体上,其中2条染色体上均包含4个bZIP基因,其余染色体上则有1~3个bZIP基因。
2.5 马铃薯bZIP基因家族的表达模式分析
利用生物信息学手段分析马铃薯数据库中bZIP基因在不同组织中的表达情况与响应非生物胁迫的表达模式。由图3A可以看出,在104个马铃薯bZIP基因中,PGSC0003DMT400025921、PGSC0003DMT400004821和PGSC0003DMT400030585基因在根、茎、叶中的相对表达量均最高;PGSC0003DMT400004821、PGSC0003DMT400019462基因只在茎中有高表达量;PGSC0003DMT400032381、PGSC0003DMT400032382基因只在叶中有高表达量,推测其在马铃薯茎、叶生长发育过程中起着重要作用;PGSC0003DMT400025921、PGSC0003DMT400030585基因在根系中的表达量非常高,提示其可能在根系的生长发育过程中起作用。
由图3B可以看出,在响应非生物胁迫方面,PGSC0003DMT400085559、PGSC0003DMT400030585和PGSC0003DMT400025921基因的相对表达量分别在ABA、NaCl和甘露醇(Mannitol)处理下最高。多数基因的相对表达量在ABA处理下较高,而PGSC0003DMT400085559基因的相对表达量只在ABA处理下较高,暗示其在响应ABA中起着关键作用。在盐胁迫及干旱处理下,PGSC0003DMT400020670、PGSC0003DMT400020671基因的相对表达量较高,可能与其对盐、干旱逆境等胁迫的响应有关。

A:组织表达模式;B:非生物胁迫下表达模式。图3 马铃薯bZIP基因的表达模式分析Fig.3 Expression pattern analysis of bZIP gene in potato
2.6 马铃薯bZIP基因表达模式的验证
为了验证生物信息学分析结果,本研究采用荧光定量PCR方法分析所挑选的12个bZIP基因在不同组织中的表达模式。同时分别用5%PEG-6000、10 μmol/LKCl、200 μmol/LNaCl、1 μmol/L ABA、10 mmol/L H2O2对马铃薯组培苗进行胁迫处理,检测所挑选的12个bZIP基因在胁迫处理前及胁迫处理3 h、6 h、12 h后的相对表达量,结果如图4、图5所示。
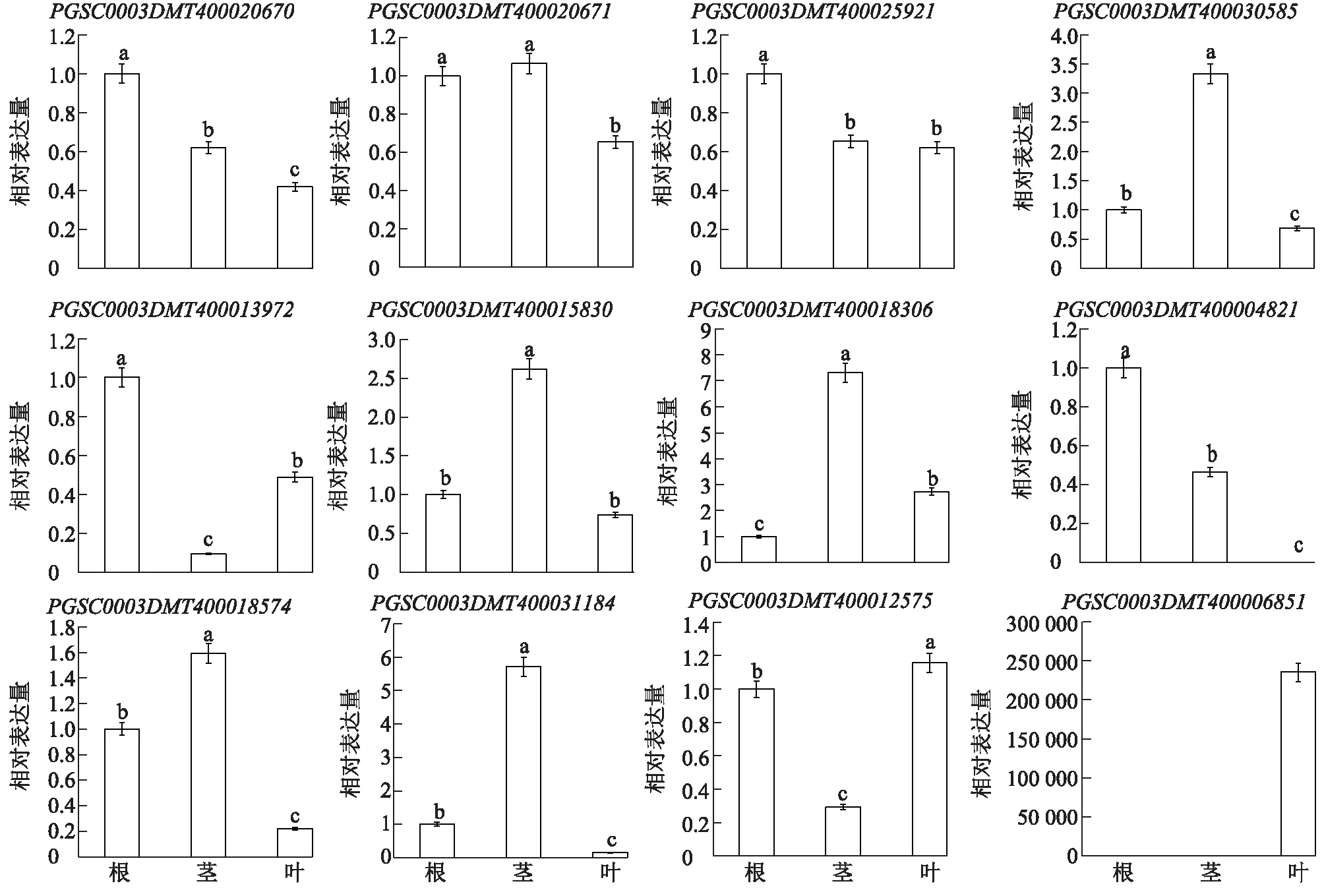
不同组织对应的柱上标有不同小写字母表示具有显著差异(P<0.05)。图4 马铃薯不同组织中部分bZIP基因的相对表达量Fig.4 Relative expression of some bZIP genes in different tissues of potato

同一类处理的不同处理时间对应柱上标有不同小写字母表示差异显著(P<0.05)。图5 马铃薯在不同逆境环境下基因的相对表达量Fig.5 Relative expression of genes in potato under different stress conditions
qPCR结果显示,在本研究检测的12个基因中,在马铃薯根中的相对表达量较高的有6个,分别为PGSC0003DMT400020670、PGSC0003DMT400020671、PGSC0003DMT400025921、PGSC0003DMT400013972、PGSC0003DMT400004821、PGSC0003DMT400012575。在茎中的相对表达量较高的基因也有6个,分别为PGSC0003DMT400020671、PGSC0003DMT400015830、PGSC0003DMT400030585、PGSC0003DMT400018306、PGSC0003DMT400018574、PGSC0003DMT400031184。在叶中,PGSC0003DMT400012575、PGSC0003DMT400006851基因的相对表达量均较高。总体来看,虽然qPCR的分析结果与利用生物信息学手段分析的表达模式结果有些差异,但基本一致。
在ABA胁迫处理下,与对照相比,12个基因中只有PGSC0003DMT400006851基因的相对表达量全部下降,PGSC0003DMT400020670基因的相对表达量变化不明显,其他10个bZIP家族成员的相对表达量在胁迫3 h或6 h均有不同程度的上升(图5)。在高盐胁迫下,与0 h相比,除PGSC0003DMT400015830、PGSC0003DMT400006851基因的相对表达量下调外,其余10个基因均上调表达。在模拟干旱处理下,与0 h相比,PGSC0003DMT400006851、PGSC0003DMT400025921基因的相对表达量下调,其余10个基因整体表现为上调表达。
为了进一步探究马铃薯bZIP家族成员对非生物胁迫的响应广泛度,又进行了低钾、H2O22个胁迫处理。图5结果表明,在低钾条件下,与0 h相比,有10个基因的相对表达量有一定程度的升高,其中PGSC0003DMT400004821、PGSC0003DMT400015830基因的相对表达量较高,PGSC0003DMT400013972、PGSC0003DMT400006851基因的相对表达量有所降低。在H2O2胁迫下,除PGSC0003DMT400006851基因外,其余11个基因的相对表达量均有所提高,其中PGSC0003DMT400004821、PGSC0003DMT400031184、PGSC0003DMT400012575等3个基因的相对表达量较高。
值得关注的是,与0 h相比,PGSC0003DMT400004821基因在5种胁迫条件下均高度表达,尤其是在低钾条件下的相对表达量最高;而PGSC0003DMT400006851基因在所有胁迫条件下均下调表达。对马铃薯bZIP基因家族在非生物胁迫下表达模式的分析结果表明,该基因家族在马铃薯的逆境响应中具有一定作用。
3 讨论
本研究采用生物信息学方法[8,16],共从马铃薯基因组中鉴定出104个bZIP转录因子。通过构建系统进化树,将bZIP家族成员划分成10个亚族。本研究的分组结果与拟南芥bZIP家族的分组结果大体一致[8],初步证实了鉴定结果的准确性。在这10个亚族中,有7个亚族(A、C、D、E、G、H、S)包含的bZIP家族成员比拟南芥的多,1个亚族(B)的数量相等,2个亚族(F、I)的数量比拟南芥的少。通过对马铃薯bZIP蛋白进行结构分析,得到20个Motif,其中Motif1的分布最广泛,存在于98个成员中。由此可见,马铃薯bZIP家族在漫长的生物进化过程中发生了结构及功能上的分化以适应外界环境的变化。
基因的表达模式能够在某种程度上反映其所发挥的功能。马铃薯的104个bZIP基因在马铃薯根、茎、叶中均有表达,并具有十分明显的组织表达特异性。其中PGSC0003DMT400004821、PGSC0003DMT400019462基因只在茎中有高表达,PGSC0003DMT400032381、PGSC0003DMT400032382基因只在叶中有高表达,推测其分别在马铃薯茎、叶2个不同组织的生长发育过程中起重要作用;PGSC0003DMT400025921、PGSC0003DMT400030585基因的相对表达量在根系中非常高,提示其在根系的发育和对外界物质的吸收等过程中扮演重要角色。
前人研究发现,bZIP基因广泛参与植物对逆境胁迫的响应[28-30],如bZIP转录激活子Atf1参与Sty1-Atf1途径响应H2O2诱导的活性氧的转录调节机制[31]。bZIP家族A亚族成员对ABA有一定程度的响应,但响应模式不尽相同[16]。大豆中的bZIP基因Glyma04g04170可能通过负调控的方式参与耐涝应答反应[32]。在本研究中,马铃薯的多数bZIP基因在ABA处理下的相对表达量较高,其结果与拟南芥、烟草等的相关结果基本一致,且PGSC0003DMT400085559基因只在ABA处理下有较高的相对表达量,提示其在ABA响应中起着关键作用。在盐胁迫及干旱处理下,PGSC0003DMT400020670、PGSC0003DMT400020671基因的相对表达量较高,可以推测其在抗胁迫中的作用。PGSC0003DMT400085559、PGSC0003DMT400030585和PGSC0003DMT400025921等基因在ABA、NaCl、Mannitol胁迫下均具有高的相对表达量,说明它们在应对这些非生物胁迫的过程中具有某种共同机制。
此外,还有一些基因,如PGSC0003DMT400004821、PGSC0003DMT400015830基因在低钾胁迫下的相对表达量较高,在H2O2处理下,PGSC0003DMT400004821、PGSC0003DMT400031184、PGSC0003DMT400012575等3个基因的相对表达量显著上调。上述结果均表明,bZIP基因家族在马铃薯抗逆响应中发挥着广泛作用。值得关注的是,PGSC0003DMT400006851基因在所有胁迫处理下均下调表达,表明该基因可能以某种负调控的方式参与了马铃薯的非生物胁迫响应。
4 结论
本研究采用生物信息学的手段从马铃薯基因组中鉴定出了bZIP家族的104个基因,可以分为10个亚族。在结构上,这些基因编码的bZIP家族转录因子包含20个Motif,转录因子之间的Motif数量不同。马铃薯bZIP基因广泛参与了干旱、高盐、ABA等非生物胁迫的响应过程,本研究结果能为马铃薯bZIP家族的功能研究奠定基础。
