嵌合抗原受体巨噬细胞的研究进展
2022-02-06吕翠翠
吕翠翠,沈 俊,邓 琦
(1. 天津市第一中心医院 血液科, 天津 300192;2.中国医学科学院血液病医院血液学研究所 实验血液学国家重点实验室, 天津 300020)
嵌合抗原受体(chimeric antigen receptor,CAR)介导的细胞免疫疗法是一种治疗肿瘤的新型精准靶向疗法,该方法能够实现对肿瘤细胞的快速识别和高效精准杀伤。近些年,基于CAR的免疫细胞疗法(如CAR-T和CAR-NK)正处于快速发展中,其中嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)疗法目前已在血液肿瘤中取得了巨大的成效,尤其是在急性B淋巴细胞白血病的治疗中[1-5]。在实体瘤治疗中CAR-T和嵌合抗原受体修饰的自然杀伤细胞(chimeric antigen receptor-engineered NK cells,CAR-NK)的疗效有限(表1),其主要瓶颈包括T细胞和自然杀伤细胞(natural killer cells, NK)的渗透性不足以及免疫抑制性微环境等[6-8]。与T细胞或NK浸润不良相反,巨噬细胞在实体瘤的肿瘤微环境中可被广泛募集[9-11]。此外,与免疫抑制微环境会促使肿瘤浸润的T淋巴细胞发生衰竭不同,肿瘤浸润的巨噬细胞不会发生衰竭,具有更高程度的表型可塑性[9-11]。有研究发现,结合了CAR的巨噬细胞(CAR-M)在实体瘤内更易倾向发展成M1型活化的巨噬细胞,能在实体瘤内持续发挥抗肿瘤效应[12-14]。另外,作为抗原呈递细胞,巨噬细胞还能提呈抗原给T细胞,从而激活T细胞,进一步发挥抗肿瘤作用。与T细胞相比,巨噬细胞无组织相容性复合体(major histocompatibility complex,MHC)的限制性和发生移植物抗宿主病(graft versus host disease, GVHD)的风险,在体内循环时间有限,非肿瘤靶向毒性也较小(表1)。因此,巨噬细胞有潜力被开发为靶向肿瘤的CAR-M疗法,基于CAR-M的免疫细胞疗法是攻克实体瘤的重要途径。本文通过对当前CAR-M的相关研究(包括CAR-M的细胞来源,CAR-M载体的结构构建和传递及CAR-M的临床研究)进行综述,旨在为CAR-M的临床转化应用提供参考和奠定理论基础。
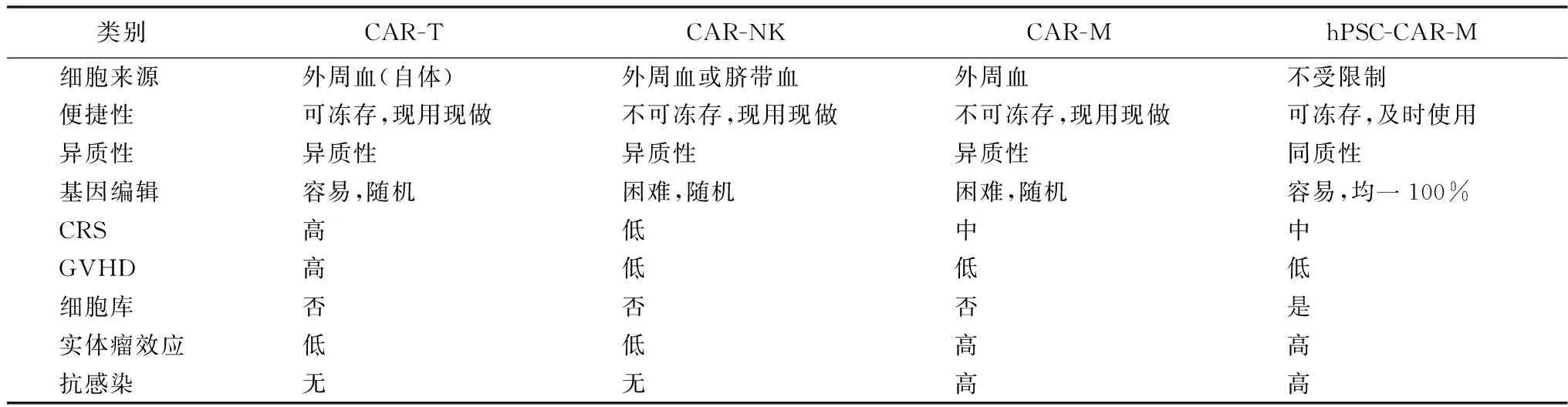
表1 不同CAR免疫细胞比较
1 CAR-M的细胞来源
1.1人肿瘤细胞系 人肿瘤细胞系(THP-1)是从一名1岁儿童患者中分离出来的一种急性单核细胞白血病细胞系。该细胞系具有与人原代单核细胞类似的形态学和功能学特性。例如,THP-1可被佛波酯(phorbol 12-myristate 13-acetate, PMA)等诱导分化为巨噬细胞;在脂多糖(lipopolysaccharide, LPS)和干扰素-γ(interferon-γ,IFN-γ)的刺激下能进一步被诱导为M1型巨噬细胞;而在白细胞介素(interleukin,IL)-4等刺激下又可向M2型巨噬细胞转变。与人原代单核/巨噬细胞不同的是,THP-1具有稳定一致的遗传背景,易于体外扩增、存储和基因编辑。因此在实验室条件下,THP-1常被用来探究单核/巨噬细胞生理行为的调节,如免疫反应、细胞间相互作用和信号转导途径[15]。尽管THP-1与原代单核/巨噬细胞具有高度的相似性,但在生理功能上并不完全一致,因此无法完全替代原代单核/巨噬细胞。例如,在原代巨噬细胞中通常可以观察到LPS的诱导耐受,但THP-1来源的巨噬细胞能通过上调核因子κB(nuclear factor kappa-B,NF-κB)等特定基因信号的表达,从而维持对LPS的敏感性[15]。此外,在M1极化过程中,相对于外周血的原代单核细胞,THP-1中的IL-6和IL-10的表达会缺失,IL-8的分泌会减少[15]。随着CAR技术的进步,THP-1可被用作CAR-M载体结构设计和筛选的工具用来研究和提高CAR-M抗原依赖性的吞噬能力。有研究发现,以CD3ζ为基础的CAR可增强THP-1源性巨噬细胞的抗肿瘤吞噬功能[13]。然而,考虑到成瘤风险,将来THP-1介导的CAR-M应用于临床面临着较大的挑战。
1.2人外周血单核细胞 人外周血单个核细胞包含多种类型的免疫细胞,如单核细胞。在粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)等细胞因子的刺激下,单核细胞可进一步向巨噬细胞分化[13]。与THP-1相比,外周血来源的单核/巨噬细胞能更好地保留其原始形态[15]。此外,外周血来源的单核/巨噬细胞具有更强大的促炎症特性:在LPS和IFN-γ刺激下,原代单核/巨噬细胞能产生更多的促炎因子,如IL-6、IL-8和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),并表达更高水平的表面标志物,包括利钠肽受体、CD14和CD68[15]。借助腺病毒转染体系,有研究者利用外周血来源的单核/巨噬细胞构建了靶向实体瘤抗原的CAR-M,并在体内外实验中验证了原代CAR-M良好的抗肿瘤效应[13]。然而,考虑到原代巨噬细胞的来源有限,转染困难及无法有效扩增和冻存(表1),将来人外周血单核细胞介导的CAR-M在临床上的大规模应用面临着巨大的挑战。
1.3人多能干细胞 人多能干细胞 (human pluripotent stem cells, hPSC)包括胚胎干细胞和诱导性多能干细胞(induced pluripotent stem cells,iPSC),具有自我更新和多向分化潜能,理论上可以源源不断地分化成巨噬细胞[16-19]。目前,借助于共培养或基质胶介导的2D分化方案或拟胚体介导的3D分化体系,研究人员已能够将hPSC在体外诱导分化出巨噬细胞[20]。hPSC来源的巨噬细胞首先解决了原代巨噬细胞来源不足的问题,而且利用单克隆来源的hPSC还可以生成同质性的标准化的巨噬细胞产品(表1)。此外,hPSC易于被基因编辑,经基因编辑和纯化后的hPSC在分化过程中能百分百携带编辑位点,因此,结合CAR等技术能够做到高靶向性(表1)。此外,hPSC来源的巨噬细胞可以在分化早期进行冻存和复苏,易于做成现货型产品(表1)。基于上述优点,hPSC正在成为巨噬细胞分化和治疗的研究热点。实际应用中,我们可以将特定的CAR转导到hPSC中,然后经过分选和单克隆扩增建立CAR-hPSC, 最后利用分化技术将CAR-hPSC分化成巨噬细胞,从而源源不断地得到均一的CAR-M(图1)。在一项以iPSC为种子细胞的CAR-M研究中,研究者首先使用编码重编程因子的非整合载体诱导iPSC克隆;然后将含有4-1BB和CD3ζ胞内结构域的CAR转导到iPSC中再进一步诱导为巨噬细胞,这些诱导来的CAR-M具有M2表型; 当遇到靶细胞时,这些CAR-M能吞噬靶细胞,并向M1型转化;体内研究进一步表明,iPSC来源的CAR-M可以发挥肿瘤靶向作用[12]。
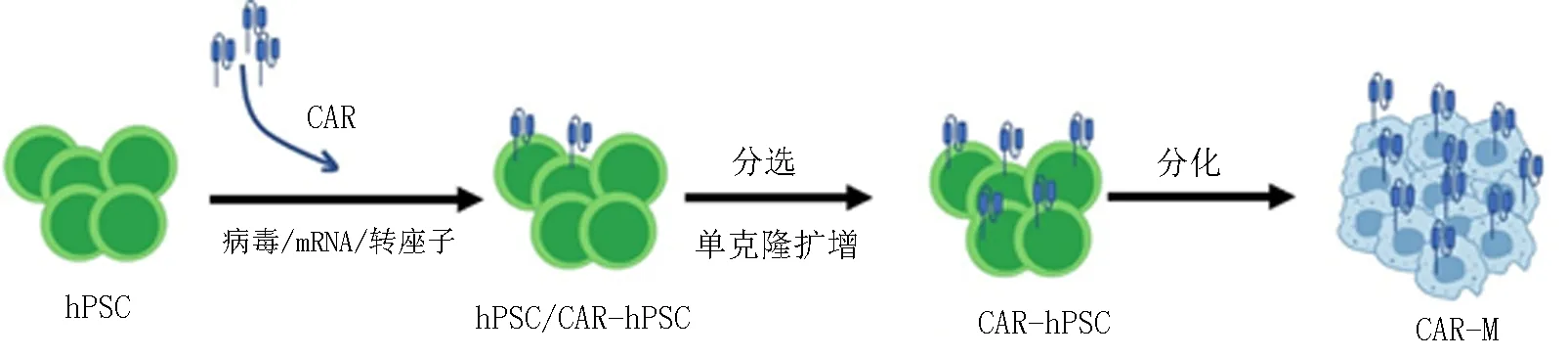
图1 利用hPSC构建CAR-M的过程 注:hPSC:人多能干细胞;CAR-hPSC: 嵌合抗原受体人多能干细胞; CAR-M:嵌合抗原受体巨噬细胞
2 CAR-M载体的构建和传递
在CAR结构设计上,CAR-M整体上遵循CAR-T的构建原则,包括细胞外抗原识别域、铰链区和一个或多个胞内信号转导域。CAR-M与CAR-T结构设计的主要不同在于胞内结构域。
2.1吞噬信号激活载体的设计 CAR-M载体结构设计的重点和难点在于细胞内信号转导结构域。CD3ζ信号转导结构域包含免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,ITAM),在CAR-T中介导T细胞的信号转导[13]。与CAR-T类似,CAR-M可以直接使用CD3ζ信号转导结构域激活吞噬信号,但激活的分子机制与CAR-T不同。在CAR-T中,ITAM在CAR结合时被Src家族激酶磷酸化,接着与激酶ZAP70中的串联SH2结构域结合,进而激活CAR-T以发挥杀伤作用[21]。巨噬细胞不表达ZAP70,而是表达另一种含有串联SH2结构域的激酶Syk,可以结合CD3ζ并在巨噬细胞中传递吞噬信号[21]。除CD3ζ外,其他含有ITAM的细胞内结构域,如Fc受体共同γ链(Fc receptor common gamma chain, FcRγ)和多个表皮生长因子样结构域蛋白10(multiple epidermal growth factor-like domains protein 10, Megf10),也被发现与CD3ζ具有相当的吞噬作用,而含有黏附G蛋白偶联受体B1(adhesion G protein-coupled receptor B1, Bai1)和酪氨酸蛋白激酶 Mer (tyrosine-protein kinase Mer, MerTK) 胞内结构域的CAR-M则不能进行有效的吞噬[22]。研究发现,FcRγ主要介导巨噬细胞中抗体依赖性细胞吞噬信号的转导,而Megf10在巨噬细胞吞噬凋亡细胞中起关键作用[22]。在另一项靶向C-C趋化因子受体7型(C-C chemokine receptor type 7, CCR7)的CAR-M研究中,研究者则发现相比Toll样受体(Toll-like receptor, TLR)2、TLR4和TLR6等信号转导结构域,含有MerTK的CAR-M在体外具有较强的吞噬能力和细胞杀伤活性[23]。
大多数CAR-M仅能内化靶细胞片段,而不能整个吞噬肿瘤细胞,如何提高CAR-M对靶细胞的整体吞噬能力是该领域的难点。在CAR-T相关研究中发现含有CD3结构域而不含共刺激结构域的第一代CAR-T在体内的活性和功能有限[24-27]。因此,现阶段批准上市的CAR-T产品都含有共刺激胞内结构域,CD28和(或)41BB。与第二代和第三代CAR-T类似,额外的信号传导域或许能进一步增强巨噬细胞的吞噬作用。此前有报道称,磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)信号对大颗粒的吞噬作用很重要,这表明额外的PI3K信号或许能增强CAR-M的吞噬作用[28]。研究者通过将CD19-PI3K募集结构域串联融合到基于FcRγ的CAR结构中,结果使靶细胞的整体吞噬作用显著增强[28]。
2.2非吞噬信号激活载体的设计 除了设计上述具有激活吞噬作用的细胞内结构域,有研究者设计了一种含有CD147激活域(CAR-147)的CAR用来降解肿瘤微环境中的细胞外基质(extracellular matrix, ECM)[14]。CD147是一种调节基质金属蛋白酶(matrix metalloproteinases, MMP)表达和ECM重塑的蛋白质。ECM所造成的物理屏障是引起免疫细胞向肿瘤浸润不足的重要原因。CAR-147不转导吞噬信号,CAR-147巨噬细胞与靶细胞的结合显著上调某些MMP的表达,但不影响巨噬细胞的其他功能,如吞噬作用、促进活性氧产生和炎性细胞因子分泌等[14]。研究发现,CAR-147巨噬细胞上调少量MMP的表达可显著降低肿瘤中的胶原含量,诱导CD3+T细胞浸润并抑制肿瘤生长[14]。
2.3CAR-M载体传递方式 单核/巨噬细胞对基因操纵具有天然抵抗力,因此将CAR和其他基因转导进单核/巨噬细胞具有一定的挑战性[29]。目前针对巨噬细胞的主要传递策略有病毒和非病毒两种,在具体操作上又分为体外传递和体内传递。
Bobadilla等[30]创造了新的HIV-1衍生慢病毒颗粒,能够通过利用病毒辅助蛋白Vpx感染髓系细胞。Vpx平台可以容纳任何预先存在的基于艾滋病病毒(HIV)的慢病毒载体,因此提供了一种编辑髓系细胞的可行性策略。鉴于巨噬细胞的增殖能力有限,有研究者假设非整合、复制缺陷型腺病毒载体或许具有好的转导效果,并依此设计了一种复制功能不全的嵌合腺病毒载体作为向巨噬细胞递送CAR的方法[13]。该策略不仅显示出转导的高效性,而且在不同供体之间展现了可重复性[13]。此外一些非病毒策略也被开发用于工程化单核/巨噬细胞,包括质粒DNA,信使核糖核酸(mRNA)和转座子系统[31-33]。
在CAR传递的具体操作上,目前基本上都是基于体外编辑后系统回输这种传统操作。为了避免复杂和昂贵的体外制备过程,一种基于纳米载体的体内编辑递送技术正在兴起。有研究表明,在体内注射巨噬细胞靶向纳米载体和编码CAR-IFN-γ的质粒DNA所组成的纳米复合物后能够诱导体内巨噬细胞形成CAR-M1型巨噬细胞,并能发挥抗肿瘤作用[34]。在另一项研究中,研究者构建了一种可注射的基因纳米载体-水凝胶超结构递药系统,可对术后瘤腔周围巨噬细胞进行原位编辑,并成功应用于恶性脑胶质瘤动物模型的术后免疫治疗[35]。
3 CAR-M临床研究进展
在一项针对非肌肉浸润性膀胱癌的多中心、随机临床试验中,研究者已证实大剂量(109个/次)多次回输巨噬细胞后无明显毒副作用[36]。此外,到目前为止,已有一项CAR-M的I期临床试验被美国FDA批准 (Clinicaltrials.gov 号:NCT04660929)。该试验来自CARISMA Therapeutics的候选药物CT-0508。这是一种来源于外周血单核细胞经由腺病毒载体转导的抗人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER2)的自体CAR-M疗法,主要适应证是治疗复发/难治性HER2过表达的肿瘤患者。该试验于2021年开始,目前该款CAR-M产品在人体内的安全性和有效性仍有待进一步验证。
4 小结与展望
基于CAR-M的细胞免疫疗法在实体瘤的治疗上尽管展现出了巨大的发展潜力,但仍有很多问题亟待解决。可靠的细胞来源和可持续扩增是CAR-M临床应用的必要条件。相比肿瘤细胞及外周血单核细胞,hPSC是CAR-M将来能做到成药的重要候选细胞。然而,当前hPSC向巨噬细胞的分化仍然面临效率低下,功能不足等难题,基于多能干细胞的高效分化策略仍有待进一步开发和优化。其次,如何提高CAR-M的抗肿瘤效应是CAR-M临床应用的另一难点。设计和筛选针对巨噬细胞的胞内信号转导结构域是进一步提升CAR-M功效的重要手段。鉴于实体瘤靶点不明确,筛选合适的靶点对于提升CAR-M的疗效也有积极意义。从安全性角度考虑,巨噬细胞虽无GVHD风险,但在CAR-M的制作上仍然面临很多安全问题。hPSC具有成瘤风险,筛选高纯度的巨噬细胞能大大降低多能干细胞的残留。此外,CAR-M多采用病毒转导的方法,可能会诱发插入突变;体内直接编辑也存在靶向性问题、递送效率问题和毒性问题等。然而,随着美国FDA批准的基于CAR-M的I期临床试验的开展,将来关于CAR-M的临床研究会越来越多,相关的各种难题也会随着技术的进步逐渐被攻克。可以预期未来基于CAR-M的肿瘤免疫疗法在实体瘤的治疗中将发挥重要作用。
