长链非编码RNA LINP1抑制DNA损伤促进非小细胞肺癌电离辐射抗性
2022-02-03张春婷梁枭婷王乐周良
张春婷 梁枭婷 王乐 周良
南方医科大学公共卫生学院(广东省热带病研究重点实验室)毒理学系(广州 510515)
肺癌是对人群健康和生命威胁最大的恶性肿瘤之一,死亡率仅次于心脏病,在所有肿瘤中发病率和病死率最高[1-2],其中非小细胞肺癌(NSCLC)是肺癌最常见的组织学亚型,约占肺癌发病率的85%[3]。目前,肺癌的治疗手段主要是手术、放疗、化疗等。由于早期NSCLC患者症状隐匿,确诊时大多已是晚期,病情发展迅速、预后差,无法施行手术治疗,因此较依赖于放射治疗[4]。直接或者间接造成DNA损伤从而消灭肿瘤细胞是放射治疗的主要杀伤机制,然而大多数晚期肺癌对放射治疗具有较高的抗性,患者5年生存率很低[5-6]。因此,如何减弱NSCLC患者放疗抗性是目前肺癌治疗中亟需解决的重要课题,研究影响NSCLC放射治疗下DNA损伤效应的因素,寻找更有效的治疗靶点,对降低NSCLC患者电离辐射抗性、促进NSCLC的临床治疗提供新思路具有重要意义。
近年来,生物靶向治疗日益成熟,其与放射治疗的联合运用的研究也受到广泛关注[7-8]。长链非编码RNA(Long noncoding RNA,LncRNA)是一类转录本长度大于200个核苷酸、不具备蛋白编码能力的RNA分子[9-10]。异常的LncRNA表达可能参与诱导或抑制癌症的发生发展、转移和化学抗性的产生[11-12]。非同源末端连接途径长链非编码 RNA 1(lncRNA in non⁃homologous end joining pathway 1,LINP1)与多种肿瘤的进展密切相关,其表达和功能受p53和表皮生长因子受体信号调节[13-15]。沉默LINP1会增加肿瘤细胞对乳腺癌放疗的敏感性[16]。在胰腺癌中,LINP1能够通过调节microRNA⁃491⁃3p来增强细胞的增殖和转移,从而影响患者的淋巴结或远处转移的发生率和预后[17]。在食管鳞状细胞癌中[13],敲减 LINP1 可以抑制食管鳞状细胞癌的恶性进展,且LINP1能作为其预后指标。在甲状腺癌中[18],高表达的LINP1通过抑制AMPK信号通路促进细胞的增殖并阻抑其凋亡。目前,LINP1对肺癌进展尤其是对肺癌放疗抗性的影响尚未明确。
本研究比较了NSCLC细胞在模拟放射治疗条件下电离辐射照射后LINP1表达水平的变化,分析了在电离辐射条件下,敲减LINP1对肺癌细胞H1299的活力和DNA损伤效应的影响。通过研究LINP1在放射治疗中对NSCLC的DNA损伤和电离辐射抗性的影响,为NSCLC的临床治疗提供新的思路。
1 材料与方法
1.1 实验材料H1299细胞购自上海启达生物科技有限公司。1640培养基(美国Gibco公司),小牛血清(上海依科赛生物有限公司),磷酸盐缓冲液(PBS),胰蛋白酶(美国 Gibco公司);结晶紫(美国Roche公司);蛋白酶抑制剂(美国Roche公司);CCK⁃8试剂盒(北京TransGen Biotech公司);EL转染试剂(北京TransGen Biotech公司);ECL显色液(德国Merck Millipore公司);二氧化碳培养箱。
1.2 实验方法
1.2.1 细胞培养H1299细胞5% CO2,37℃条件下,用含10%小牛血清的1640培养基培养,取对数生长期细胞进行实验。
1.2.2 细胞转染使用siRNAs(siNC,siLINP1⁃1,siLINP1⁃2)和转染试剂EL敲减LINP1。细胞培养到汇合度达到70% ~80%时,用siNC,siLINP1⁃1,siLINP1⁃2分别与EL按操作手册的要求混合后进行转染,6 h后换完全培养基继续培养。
1.2.3 细胞照射将细胞接种于培养皿中,贴壁24 h后进行siRNA的转染,使用siRNAs(siNC,siL⁃INP1⁃1,siLINP1⁃2)和EL敲减LINP1。细胞培养到汇合度达到70% ~ 80%时,用siNC,siLINP1⁃1,siL⁃INP1⁃2分别与EL混合后进行转染,6 h后换完全培养基继续培养。24 h后换液,液面深度为5 mm,上盖1 cm玻璃厚补偿物,使用Elekta Precise医用直线加速器radiation type X ray,Energy 6 MV,Dose Rate 300 MU/min,0 °照射,剂量为8.0 Gy。
1.2.4 CCK⁃8法检测细胞增殖采用上述成功转染后的细胞,按照按每孔5×103个细胞接种在96孔板中,每孔100 μL的细胞悬液,培养24 h后进行电离辐射(8.0 Gy)照射,分别在照后0、12、24、48、72 h各时间点每孔加入10 μL的 CCK⁃8溶液,继续培养2 h,测定450 nm的吸光度值。实验重复3次。
1.2.5 克隆形成实验取上述成功转染的细胞使用胰酶消化后计数,每孔5.0×102个细胞接种培养在6孔板中,24 h后进行电离辐射(8.0 Gy)的照射,培养12~14 d,中间更换两次培养基。克隆集落出现后,用PBS洗涤两次,在4%多聚甲醛中固定15 min,最后0.1%结晶紫染色15min后观察,评估LINP1表达水平变化对细胞克隆形成能力的影响。
1.2.6 Western blot蛋白检测2 500 rpm离心收集细胞,用加有 1×Protease Inhibitor Cocktail(Roche)的RIPA缓冲液制备细胞裂解液,提取细胞总蛋白。每孔加20 μg等量蛋白,电泳后转(PVDF)膜上,3%BSA室温封闭1 h,特异性一抗结合靶蛋白4℃孵育过夜,TBST漂洗后辣根过氧化酶(horse⁃radish peroxidase,HRP)偶联的二抗用于化学发光成像检测,ECL发光试剂盒检测发光强度。
1.2.7 单细胞凝胶电泳细胞转染6 h后换液,24 h后进行电离辐射(8.0 Gy)的照射,4 h后使用胰酶将细胞消化后用PBS将细胞重悬,将细胞悬液和0.8%低熔点琼脂糖按照1∶4混合均匀,铺在预处理后的载玻片上,4℃下放置1 h。将铺好胶的载玻片放入裂解液中裂解4 h。裂解后用PBS清洗,将载玻片放入现配现用的电泳缓冲液中,变性解旋 20 min,电泳 20 min(20 V,300 mA)。用中和缓冲液中和15 min,全程避光进行。将载玻片置于EB中染色20 min后洗脱10 min,使用荧光倒置显微镜拍照后,用分析软件Image J进行图像分析。
1.2.8 实时定量PCR(qRT⁃PCR)检测qRT⁃PCR参照 HAN 等[19]的方法,用 TRIzol试剂(Life Tech⁃nologies)按说明书操作提取总RNA,采用Nanodrop 2000(ThermoFisher Scientific)定量RNA的浓度,取1 μg总RNA使用Honor II 1st cDNA Synthesis Super⁃mix for qPCR(Novogene)按说明书进行逆转录反应,所得cDNA稀释10倍用于后续反应。按每孔混合 3 μL 稀释后的 cDNA、0.2 μL 引物和 5 μL Unique Apatamer qPCR SYBR Green Master Mix(No⁃vogene)并加ddH2O至体积10 μL配制反应体系,置于qPCR仪LightCycler 480 PCR System(Roche),按程序(预变性:94℃ 3 min;扩增:94℃ 10 s,56℃15 s,72 ℃ 30 s,40个循环;72 ℃,7 min;12 ℃保温)进行qRT⁃PCR检测和分析。
1.3 统计学方法采用SPSS 21.0软件进行统计分析。多个实验组与对照组均数的比较采用方差分析的Dunnett⁃t检验,两样本均数的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 电离辐射条件下肺癌细胞中LINP1的表达水平为了探索LINP1在NSCLC电离辐射抗性中的作用,首先分别收集了0、2.0、4.0、8.0、16.0 Gy照射后的H1299细胞,并通过qRT⁃PCR检测电离辐射条件下肺癌细胞中LINP1的表达水平,结果显示:照射后LINP1的表达均明显升高,提示LINP1可能在NSCLC的电离辐射抗性中发挥作用。且在8.0 Gy电离辐射照射下,细胞中LINP1的表达量最高(图1),因此后续选择8.0 Gy作为照射剂量。
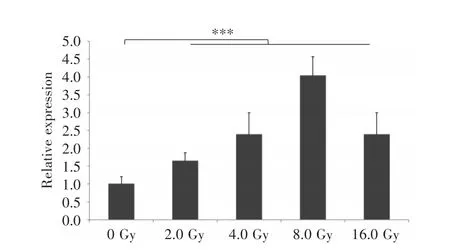
图1 qRT⁃PCR检测电离辐射条件下H1299细胞中LINP1的表达水平Fig.1 Expression of LINP1 in H1299 cells under ionizing radiation assessed by qRT⁃PCR
2.2 敲减LINP1抑制电离辐射条件下H1299细胞的增殖能力本研究使用RNA干扰在H1299细胞中沉默LINP1,并采用qRT⁃PCR验证了敲减效率(图2)。为了研究LINP1对电离辐射条件下非小细胞肺癌增殖能力的影响,对转染24 h后的H1299细胞进行8.0 Gy电离辐射照射,采用CCK⁃8方法和克隆形成实验对其增殖能力进行分析,其结果显示:8.0 Gy照射后H1299细胞的增殖能力明显下调,且敲减组相比siNC组增殖能力(图3A)和克隆形成能力(图3B)进一步降低。以上结果表明敲减LINP1抑制电离辐射条件下H1299细胞的增殖。
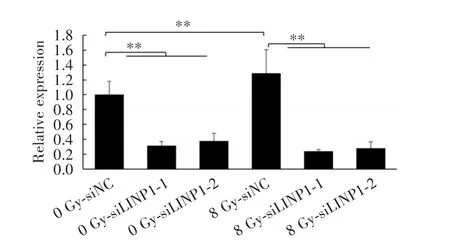
图2 qRT⁃PCR检测H1299细胞中LINP1的敲减效率Fig.2 Expression of LINP1 in H1299 cellsafter LINP1 knockdown assessed by qRT⁃PCR

图3 电离辐射条件下敲减LINP1后对H1299细胞增殖能力和克隆形成的影响Fig.3 Effect of LINP1 knockdown on proliferation and clone formation of H1299 cells under ionizing radiation
2.3 敲减LINP1促进电离辐射下肺癌细胞的DNA损伤本研究通过彗星电泳和Western blot蛋白检测DNA损伤修复相关蛋白γ⁃H2AX来观察肺癌细胞H1299中DNA损伤的变化情况。彗星电泳结果显示:8.0 Gy照射组的彗星拖尾更长,Tail DNA%、Tail Length、Comet Length、Tail Moment、Olive Tail Moment这5个特异指标明显升高(表1),DNA损伤明显增加;且电离辐射条件下,与转染siNC的H1299细胞相比,转染siLINP1⁃1和siLINP1⁃2的H1299细胞5个特异指标明显进一步升高,DNA损伤进一步增加,差异有统计学意义(P<0.01,图4)。Western blot结果显示8.0 Gy电离辐射条件下γ⁃H2AX蛋白表达明显增加;在电离辐射条件下敲减LINP1进一步提高了γ⁃H2AX的表达(图5)。以上结果说明敲减LINP1能进一步增加电离辐射条件下H1299的DNA损伤。
表1 彗星电泳分析电离辐射条件下敲减LINP1后H1299细胞各指标的影响Tab.1 Comet electrophoresis analysis of the effects of LINP1 knockdown on various indicators of H1299 cells under ionizing radiation ±s

表1 彗星电泳分析电离辐射条件下敲减LINP1后H1299细胞各指标的影响Tab.1 Comet electrophoresis analysis of the effects of LINP1 knockdown on various indicators of H1299 cells under ionizing radiation ±s
注:*P<0.05,**P<0.01,***P <0.001
组别0 Gy⁃siNC 0 Gy⁃siLINP1⁃1 0 Gy⁃siLINP1⁃2 8.0 Gy⁃siNC 8.0 Gy⁃siLINP1⁃1 8.0 Gy⁃siLINP1⁃2 Comet Length 257.56±9.82 305.80±6.23*301.13±9.76***412.65±9.95***376.41±10.43***412.90±10.58 Tail Length 12.73±10.67 30.17±10.20***30.15±7.73***63.48±9.60***81.75±8.80***75.11±9.28***Tail DNA Percent%5.01±2.94 11.02±9.06***13.90±8.91***13.61±7.00***20.59±7.02***25.99±8.28***Tail Moment 22.74±5.94 29.67±9.39*38.59±10.91***38.93±9.72***40.80±9.65 45.73±10.62**Olive Tail Moment 12.86±8.35 20.28±8.20***18.98±3.87**31.65±7.71***36.48±8.79*44.10±8.85***

图4 彗星电泳检测电离辐射条件下敲减LINP1后H1299细胞DNA损伤变化情况Fig.4 DNA damage of H1299 cells with LINP1 knockdown under ionizing radiation detected by Comet assay

图5 Western blot检测电离辐射条件下敲减LINP1后H1299细胞蛋白γ⁃H2AX的变化Fig.5 The changes of γ⁃H2AX of H1299 cells with LINP1 knockdown under ionizing radiation detected by Western blot
3 讨论
放射治疗是利用放射线如放射性同位素产生的射线和各类X线治疗机或加速器产生的X线、电子束、质子束及其他粒子束等治疗疾病,是恶性肿瘤治疗的重要方法之一,可用于治疗几乎所有类型的实体瘤,为肿瘤的治疗提供了更简单更安全有效的治疗方案。随着特异性增强靶区剂量、减少周边组织和器官非特异性损伤的放疗技术的迭代更新,放疗技术日趋完善,在临床癌症治疗中得到了更广泛的应用[9]。然而晚期肺癌对放射治疗不敏感,具有电离辐射抗性是一大问题。而放射治疗的主要作用靶点是癌细胞的DNA,引起DNA损伤,进而杀死癌细胞,因此如何增加电离辐射对癌细胞的DNA损伤是研究如何减弱电离辐射抗性的关键。随着近年来生物靶向治疗结合放射治疗受到越来越广泛的关注[20-21],长链非编码RNA在DNA损伤和电离辐射抗性中发挥的作用也逐渐被揭示。
在本研究中首先通过梯度剂量照射处理后发现LINP1显著升高,并且8.0 Gy电离辐射处理下最为明显。LINP1作为一种在三阴性乳腺癌(TNBC)中促进治疗耐药性的LncRNA首次被发现,研究表明LINP1能够通过充当Ku80和DNA⁃PKcs的连接支架来增强DNA双链断裂的修复,并且结合依赖ATP的DNA螺旋酶复合物Ku80⁃Ku70异质二聚体,与断裂的末端结合,形成一个钳形复合体,将依赖DNA的蛋白激酶催化亚基DNA⁃PKcs招募至损伤部位,促进断端的连接修复,从而协调非同源末端连接(NHEJ)途径[22]。此外,有研究在宫颈癌放射治疗中,LINP1从细胞质转位至细胞核结合Ku80和DNA⁃PKcs以促进放疗时的DNA损伤修复,敲减LINP1的表达则显著增强电离辐射后细胞凋亡水平,进而降低宫颈癌细胞对电离辐射的敏感性[23]。以上研究提示LINP1在DNA损伤及辐射抗性中可能发挥着作用,但目前关于LINP1与NSCLC DNA损伤以及辐射抗性的研究几乎未见有,因此本文研究了LINP1对电离辐射下NSCLC DNA损伤效应的影响,探索能够增强NSCLC放射敏感性的治疗方案。
本研究首先通过qRT⁃PCR检测电离辐射对肺癌细胞中LINP1表达情况的影响,结果显示,在电离辐射条件下肺癌细胞中LINP1的表达上调,提示电离辐射与LINP1的变化有明确的诱导关系。在通过siRNA敲减LINP1表达后,电离辐射条件下的NSCLC H1299的增殖能力和克隆形成能力进一步下降,提示敲减LINP1能够进一步加强电离辐射对NSCLC增殖的抑制作用,这与LINP1在宫颈癌中的研究结果一致。
在明确LINP1能增强细胞的增殖能力后本研究对H1299细胞的DNA损伤和DNA损伤修复进行了探索。彗星电泳实验发现敲减LINP1能够增强电离辐射对NSCLC的DNA损伤作用。当DNA发生内源性或外源性损伤时,形成双链断裂(DS⁃Bs),组蛋白H2AX发生磷酸化。这种新磷酸化的蛋白质γ⁃H2AX是招募和定位DNA修复蛋白的第一步。γ⁃H2AX病灶迅速形成,这些病灶以1∶1的方式代表DSB,可以用作损伤的生物标志物[24-25]。Western blot结果表明在电离辐射条件下,敲减LINP1后γ⁃H2AX的表达增加,进一步说明LINP1可能通过DNA损伤和DNA损伤修复相关通路来抑制NSCLC细胞DNA损伤效应从而导致电离辐射抗性的产生。
综上所述,本研究探讨了LINP1电离辐射条件下在NSCLC中的生物学作用,揭示了LINP1抑制NSCLC中DNA损伤增强其电离辐射抗性的作用,为NSCLC患者尤其是晚期患者的电离辐射治疗与抑制LINP1的生物靶向治疗的联合应用提供新的思路和科学依据,但目前本研究结论待体内实体瘤实验中进一步充实,其具体是通过何种机制发挥DNA损伤抑制作用及电离辐射抗性作用有待更进一步研究。
