一株高效溶磷菌的条件优化及其促生特性研究
2022-02-02李思思符运会屈建航
李思思,符运会,罗 宇,周 佳,赵 帅,屈建航
(河南工业大学 生物工程学院,河南 郑州 450001)
磷元素是植物生长的限制因子之一,缺磷会导致出现生长缓慢、产量降低等现象[1],然而土壤中95%以上的磷是以难溶性磷酸盐形式存在的无效磷,不能被植物吸收利用[2-3]。在农业生产中主要通过施加磷肥来缓解土壤缺磷状况,满足作物对磷的生长需求。有研究表明,施入土壤的磷肥当季利用率只有10%~25%[4],大部分的水溶性磷与土壤中的金属离子螯合成难溶性磷,造成土壤板结、肥力降低等现象[5-6]。
溶磷菌是一类能够溶解难溶性磷酸盐或有机磷的微生物,它可以参与到土壤生态系统的物质循环中,间接促进植物的生长发育[7]。因此,利用溶磷微生物提高土壤磷的有效性具有重要意义。目前,已发现的溶磷微生物属主要有芽孢杆菌属(Bacillus)[8]、假单胞菌属(Pseudomonas)[9-10]、不动杆菌 属(Acinetobacter)[11]、伯 克 霍 尔 德 菌 属(Burkholderia)[6]、青霉菌属(Penicillium)、曲霉菌属(Aspergillus)[12]等。溶磷微生物对土壤磷养分循环和植物生长具有重要影响,同时还可以有效缓解土壤矿质化污染问题,具有较好的应用价值及生态效益[6-7,13]。如何利用溶磷微生物提高土壤磷利用率,减少磷肥使用量,仍是目前研究的热点内容之一。
沉积物是微生物天然的种质资源库,具有丰富的微生物多样性[14]。目前,研究人员筛选到的溶磷菌多源自土壤[15-16],而关于沉积物中溶磷菌的研究报道相对较少。另外,已有报道的溶磷菌大多数停留在实验室摇瓶培养阶段,其在活化土壤磷方面的作用仍不明确,这制约了已报道溶磷菌的广泛应用。鉴于此,拟以筛选自太湖沉积物的高效溶磷菌1416X3 为对象,优化溶磷条件,明确其在土壤中的溶磷效果及其对玉米生长的影响,为该菌进一步研究和利用提供依据。
1 材料和方法
1.1 菌株
细菌1416X3 由河南工业大学环境微生物技术课题组于2014年筛选自太湖沉积物,该沉积物样品采集自太湖竺山湾(31°27′033″N,120°02′255″E),置于4 ℃冰箱中带回实验室,保存于-80 ℃冰箱。
1.2 培养基
NBRIP 培养基[17]:葡萄糖10 g、MgCl2·6H2O 5 g、MgSO4·7H2O 0.25 g、KCl 0.20 g、(NH4)2SO40.10 g、Ca3(PO4)25 g、蒸馏水1 L,pH 值7.0,115 ℃灭菌30 min。
LB 培养基[17]:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、琼脂粉15 g、蒸馏水1 L,pH 值7.0~7.2,121 ℃灭菌20 min。
1.3 溶磷菌1416X3的鉴定
形态学观察及生理生化特性鉴定参照《常见细菌系统鉴定手册》[18]进行。采用SDS-碱裂解法提取细菌DNA,利用通用引物27F 和1492R 进行16S rRNA 基因PCR 扩增[19]。扩增产物用琼脂糖凝胶电泳检测并进行核苷酸序列测定,所得序列在GenBank数据库中进行对比,采用MEGA 7.0软件以邻近法构建系统发育树。
1.4 溶磷菌1416X3的溶磷条件优化
采用不同碳源(葡萄糖、麦芽糖、果糖、蔗糖、可溶性淀粉)代替NBRIP 培养基中的碳源,通过钼锑抗比色法测定上清液有效磷含量,确定最佳碳源;采用不同氮源(尿素、硫酸铵、硝酸钾、硫酸铵、胰蛋白胨)代替NBRIP 培养基中的氮源,通过钼锑抗比色法测定上清液有效磷含量,确定最佳氮源。在其他条件不变的情况下,分别改变培养液的pH 值(6.0、6.5、7.0、7.5、8.0)和 培 养 温 度(25、28、37、40 ℃)以及接种量(1%、2%、3%、5%、7%、9%、10%),选取上清液中可溶性磷含量最高时的条件进行后续试验[20]。
1.5 溶磷菌1416X3的土壤溶磷试验
供试土壤取自校园(34°83′N,113°55′E)菜地(西南方向)及花圃(东北方向)5~10 cm 土壤。其中,菜地土壤全磷含量为13.85 mg/kg、速效磷含量为4.53 mg/kg;花圃土壤全磷含量为26.74 mg/kg、速效磷含量为4.20 mg/kg。将土壤自然风干后过0.85 mm 孔径筛子,用250 mL 三角瓶分装100 g 土壤,121 ℃、30 min 间歇灭菌3 次。1416X3 处理是向瓶中加2 mL 的1416X3 菌悬液(OD600为1),对照(CK)则是加入等体积无菌水。之后向土壤中添加1%的葡萄糖,土壤湿度为40%,28 ℃培养。在0、1、3、5、8、12、17、23 d 时采样,测定土壤速效磷、pH 值变化以及菌株1416X3的定殖情况[21-23]。
1.6 溶磷菌1416X3对玉米促生效果试验
将供试土壤风干过筛后做灭菌处理备用,每盆分装1.2 kg 土壤。使用75%乙醇对玉米种子消毒,之后用无菌水冲洗干净,置于28 ℃培养箱催芽,每盆播种3 粒种子。将1416X3 种子液培养12 h 后离心,并用无菌水重悬,制备成OD600为1 的菌悬液,接入等体积的无菌水作为对照(CK),采用浇根方式在玉米苗根际接入溶磷菌。自然条件下室内培养,试验期间保持土壤湿润,25 d 后收获植株,测定株高、鲜质量、干质量和全磷含量;采集植株根际土壤,测定土壤速效磷、pH值[22-23]。
我在给四年级学生上《风向和风速》一课时,让学生担任“教师”的角色,让学生说关于风的谜语,再由学生自己回答,让学生介绍八大方位图和风速歌,自己写板书,鼓励学生发挥各自的聪明才智动手制作风向标和风旗。有的学生不善于表达,有的学生不敢展示自己的风向标等等。我大胆的锻炼学生的能力,对学生不断的鼓励,积极的赞扬,此时,在这个时候,我指出学生出现的问题,学生会从心理改正错误,激励自己进步。
1.7 数据处理
采用SAS 9.4 软件进行数据统计及差异显著性分析[24],利用Origin 9.0软件作图[25]。
2 结果与分析
2.1 溶磷菌1416X3的形态学、生理生化及分子生物学鉴定
溶磷菌1416X3 为革兰氏阴性菌,长杆状,菌落为黄色圆形(图1)。接触酶反应、氧化酶反应、硝酸盐还原反应、荧光反应、脲酶反应、淀粉水解反应均呈阳性,明胶水解反应、精氨酸水解酶反应均呈阴性。对新霉素、四环素敏感,对氨苄青霉素、链霉素、氯霉素、青霉素、卡那霉素不敏感。在0~3%NaCl条件下、pH值介于4~8时生长。
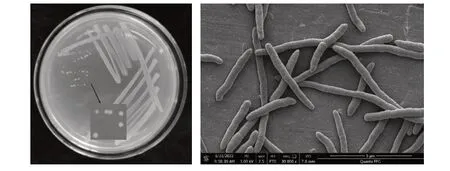
图1 溶磷菌1416X3的菌落形态及电镜扫描结果Fig.1 Colony morphology and scanning electron result of phosphate-solubilizing bacterium 1416X3
将菌株1416X3的16S rRNA 基因序列(登录号:MK280701.1)输入GenBank 数据库中进行BLAST 对比 发 现,其 与Pseudomonas fildesensisKG01(NR 170438.1,假单胞菌属)的相似度最高,同源性为99.65%。利用MEGA 7.0 软件构建系统发育树(图2),结合菌落形态及生理生化特征,初步鉴定菌株1416X3为假单胞菌(Pseudomonassp.)。

图2 溶磷菌1416X3基于16S rRNA基因序列的系统发育树Fig.2 Phylogenetic tree based on 16S rRNA gene sequences of phosphate-solubilizing bacterium 1416X3
2.2 溶磷菌1416X3溶磷条件优化结果
菌株1416X3 的溶磷条件优化结果见图3。碳源对菌株1416X3 溶磷能力影响见图3a,不同碳源间菌株1416X3 溶磷能力差异显著(P<0.05)。以葡萄糖为碳源时,溶磷量最高,为793.16 mg/L,对应pH 值为3.72;当碳源为麦芽糖时,溶磷效果最差,溶磷量仅为40.12 mg/L,此时pH 值为7.00。因此,选择葡萄糖为菌株1416X3溶磷的最佳碳源。

图3 不同因素对溶磷菌1416X3溶磷能力的影响Fig.3 Effect of different factors on the phosphorus solubilization capacity of phosphate-solubilizing bacterium 1416X3
氮源对菌株1416X3 溶磷能力影响如图3b 所 示。菌株1416X3 在5 种氮源培养基的溶磷效果从大到小依次为硫酸铵、草酸铵、胰蛋白胨、尿素、硝酸钾,且差异达显著水平(P<0.05)。以硫酸铵为氮源时,菌株1416X3 溶磷量最高,为827.12 mg/L。因此,选择硫酸铵为1416X3最佳溶磷氮源。
初始pH 值对菌株1416X3 溶磷能力影响见图3c。在不同初始pH 值下,菌株1416X3 都有一定的溶磷能力。pH值为6.0、7.0、7.5时,溶磷量差异不显著(P>0.05)。其中,pH 值为7.0 更趋近于菌株原始生长环境,此时溶磷量为774.52 mg/L。pH 值为8.0时,溶磷量最低,为608.06 mg/L。因此,选择pH 值7.0为最佳初始pH值。
接种量对菌株1416X3 溶磷能力影响如图3e 所示。接种量介于1%~5%时,菌株1416X3 的溶磷量差异不显著(P>0.05);接种量大于5%时,溶磷量逐渐降低,且不同接种量之间差异显著(P<0.05)。其中,接种量为1%时,溶磷量最高,为765.46 mg/L,此时pH 值为3.99。因此,菌株1416X3 溶磷的最佳接种量为1%。
2.3 溶磷菌1416X3土壤溶磷试验结果
2.3.1 溶磷菌1416X3 在土壤中的定殖情况 菌株1416X3 在土壤中的定殖情况如图4 所示。将菌株1416X3分别接种到菜地以及花圃中,菌落数分别在第5 天、第3 天达到最大,分别为35.4×107、30.4×107cfu/g,之后开始逐渐下降。在第23天时,菜地土壤菌落数为6.05×107cfu/g,花圃土壤菌落数为0.97×107cfu/g。综上,菌株1416X3 在菜地土壤中具有较好的定殖能力。

图4 溶磷菌1416X3在菜地、花圃中的定殖情况Fig.4 Colonization of vegetable patch and flower nursery by the phosphate-solubilizing bacterium 1416X3
2.3.2 溶磷菌1416X3 对土壤速效磷含量及pH 值变化的影响 由图5可知,不论是菜地还是花圃,接种1416X3 的土壤速效磷含量均高于对照,且该菌株能够降低土壤pH 值。接种1416X3 的菜地第3 天土壤速效磷含量达到最高,为7.87 mg/kg,较对照增加了59.46%;接种1416X3 的花圃第8 天土壤速效磷含量达到最大,为7.74 mg/kg,较对照增加了118.87%。接种1416X3 的菜地和花圃土壤pH 值在第12 天达到最低。综上所述,接种1416X3 的2 种土壤速效磷含量均明显高于对照,且均能够降低土壤pH值,说明该菌株具有较好的溶磷效果。
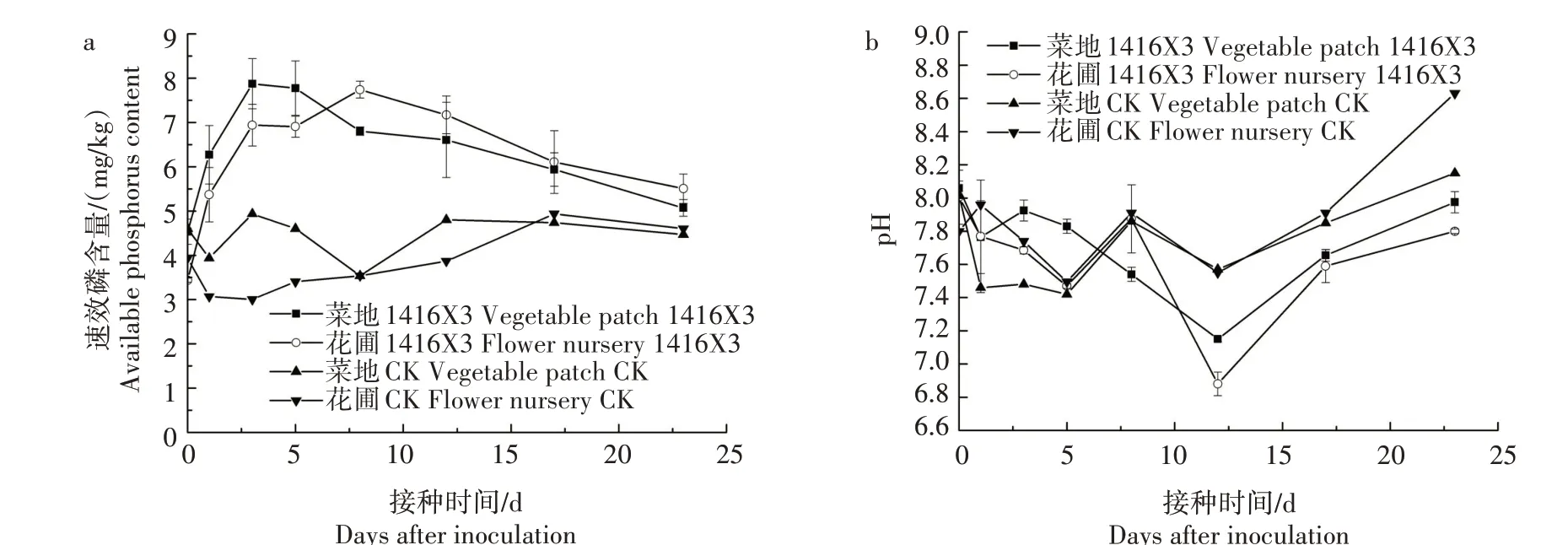
图5 溶磷菌1416X3对土壤速效磷含量以及pH值的影响Fig.5 Effect of phosphorus-solubilizing bacterium 1416X3 on soil available phosphorus content and pH
2.4 溶磷菌1416X3的盆栽试验结果
2.4.1 溶磷菌1416X3 对玉米幼苗生长的影响 盆栽试验结果(表1)表明,菌株1416X3 在土壤中具有较好的促生长活性,可以明显促进玉米幼苗的生长。第25天菌株1416X3处理玉米的根长、茎粗、鲜质量、干质量、全磷分别为29.47 cm、4.62 mm、7.77 g、0.85 g、2.06 g/kg,较 对 照 分 别 提 高 了114.02%、43.03%、80.28%、80.85%、88.99%,且差异均达到显著水平(P<0.05)。另外,1416X3 处理株高为51.47 cm,较对照提高了16.90%。综上所述,菌株1416X3 对玉米植株具有较好的促生作用。

表1 溶磷菌1416X3对玉米幼苗生长的影响Tab.1 Effect of phosphorus-solubilizing bacterium 1416X3 on the growth of maize seedlings
2.4.2 溶磷菌1416X3 对土壤速效磷以及pH 值的影响 由图6 可知,1416X3 处理在接种4、8、12 d 时可以明显提高土壤速效磷含量,且降低土壤pH 值。由图6a 知,1416X3 在接种4、8、12 d 时,其与对照土壤速效磷含量差异达显著水平(P<0.05)。其中,1416X3 处理土壤速效磷含量在接种8 d 时达到最大,为11.38 mg/kg,较对照提高了111.80%。此时,土壤pH 值为7.96(图6b),与对照差异也达到了显著水平(P<0.05)。接种1416X3 的处理,土壤pH 值呈先降低后上升趋势,在接种16 d 时,土壤pH 值降到最低,为7.00,与对照差异达显著水平(P<0.05)。随着接种时间的推移,在土壤中营养物质逐渐消耗以及金属离子等多种因素共同作用下,溶磷菌1416X3的活性受到影响,这导致溶出的速效磷再次在土壤中被固定,从而导致土壤速效磷含量降低,pH值上升。
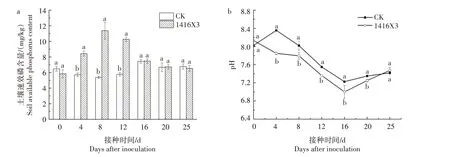
图6 接种溶磷菌1416X3后不同时间土壤速效磷含量及pH值变化Fig.6 Changes of soil available phosphorus content and pH value at different time after inoculation of phosphorussolubilizing bacterium 1416X3
3 结论与讨论
假单胞菌属是主要溶磷微生物之一,较多研究表明,该属菌株对难溶性磷酸盐有较好的溶解效果[9-10]。孙珊等[26]筛选的假单胞菌CJT-1 对磷酸钙和磷矿粉的溶磷量分别达到224.51、120.59 mg/L;乔志伟等[27]筛选出的最佳溶磷组合(拉恩式菌W2、假单胞菌W3、假单胞菌W4)在最优培养条件下,溶磷量为664.29 mg/L。本研究中,溶磷菌1416X3 经鉴定为假单胞菌(Pseudomonassp.),对Ca3(PO4)2的溶磷量为827.12 mg/L,具有良好的溶磷效果。
碳源、氮源作为微生物的主要能源,影响微生物的生长繁殖和生理生化代谢等。溶磷菌在以不同的碳、氮源为营养物质时,会表现出不同的溶磷能力。柯春亮等[28]筛选出的嗜气芽孢杆菌B3-5-6的最优溶磷碳、氮源分别为蔗糖、硫酸铵。本研究中,菌株1416X3 以葡萄糖为碳源时,具有较强的溶磷能力,以麦芽糖为碳源时,溶磷量最低;在氮源利用方面,菌株1416X3 对铵态氮的利用效果较硝态氮好,这与王俊娟等[29]的研究结果相似。本研究中,菌株1416X3 以葡萄糖为碳源、硫酸铵为氮源、初始pH 值为7.0、接种量为1%、温度为28 ℃时溶磷效果最好。有研究表明,某些溶磷菌在无机磷液体培养中具有较高的溶磷活性,但施入土壤后却未表现出对磷的活化能力,这可能是由于外源微生物在土壤中需要与土著微生物竞争生态位,以及土壤环境复杂等因素导致溶磷菌不能有效定殖、发挥溶磷作用[7,30]。在本研究土壤溶磷试验中,溶磷菌1416X3能够活化土壤磷,增加速效磷含量,在菜地接种第3天和和花圃接种第8天土壤中速效磷含量分别提高了59.46%、118.87%,且在土壤中有较好的定殖能力。盆栽试验第8天,施加1416X3的处理速效磷含量为11.38 mg/kg,相比于对照增加了111.80%。随着现代农业的发展,大量的促生菌被开发为菌剂并应用于农业生产中[31-32],但大多数已报到的功能菌仅具有单一的固氮或溶磷能力,为了满足实际生产需要,有研究人员将不同功能的微生物进行复配发现,菌株之间协同共栖,更有利于功能菌发挥作用[13]。在溶磷微生物的促生研究中,菌株的实际应用效果是评价促生作用的重要指标。魏畅等[33]的研究表明,接种溶磷菌W6的小麦生长30 d后,小麦的干质量、株高、全磷含量分别增加了70.5%、32.1%、94.2%。本研究盆栽试验中,施加1416X3 的处理组玉米根长、茎粗、鲜质量、干质量、全磷相较对照处理分别提高了114.02%、43.03%、80.28%、80.85%、88.99%,说明该菌株可以提高玉米对磷的利用效率,促进植株的生长。不同溶磷菌可通过分泌不同的有机酸或者通过表达磷酸酶等提高磷的溶出,张昊鑫等[34]筛选出的威兹曼芽孢杆菌YC9通过分泌吲哚乙酸促进植物根系的生长,有利于植物汲取更多的营养和水分,从而达到增产目的。可见,溶磷菌对植物的促生作用是多种因素共同作用的结果,各因素之间的相互关系有待于深入研究,后续将继续探索溶磷菌1416X3 对植物的促生机制,为其在农业生产中的进一步应用提供依据。
