亚铁离子的引入对Bi2Fe4O9纳米颗粒光催化性能的影响
2022-02-01龚伟龙严发龙高凯歌
龚伟龙,严发龙,高凯歌
(扬州大学物理学院,扬州 225000)
0 引 言
铁酸铋作为一种三元金属氧化物,以其多功能性和广泛的应用潜力受到了越来越多的关注[1-2]。研究发现,铁酸铋具有丰富的物理性质,包括弱磁性[3-5]、铁电性[6-8]和多种催化性质[9-11]。铁酸铋在陶瓷电容器、铁电存储器、信息存储、自旋电子学、传感器、铁电超快光电器件、多种环境净化催化剂等领域具有应用潜力[12-14]。具有弱磁性的Bi2Fe4O9是一种多功能催化剂,可以用来清除有机污染物[15-17]。其降解有机物的途径可有两种,第一种是通过紫外可见光下的光芬顿氧化和光催化,第二种是通过黑暗环境下的类芬顿氧化反应[18-20]。因为具有弱磁性,铁酸铋催化剂可以通过磁性分离技术从处理过的废水中回收[21],大幅降低催化成本,有助于光催化技术的应用。然而纯的Bi2Fe4O9晶体的物理性质还不足以达到应用的程度,因此掺杂改性成为研究的重点。一般来说,掺杂首选同价态的原子,同价态原子掺杂对晶格的匹配度更高,产生的缺陷更少。但是不同价态的原子掺杂可产生阴离子或者阳离子空位,这对于晶体的磁性、电子结构等均有显著的影响[22-24]。目前为止,Bi2Fe4O9纳米颗粒中存在的缺陷和Fe的价态的变化对其光催化性能的影响还鲜有报道。纯的Bi2Fe4O9晶体中的Fe为三价,本文尝试用二价铁离子取代其中的三价铁离子,形成二价铁离子掺杂的Bi2Fe4O9,希望通过二价取代效应来改变Bi2Fe4O9的电子结构从而提高其催化性能。本文利用水热法制备了块状Bi2Fe4O9纳米颗粒,通过在原料中加入FeCl2的方法,成功地在Bi2Fe4O9纳米颗粒中引入了更多的氧空位缺陷和更多的低价态铁离子,研究更低价态铁的引入对Bi2Fe4O9光催化性能的影响。
1 实 验
1.1 实验原料和制备方法
将(4-x) mmol Fe(NO3)3·9H2O、2 mmol Bi(NO3)3·5H2O、xmmol FeCl2·4H2O(x分别取0、0.2、0.4,分别记为样品S1、S2、S3)溶入4 mL 2 mol/L 稀硝酸中,然后在溶液中缓慢加入8 mL 12 mol/L NaOH水溶液,搅拌15 min。将溶液转移至水热釜中,在200 ℃温度下反应24 h,并在室温下自然降温至室温。将反应釜中的混合液体离心得到固体颗粒,并用去离子水洗涤两遍,乙醇洗涤两遍,之后放入真空干燥箱干燥12 h。最终得到三份样品:S1、S2、S3。所用化学试剂均为分析纯,厂家为阿拉丁。
1.2 性能测试与表征
样品的粉末X射线衍射图谱(PXRD)使用日本Shimadzu公司的Mini-Flex600型X射线衍射仪进行测试,靶材为Cu,扫描范围为10°~90°,测试电压和电流分别为40 kV和20 mA。
样品的紫外可见吸收谱使用美国Varian公司的Cary 5000紫外-可见-近红外吸收光谱仪进行测试,扫描的波长范围为200~1 200 nm。
样品的X射线光电子能谱(XPS)使用美国ThermoFisher Scientific公司的ESCALAB250Xi光电子能谱仪进行测试。
样品的扫描电子显微镜(SEM)照片采用日立S-4800场发射扫描电镜(FESEM)进行测试。
光催化降解染料分子测试装置:样品的光催化实验使用的光源为500 W汞灯,使用的试管为直径25 mm,高200 mm的石英管,使用的染料为1×10-5mol/L的甲基橙溶液。样品的光催化实验每次取200 mg Bi2Fe4O9样品,100 mL甲基橙溶液。考虑到光芬顿效应,双氧水的添加可有效提高Bi2Fe4O9的光催化性能,Bi2Fe4O9的光催化实验分为3个部分:(1)不加双氧水光催化;(2)加20 μL双氧水光催化;(3)加40 μL双氧水光催化。
光催化降解染料分子实验过程:分别取200 mg S1、S2、S3加入到含有100 mL甲基橙溶液的试管中,再向试管中加入对应量的双氧水,搅拌30 min让染料分子充分吸附在纳米颗粒上,将试管放入光催化测试装置中,每20 min取5 mL溶液,取样溶液离心后取上层清液,测量溶液中的染料分子的特征荧光强度,通过荧光强度与暗吸附反应后的初始荧光强度的比值计算出C/C0。
2 结果与讨论
2.1 XRD分析
S1、S2、S3三个样品的PXRD图谱如图1所示。将测试得到的PXRD数据利用GSAS软件进行Rietveld精修,精修结果如图1所示,可以看到精修得到的衍射峰的峰形和峰位和实验结果均符合得很好,并且没有其他杂峰出现,证明三个样品均为纯的结晶度较好的Bi2Fe4O9。Bi2Fe4O9室温下的结构为Pbam空间群,通过Rietveld精修可以得到三个样品的晶格参数。S1的晶格参数为a=0.797 2 nm,b=0. 843 5 nm,c=0.599 3 nm,α=90°,β=90°,γ=90°; S2的晶格参数为a=0.795 9 nm,b=0.843 6 nm,c=0.599 0 nm,α=90°,β=90°,γ=90°; S3的晶格参数为a=0.796 4 nm,b=0.844 6 nm,c=0.600 0 nm,α=90°,β=90°,γ=90°。从精修得到的晶格参数可以看到三个样品的晶格参数几乎没有变化,说明FeCl2的加入对Bi2Fe4O9结构影响比较小。

图1 制备得到的Bi2Fe4O9样品的PXRD衍射图谱,从上到下依次为S1,S2,S3。×是实际测量结果,实线是Rietveld精修结果,|是Bi2Fe4O9的衍射峰位置Fig.1 XRD patterns of the synthesized Bi2Fe4O9, from top to bottom, S1, S2, S3. “×”is the measured data, the line is the Rietveld refinement result and “|”is the diffraction peak position of Bi2Fe4O9 XRD pattern
2.2 UV-Vis分析
分别测量三个样品S1、S2、S3的紫外可见吸收谱,如图2(a)所示。通过Tauc plot变换(n取2),将横轴转换为入射光子能量hν,纵轴变换为(Ahν)2,A为吸收度,可得到三个样品中对光催化起主要作用的禁带宽度分别为2.06 eV、2.02 eV、1.96 eV。图2(b)为Tauc plot变换后的禁带宽度拟合图。可见FeCl2的加入降低了Bi2Fe4O9的禁带宽度,且加入量越大,禁带宽度越小。禁带宽度的减小可能是由于更多低价态的铁离子被引入Bi2Fe4O9晶体表面。
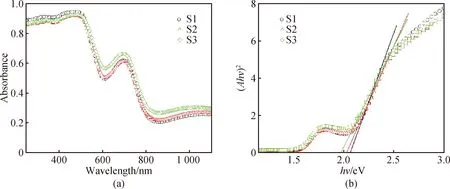
图2 三个样品的紫外可见吸收光谱(a)和Tauc plot变换得到禁带宽度拟合图(b)Fig. 2 UV-Vis absorption spectra (a) of the three samples, and band gap fit (b) obtained by Tauc plot transformation
2.3 SEM分析
用扫描电子显微镜表征三个样品的表面形貌,如图3所示。从图中可以看到合成的三个样品均呈正方形片状纳米晶,正方形边长约1 μm,厚度约0.2 μm。SEM照片中看不到明显的其他形状的杂相形貌,说明制备的是比较纯的Bi2Fe4O9纳米晶。

图3 样品S1、S2、S3的表面形貌Fig.3 Surface morphology of samples S1, S2, S3
2.4 Bi2Fe4O9的XPS分析
为了研究三个样品中Fe原子价态的变化,测量了三个样品的X射线光电子能谱(XPS)。图4为三个样品的Fe 2p电子能谱,并使用XPSpeak4软件进行了峰位拟合,可以发现三个样品表面均为Fe2+和Fe3+共存状态。无缺陷的Bi2Fe4O9晶体中是不含有二价铁离子的,然而水热法合成得到的Bi2Fe4O9样品不可避免地存在氧空位缺陷,尤其是纳米晶体,氧空位缺陷的产生使得样品中产生二价铁离子。通过XPSpeak4软件拟合得到的三个样品表面的二价铁Fe 2p3/2峰位和面积分别为S1:峰位709.49 eV,面积15 347; S2:峰位709.46 eV,面积19 803;S3:峰位709.49 eV,面积21 111。三价铁Fe 2p3/2峰位和面积分别为S1:峰位711.08 eV,面积30 803; S2:峰位711.06 eV,面积29 139;S3:峰位711.19 eV,面积23 024。根据每个样品中二价铁的Fe 2p3/2峰面积占比可以得到三个样品表面上二价铁在所有铁原子中的含量分别为S1:33.3%,S2:40.5%,S3:47.8%。XPS结果证明FeCl2的加入显著提高了Bi2Fe4O9样品表面的亚铁离子含量,这也就意味着可以通过添加FeCl2的方式在Bi2Fe4O9样品中引入更多的低价态铁离子。更多的低价态铁离子的引入可能是Bi2Fe4O9样品光学带隙降低的根本原因。表面更多的亚铁离子的引入可以显著影响Bi2Fe4O9光催化性能。
2.5 Bi2Fe4O9的光催化性能分析
为了充分比较FeCl2加入对Bi2Fe4O9的光催化性能的影响,将实验分为3个部分:(1)不加双氧水催化;(2)加20 μL双氧水催化;(3)加40 μL双氧水催化。双氧水的加入可以为光催化提供羟基自由基,提高光催化效率。
2.5.1 不加双氧水的Bi2Fe4O9光催化性能
各取200 mg样品S1、S2、S3,分别加入三根试管中,再分别取100 mL的1×10-5mol/L浓度的甲基橙溶液倒入三根试管中,搅拌30 min,使得溶液达到暗反应的吸附与解吸附平衡,然后放入光催化测试装置中,用500 W汞灯照明,每隔20 min对三根试管分别取一次样,测其特征荧光峰值,得到三个样品的甲基橙浓度随时间变化曲线。通过测量原溶液的荧光强度和搅拌30 min之后的溶液的荧光强度可以得到未加双氧水时,S1、S2、S3的暗吸附率分别为4.4%、44.4%和4.7%。由此可见氯化亚铁的加入不仅导致了光学带隙的变化,还大幅影响了Bi2Fe4O9的吸附性能,适当的亚铁离子引入可以增加Bi2Fe4O9纳米晶对染料分子的吸附能力。图5为不加双氧水时,三个样品的光催化性能曲线,可以看出,不加双氧水时S2的催化性能最好,其次是S1、S3。这说明适量的FeCl2加入可以改善Bi2Fe4O9的光催化性能。其中S2的吸附曲线在60 min时出现波动,这可能是由吸附解吸附平衡变化导致的,S2高达44.4%的吸附率使得其在光催化过程中可能出现了解吸附峰值。但是不加双氧水时,三个样品的光催化效率都很低,100 min时,降解率都不足70%。
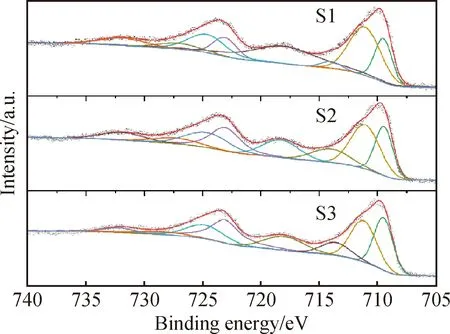
图4 样品S1、S2、S3的Fe 2p XPS曲线及拟合结果Fig.4 XPS curves and fitted results of Fe 2p in S1, S2 and S3
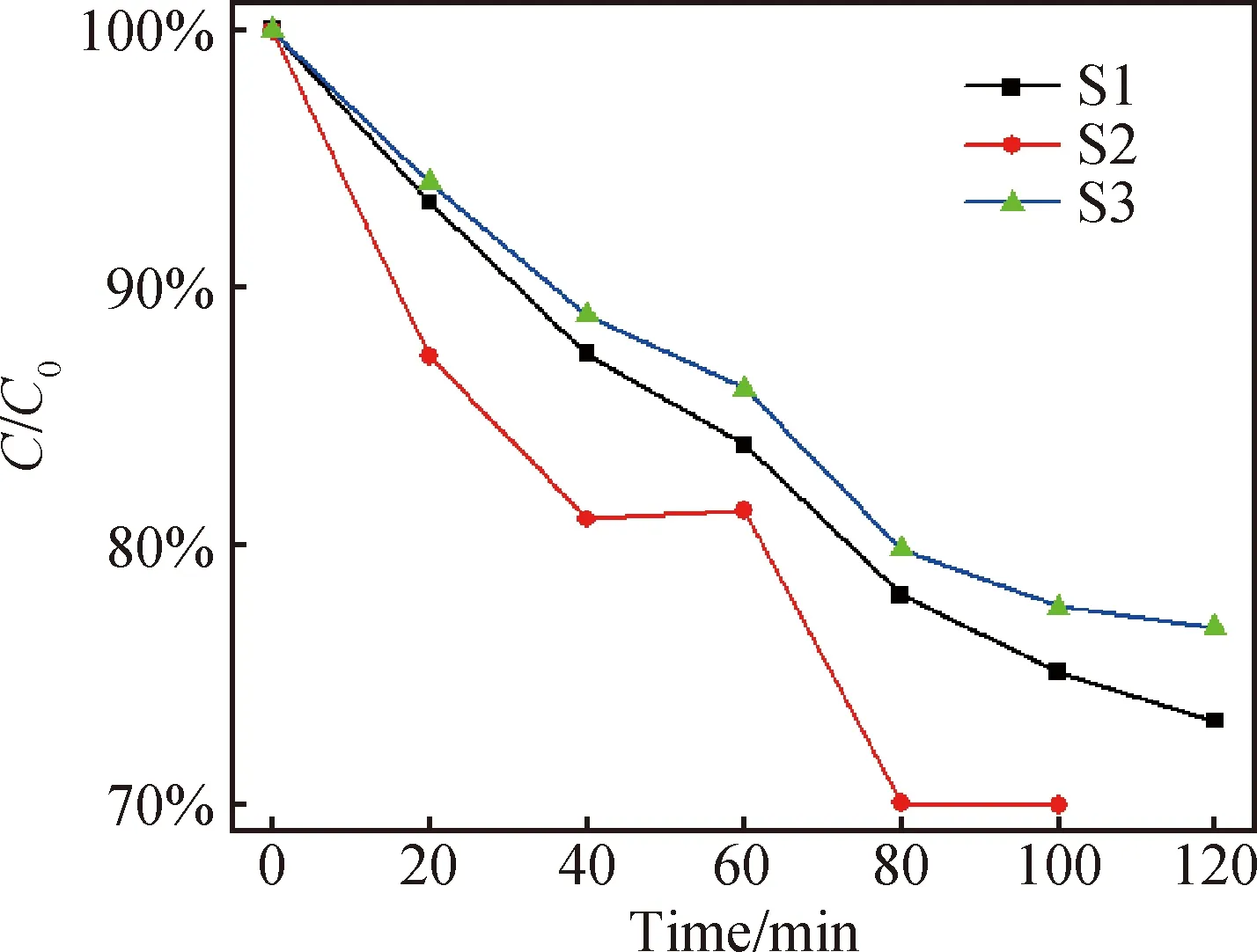
图5 不加双氧水时甲基橙浓度随时间变化曲线Fig.5 Variation of methyl orange concentration with time when no hydrogen peroxide is added
2.5.2 加20 μL双氧水的Bi2Fe4O9光催化性能
如上述实验过程配制光催化溶液,在三个光催化试管分别加入20 μL双氧水,搅拌30 min,通过测量溶液的特征荧光强度,得到S1、S2、S3三个样品的吸附率分别为32.776%、30.35%、34.019%。与不加双氧水的吸附率对比可以发现,双氧水的加入可以很大程度上影响样品的暗吸附率,这可能是由于羟基自由基的加入改变了晶体的表面活性,进而导致吸附率的变化。光催化实验条件同上,图6为加入20 μL双氧水溶液时测量得到的甲基橙降解曲线。从图中可以看到加入20 μL双氧水之后,三个样品的光催化性能均有明显提升,S1、S2、S3三个样品20 min的降解率分别达到77%、73%、88%。因为光催化实验装置的差距和光催化反应初始条件的不同,光催化性能很难与其他文献中的数据作对比。但是20 min达到88%降解率的结果与其他文献相比还是很优异的[25-26]。从降解速率上来说,S3>S1>S2。80 min后,三个样品的最终降解率均高于90%,分别为95.9%、94.7%、92.6%。S1、S2样品对应的降解曲线都是单调递减的,但是S3对应试管中的甲基橙浓度在汞灯照射后的40 min内都持续下降,40 min后浓度有所回升,推测可能是因为S3对应的吸附率最高,且过快的光催化降解速率使得解吸附速率大于吸附速率和降解速率导致40 min后浓度有所回升。综上可得,在加入20 μL双氧水的情况下,高浓度染料废液时S3的降解速率最快,其次是S1、S2。从降解率上来说S1>S2>S3。
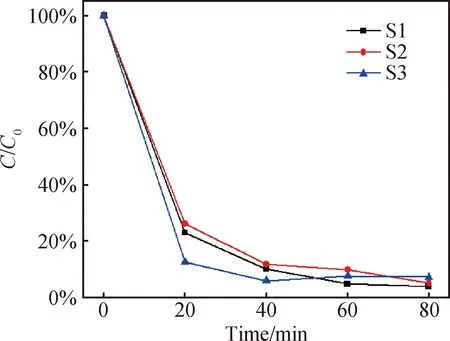
图6 加入20 μL双氧水时甲基橙浓度随时间变化关系Fig.6 Variation of methyl orange concentration with time when 20 μL of hydrogen peroxide is added
2.5.3 加40 μL双氧水的Bi2Fe4O9光催化性能
分别在各试管加入40 μL双氧水,其余实验条件同上。搅拌30 min后,可得S1、S2、S3三个样品的暗吸附率分别为7%、25.6%、31.7%。在500 W汞灯照射下,三个样品的降解曲线如图7所示,从图中可以看出20 min照射后,S1、S2、S3三个样品的降解率分别为80%、73%和19%。与加20 μL双氧水的结果对比,S3的光催化降解能力严重下降,S2的降解速率前期保持不变,后期略微下降,S1的降解速率前期提升,后期下降。这说明更多的双氧水不能提高Bi2Fe4O9的光催化性能,反而降低了其降解速率和最终降解率。更多的双氧水对S3的影响远高于S1和S2,这可能是因为双氧水的氧化能力导致S3晶体表面的更低价态的铁离子被氧化,产生了一种类似钝化的效果,进而降低了其光催化降解染料分子的能力。
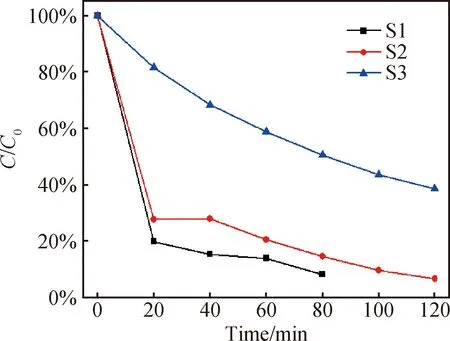
图7 加入40 μL双氧水时甲基橙浓度随时间变化关系Fig.7 Variation of methyl orange concentration with time when 40 μL of hydrogen peroxide is added
从本文的实验结果可以明显看出,双氧水的加入可以显著提高Bi2Fe4O9的光催化降解甲基橙的能力。据报道,双氧水增强铁氧化物的光催化性能可归因于传导电子清除和溶解的铁离子的芬顿反应的综合作用[27]。添加双氧水对样品光催化降解甲基橙能力的提升可能是通过下面列出的类似反应过程实现[25]。
H2O2+Bi2Fe4O9(e-)→·OH+OH-
(1)
(2)
Fe2++H2O2→Fe3++·OH+OH-
(3)
Fe3++H2O2→Fe2++HO2·+OH-
(4)
从上式可以看出,这一反应过程中需要亚铁离子的参与。普通的Bi2Fe4O9晶体中含有的二价铁离子数量很少,对此反应的增强能力有限。本文合成的Bi2Fe4O9纳米晶表面有大量二价铁离子,所以双氧水的加入使得这一反应得到加强。而FeCl2的加入在Bi2Fe4O9纳米晶表面产生了更多的二价铁离子,这更有利于芬顿效应的产生,从而提高Bi2Fe4O9纳米晶的光催化性能。
3 结 论
综上,通过控制水热法过程中FeCl2加入量合成了三个Bi2Fe4O9纯相纳米晶样品,三个样品微观形貌均呈正方形片状纳米晶,正方形边长约1 μm,厚度约0.2 μm。FeCl2的加入引入更多更低价态的铁离子,使得其光学带隙从2.06 eV降低到1.96 eV。实验证实适当的双氧水浓度和FeCl2的添加不仅可以提升Bi2Fe4O9对染料分子吸附性能还可以提高其光催化降解染料分子的速率。
