硫酸亚铁溶液氧化制备硫酸高铁条件探讨
2015-03-06李少龙孙宁磊赵鹏飞
李少龙, 孙宁磊, 李 斌, 赵鹏飞
硫酸亚铁溶液氧化制备硫酸高铁条件探讨
李少龙, 孙宁磊, 李 斌, 赵鹏飞
(中国恩菲工程技术有限公司, 北京 100038)
本文研究了硫酸亚铁溶液氧化制备硫酸高铁溶液过程的影响因素。研究发现,一定条件下,硫酸亚铁- 硫酸体系中,温度、氧分压及反应时间的增加可以提高二价铁的转化率;反应温度为110 ℃,釜表压2 bar,反应时间为4 h,可以获得90%的二价铁转化率。
三价铁; 二价铁; 氧化
在氧化浸出有色金属原料过程中,三价铁离子是一种非常优异的氧化剂,可以采用三氯化铁或者硫酸高铁溶液作为氧化剂,在辉铜矿、黄铜矿或者红合金的浸出过程中选择性浸出有价金属[1-2],而将非还原性物质留在浸出渣中,具有很高的利用效率。
然而,浸出后三价铁被还原转化成为二价铁,选择合理的方法使二价铁再生为三价铁返回浸出,是使得浸出工艺流程闭路的关键。
再生三价铁主要有电解法和氧化法。电解法再生三价铁有耗电量大、设备复杂等缺点;氧化法是采用氧化剂对二价铁进行氧化转化为三价铁,其氧化剂有很多种,采用空气或纯氧进行氧化是较为普遍的方法,这种方法不在体系中引入杂质离子,同时能把系统积累的二价铁氧化沉淀除去。
本文研究了在硫酸盐体系中,硫酸过量的情况下二价铁离子氧化成三价铁离子的工艺过程影响因素,为三价铁氧化浸出整套工艺流程的开发提供方向及依据。
1 试验部分
1.1 试验原料
试验采用化学药剂均为分析纯,配制一定浓度的硫酸亚铁溶液,加入硫酸配制成90 g/L硫酸的酸性溶液。
每次试验溶液量偏小,硫酸理论消耗量只有不到20 mL,很难连续计量加入,试验采用了反应前一次性加入的方式,且酸过量程度基本满足反应末期体系pH,不至于造成三价铁离子继续转化成为碱式硫酸铁或者氢氧化铁沉淀。
1.2 试验方法
试验中采用了常压反应及加压反应两种方式,取二价铁溶液,直接加入一定量的硫酸,在一定氧分压与反应温度下,反应过程中通入空气或者纯氧,搅拌反应一段时间后,分析溶液成分前后的变化。探索试验中采用了一般搅拌桨,通气气泡较大,与液体接触面小,氧溶解情况较差,从而造成了氧化率很低,正式条件试验中采用涡轮桨叶打散气流。
1.3 分析方法
元素成分的测定:化学滴定。二价铁转化率计算公式如下:
η=反应后液Fe3+浓度/原液中Fe2+浓度
(1)
2 试验结果及讨论
2.1 试验原理简述
二价铁氧化成三价铁离子反应原理如下:
2FeSO4+H2SO4+0.5O2=Fe2(SO4)3+H2O
(2)
图1为铁- 水系的电位pH图(25 ℃),从图1可以看出,二价铁、三价铁离子稳定存在于强酸性条件下,且二价铁与三价铁离子的转化平衡线①线处于氧线b之下。按照实际反应过程中铁离子浓度的变化计算电位范围在0.70~0.86 V之间,对应氧气电位约为1.20 V,从热力学上讲,采用氧气进行氧化的工艺是可行的。

图1 铁- 水系的电位pH图(25 ℃)
2.2 常压试验结果
表1为常压反应中,分别采用空气及氧气作为氧化剂进行二价铁的氧化反应,并且对70 ℃和90 ℃的温度条件进行了试验。空气和氧气试验结果对比看来,氧气效果远优于空气,氧分压的提高可以增加氧在体系中的溶解度,从而提高氧化效果。而温度对结果影响不大,较高的温度下可能造成氧气溶解度的降低,反而不利于氧化反应的进行。

表1 常压试验条件及结果
2.3 加压试验结果
试验采用加压釜进行二价铁氧化的加压试验,氧化气氛采用纯氧。分别对一定条件下的氧化温度、釜压及反应时间进行了试验,探讨了反应条件对二价铁转化率的影响。
2.3.1 温度
图2为5 bar釜表压、反应4 h后二价铁转化率与温度的关系。100 ℃以下,转化率随温度的升高上升明显,当温度达到110 ℃以上,转化率变化不大。100 ℃以上,二价铁的转化率可以稳定在90%以上。

图2 5 bar釜表压反应4 h后温度对转化率的影响
2.3.2 釜压
图3表明了110 ℃下反应4 h后釜压对转化率的影响。可以看出,随着釜压的提高,二价铁氧化率缓慢提高,幅度不大。此温度下,当釜表压1 bar,此时饱和蒸汽压为1.46 bar(绝压),对应氧分压为0.54 bar(绝压),氧气浓度为27%,转化率87.0%,是可以接受的。
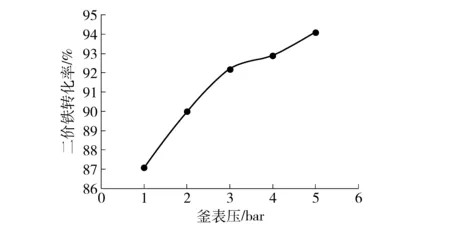
图3 110 ℃下反应4 h后釜压对转化率的影响
2.3.3 反应时间
试验中对110 ℃,釜表压2 bar下,反应过程取样,分析反应时间对转化率的影响。图4中显示,釜表压2 bar时,1.5 h后转化率可以达到80%以上,随后上升较为缓慢,4 h可以达到90%。

图4 110 ℃釜表压2 bar下反应时间对转化率的影响
上述温度、压力及时间对氧化率的影响试验表明,温度、氧分压及反应时间的增加可以提高二价铁的转化率,可选择适当条件满足实际工况。
氧化浸出工艺中,浸出液中90%的二价铁可以通过上述条件转化为三价铁回用,然而仍有10%未转化的二价铁,若闭路循环则造成体系中二价铁浓度的升高,所以必须有二价铁开路才能维持整个系统的金属平衡。可以通过开路部分溶液单独处理以开路二价铁,但最好的方法是在氧化过程中使剩余二价铁氧化沉淀。二价铁离子氧化成三价铁离子反应消耗硫酸,本研究中设定了过量的残酸,实际应用中,可以调整残酸浓度满足二价铁氧化沉淀的条件下,同时保证三价铁不发生水解,在氧化反应后期沉淀出针铁矿或赤铁矿来开路二价铁离子,同时在浸出工序中补加对应量的三价铁离子,保证整个系统的平衡及连续运行。
3 结论
(1)一定条件下,硫酸亚铁- 硫酸体系中,温度、氧分压及反应时间的增加可以提高二价铁的转化率。
(2)反应温度为110 ℃,釜表压2 bar,反应时间为4 h,可以获得90%的二价铁转化率。
[1] 孙家寿,罗息华,齐振龙.超声波作用下FeCl3浸出硫化铜精矿的研究[J].湿法冶金,1999,(1):22-24.
[2] Weian D.Leaching behavior of complex sulfide concentrate with ferric chloride by microwave irradiation[J].Rare metals,1997,16(2):152-155.
Discussion of preparation process of ferric sulfate solution from ferrous sulfate via oxygen oxidization method
LI Shao-long, SUN Ning-lei, LI Bin, ZHAO Peng-fei
This article introduced the study of preparation process of ferric sulfate solution from ferrous sulfate via oxygen oxidization method. Results show that the enhancement of temperature, partial pressure of oxygen and retention time increases the ferrous conversion rate into ferric ion. Optimum is determined as 110 ℃ of temperature, 2 bar of gage pressure as well as 4 h retention time, under which ferrous ion conversion reaches 90%.
ferric; ferrous; oxidization
李少龙(1979—),男,山东烟台人,高级工程师,从事有色冶金设计咨询工作。
2015-- 03-- 30
TF803.2; TF111.3
B
1672-- 6103(2015)05-- 0074-- 03
