胆囊收缩素A型受体基因序列变异和表达与略阳乌鸡饲料转化率的关联性研究
2022-02-01王哲鹏周雯馨贺俊锡虎巧燕赵家悦
王哲鹏,周雯馨,贺俊锡,虎巧燕,赵家悦
胆囊收缩素A型受体基因序列变异和表达与略阳乌鸡饲料转化率的关联性研究
王哲鹏,周雯馨,贺俊锡,虎巧燕,赵家悦
西北农林科技大学动物科技学院,陕西杨凌 712100
【背景】食欲和饲料转化率的提高构成了现代肉鸡快速生长的生理基础。胆囊收缩素A型受体(CCKAR)是介导胆囊收缩素(CCK)饱食信号和消化调节作用的关键受体。鉴于CCK信号在能量平衡调节中的重要作用,CCKAR的表达水平与鸡的生长性能密切相关。然而,CCKAR水平调节鸡生长的确切机制尚不清楚。【目的】通过研究阐明CCKAR基因表达水平和序列变异与鸡饲料转化率的关系,为鸡生长性状遗传调控研究和饲料转化率选育奠定基础。【方法】测定略阳乌鸡12—16周龄料肉比(公鸡n=62,母鸡n=67)和26—30周龄料蛋比(n=150)。用PCR-RFLP法检测CCKAR基因内两个同义突变(g.73206714T>C和g.73209189C>T)的基因型。以性别为固定效应,用双因素方差分析检验g.73206714T>C和g.73209189C>T与料肉比的关联性,用单因素方差分析检验2个SNP与料蛋比的关联性。用JASPAR数据库预测g.73206714T>C对转录因子结合位点产生的影响。以g.73206714T>C为标记,选取10只杂合子(CT)公鸡,用PCR-RFLP法检测CCKAR基因在g.73206714T>C位点等位基因间的表达差异。选取30只带有采食量和料肉比记录的公鸡,用qPCR检测CCKAR基因在下丘脑、脑垂体、胰腺、胆囊和十二指肠中的表达水平,分析CCKAR表达水平与采食量和料肉比的相关性。【结果】性别效应对略阳乌鸡料肉比有显著影响(=29.44,<0.0001),公鸡的料肉比(5.41±0.76)显著低于母鸡(6.62±1.00)。在两个同义突变中,只有g.73206714T>C与料肉比显著关联(=8.44,=0.0004),其中,TT型的料肉比(5.18±0.63)显著低于CC(6.37±1.1)和CT型(6.17±0.95)。CC型和CT型的料肉比无显著差异。g.73206714T>C与性别的互作效应对料肉比的影响不显著。G.73206714T>C对28个转录因子结合位点有潜在影响。等位基因特异性表达试验显示,T等位基因的转录本丰度显著高于C等位基因,表明CCKAR在等位基因间的表达差异很可能是构成g.73206714T>C与料肉比关联性的遗传基础。略阳乌鸡26—30周龄的平均料蛋比为2.85±0.41。g.73206714T>C和g.73209189C>T的基因型效应对料蛋比的影响均不显著。在5个组织中,CCKAR基因在胰腺中的表达水平最高,且与采食量呈负相关(=-0.45,=0.017)。但是,在其他组织中,CCKAR的表达水平与采食量的关联性均不显著。对于料肉比性状,CCKAR基因在胰腺(=-0.41,=0.03)和脑垂体(=-0.57,=0.0018)中的表达水平越高,料肉比越低。在其他组织中,这种负相关性均不显著。【结论】研究发现CCKAR基因表达水平上调有利于提高鸡的饲料转化率。G.73206714T>C的T等位基因是一个与CCKAR基因高表达活性和高饲料转化率显著关联的分子标记。
鸡;生长;CCKAR;饲料转化率;食欲
0 引言
【研究意义】鉴定影响鸡饲料转化率的候选基因对提高饲料的利用率,降低养殖成本,节约饲料用粮,缓解人畜争粮的矛盾具有重要意义。【前人研究进展】胆囊收缩素(CCK)是一种主要由小肠Ⅰ型内分泌细胞分泌的肽类激素,具有诱导食欲调控中枢产生饱腹感,促进胆囊收缩、胰酶分泌,抑制嗉囊排空、胃酸分泌、调节胃肠蠕动等多种生理功能[1]。胆囊收缩素A型受体(CCKAR)是介导CCK信号的关键受体[2]。在人类中,CCKAR转录本异常剪切与肥胖和胆结石显著关联[3]。在大鼠中,由基因突变引起的CCKAR缺失将导致贪吃、肥胖和糖尿病[4]。在鸡中,CCKAR基因表达下调能显著提高生长速度[5]。CCKAR拮抗剂(对CCK与受体的结合产生竞争性抑制)处理能刺激食欲、提高采食量[6-7],而CCKAR类似物处理会减少采食量[8],表明CCKAR水平对哺乳动物能量平衡的调节极有可能通过食欲调控途径来实现。但是,CCKAR拮抗剂、CCK类似物和CCK释放促进剂处理并不能改变鸡的采食量,而是对胆汁和胰淀粉酶的分泌、嗉囊的排空有明显调节作用[9-10]。Covasa等发现CCKAR拮抗剂只有在高剂量(>90 μg·kg-1BW)添加的情况下才能提高鸡的采食量,但CCKAR拮抗剂预处理并不能有效阻断内源CCK诱导的厌食效应[11]。这些研究对CCK信号在鸡中的食欲调节作用提出质疑,但支持CCK信号与消化液分泌、嗉囊排空等消化相关的生理活动存在密切联系。【本研究切入点】鉴于CCK信号对消化的调节作用及CCKAR的信号转导功能,本研究推测CCKAR水平可能通过营养物质消化途径影响鸡的饲料转化率。Xu等发现CCKAR在低剩余采食量组特异表达,支持CCKAR是影响鸡饲料转化率的一个候选基因[12]。【拟解决的关键问题】测定了略阳乌鸡12—16周龄的料肉比和26—30周龄的料蛋比,检测了CCKAR基因在下丘脑、脑垂体、胰腺、胆囊和十二指肠中的表达水平,研究了CCKAR基因表达水平及序列变异与饲料转化率的关联性,旨在阐明CCKAR基因遗传差异与饲料转化率的联系,为从育种和CCKAR活性干预角度提高鸡的饲料转化率奠定理论基础。
1 材料与方法
1.1 略阳乌鸡的饲养和饲料转化率测定
略阳乌鸡是产自陕西省略阳县的地方鸡种。具有类似于丝羽乌鸡的真皮超黑色素(dermal hyperpigmentation)特征,是我国一种体形较大的乌鸡品种[13]。由于缺乏系统选育,略阳乌鸡在产蛋和生长性能方面存在较大群体变异性,表明一些调控生产性能的功能突变很可能处于分离状态[14]。这为功能突变的鉴定创造了条件。
在略阳乌鸡蛋用系育种核心群三世代41个半同胞家系中随机选取62只公鸡和67只母鸡,测定料肉比。在四世代56个半同胞家系中随机选取150只母鸡,测定料蛋比。料肉比和料蛋比测定所用样本为同一批次孵化,在同一栋鸡舍饲养。笼养育雏,全价料饲喂,自由采食、饮水。育雏期采用18—22 h光照,育成期采用自然光照,产蛋期采用16 h恒定光照。在60 d时将鸡从育雏舍转入产蛋鸡舍,单笼饲养。三世代在2019年2月25日出雏,2020年1月8日淘汰,四世代在2019年12月9日出雏,2020年12月21日淘汰。三世代鸡的性别用PCR法鉴定,用5′-GTAGTCTGTGTCTTATCATAGC-3′和5′-GGT CTCTGTACTTGGCATT-3′ 引物检测个体是否携带W染色,用5′-GCCATGCATGTCTAAGTAC-3′和5′-G CACAGACAGTACCATCG -3′ 扩增18 s rRNA片段,确保PCR成功进行[15]。
以个体为单位,测定料肉比和料蛋比。2只鸡之间隔1个空笼位,避免互相采食对方的饲料。每周测定初始料重、初始体重,周末料重、周末体重和产蛋量,按(期末料重-初始料重)/(期末体重-初始体重)计算料肉比,按(期末料重-初始料重)/试验期内产蛋量计算料蛋比。料肉比测定周期为12—16周龄,测定时间为2019年5月22日至2019年6月19日;料蛋比测定周期为26—30周龄,测定时间为2020年6月8日至2020年7月5日。略阳乌鸡养殖和料肉比、料蛋比测定均在陕西略阳龙佳农业发展有限公司完成。
1.2 CCKAR序列变异基因型检测
在饲料转化率测定结束后,翅静脉采血0.5 mL,用ACD(血:ACD=3﹕1)抗凝。ACD的配方为0.48 g柠檬酸,1.32 g柠檬酸三钠,1.47 g葡萄糖,用双蒸水溶解后,定容至100 mL。取20 μL抗凝血,用Blood Genome DNA Extraction试剂盒(Takara)按试剂盒说明提取基因组DNA。用1 %琼脂糖凝胶电泳检测DNA的完整性,用NanoDrop™ 2000(Thermo)分光光度计测定DNA浓度,将DNA浓度调至50 ng·μL-1备用。
g.73206714T>C (dbSNP登录号:rs315131298)和g.73209189C>T(dbSNP登录号:rs317682933)是分布位于CCKAR基因第3和第5外显子内的两个同义突变。研究发现g.73206714T>C和g.73209189C>T与鸡的生长速度显著关联[5]。本研究用PCR-RFLP法检测这两个SNP的基因型。PCR体系由1 μL DNA(50 ng·μL-1),0.5 μL正链引物(10 μmol·L-1),0.5 μL反链引物(10 μmol·L-1),10 μL预染2 × Taq Plus MasterMix (康为) 和8 μLddH2O组成。g.73206714T>C位点的PCR扩增引物为5′-AGCACGGAGACC AAGACCCA-3′和5′-GCAAATGGCACTGTACCGCT -3′,g.73209189C>T位点的PCR扩增引物为5′-ATGC TGATGGTGATAGTGGT-3′和5′-GGTGAAAGTGGC TAGAAAAC-3′。PCR扩增条件为94℃预变性3 min,(94℃变性30 s, 60℃退火30 s, 72℃延伸20 s)×33个循环,72℃延伸5 min。PCR在伯乐T100TM热循环仪上进行。g.73206714T>C扩增产物用MnlI内切酶(NEB)消化,g.73209189C>T扩增产物用MboII内切酶(NEB)消化。消化反应体系为1 μL 10× CutSmart Buffer, 1.5 μLPCR产物, 0.6 μL(3 U)内切酶和6.4 μL ddH2O。消化条件为37℃水浴消化1 h。用3.0%(wt/vol)琼脂糖凝胶电泳分离消化产物,经0.1%(vol/vol)的溴乙锭染色,用Gel DocTMXR+凝胶成像系统(伯乐)拍照记录结果。电泳条件为90 V,40 min。部分PCR-RFLP基因型检测结果用Sanger测序进行验证。
1.3 g.73206714T>C位点对转录因子扰动作用预测
在JASPAR(http://jaspar.genereg.net)数据库中,选取Vertebrata门类下1 011个转录因子,在Scan窗口提交FASTA格式序列,分别搜索T等位基因可结合的转录因子和C等位基因可结合转录因子,分析g.73206714T>C对转录因子-DNA结合产生的潜在影响。搜索转录因子的Relative profile score 阈值设定为80 %。
1.4 CCKAR基因表达量检测
在参与料肉比测定的62只公鸡中随机选取30只公鸡,在16周龄宰杀,采集下丘脑、脑垂体、胰腺、胆囊和十二指肠,剪碎,置RNAstore(康为)4 ℃浸泡过夜,置-80℃冰箱保存备用。在采集胆囊时,需划破胆囊,弃胆汁,用1×PBS缓冲液(Gibco)漂洗3次后,保存备用。在距幽门约5 cm处采集十二指肠。取约100 mg组织,用1 mL TRNzol Universal 总 RNA 提取试剂(天根),按TRNzol操作说明提取总RNA。用1 %琼脂糖电泳检测RNA的完整性,用NanoDrop™ 2000(Thermo)分光光度计测定RNA的浓度。取1 μg RNA,用PrimeScriptTM1st Strand cDNA synthesis试剂盒(Takara)按试剂盒说明将RNA反转录为cDNA。用qPCR检测CCKAR基因在各组织中的表达量。qPCR体系为2 μL cDNA,10 μL 2×TB Green Advantage qPCR Premix (Takara), 0.4 μL正链引物(10 μmol·L-1),0.4 μL 反链引物(10 μmol·L-1)和7.2 μL ddH2O。qPCR在LightCycler® 96 Instrument实时荧光定量PCR仪(Roche)上进行,扩增条件为95℃ 30 s,(95℃5 s, 60℃20 s 72℃ 15 s)×40个循环。扩增反应结束后执行熔解曲线反应程序,检测qPCR的特异性,溶解曲线反应程序为95℃ 10 s,65℃ 60 s和97℃ for 1 s。LBr被用作持家基因,校正由cDNA浓度和cDNA模板加样量差异引起的实验误差。CCKAR基因扩增引物:5′-TACAGCAAGCTGGTC CCTTT-3′和5′-AATGAAATGAGGCCATACGC-3′, LBr扩增引物:5′-AGGGCTTCTTGTCACAGGTT-3′和5′-ATCACGAGCTTCTCGATGAACA-3′。目标和持家基因每个样本均执行3个技术重复。用ΔCt(CtLBr- CtCCKAR)表示CCKAR基因的表达水平,即CCKAR基因表达水平越高,ΔCt值越大。
1.5 g.73206714T>C位点等位基因特异性表达水平检测
在30只采集组织样的公鸡中,有10只公鸡g.73206714T>C的基因型为CT。取10只公鸡下丘脑、脑垂体、胰腺、胆囊和十二指肠cDNA,执行RT-PCR,获得包含g.73206714T>C位点的扩增片段。RT-PCR扩增体系为cDNA模板2 μL,正链引物0.5 μL(10 μmol·L-1),反链引物0.5 μL(10 μmol·L-1),2× Taq MasterMix(康为)10 μL,ddH2O 7μL。RT-PCR所用引物序列为5′-CTCATTCCCAACCTGCTGAA-3′和5′-GCAAATGGCACTGTACCGCT-3′。RT-PCR产物用MnlI(NEB)内切酶消化。RT-PCR扩增条件,酶切体系、条件,酶切产物电泳检测方法见材料方法1.2。
1.6 统计分析
在统计分析前,以下四分位数(first quantile)-1.5 ×四分位距(interquantile range)为下限,以上四分位数(third quantile)+ 1.5 ×四分位距(interquantile range)为上限,删除采食量、增重、产蛋量和CCKAR表达量数据中的异常值。g.73206714T>C和g.73209189C>T与料肉比的关联性用双因素方差分析进行检验,模型为FCRi= μ + sexi+ genotypei+ sexi× genotypei+ ei,FCRi为个体i的料肉比,μ为群体均值,genotypei为基因型效应,sexi×genotypei为性别与基因型的互作效应,ei为误差项;料蛋比方差分析模型为FCRi= μ + genotypei+ ei,各项含义与料肉比模型相同。CCKAR基因在各组织间的表达差异用单因素方差分析进行检验,统计模型为ΔCt = μ + tissue + e。如果主效应统计检验的结果为显著,则进一步执行各水平间最小二乘均数多重比较,多重比较校正方法为Tukey-Kramer。显著水平为P<0.05。方差分析用SAS University Edition的GLM过程完成。CCKAR表达水平与采食量和料肉比的相关性用R语言Hmisc软件包分析。
2 结果
2.1 略阳乌鸡饲料转化率描述统计
性别效应对略阳乌鸡料肉比有显著(F=29.44,<0.0001)影响,公鸡料肉比5.41±0.76显著低于母鸡(6.62±1.00;图1)。略阳乌鸡26到30周龄平均料蛋比为2.85±0.41。略阳乌鸡同期饲料转化率不仅低于商业蛋鸡和肉鸡,而且存在较大群体变异性,公鸡料肉比变异范围在3.6—7.4之间(变异系数(C.V.)=14.0 %),母鸡在4.8—9.1之间(C.V.= 15.1%),料蛋比变异范围在2.0—4.4之间(C.V.=14.3%;图2)。
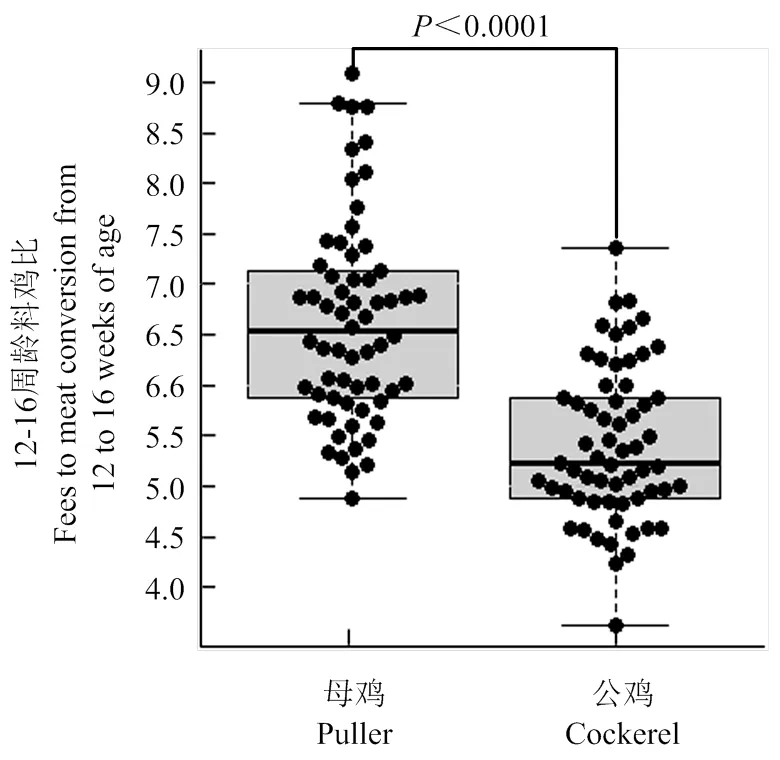
图1 略阳乌鸡12—16周龄料肉比分布
2.2 CCKAR序列变异与略阳乌鸡饲料转化率的关联性
本研究分析了CCKAR基因内两个SNP与略阳乌鸡料肉比和料蛋比的关联性。g.73206714T>C的基因型效应对略阳乌鸡12—16周龄料肉比有显著影响(= 8.44,=0.0004),TT型料肉比(5.18±0.63)显著低于CC(6.37±1.1)和CT型(6.17±0.95),CC型和CT型的料肉比无显著差异(图2)。g.73206714T>C与性别的互作效应对料肉比无显著影响(=0.72,=0.49)。g.73206714T>C位点的基因型效应对略阳乌鸡26—30周龄的料蛋比无显著影响(=2.16,=0.12;图2)。在略阳乌鸡样本中,本研究在g.73209189C>T位点主要检测到CC和CT两种基因型。g.73209189C>T的基因型效应对料肉比(=0.67,=0.41)和料蛋比(=0.48,=0.62)均无显著影响(图2)。在料肉比性状上,g.73209189C>T与性别也不存在显著的互作效应(=3.20,=0.07)。
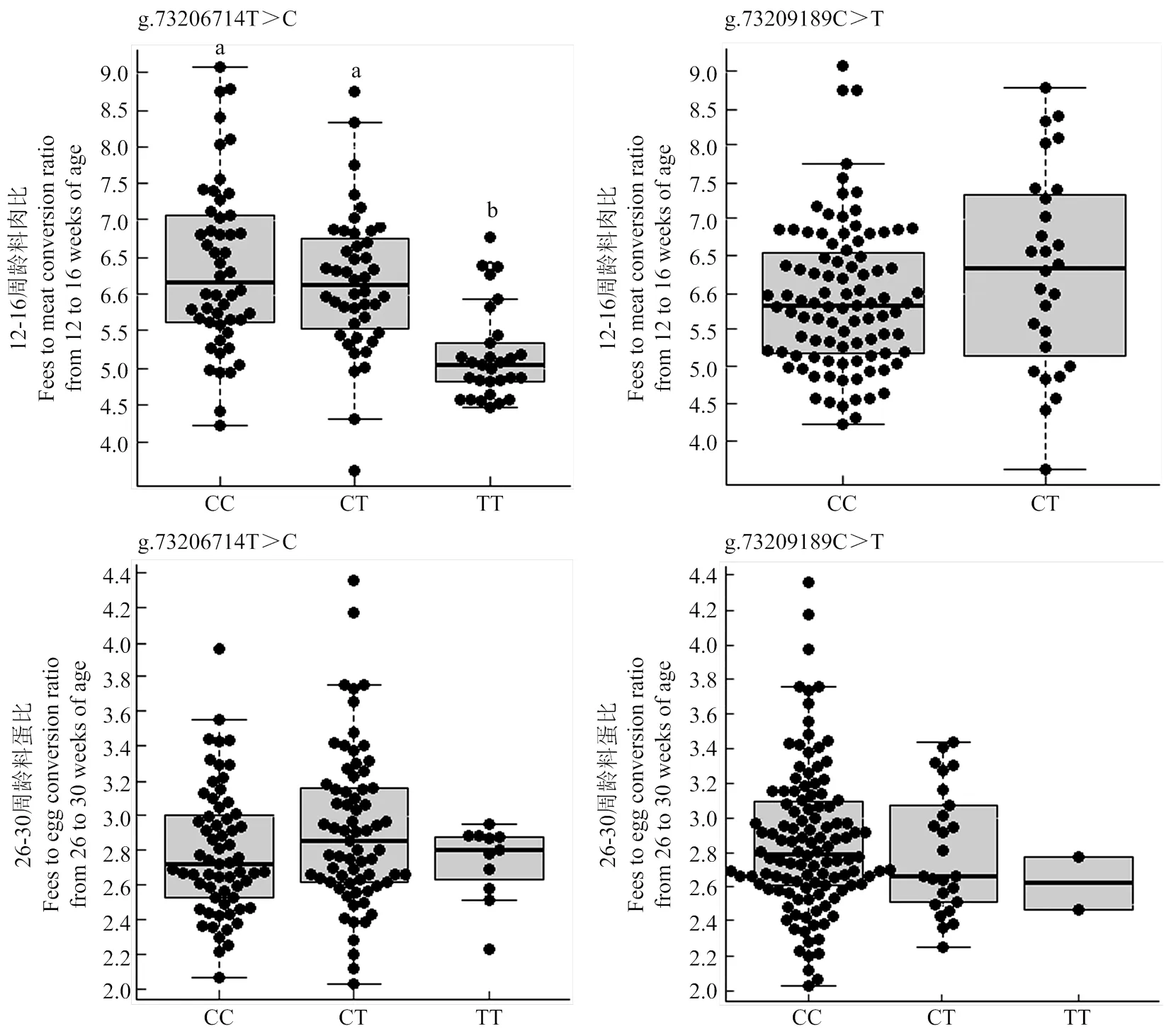
箱线图上方小写字母标出多重比较结果,相同字母或未标注字母代表基因型间差异不显著,不同字母代表基因型间存在差异显著(P<0.05)
2.3 g.73206714T>C位点等位基因特异性表达分析结果
关联分析发现g.73206714T>C显著关联到略阳乌鸡料肉比。g.73206714T>C是CCKAR基因第三外显子上的一个同义突变。如果g.73206714T>C直接参与饲料转化效率调控,g.73206714T>C可能通过影响CCKAR基因的表达发挥作用。经转录因子预测,g.73206714T>C的T等位基因会影响RORC、Myb、Tcf15、Mycn、HOXA4、GSX2、hoxc4、YY2与DNA的结合,而C等位基因会影响NR5A1、Esrrg、VDR、Dmrt1、HLTF、Nr2e3、ZEB1、FOXK1、SOX10、Foxo1、DMRTA2、Sox5、LBX1、Foxj2、FOXO3、FOXC1、FOXO4、FOXO6、FOXI1、C/EBPα与DNA的结合。
为了进一步阐明g.73206714T>C与CCKAR基因表达水平间的联系,本研究通过等位基因特异性表达试验检测CCKAR基因在T和C等位基因间的表达差异。本研究以基因组DNA扩增产物为对照,控制由酶切效率产生的潜在误差。在理论上,以基因组DNA为模板进行PCR扩增时,CT杂合子将产生数量相当的C等位基因和T等位基因扩增产物。PCR-RFLP结果显示,CT产生138 bp(T等位基因扩增产物)和109 bp(C等位基因扩增产物)两种亮度接近的电泳条带(图3),表明PCR-RFLP能够准确检测等位基因特异性扩增子丰度。在对10只杂合仔鸡的RT-PCR(模板为cDNA)产物酶切后,除了个别样本外,多数样本T等位基因转录本丰度均明显高于C等位基因,说明CCKAR基因在g.73206714T>C位点存在等位基因表达不平衡性,其中,T等位基因与CCKAR基因高表达活性关联。
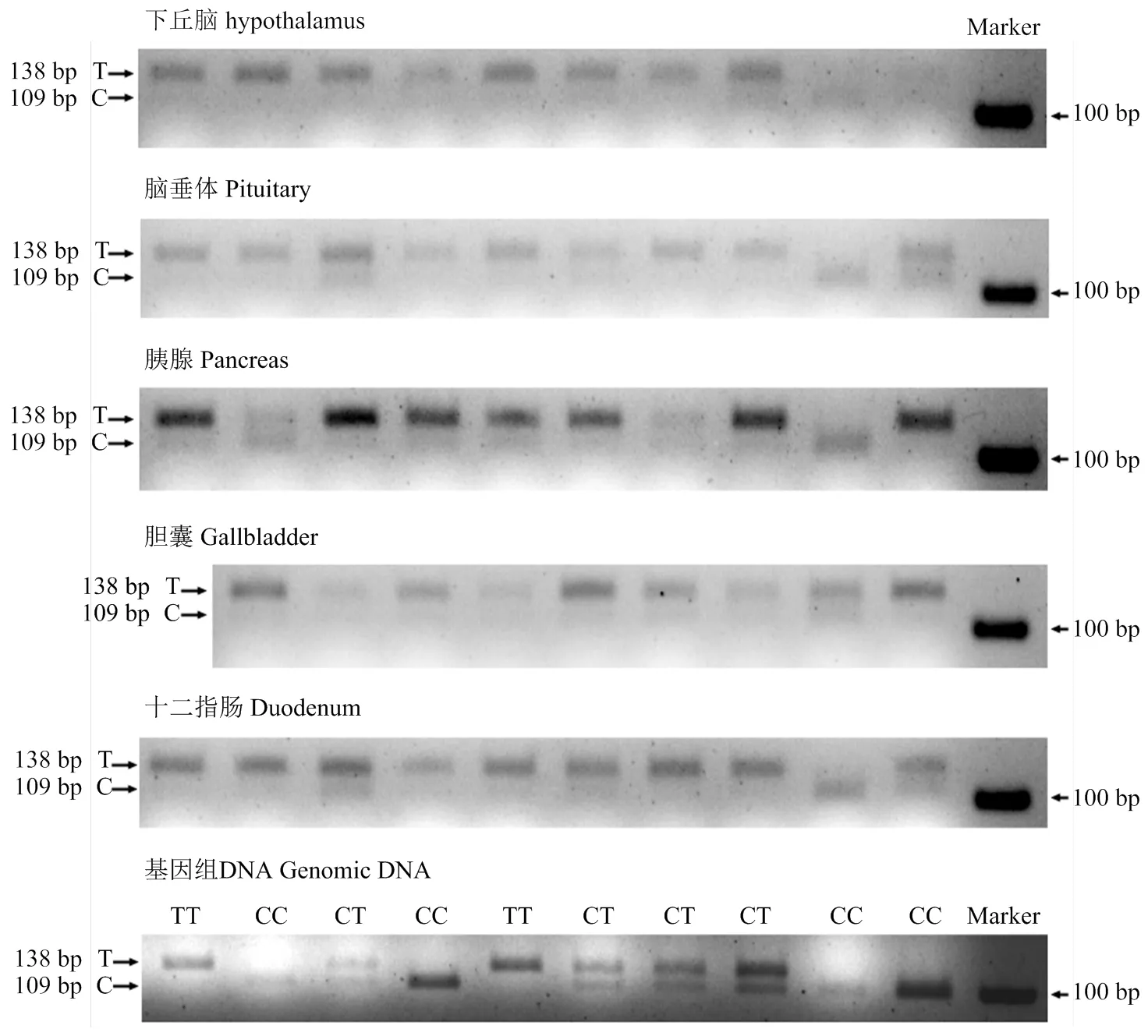
以g.73206714T>C为标记,选取10只杂合子(CT)个体,用MnlI内切酶消化各组织RT-PCR产物。消化产物用3%琼脂糖凝胶电泳分离。T等位基因将产生138 bp条带,C等位基因将产生109 bp和29 bp两种条带,29 bp条带在3%琼脂糖电泳中不可见。基因组DNA扩增产物被用作对照,验证MnlI检测等位基因特异性转录本丰度差异的准确性
2.4 CCKAR基因表达水平与料肉比的相关性
为了进一步分析CCKAR基因表达水平与料肉比的关系,本研究检测了CCKAR基因在下丘脑、脑垂体、胰腺、胆囊和十二指肠中的表达量。CCKAR基因在胰腺中表达水平最高(图4)。CCKAR基因表达水平除了在十二指肠和下丘脑间无显著差异外,在其他组织间均存在显著差异。CCKAR基因在胰腺和脑垂体中的表达水平与料肉比呈现出显著负相关(图5)。CCKAR基因在胆囊中的表达水平与料肉比存在潜在的负相关。在十二指肠和下丘脑中,CCKAR表达水平与料肉比间的负相关均未达到统计显著水平。CCKAR基因在胰腺中的表达水平与采食量存在显著负相关关系,但在其他组织中,二者的相关关系均不具有统计学意义。
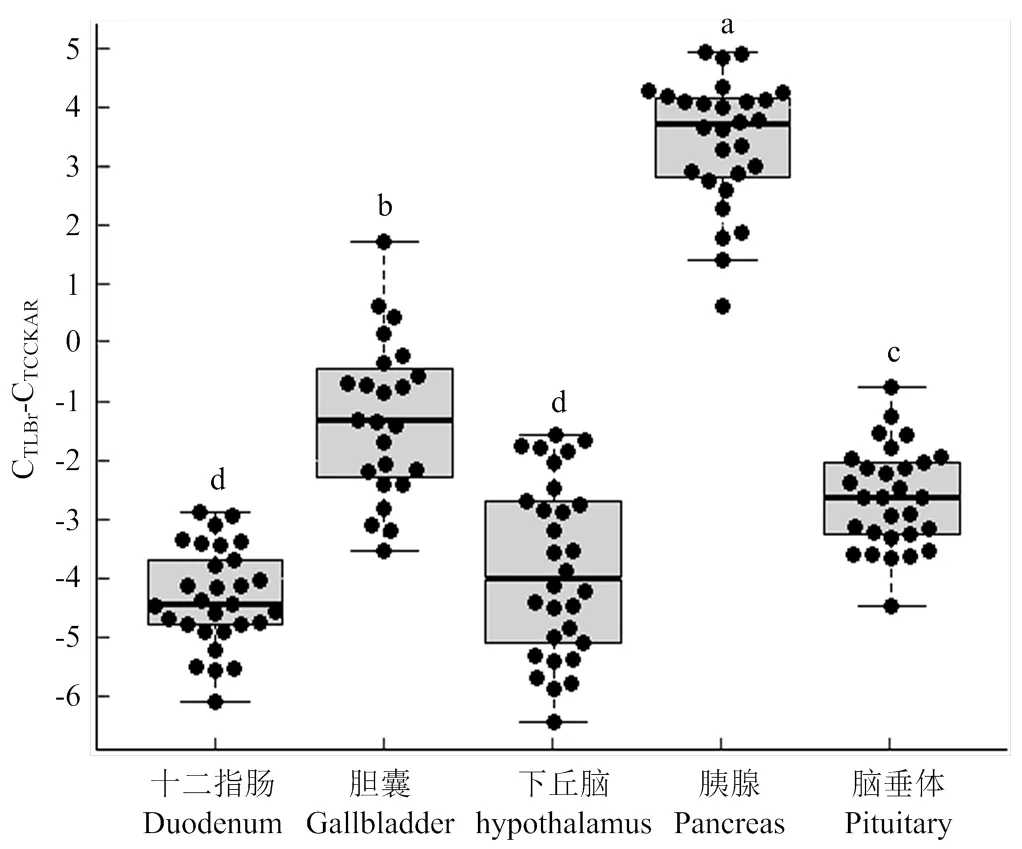
箱线图上方的字母标出了多重比较的结果,相同字母表示组织间差异不显著,不同字母表示组织间差异显著(P<0.05)
3 讨论
鉴于CCK信号在食欲调控和能量平衡调节中的作用[16-17],CCKAR的表达水平与动物的采食量、生长速度及一些代谢疾病的发生密切相关[3-5]。在鸡中,CCKAR基因在快速生长型鸡中的表达水平显著低于慢速生长型鸡[5]。研究人员推测CCKAR基因低表达促生长的机制很可能与饱食信号阈值改变有关[5]。除了影响食欲外,CCK信号对消化的调节作用表明,CCKAR的表达水平很可能与饲料利用率也有密切联系。本研究发现CCKAR基因在胰腺、脑垂体和胆囊中的表达水平越高,鸡的料肉比越低,为上述推测提供了直接证据。进而,在CCKAR基因第三外显子上发现同义突变g.73206714T>C不仅与CCKAR基因的表达活性有关,而且与料肉比显著关联。这些结果支持CCKAR基因是一个调节鸡饲料转化率的候选基因,而该基因内一些影响表达的功能变异很可能构成了鸡饲料转化率差异的分子基础。
3.1 CCKAR基因表达水平影响饲料转化率的潜在机制
基于相关分析的结果,本研究推测CCKAR水平可能通过以下3种途径影响饲料转化率。第一、消化液分泌途径。CCK作为一种肠肽激素,能刺激胰酶和胆汁分泌[1]。CCKAR拮抗剂能有效阻断CCK对胰酶分泌的刺激作用,说明CCKAR是介导CCK消化调节作用的特异性受体,CCKAR水平直接影响消化液的分泌[9]。本研究发现CCKAR基因在胰腺中的表达水平与料肉比呈中等强度的负相关,支持CCKAR水平可以通过影响消化液的分泌,影响饲料利用率。第二、脂代谢途径。将饲料转化为脂肪是极不经济的一种做法。相反,提高脂肪的分解效率,抑制脂肪的沉积将有助于提高饲料利用率[18]。胆汁可以通过脂滴乳化促进脂肪的消化,也可以通过白色脂肪棕色化促进脂肪组织的分解[19]。外源CCK注射证明,胆汁的分泌量随CCK剂量的增加而增加[9]。所以,CCKAR表达水平的升高有可能通过提高胆汁的分泌量,促进脂代谢,提高饲料转化率。此外,生长激素可以促进脂代谢和同化作用[20]。外源注射CCK能显著提高生长激素的分泌量[21]。本研究发现CCKAR基因在脑垂体中的表达水平与料肉比存在负相关性。据此推测CCKAR表达上调可能对生长激素的分泌有促进作用,进而提高饲料转化率。第三、采食量途径。研究表明,家禽的采食量越低,饲料利用率越高[12,22-23]。Zeng等[23]发现CCK在下丘脑中的表达水平越高,鸭的饲料转化率越高。本研究发现CCKAR基因在胰腺中的表达水平不仅与采食量呈负相关,而且与料肉比也呈负相关。这些结果支持CCK系统也可能通过抑制鸡的采食量,提高饲料转化率。
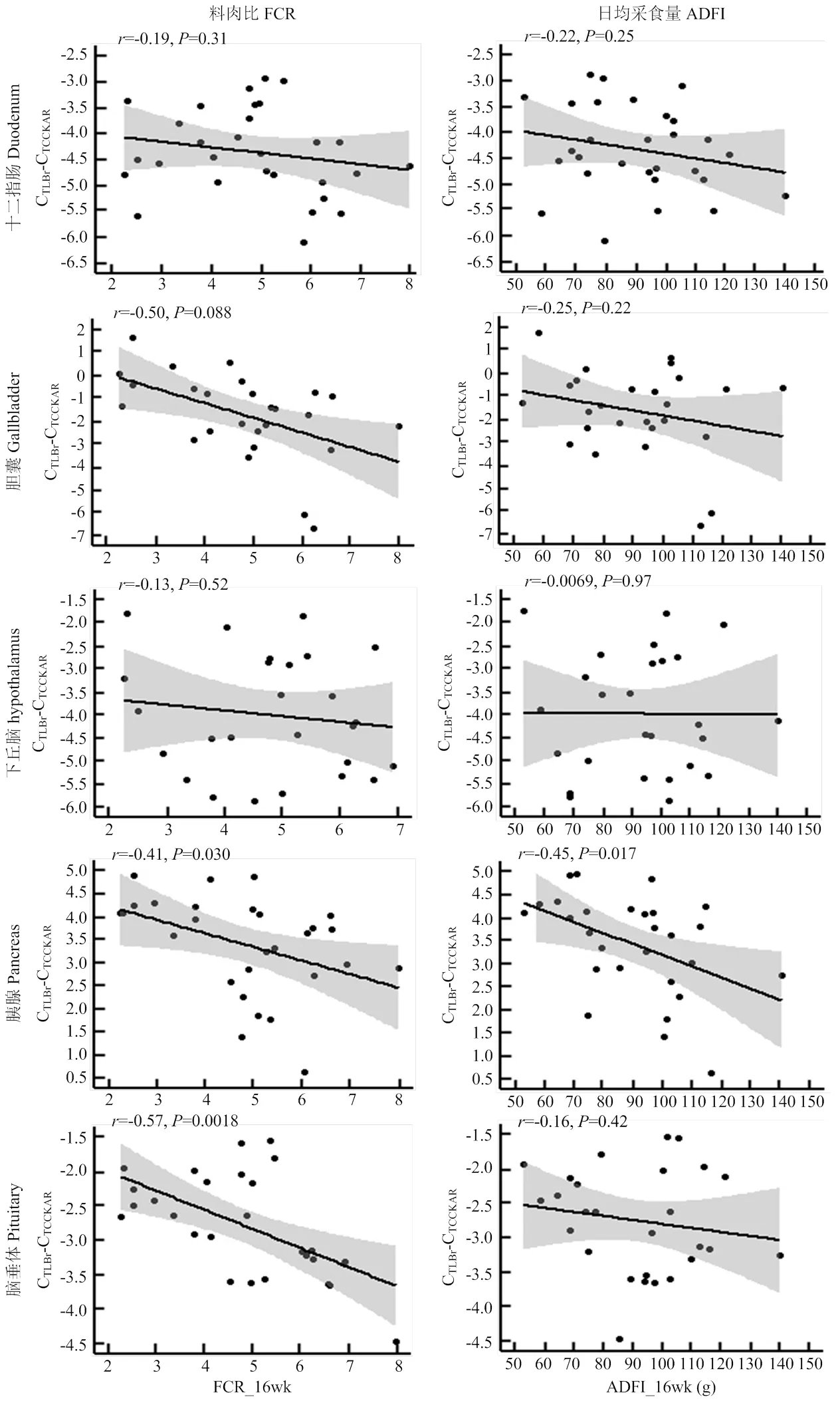
ADFI_16wk代表16周龄日平均采食量,FCR_16wk代表16周龄料肉比。图上方的数字是相关系数和相关系数显著性检验的P值
3.2 CCKAR基因表达水平对鸡食欲的调节作用
在肠-脑轴食欲调控系统中,CCK作为一种小肠分泌的饱食信号分子,它通过与迷走神经中的受体结合向食欲调控中枢(下丘脑弓状核)传递饱食信号,也可以直接与食欲调控神经元表面的受体结合产生饱食信号,调节动物的食欲和采食量[24-25]。CCKAR作为CCK饱食信号转导的关键分子,其表达水平与采食量密切相关[5]。本研究在胰腺中检测到CCKAR表达水平与采食量呈负相关,但是在食欲调控关键组织(下丘脑和十二指肠)中均未检测到这种负相关性。鉴于CCKAR基因在胰腺中表达水平最高,本研究推测胰腺很可能是发出CCK饱食信号的关键外周器官。
3.3 g.73206714T>C对CCKAR基因表达的调控机制
本研究发现CCKAR基因的表达水平与鸡饲料转化率显著相关,而鉴定表达调节突变是从分子层面揭示CCKAR对饲料转化率遗传调控机制的关键。g.73206714T>C是一个与鸡的体重显著关联的突变[5]。本研究进一步发现这个变异不仅与料肉比显著关联,而且与CCKAR基因的表达水平也密切相关。g.73206714T>C对28个转录因子与DNA的结合产生潜在影响。这些转录因子的功能涉及脂代谢、性别决定、神经、软骨、肌肉等组织的发育等多个生物学过程[26-31]。其中,FOXO1, C/EBPα和FOXK1是3个潜在的CCKAR表达调节蛋白。FOXO1通过调节食欲调控神经肽在下丘脑弓状核中的表达来调控动物的食欲,而C/EBPα和FOXK1通过调节能量代谢相关蛋白FTO、PPARγ、IGF-1、leptin、insulin等的表达,参与能量平衡调节[29-33]。尽管目前并无直接证据表明这些转录因子参与CCKAR的表达调控,但是鉴于CCK系统在鸟类食欲和能量平衡调节中的作用[16],CCKAR很可能也是受这些转录因子调控的靶基因。
3.4 g.73206714T>C与饲料转化率关联性对鸡育种的意义
通过检测C等位基因在不同生长性能品种中的频率分布,研究人员发现C等位基因频率与鸡生长性能存在显著正相关性[5]。这表明C等位基因很可能是受到正向选择的一个功能突变。然而,对饲料转化率而言,本研究发现C等位基因并不是一个优势等位基因。C等位基因有更低的表达活性,而CCKAR基因低表达将减弱鸡饱食信号阈值,增大采食量[5]。这些结果提示,如果以C等位基因为标记,对鸡生长性能进行辅助选择,极有可能是以提高鸡采食量的方式促进鸡的生长[34]。这种育种策略并不利于提高饲料利用率,降低养殖成本。相反,以牺牲一定生长速度为代价改进品种的饲料转化率,可能具有更大的实际意义。
4 结论
本研究发现提高CCKAR基因表达水平更有利于改进鸡的饲料转化率,而g.73206714T>C的T等位基因是一个与CCKAR基因的高表达活性和高饲料转化率关联的分子标记。这些发现为鸡的饲料转化率遗传调控机制研究提供线索,为从育种和CCKAR活性干预角度改进鸡的饲料转化率提供思路。
[1] REHFELD J F. Cholecystokinin-from local gut hormone to ubiquitous messenger. Frontiers in Endocrinology, 2017, 8: 47. doi:10.3389/fendo. 2017.00047.
[2] DUFRESNE M, SEVA C, FOURMY D. Cholecystokinin and gastrin receptors. Physiological Reviews, 2006, 86(3): 805-847. doi:10.1152/ physrev.00014.2005.
[3] MILLER L J, HOLICKY E L, ULRICH C D, WIEBEN E D. Abnormal processing of the human cholecystokinin receptor gene in association with gallstones and obesity. Journal of the American Chemical Society, 1995, 109(4): 1375-1380. doi:10.1016/0016-5085 (95)90601-0.
[4] Moran T H, Bi S. Hyperphagia and obesity in OLETF rats lacking CCK-1 receptors. Philosophical transactions Royal Society Biological sciences, 2006, 361(1471):1211-1218.
[5] DUNN I C, MEDDLE S L, WILSON P W, WARDLE C A, LAW A S, BISHOP V R, HINDAR C, ROBERTSON G W, BURT D W, ELLISON S J, MORRICE D M, HOCKING P M. Decreased expression of the satiety signal receptor CCKAR is responsible for increased growth and body weight during the domestication of chickens. American Journal of Physiology Endocrinology and Metabolism, 2013, 304(9): E909-E921. doi:10.1152/ajpendo.00580. 2012.
[6] BEGLINGER C, DEGEN L, MATZINGER D, D'AMATO M, DREWE J. Loxiglumide, a CCK-A receptor antagonist, stimulates calorie intake and hunger feelings in humans. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2001, 280(4): R1149-R1154. doi:10.1152/ajpregu.2001.280.4.r1149.
[7] EBENEZER I S. Effects of intracerebroventricular administration of the CCK(1) receptor antagonist devazepide on food intake in rats. European Journal of Pharmacology, 2002, 441(1/2): 79-82. doi:10. 1016/s0014-2999(02)01485-1.
[8] CHRISTOFFERSEN B Ø, SKYGGEBJERG R B, BUGGE A, KIRK R K, VESTERGAARD B, ULDAM H K, FELS J J, PYKE C, SENSFUSS U, SANFRIDSON A, CLAUSEN T R. Long-acting CCK analogue NN9056 lowers food intake and body weight in obese Göttingen Minipigs. International Journal of Obesity (2005), 2020, 44(2): 447-456. doi:10.1038/s41366-019-0386-0.
[9] CHOI Y H, FURUSE M, SATOH S, OKUMURA J. Endogenous cholecystokinin is not a major regulator of food intake in the chicken. Journal of Comparative Physiology B, Biochemical, Systemic, and Environmental Physiology, 1994, 164(6): 425-429. doi:10.1007/ bf00714578.
[10] Furuse M, Chol Y H, Yang S I, Kita K, Okumura J. Enhanced release of cholecystokinin in chickens fed diets high in phenylalanine or tyrosine. Comparative Biochemistry and Physiology A Comparative Physiology, 1991, 99(3):449-451.
[11] COVASA M, FORBES J M. Effects of the CCK receptor antagonist MK-329 on food intake in broiler chickens. Frontiers in Genetics, 1994, 48(2): 479-486. doi:10.1016/0091-3057(94)90556-8.
[12] XU Z, JI C, ZHANG Y, ZHANG Z, NIE Q, XU J, ZHANG D, ZHANG X. Combination analysis of genome-wide association and transcriptome sequencing of residual feed intake in quality chickens. BMC Genomics, 2016, 17: 594. doi:10.1186/s12864-016-2861-5.
[13] Dang L P, Liu R F, Zhao W Y, Zhou W X, Min Y N, Wang Z P. Investigating structural impact of a valine to isoleucine substitution on anti-Müllerian hormone in silico and genetic association of the variant and AMH expression with egg production in chickens. Journal of Integrative Agriculture, 2020, 19:1635-1643.
[14] 党李苹, 周雯馨, 刘瑞芳, 白云, 王哲鹏. 略阳乌鸡体重和产蛋数性状遗传参数估计. 中国农业科学, 2020(17): 3620-3628.
DANG L P, ZHOU W X, LIU R F, BAI Y, WANG Z P. Estimation of genetic parameters of body weight and egg number traits of Lueyang black-boned chicken. Scientia Agricultura Sinica, 2020(17): 3620-3628. (in Chinese)
[15] DHANASEKARAN S, RAJ G D, VIGNESH A R, SELVAN S T, PRAKASH B, PERUMAL P, ARIVUDAINAMBI S, BABU T G. Gender identification in Chicken () by PCR using whole blood and dried blood spot on filter paper as template: without prior DNA isolation. bioRxiv, 2016, doi:10.1101/046888.
[16] HONDA K, SANEYASU T, KAMISOYAMA H. Gut hormones and regulation of food intake in birds. The Journal of Poultry Science, 2017, 54(2): 103-110. doi:10.2141/jpsa.0160100.
[17] Wren A M, Bloom S R. Gut hormones and appetite control. Gastroenterology, 2007, 132(6):2116-2130.
[18] ZUIDHOF M J, SCHNEIDER B L, CARNEY V L, KORVER D R, ROBINSON F E. Growth, efficiency, and yield of commercial broilers from 1957, 1978, and 2005. Poultry Science, 2014, 93(12): 2970-2982. doi:10.3382/ps.2014-04291.
[19] VELAZQUEZ-VILLEGAS L A, PERINO A, LEMOS V, ZIETAK M, NOMURA M, POLS T W H, SCHOONJANS K. TGR5 signalling promotes mitochondrial fission and beige remodelling of white adipose tissue. Nature Communications, 2018, 9(1): 245. doi:10.1038/ s41467-017-02068-0.
[20] VIJAYAKUMAR A, YAKAR S, LEROITH D. The intricate role of growth hormone in metabolism. Frontiers in Endocrinology, 2011, 2: 32. doi:10.3389/fendo.2011.00032.
[21] CALOGERO A E, NICOLOSI A M, MONCADA M L, CONIGLIONE F, VICARI E, POLOSA P, D'AGATA R. Effects of cholecystokinin octapeptide on the hypothalamic-pituitary-adrenal axis function and on vasopressin, prolactin and growth hormone release in humans. Neuroendocrinology, 1993, 58(1): 71-76. doi:10. 1159/000126514.
[22] JIN S, YANG L, ZANG H, XU Y, CHEN X, CHEN X, LIU P, GENG Z. Influence of free-range days on growth performance, carcass traits, meat quality, lymphoid organ indices, and blood biochemistry of Wannan Yellow chickens. Poultry Science, 2019, 98(12): 6602-6610. doi:10.3382/ps/pez504.
[23] ZENG T, CHEN L, DU X, LAI S J, HUANG S P, LIU Y L, LU L Z. Association analysis between feed efficiency studies and expression of hypothalamic neuropeptide genes in laying ducks. Animal Genetics, 2016, 47(5): 606-609. doi:10.1111/age.12457.
[24] Owyang C, Heldsinger A. Vagal control of satiety and hormonal regulation of appetite. Journal of neurogastroenterology and motility, 2011, 17:338-348.
[25] PERRY B, WANG Y. Appetite regulation and weight control: the role of gut hormones. Nutrition & Diabetes, 2012, 2: e26. doi:10.1038/ nutd.2011.21.
[26] SMITH C A, ROESZLER K N, HUDSON Q J, SINCLAIR A H. Avian sex determination: what, when and where? Cytogenetic and Genome Research, 2007, 117(1/2/3/4): 165-173. doi:10.1159/ 000103177.
[27] SMITS P, LI P, MANDEL J, ZHANG Z, DENG J M, BEHRINGER R R, DE CROMBRUGGHE B, LEFEBVRE V. The transcription factors L-Sox5 and Sox6 are essential for cartilage formation. Developmental Cell, 2001, 1(2): 277-290. doi:10.1016/s1534-5807(01)00003-x.
[28] SHIKATANI E A, CHANDY M, BESLA R, LI C C, MOMEN A, EL-MOUNAYRI O, ROBBINS C S, HUSAIN M. C-myb regulates proliferation and differentiation of adventitial Sca1+ vascular smooth muscle cell progenitors by transactivation of myocardin. Arteriosclerosis, Thrombosis, and Vascular Biology, 2016, 36(7): 1367-1376. doi:10. 1161/atvbaha.115.307116.
[29] Peng S, Li W, Hou N, Huang N. A review of FoxO1-Regulated metabolic diseases and related drug discoveries. Cells, 2020, 9(1):184.
[30] SAKAGUCHI M, CAI W, WANG C H, CEDERQUIST C T, DAMASIO M, HOMAN E P, BATISTA T, RAMIREZ A K, GUPTA M K, STEGER M, WEWER ALBRECHTSEN N J, SINGH S K, ARAKI E, MANN M, ENERBÄCK S, KAHN C R. FoxK1 and FoxK2 in insulin regulation of cellular and mitochondrial metabolism. Nature Communications, 2019, 10(1): 1582. doi:10.1038/s41467- 019-09418-0.
[31] Ren W, Guo J, Jiang F, Lu J, Ding Y, Li A, Liang X, Jia W. CCAAT/enhancer-binding protein α is a crucial regulator of human fat mass and obesity associated gene transcription and expression. BioMed Research International, 2014, 2014:406909.
[32] STAIGER J, LUEBEN M J, BERRIGAN D, MALIK R, PERKINS S N, HURSTING S D, JOHNSON P F. C/EBPbeta regulates body composition, energy balance-related hormones and tumor growth. Carcinogenesis, 2009, 30(5): 832-840. doi:10.1093/carcin/bgn273.
[33] MILLWARD C A, HEANEY J D, SINASAC D S, CHU E C, BEDERMAN I R, GILGE D A, PREVIS S F, CRONIGER C M. Mice with a deletion in the gene for CCAAT/enhancer-binding protein beta are protected against diet-induced obesity. Diabetes, 2007, 56(1): 161-167. doi:10.2337/db06-0310.
[34] Pauwels J, Coopman F, Cools A, Michiels J, Fremaut D, De Smet S, Janssens G P. Selection for growth performance in broiler chickens associates with less diet flexibility. PLoS One, 2015, 10(6):e0127819.
Association of Levels of Cholecystokinin A Receptor Expression and Sequence Variants with Feed Conversion Efficiency of Lueyang Black-Boned Chicken
WANG ZhePeng, ZHOU WenXin, HE JunXi, HU QiaoYan, ZHAO JiaYue
College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi
【Background】Increased appetite and feed conversion efficiency forms a physiological basis underlying high growth of modern commercial broiler chickens. Cholecystokinin A receptor (CCKAR) is a key receptor for mediating CCK signals and involving in regulation of appetite and digestion. In view of the important role of CCK signals in the control of energy balance, the levels of CCKAR expression are closely related to the growth of chickens. However, the mechanism by which the abundance of CCKAR affects the growth of chickens remains unclear. 【Objective】 The aim of this study was to elucidate the relationship of levels of CCKAR expression and sequence variants with feed conversion efficiency, which would promote the understanding of genetic basis of the growth traits and breeding for improvement of feed efficiency in the chicken. 【Method】The feed to meat conversion ratio of Lueyang black-boned chickens (rooster n=62, pullet n=67) from 12 to 16 weeks of age and the feed to egg conversion ratio from 26 to 30 weeks of age (n=150) were individually measured. Two synonymous mutations (g.73206714T>C and g.73209189C>T) in the CCKAR gene were genotyped by using PCR-RFLP. Association of two SNP with the feed to meat conversion ratio was tested by using two-way analysis of variance with sex treated as a fixed effect. Association of two SNP with the feed to egg conversion ratio was tested by using one-way analysis of variance. Disrupting effect of g.73206714T>C on transcription factor binding sites was predicted in silico by using JASPAR database. Ten birds that were heterozygotes (CT) at the g.73206714T>C locus were selected to analyze imbalance of CCKAR expression between T and C alleles. The difference of allele-specific expression was detected by using PCR-RFLP. The Levels of CCKAR expression were detected by qPCR in the hypothalamus, pituitary, pancreas, gallbladder and duodenum of Lueyang black-boned chickens (n=30). The correlation of levels of CCKAR expression with food intake and feed to meat conversion ratio was analyzed. 【Result】 Sex had a significant (=29.44,<0.0001) effect on the feed to meat conversion ratio, and the feed efficiency (5.41±0.76) of roosters was significantly superior to pullets (6.62± 1.00). Of two SNP, only g.73206714T>C was significantly associated with the feed to meat conversion ratio. The feed to meat conversion ratio (5.18±0.63) of the TT genotype was significantly lower than ones of CC (6.37±1.1) and CT (6.17±0.95) genotypes. The feed to meat conversion ratio had no significant difference between CC and CT. There was no significant interaction effect between genotypes of g.73206714T>C and sex. G.73206714T>C potentially disrupted binding sites of 28 transcription factors. Allele-specific expression assay showed that the abundance of transcripts with the T allele was higher than one of transcripts with the C allele, supporting that differential expression of CCKAR gene between alleles might likely contribute to genetic association of g.73206714 with the feed to meat conversion ratio. Average feed to egg conversion ratio of Lueyang black-boned chickens was 2.85±0.41 at the 26-30 weeks of age. Both g.73206714T>C and g.73209189C>T had no significant effect on the feed to egg conversion ratio. The levels of CCKAR expression in the pancreas were the highest among five tissues, which showed a negative correlation (=-0.45,=0.017) with feed intake. But there was no significant correlation between levels of CCKAR expression and feed intake in other tissues. In the pancreas (=-0.41,=0.03) and pituitary (=-0.57,=0.0018), the higher levels of CCKAR expression was, the lower the feed to meat conversion ratio was. But in other tissues, there was no the negative correlation.【Conclusion】This study found that increased levels of CCKAR was associated with high feed efficiency. The T allele of g.73296714T>C was associated with high expression activity of CCKAR gene, and with high feed efficiency.
chicken; growth; CCKAR; feed conversion efficiency; appetite

10.3864/j.issn.0578-1752.2022.22.017
2021-09-03;
2021-11-24
陕西省重点研发计划(2021NY-028)、略阳乌鸡蛋用型配套系选育(WJYJY-2021-3)
王哲鹏,Tel:15619295726;E-mail:wangzhepeng-001@163.com
(责任编辑 林鉴非)
