基于高通量测序与UPLC-Q-TOF/MS技术的不同产地银杏叶内生菌与其主要化学成分相关性探究△
2022-01-28陈冉张艳欣王丹丹
陈冉,张艳欣,王丹丹
上海上药杏灵科技药业股份有限公司,上海 201203
银杏Ginkgo bilobaL.是一种药食同源的植物,其叶片可以产生黄酮、内酯等次生代谢物,这些化合物具有增加脑血流量、降低脑血管阻力、改善脑血管循环功能、扩张冠状动脉、增加冠状动脉血流量、改善心脏供血、防止心绞痛及心肌梗死形成的功能[1]。生长环境及土壤营养通常被认为是影响药材质量的主要因素,近年来,人们逐渐认识到内生菌对于植物药用成分的合成与积累起着非常重要的作用[2]。研究人员发现,与植物共生的某些内生菌可促进宿主植物次生代谢产物的合成与积累,甚至产生与宿主相同或相似的活性次生代谢产物[3],也通过培养筛选出能产生活性次生代谢物的内生菌[4]。然而,在自然界中,大部分内生菌都是不可培养的,难以从植物组织中分离。因此,植物体内生菌与植物次生代谢物之间相关性尚不明确。本研究运用高通量测序技术和超高效液相色谱-四级杆-飞行时间质谱法(UPLC-Q-TOF/MS)检测,分别对都江堰、平邑、崇明3个产地的银杏叶内生细菌和真菌进行多样性分析,比较不同产地银杏叶片内生菌群落多样性及群落结构,分析银杏叶内生菌多样性与其主要化学成分含量的相关性,通过生物信息学分析技术预测化学成分与菌群之间的互作关系,从而指导可协作产生药用成分菌株的筛选,利用内生菌促进药用成分的代谢累积,可为异源获得银杏药效成分提供参考。
1 材料
1.1 试药
选取四川省都江堰市(DY)、上海市崇明岛(CY)、山东省平邑县(PY)3 个银杏生产基地作为采样区。银杏树于4月初开始萌发初芽,直至7月开始采收,本研究所有样品均采于2019年4—7月的每月中旬,为较完整的银杏生长-采收期,采样地点均选取远离道路的种植区,以避免汽车尾气等其他生产生活因素对实验的影响。采集样品时,每个产地随机选取3~4个5 m×5 m的样方作为采样点(A、B、C、D),每个样方内按5 点取样法采集银杏叶片,将5点的叶片样品充分混合形成1个样品,装入无菌的自封袋中,做好标记,储存于干冰/冰袋中带回实验室,并保存于-80 ℃冰箱用于后续实验分析。样品采收时间和编号见表1。
表1 不同产地银杏叶药材来源信息
对照品银杏内酯A(批号:W25A7K13730)、银杏内酯B(批号:D15D8G50608)、银杏内酯C(批号:C28S6G3986)、白果内酯(批号:P08J9F52398)、银杏内酯J(批号:D29J9G53845)、芦丁(批号:Y16M9S61523)、山柰酚-3-O-芸香糖苷(批号:Y15N8H48277)、碟豆素(批号:M13J10S90494)、槲皮素3-O-葡萄糖基(1→2)鼠李糖苷(批号:M13J10S90493)、水仙苷(批号:S08A8D33447)、3-O-(2-O-[6-O-(β-羟基-反-香豆酰)-葡萄糖基]-鼠李糖基)山柰酚(批号:M13J10S90492)、3-O(2-O-[6-O(β-羟基-反-香豆酰)-葡萄糖基]-鼠李糖基)槲皮素(批号:M13J10S90491)、银杏双黄酮(批号:GR-133-150405)、金松双黄酮(批号:P03M9F55041)、白果双黄酮(批号:Y15J9L63710)、银杏酸(C17∶1)(批号:Y18J10H73680)、银杏酸(C13∶0)(批号:P11D8F50448)、D-(-)奎宁酸(批号:A06N11L130218)均购于上海源叶生物科技有限公司;穗花杉双黄酮(批号:10412)、银杏酸(C15∶1)(批号:1130)、原儿茶酸(批号:5668)、莽草酸(批号:863)均购于上海诗丹徳生物技术有限公司;所有对照品纯度均≥98%;DNeasy®Plant Mini Kit(50)试剂盒(德国Qiagen公司);琼脂糖(Sigma 公司);三(羟甲基)氨基甲烷盐酸盐(Tris-HCl)、TAE电泳缓冲液[生工生物工程(上海)股份有限公司];DNA 凝胶回收试剂盒(美国Axygen Biosciences 公司);三氯甲烷、异戊醇、无水乙醇(分析纯,国药集团化学试剂有限公司);液氮(上海氯闵气体有限公司);超纯水;植物内生细菌引物(上海美吉生物医药科技有限公司)。
1.2 仪器
Waters Xevo G2-XS 型Q-TOF 飞行时间质谱仪,配有电喷雾离子源(ESI);Waters ACQUITY UPLC型超高效液相色谱仪,含二元梯度泵、自动进样器、柱温箱、二极管阵列(DAD)检测器、Masslynx 4.1 软件;Proflex base 型聚合酶链式反应(PCR)仪、NanoDrop2000 型紫外-可见分光光度计、Sorvall Legend Micro 17R 型离心机(美国Thermo Fisher Scientific 公司);Mini-Sub Cell GT 型电泳仪(美国Bio-Rad 公司);QuantiFluor™-ST 型微型荧光计(美国Promega 公司);5200 multi 型凝胶成像仪(上海天能科技有限公司);KQ5200DE 型数控超声波清洗器(昆山市超声仪器有限公司);Direct-Q 3UV 型超纯水机(美国Millipore 公司);Illumina MiSeq型高通量测序平台(美国Illumina公司)。
2 方法
2.1 银杏叶片表面无菌处理
将银杏叶表面用双蒸水(ddH2O2)清洗,用滤纸吸干表面水分。将样品放入超净操作台中,在培养皿中用75%的乙醇浸泡1~2 min,ddH2O2清洗后放入0.1 mol·L-1的磷酸盐缓冲液(PBS)中,超声清洗1 min,涡旋10 s,重复2 次,最后用无菌水冲洗2 次,用无菌滤纸吸干表面水分。
2.2 银杏叶片内生菌基因组提取及测序
将无菌处理后的叶片放入研钵,加液氮研磨至粉碎,采用DNeasy®Plant Mini Kit(50)试剂盒提取内生菌DNA。使用NanoDrop 2000 紫外-可见分光光度计和1%琼脂糖凝胶电泳检测DNA 浓度、纯度与完整性。将获得的DNA 进行扩增,引物见表2,该引物通过巢式PCR 方法,极大降低宿主污染比例。内生真菌引物选择ITS1F_ITS2R。

表2 银杏叶内生菌引物
使用2%琼脂糖凝胶回收PCR 产物,利用DNA凝胶回收试剂盒进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用微型荧光计进行检测定量。根据Illumina MiSeq高通量测序平台标准操作规程将纯化后的扩增片段构建PE 2×300 的文库。使用Illumina MiSeq测序平台进行测序,R 3.3.1软件作图。
2.3 银杏叶主要化学成分检测
2.3.1 供试品溶液制备 将叶片洗干净后,60 ℃烘干,研磨过筛后干燥,储存备用。银杏叶双黄酮和烷基酚类成分检测样品处理如下:称取银杏叶中粉粉末约0.1 g,用乙醇5 mL 超声提取10 min,3000 r·min-1(离心半径为16 cm)离心10 min,吸取上清液,重复超声提取3 次,合并上清液,加入10.189 μg·mL-1格列本脲内标乙醇中间液500 μL 并定容至25 mL 量瓶中。其他成分检测样品处理如下:称取银杏叶中粉粉末0.1 g,用50%甲醇5 mL 超声提取10 min,3000 r·min-1(离心半径为16 cm)离心10 min,吸取上清液,重复超声提取3次,合并上清液,加入内标50%甲醇中间液(10.189 μg·mL-1)500 μL 并定容至25 mL量瓶中。
2.3.2 对照品溶液制备 精密称取干燥至恒重的编号为1~22的对照品(表3),加入50%甲醇制成质量浓度分别为9.89、14.46、9.28、4.71、21.19、8.91、5.89、6.21、5.91、6.85、15.90、16.34、9.84、4.07、8.04、9.51、179.68、90.97、16.11、41.10、2.02、97.50 μg·mL-1的储备液,逐级稀释得不同质量浓度的对照品溶液。
2.3.3 色谱条件 色谱柱Waters ACQUITY UPLC C18(50 mm×2.1 mm,1.7 μm);流动相为含0.05%甲酸的甲醇溶液(A)-0.05%甲酸水溶液(B);梯度洗脱(0~1 min,98%A;1.0~13.5 min,98%~2%A;13.5~16.5 min,2%A;16.5~20.0 min,2%~98%A);检测波长为360 nm;流速为0.4 mL·min-1;柱温为40 ℃;进样量为5 μL。
2.3.4 质谱条件 负离子条件下,采用Sensitivity模式,扫描时间为20 min;毛细管电压为2.5 kV;离子源温度为120 ℃;脱溶剂气流速为800 L·h-1;脱溶剂气温度为400 ℃;样品锥孔电压为35 V;萃取锥孔电压为4.0 V。
2.4 方法学考察
2.4.1 线性关系考察 精密吸取不同质量浓度的对照品溶液,重复进样2 次,以质量浓度为横坐标(X)、峰面积为纵坐标(Y),得到不同对照品线性方程,结果见表3。

表3 银杏叶成分的标准曲线和线性范围
2.4.2 精密度试验 取山东省平邑县PY4A样品,按2.3.1项下方法制备供试品溶液,按2.3.3项下色谱条件重复进样6次,计算各成分色谱峰出峰时间和峰面积的RSD,结果均小于3%,表明仪器精密度良好。
2.4.3 稳定性试验 取山东省平邑县PY4A 样品,按2.3.1项下方法制备供试品溶液,按2.3.3项下色谱条件分别在0、2、4、6、8、12、24 h进样,计算各个成分色谱峰出峰时间和峰面积的RSD,结果均小于3%,表明该方法在24 h内稳定性良好。
2.4.4 重复性试验 取山东省平邑县PY4A 样品,按2.3.1项下方法制备供试品溶液,按2.3.3项下色谱条件重复进样6 次,计算各成分含量的RSD,结果均小于3%,表明该方法重复性良好。
2.4.5 加样回收率试验 分别精密称取已测含量的银杏样品粉末0.05 g,共6 份,分别按含量的50%、100%和150%量加入对应量的22 个对照品,按2.3.1 项下供试品制备方法制备,每个加入量平行制备2 份供试品溶液。计算得到22 个化合物的回收率为90%~105%,RSD均小于3%。
2.4.6 样品测定 取2.3.1项下供试品溶液1.0 mL,12 000 r·min-1(离心半径为7 cm)离心10 min,吸取上清液进样分析。
3 结果与分析
3.1 不同产地银杏叶内生细菌、真菌群落多样性分析
选择97%相似度的分类单元(OTU),利用mothur 计算不同随机抽样下的α多样性指数,利用R 语言工具制作曲线图。Shannon曲线趋向平坦,说明测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息,该测序结果中包含了大多数微生物类群,能够真实地反映3 个产区叶片样品中微生物的群落组成,见图1。

图1 3个产地不同月份银杏叶内生真菌、细菌的稀释性曲线
Chao 指数反映群落丰富度,Shannon 指数反映群落多样性,结合2个指数分析,由图2可知,平邑地区银杏叶片内生真菌的多样性最低,都江堰相对较高;内生真菌的丰富度也是平邑最小,都江堰相对较大;3 个产地内生真菌多样性、丰富度随月份变化无明显规律。

图2 3个产地不同月份银杏叶内生真菌α多样性指数
由图3 可知,3 个产地的银杏叶内生细菌在多样性上4、5 月份变化不大,而在采收季7 月份都江堰和崇明的多样性最低,多样性随着月份的变化整体呈降低趋势;在内生细菌丰富度上,3 产地银杏叶都在6月份的时候呈最高;3个产地银杏叶内生细菌多样性和丰富度随月份的变化趋势较一致。

图3 3个产地不同月份银杏叶内生细菌α多样性指数
在门水平上,3产地银杏叶内生优势真菌菌群为子囊菌门(Ascomycota)、担子菌门(Basidiomycota),随着月份的变化群落结构较稳定;在属水平上对优势内生真菌菌属(将比例<5%的菌属合并为others)进行分析,结果表明,崇明和平邑的优势真菌属为链格孢属(Alternaria),但都江堰的优势真菌属为乌氏霉属(Uwebraunia);而平邑在7 月采收季出现了大量的Septoria。3 产地的银杏叶片内生真菌在门水平上的群落结构非常一致,而在属水平的真菌群落结构在组成比例上有明显差异(图4)。
在门水平上,3 产地银杏叶优势内生细菌菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes);3个产地银杏叶在7月采收季都是变形菌门的量达到最多,而厚壁菌门量均降低;在属水平上对优势内生细菌菌属(将比例<5%的菌属合并为others)进行分析,结果表明,甲基杆菌属(Methylobacterium)、鞘氨醇单胞菌(Sphingomonas)在初芽期极少,但是在采收季占比最大;3 产地样品在门、属水平的内生细菌群落结构具有一定相似性(图5)。

图5 3个产地不同月份银杏叶内生细菌群落丰度占比
3.2 不同产地的银杏叶主要化学成分含量
采用UPLC-Q-TOF/MS 模式分析银杏叶提取物,总离子流图见图6。利用UNIFI质谱软件,基于保留时间、精确相对分子质量和二级碎片离子信息对色谱峰进行指认,并通过对照品的比对,确定了22 个主要化学成分(图7)。
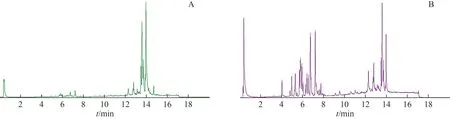
图6 银杏叶主要成分总离子流图

图7 银杏叶中22种主要化学成分总离子流图
基于UPLC-Q-TOF/MS 技术,以内标法(格列本脲为内标)对银杏叶中22 个化合物进行含量测定,建立了22 个化合物的含量测定方法。通过标准曲线计算得到3 个产地不同月份银杏叶中主要化学成分含量,并将22 个成分归类为萜内酯类(银杏内酯A、银杏内酯B、银杏内酯C、白果内酯、银杏内酯J)、黄酮醇苷类{芦丁、山柰酚-3-O-芸香糖苷、碟豆素、槲皮素-3-O-葡萄糖基(1→2)鼠李糖苷、水仙苷、3-O-(2-O-[6-O-(β-羟基-反-香豆酰)-葡萄糖基]-鼠李糖基)山柰酚、3-O-(2-O-[6-O-(β-羟基-反-香豆酰)-葡萄糖基]-鼠李糖基)槲皮素}、有机酸类[D-(-)奎宁酸、原儿茶酸、莽草酸]、烷基酚类[银杏酸(C17∶1)、银杏酸(C15∶1)、银杏酸(C13∶0)]、双黄酮类(银杏双黄酮、穗花杉双黄酮、金松双黄酮、白果双黄酮)5类(表4)。

表4 3个产地银杏叶不同月份的主要化学成分质量分数(n=3)%
3.3 不同产地的银杏叶主要化学成分与内生菌群落的相关性分析
通过计算银杏叶主要化学成分含量与其内生菌基因组高通量数据之间的相关性系数(Spearman 等级相关系数、Pearson 相关系数等),将获得的数值矩阵通过Heatmap 直观展示。在银杏叶片内生细菌中,萜内酯与其相关性小;黄酮醇苷与其大多呈正相关,如假单胞菌(Pseudomonas)、罗姆布茨菌(Romboutsia)、葡萄球菌(Staphylococcus)、unclassified_f_Burkholderiaceae等;有机酸与其也大多呈正相关,如短波单胞菌(Brevundimonas)、假单胞菌、红球菌属(Rhodococcus)、葡萄球菌;内生细菌与烷基酚和双黄酮大多呈显著负相关。银杏叶片中内生真菌中,萜内酯大部分与内生真菌呈显著负相关;黄酮醇苷与内生真菌多数呈负相关,但黄酮醇苷与链格孢属(Alternaria)、枝孢属(Cladosporium)、球腔菌属(Mycosphaerella)呈显著正相关;有机酸与其多数呈正相关,尤其与链格孢属、球腔菌属、掷孢酵母属(Sporobolomyces)、匍柄霉属(Stemphylium)呈显著正相关;烷基酚与内生真菌相关性较小;双黄酮与担孢酵母属(Erythrobasidium)、乌氏霉属(Uwebraunia)呈显著正相关(图8)。

图8 3个产地银杏叶内生菌与其主要化学成分的相关性
4 讨论
内生菌在植物体内特殊的生态环境中与宿主植物长期协同进化,产生或者参与合成同植物次生代谢物相似的次级代谢产物[5-7]。因此药用植物内生菌也是影响中药材品质的重要因素,内生菌的组成受多种因素的影响,如取样部位不同[8]、生长阶段[9]及地域差异[10]等环境因素。在本研究中,随着月份的变化,3 产地的银杏叶内生菌多样性和丰富度都有明显的波动变化,表明了季节是影响银杏叶内生菌多样性和丰富度的因素之一。已有文献报道从银杏中分离的内生细菌主要有枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽胞杆菌(Bacillus amyloliquefaciens),具有抑制病原菌侵染的作用[11-12],在本研究结果中也发现了类似的厚壁菌门(Firmicutes)下芽孢杆菌群落,同时还发现了甲基杆菌属、鞘氨醇单胞菌属等为优势菌。查阅文献发现产内酯类成分的内生真菌有毛霉属(Mucor)、镰孢菌属(Fusarium);分离出产黄酮类化合物的内生真菌有卷枝毛霉(Mucor circinelloides)、刺盘孢属(Colletotrichura)、匐柄霉(Stemphylium botryosum)、交链孢属(Alternaria)、赤霉属(Gibberella)、蜜孢霉(Sphacelia)和放线菌属(Actinomyces)[13-14],本研究丰富了银杏叶内生细菌和内生真菌的种类与资源。
本研究采用UPLC-Q-TOF/MS 建立了快速灵敏测定银杏叶中的萜内酯类、黄酮醇类、双黄酮类、有机酸类、烷基酚等类化合物含量的方法,并对都江堰、崇明、平邑3 个不同地区银杏叶内生真菌、细菌多样性与其主要化学成分进行了相关性分析,期望找到与银杏叶关键次生代谢产物呈正相关关系的内生菌[15]。通过相关性分析,在银杏叶片内生细菌中,萜内酯与其相关性小;黄酮醇苷与其大多呈正相关,如假单胞菌、罗姆布茨菌、葡萄球菌等。银杏叶片中内生真菌中,萜内酯大部分与内生真菌呈显著负相关;黄酮醇苷与内生真菌多数呈负相关,但黄酮醇苷与链格孢属、枝孢属、球腔菌属呈显著正相关。这为进一步探究该类菌对银杏叶次生代谢产物影响的机制提供了研究基础,为提高银杏次生代谢产物的含量及质量提供了理论依据。在后续研究中,将进一步对银杏叶内生菌进行培养做相互验证,深入研究优势菌的功能,为银杏叶品质形成、合理采收提供科学依据。
