中学化学几例疑难实验问题的探究
2022-01-27俞崟
俞崟

摘要: 对中学化学实验教学中遇到的六个疑难问题[盛满二氧化氮气体的试管倒扣在水中(足量),水位上升高度为何大于试管容积的2/3; Al(OH)3能被NH3·H2O溶解吗;能否用KI来区分真假碘盐;酸碱中和反应实验中,烧碱溶液的浓度应为多少;Cu和浓HNO3反应为何先慢后快;长期存放的溴水会褪色吗]进行实验探究和讨论,以期为化学教学提供参考。
關键词: 疑难实验问题; 实验探究; 化学教学
文章编号: 10056629(2022)01007905
中图分类号: G633.8
文献标识码: B
对课堂实验教学中常涉及的六个疑难问题进行实验探究及深度思考,以供同行们参考。
1 盛满二氧化氮气体的试管倒扣在水中(足量),水位上升高度为何大于试管容积的2/3
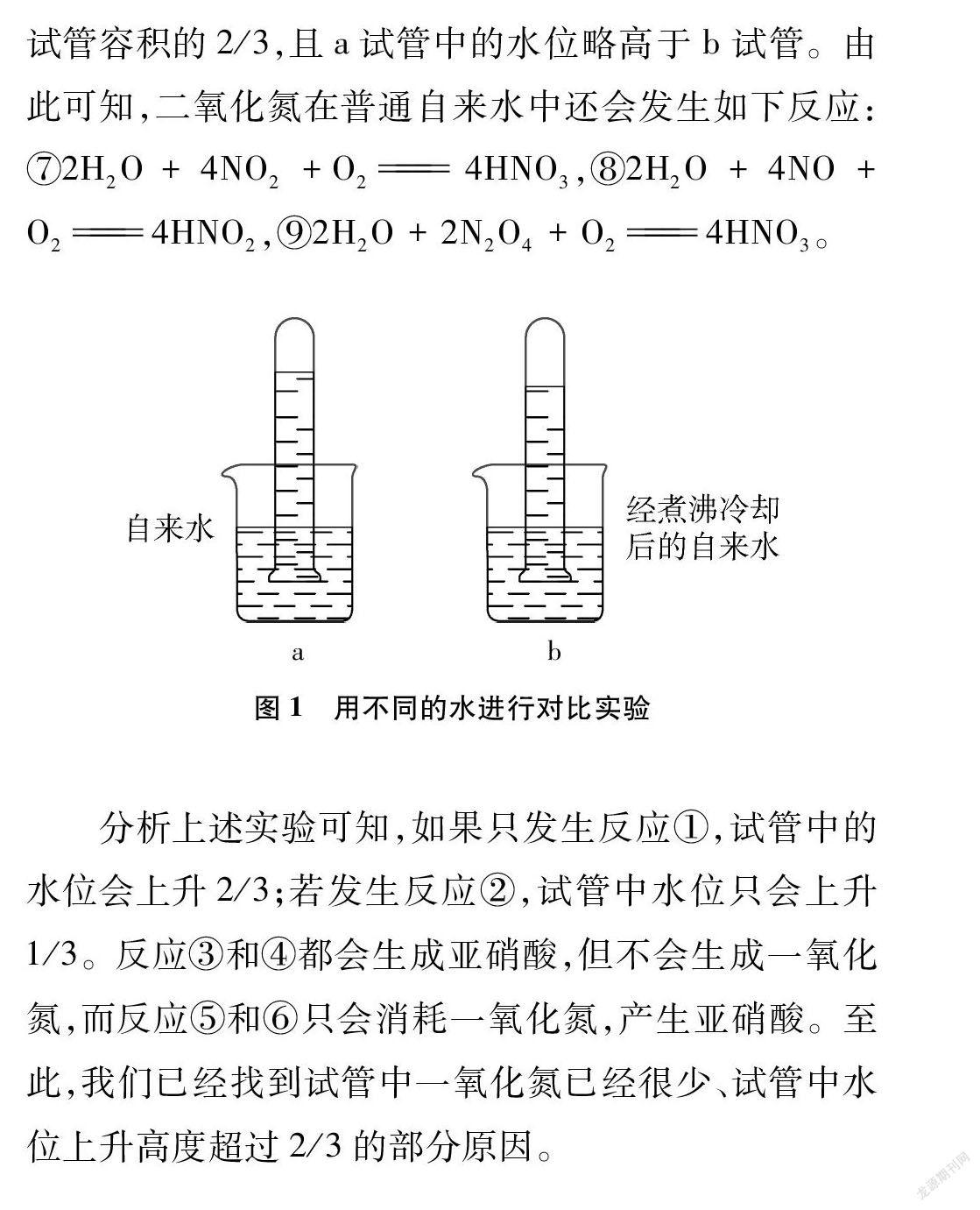
我们都知道,NO2溶于水会发生如下反应: ①H2O+3NO2NO+2HNO3,很多同行把反应①视为试管中水位上升2/3的重要依据。笔者认为,这种观点是欠妥的。首先,NO2在常温下就会转化成N2O4,也就是说常温下有NO2和N2O4的混合物存在,所以还会发生如下反应: ②2H2O+3N2O42NO+4HNO3。其次,二氧化氮还会和水反应生成亚硝酸: ③H2O+2NO2HNO2+HNO3,④H2O+N2O4HNO2+HNO3;二氧化氮还会和反应①中生成的NO继续反应: ⑤NO+NO2+H2O2HNO2,⑥2NO+N2O4+2H2O4HNO2。由于普通的水中都会溶有少许氧气,二氧化氮与H2O的反应还不止上述6个。于是又做了如下尝试: 将自来水煮沸5分钟,以除去溶解在自来水中的少量氧气,密封保存降至室温,然后与普通的自来水做如下对比实验: 将两支盛满二氧化氮的试管(大小一样)同时倒置于盛有自来水和经煮沸冷却的自来水中,如图1所示。5分钟后,发现两支试管里的水位上升高度都超过试管容积的2/3,且a试管中的水位略高于b试管。由此可知,二氧化氮在普通自来水中还会发生如下反应: ⑦2H2O+4NO2+O24HNO3,⑧2H2O+4NO+O24HNO2,⑨2H2O+2N2O4+O24HNO3。
分析上述实验可知,如果只发生反应①,试管中的水位会上升2/3;若发生反应②,试管中水位只会上升1/3。反应③和④都会生成亚硝酸,但不会生成一氧化氮,而反应⑤和⑥只会消耗一氧化氮,产生亚硝酸。至此,我们已经找到试管中一氧化氮已经很少、试管中水位上升高度超过2/3的部分原因。
2 Al(OH)3能被NH3·H2O溶解吗
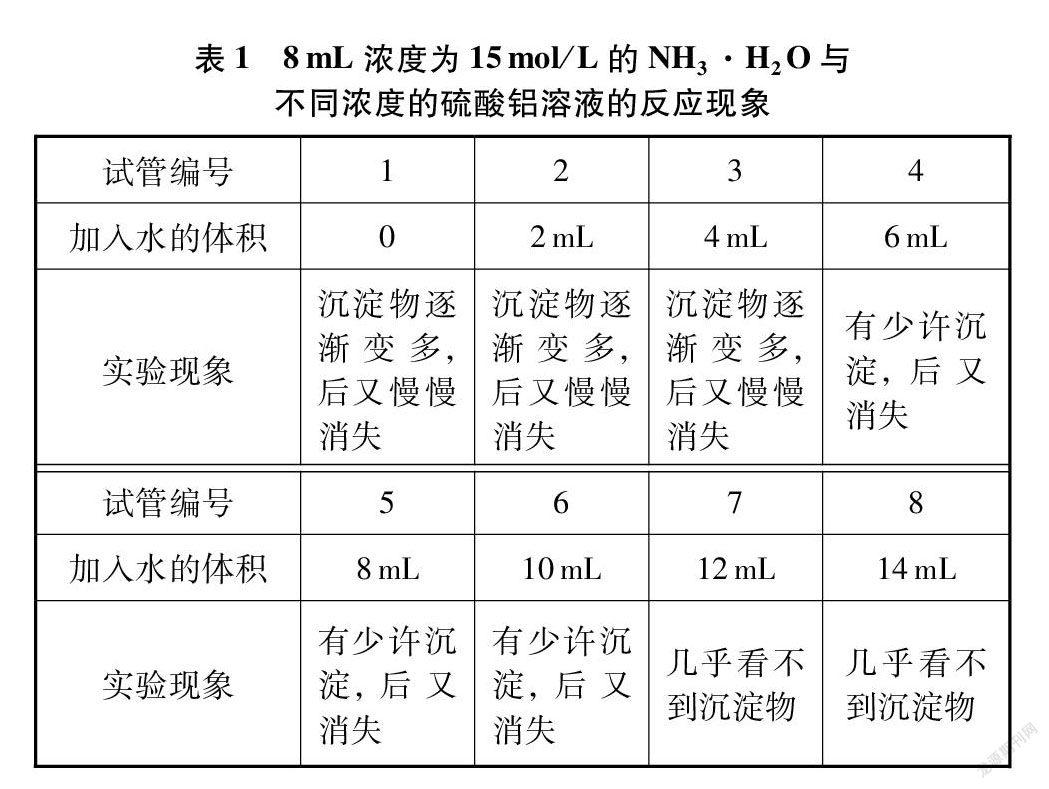
实验1 室温条件下将不同体积的蒸馏水分别注入8支盛有2mL浓度为0.1mol/L的硫酸铝溶液的试管中,再分别逐滴滴入8mL浓度为15mol/L的浓NH3·H2O,实验现象及数据记录如表1所示。
通过加入的蒸馏水的体积来改变Al2(SO4)3溶液的浓度,对上述实验现象分析可知,Al(OH)3能被浓NH3·H2O完全溶解,因为上述8支试管中的液体最后全部变澄清。
上述实验1中Al(OH)3被溶解可能有两个原因: (1)Al(OH)3被蒸馏水溶解;(2)Al(OH)3和NH3·H2O的反应。当溶液中含有的水较少时,很容易看见Al(OH)3被NH3·H2O溶解,如1~3号试管中的现象;当溶液中含有大量水时,就很难说清Al(OH)3是被水溶解还是和NH3·H2O发生了反应,或者两种情况都存在,如第7、 8两支试管内几乎看不到有沉淀产生。
为了减少Al(OH)3在H2O中溶解的干扰,笔者又配制不同浓度的NH3·H2O,进行实验2。
实验2 室温条件下向8支盛有2mL浓度为0.1mol/L的硫酸铝溶液的试管中,逐滴滴入8mL不同浓度的氨水(15mol/L的浓氨水与蒸馏水按一定体积比混合),实验现象及数据记录如表2所示。
由实验2分析可知,浓NH3·H2O能溶解一定量的Al(OH)3,一定浓度的氨水也能溶解Al(OH)3,只不过当NH3·H2O与蒸馏水的体积比小于1∶5时,Al(OH)3就不再溶解了。因此,若生成的Al(OH)3比较多,且选用的氨水的浓度和体积都比较小时,要看到Al(OH)3溶解就有点困难。
实验表明: 刚开始Al(OH)3能溶解在较稀的NH3·H2O中,随着反应的进行,AlO-2浓度变大,所需NH3·H2O浓度也要变大。随着NH3·H2O的不断加入,NH+4和AlO-2也不断被稀释,需要的NH3·H2O浓度也不会增大得太多,所以要达到一定浓度的NH3·H2O才能完全溶解Al(OH)3。
3 能否用KI来区分真假碘盐
有同行认为,用KI来区分真假碘盐(5I-+IO-3+6H+3H2O+3I2)是不正确的,将I-氧化的不一定是IO-3,有可能是溶解在水中的少量氧气,事实果真如此吗?笔者做了如下研究。
实验3 室温条件下向A试管中加2克氯化钠,再注入6mL蒸馏水,振荡试管。再依次加入10滴浓度为0.5%的淀粉溶液和2mL浓度为0.1mol/L的碘化钾溶液,振荡试管,观察实验现象。最后再滴入2滴浓度为1mol/L的硫酸溶液,振荡试管,观察实验现象。
实验4 室温条件下向B试管中依次加入10滴浓度为0.5%的淀粉溶液和2mL浓度为0.1mol/L的碘化钾溶液,振荡试管,观察实验现象。最后再滴入2滴浓度为1mol/L的硫酸溶液,振荡试管,观察实验现象。
实验5 室温条件下向C试管中加入2克加碘盐,注入6mL蒸馏水,振荡试管,使其充分溶解。再依次滴10滴浓度为0.5%的淀粉溶液和2mL浓度为0.1mol/L的碘化钾溶液,振荡试管,观察实验现象。最后再滴入2滴浓度为1mol/L的硫酸溶液,振荡试管,观察实验现象。
发现A、 B两支试管中的溶液刚开始无明显变化,加入稀硫酸后,溶液仍然显无色,三小时后发现溶液显示出非常浅的蓝色;而当加入稀硫酸后,C试管中的溶液迅速变为蓝黑色。
由实验3和实验4分析可知,溶液中溶有的氧气不足以将KI中的I-氧化,由实验5分析可知,加碘盐中的IO-3能将KI中的I-迅速氧化使淀粉显色[1]。
此外,还另行设计了如下实验,用以探究碘化钾溶液、硫酸溶液的浓度与溶液显示颜色的时间关系。
实验6 实验步骤及实验现象如表3所示。
实验7 实验步骤及实验现象如表4所示。
分析实验6和7可知,若没有碘酸钾,只靠氧气来氧化碘离子,需要3小时,溶液才会显示出很浅的蓝色[2](如表3中的6号试管和表4中的3号试管)。随着KI或H2SO4浓度的增大,氧气将I-氧化的时间从几小时变为几分钟。目前,我国食用盐中含碘量为(35±15)mg/kg,假设取1g加碘盐来进行实验,其中碘酸钾的质量最多为0.5×10-1mg,使其完全反应需要1.9×10-1mg碘化钾,换算成10-3mol/L的碘化钾溶液为1.17mL。
所以,实验过程中我们只需取1~2滴浓度为10-2~1mol/L的硫酸溶液和0.5mL浓度为10-3~10-1mol/L的碘化钾溶液就能有效地避免因氧气氧化碘离子的“意外”现象。
4 酸碱中和反应实验中,烧碱溶液的浓度应为多少
探究人教版九年级《化学》教材下册第60页“中和反应”时,发现若实验时加入的烧碱溶液的浓度过大时,酚酞溶液就会先变红再褪色,烧碱溶液浓度越大,其褪色所耗时间越短,这是因为当pH>8.2时,酚酞为红色醌式结构,这种结构在强碱条件下极不稳定,会转变成无色的羧酸盐结构[3]。若烧碱溶液浓度太小,与盐酸反应产生的热量太少,溶液温度没有明显变化,若用普通温度计测量,耗时长,散热多,测量结果误差大[4]。为此,对中和反应中盐酸和烧碱溶液的最佳质量分数做了如下实验探究。
4.1 烧碱溶液的浓度与酚酞溶液褪色的时间关系
取1~14号烧杯(25mL),室温条件下分别加入5mL浓度为1%、 1.5%、 2%、 2.5%、 3%、 3.5%、 4%、 4.5%、 5%、 6%、 7%、 8%、 9%、 10%的烧碱溶液,再各滴2滴无色酚酞溶液,记录酚酞溶液开始褪色到几乎不变色所耗时间,结果如表5所示。
由表5分析可知,烧碱溶液浓度越大,酚酞溶液褪色所耗时间越短。当烧碱溶液浓度高于8%时,酚酞溶液很快褪为无色;当烧碱溶液的浓度为5%~7%之间时,酚酞溶液褪色耗时稍长,仍可以看见很淡的红色;当烧碱溶液的浓度为3%~4.5%时,酚酞溶液褪色耗时较长,可以看到淡红色;当烧碱溶液浓度低于2.5%时,酚酞溶液部分褪色,耗时更长,此时,可以看到明显的红色。
由于酚酞的醌式結构与无色的羧酸盐结构之间的转化是一个可逆反应[5],当溶液的pH改变时,反应的平衡点会发生移动。盐酸和烧碱反应时,随着盐酸的不断加入,酚酞在碱性条件下显示的红色一开始会随着烧碱的不断消耗而慢慢变浅。待反应结束时,酚酞会变为无色。
为了让初三学生能获得更为直观的感性认识,教师演示该实验时,需要耗时4分钟左右,而该时间内酚酞没有完全褪为无色,所以烧碱溶液浓度只需1%~6%即可;如果让学生进行实验时,大概需要9分钟,可以控制酚酞溶液褪色后出现淡红色和红色,因此,烧碱溶液浓度1%~4.5%较为适宜。
4.2 烧碱溶液的浓度与反应中的放热关系
另取1~10号烧杯(25mL),室温条件下分别加入5mL浓度为1%、 2%、 2.5%、 3%、 3.5%、 4%、 4.5%、 5%、 5.5%、 6%的烧碱溶液,再各滴2滴无色酚酞溶液,用温度计测量溶液的温度;再分别向上述烧杯中依次加入浓度分别为1%、 2%、 2.5%、 3%、 3.5%、 4%、 4.5%、 5%、 5.5%、 6%的盐酸,至溶液刚好褪为无色,再用温度计测量温度,记录溶液温度变化情况,如表6所示。
由表6分析可知,烧碱溶液和盐酸的浓度越大,反应中释放的热量越多,温度上升也越大。当烧碱溶液和盐酸的浓度<2%时,用手感觉不到温度的变化,但温度计可以测出反应放热的现象;当烧碱溶液和盐酸的浓度≥3%时,温度计上升超过4℃,此时可以用手感觉到温度的变化。
因此,在实验操作过程中实验者若要用手直接感知中和反应过程中的放热现象,烧碱溶液的浓度应在4%~6%之间(实验时需注意安全);若使用温度计,可以参考沪教版初中化学教材,只需0.2mol/L的烧碱溶液,这样既安全、节约又有可行性。
5 Cu和浓HNO3反应为何先慢后快
在低温条件下,铜和浓HNO3反应的确很慢,向浓HNO3中放入冰盐水,使其温度降至-5℃,再将铜片插入其中,发现铜片周围溶液显绿色[因Cu(NO3)2溶液溶有NO2]。
另外,Cu(NO3)2在水中的溶解度相当大,在0℃时,溶解度为45.6g, 80℃时,溶解度为67.5g,因此,有人认为“铜和浓HNO3反应生成Cu(NO3)2在浓硝酸中的溶解度低,会在铜表面形成类似钝化现象”的观点是不可靠的。
浓硝酸的氧化性很强,可以将铜氧化,虽然低温环境下反应速率较慢,但不知同行们是否关注到,即便在低温环境下,铜和浓硝酸的反应速率也不慢(相对比较而言)。为此,笔者又做了如下实验探究: 向A、 B两支试管中分别注入2mL的浓硝酸,并向A管中通入少许NO2(浓HNO3因溶有NO2而略显黄色),再向A、 B两试管中同时放入两块大小几乎一样的铜片,发现即便在一样的低温条件下(5℃),A管中反应速率比B管中要快得多,溶液迅速变为深绿色[Cu(NO3)2溶液因溶有NO2而显绿色]。
浓HNO3中溶有NO2为何会使HNO3和铜的反应立刻发生,且反应速率明显加快?笔者是这样认为的:
第一,浓HNO3中溶有NO2会形成HNO2,其氧化性比浓HNO3更强(H2O+2NO2HNO2+HNO3)。为此,笔者做了如下实验进行验证: 在低温环境下(5℃时),将Cu投入浓硝酸中,发现反应很慢,再向其中加入一小粒NaNO2固体,Cu和浓硝酸的反应立刻剧烈起来: HNO3+NaNO2NaNO3+HNO2, 2HNO2NO2+NO+H2O(反应生成了氧化性更强的HNO2和对Cu和浓硝酸的反应具有催化作用的NO2)。
第二,从反应本质来分析,浓HNO3的氧化性和HNO3中含有的由于见光分解生成的NO2的催化作用有关。NO2具有传递电子的功能: e-+NO2NO-2, H++NO-2HNO2, HNO2+HNO32NO2+H2O, Cu失去的电子被HNO3通过NO2获得,反应速率便加快。溶有二氧化氮气体的浓HNO3和发烟HNO3的氧化性和反应速率比一般的浓HNO3更强、更快,是因为酸中的HNO2(氧化能力更强)和NO2(具有催化作用)所致。
综上所述,铜和浓硝酸的反应,刚开始反应慢一是因为温度低,二是没有HNO2和NO2,后来反应快,是因为自身反应生成了HNO2(氧化性更强)和聚集了越来越多的NO2(起催化作用)所致,再随着反应的进行,反应放热导致温度升高,HNO3的氧化能力变强,因此,后来的反应变得越来越快。
6 长期存放的溴水会褪色吗
实验8 向盛放在通风橱中的A、 B、 C三只细口瓶中分别注入2mL饱和溴水(实验2和实验3也在通风橱中进行),再分别注入20mL蒸馏水,A、 B两瓶口分别用磨口塞和橡皮塞塞紧,C瓶敞口放置,静置。发现两天后C瓶中的溴水橙色变淡,5天后橙色褪去;3天后B瓶橙色变淡,7天后橙色完全变为无色;而A瓶即便存放三个月,瓶中液体颜色几乎不变。用锉刀将橡皮塞锉成粉末状倒入试管中,再滴入2mL溴水,振荡试管,溴水的橙色褪去。
实验9 不管溴水濃度有多小,均可以用鼻子扇闻到溴味,将一张湿润的淀粉KI试纸悬于盛放溴水的瓶口,不久,淀粉KI试纸变蓝。
实验10 向2mL饱和溴水中注入30mL蒸馏水,配成体积比为1∶15的溴水,发现溴水呈淡淡的橙黄色,磨口瓶中密封存放半个月,发现液体颜色几乎不变,而且还可以用CCl4或C6H6将Br2萃取出来。溴水中的Br2和H2O的反应几乎可以忽略不计,只要保存得当,Br2不会减少,而且溴水的颜色和浓度也能基本保持不变。
实验11 配成不同浓度的溴水,再将溴水装满于三只同样的150mL的细口瓶中(塞上磨口塞),分为两组。一组置于阴暗处,一组置于阳光能照射到的地方,对比、观察、记录实验数据及结果如表7所示。
由上述实验分析可知: (1)Br2的挥发性比较强,若保存不够严密,Br2会挥发,溴水颜色变淡,橙色也会慢慢消失;(2)橡皮塞内的不饱和碳碳双键会与Br2发生反应,所以,用橡皮塞密封保存的溴水也会褪色;(3)只要保存得当(如用磨口塞密封),无论溴水置于暗处还是亮处,肉眼均未看到溴水褪色的现象。
参考文献:
[1]刘怀乐. 给苏教版高中化学1、 化学2的某些实验注释[J]. 化学教学, 2011, (6): 71~75.
[2]李桂林. 碘量法在中学化学实验中的应用和探究[J]. 化学教学, 2012, (2): 73~76.
[3]钱胜. 初中化学实验教学之感悟[J]. 中学化学教学参考, 2014, (17): 24~26.
[4]何如涛. 基于体验活动的课堂教学探析——以“中和反应中相关问题的讨论”专题教学为例[J]. 化学教学, 2015, (4): 37~40.
[5]张碧波, 梁善浩. 酚酞试液遇氢氧化钠溶液的实验探究[J]. 教学仪器与实验, 2014, (7): 40~43.
