黑藻抗氧化肽制备及其活性表征*
2022-01-27唐裕芳汪德颖李玉芹曾婷婷周韶华陈雅琪
唐裕芳, 梁 帆, 石 宇, 汪德颖, 周 蓉,李玉芹, 王 唯, 卢 婷, 曾婷婷, 周韶华, 陈雅琪
(湘潭大学 化工学院,湖南 湘潭 411105)
0 引言
氧化应激损伤及自由基代谢失调会加速机体衰老,引发多种慢性疾病,严重危害机体健康[1-4].摄取一定的抗氧化剂,能消除体内过多自由基(如O2-和NO-),能延缓身体衰老,预防炎症、癌症、心脑血管病、阿尔茨海默病等疾病的发生.与人工合成抗氧剂相比,酶解植物源、动物源、微生物源蛋白得到的抗氧化肽因其结构相对简单、活性强、易于机体吸收、安全无毒副作用等特点而备受青睐[5-12].如可利用西瓜籽[13]、鸭胸肉[14]、钝顶螺旋藻藻蓝蛋白[15]等材料制备不同来源的抗氧化肽.
黑藻(Hydrillaverticillata(Linn.f.)Royle)属水鳖科黑藻植物,其繁殖速率快,粗脂肪和纤维含量较低,常被用作鱼类饵料、饲料和农田绿肥.而黑藻细胞中蛋白质含量较高(>25.3%)[16],因而是制备抗氧化肽的良好原料.目前利用黑藻蛋白制备抗氧化肽鲜有报道.本研究以黑藻蛋白为原料,利用酶法水解黑藻蛋白制备酶解物,采用响应面法优化酶解黑藻蛋白工艺条件,分离纯化酶解物制得黑藻抗氧化肽,同时对其自由基清除能力进行考察,以期为黑藻多肽开发和高值化利用提供理论依据.
1 材料与方法
1.1 实验材料
黑藻粗提蛋白粉购于西安泽朗生物科技有限公司;胰蛋白酶, ABTS,过硫酸钾,甲醇,甲醛,1,1-二苯基-2-三硝基苯肼(DPPH),硝基蓝四氮唑(NBT),烟酰胺腺嘌呤二核苷酸(NADH),三羟甲基氨基甲烷(Tris)均购于上海麦克林生化科技有限公司;氢氧化钠,盐酸,磷酸二氢钠,磷酸氢二钠购于西陇科学股份有限公司.G-25葡聚糖凝胶购于西宝生物科技股份有限公司,化学试剂均为分析纯级别.
1.2 实验方法
1.2.1 黑藻蛋白质提取及含量测定称取80 g黑藻粗提蛋白粉悬浮于800 mL超纯水中,充分溶解后4 ℃离心20 min,取上清液减压抽滤后,所得滤液于30%、40%、50%、60%、70%、80%和90% 饱和硫酸铵溶液中沉淀黑藻蛋白,选择最佳的硫酸铵浓度,离心所得沉淀物以超纯水溶解后装入透析袋,透析除盐48 h后,真空冷冻干燥得黑藻蛋白.采用凯氏定氮法测定黑藻蛋白质含量.
1.2.2 影响黑藻蛋白酶解物制备的因素100 mg/mL的黑藻蛋白溶液在37 ℃酶解温度和pH 7.0条件下,以不同酶底比(2%、4%、6%、8%、10%、12%和14%)分别加入胰蛋白酶进行酶解反应,酶解4 h后,考察酶底比对黑藻蛋白酶解物的影响.
100 mg/mL黑藻蛋白溶液中加入酶底比为8%的胰蛋白酶进行酶解反应,在37 ℃酶解温度和pH 7.0条件下,分别酶解1 h、2 h、3 h、4 h、5 h、6 h和7 h后,考察酶解时间对黑藻蛋白酶解物的影响.
100 mg/mL黑藻蛋白溶液中加入酶底比为8%的胰蛋白酶进行酶解反应,在37 ℃酶解温度,pH值分别为6、6.5、7、7.5、8、8.5、9条件下,酶解6 h,考察pH值对黑藻蛋白酶解物的影响.
酶解完毕后均于90 ℃灭酶活10 min,4 000 r/min离心10 min,所得上清液冷冻干燥后即得黑藻蛋白酶解物,测定其对ABTS自由基的清除率(方法见1.2.5节).
1.2.3 响应面法优化黑藻蛋白酶解物制备条件在上述酶底比、酶解时间、酶解pH实验结果的基础上(固定酶解温度37 ℃, 固液比1∶10),采用Design Expert 10进行响应面设计,设置酶底比、酶解时间、酶解pH值3个因素3种水平,按中心组合设计,以酶解物对ABTS自由基的清除率为响应值寻找最佳黑藻蛋白酶解工艺条件.试验因素及水平如表1所示.

表1 响应面法试验因素与水平Tab.1 Coded levels for independent variables used in response surface analysis
1.2.4 黑藻抗氧化肽的分离纯化黑藻蛋白酶解物经截留分子量3 kDa和10 kDa超滤离心(4 ℃, 6 000 r/min离心15 min),按1.2.5的方法测定分离所得的两个多肽组分P-1(MW<3 kDa)和P-2(MW为3~10 kDa)抗氧化性能.抗氧化性能较强的组分进一步经Sephadex G-25凝胶柱(20 mm×70 mm)层析分离:上样体积为1 mL,上样浓度为60 mg/mL,洗脱液为超纯水,洗脱流速为0.5 mL/min,8 min收集一管,测定每管洗脱液在280 nm处的吸光(OD)值,收集峰值处洗脱液,冻干,并测定其抗氧化性能.
1.2.5 抗氧化性能测定
(1)DPPH自由基清除率测定
将0.1 mmol/L的DPPH-甲醇溶液(反应启动管)和纯甲醇溶液(未启动管)分别与500 μL样品溶液等体积混合,摇匀避光静置30 min后,于517 nm处测定反应体系的吸光度值.DPPH自由基的清除率根据公式(1)计算.
(1)
其中A0, Ai0, Ai分别为蒸馏水空白组、反应未启动管和反应启动管的吸光度值.
(2)ABTS自由基清除率的测定
将7.4 mmol/L的ABTS溶液和2.6 mmol/L的过硫酸钾溶液等体积混合,在黑暗室温环境放置12 h后用pH 7.4的PBS溶液将其稀释至OD734=0.7±0.02,此溶液为ABTS工作液.将800 mL ABTS工作液和pH 7.4的PBS溶液分别与200 mL样品以4∶1的体积比混合摇匀,作为反应启动管和未启动管,测定其在734 nm处的吸光值,根据公式(1)计算对ABTS自由基的清除率.
(3)超氧阴离子清除率测定
将100 μL 0.78 mmol/L的还原型辅酶I(NADH)和 700 μL 16 mmol/L的Tris-HCl缓冲液(pH 8.0)混合作为反应未启动管,100 μL 0.78 mmol/L的NADH,100 μL 0.5 mmol/L的氯化硝基四氮唑兰(NBT)和600 μL 16 mmol/L的Tris-HCl缓冲液(pH 8.0)3种溶液混合作为反应启动管,所有管中加入100 μL待测样品溶液,混匀后再分别加入100 μL 0.1 mmol/L的吩嗪硫酸甲酯(PMS),反应完成后在波长560 nm处测定其吸光值,根据公式(1)计算对超氧阴离子自由基的清除率.
(4)羟基自由基清除率测定
1 mL样品中依次加入300 μL 9 mmol/L的FeSO4溶液和 300 μL 8 mmol/L 的H2O2启动反应作为反应启动管,只加300 μL 9 mmol/L的FeSO4溶液,不加H2O2作为反应未启动管,全部试管摇匀后静置10 min;然后向所有试管加入300 μL由50%乙醇配制的9 mmol/L的水杨酸乙醇溶液,于37 ℃水浴锅反应30 min,冷却至室温,在510 nm测定其吸光值,根据公式(1)计算出对羟基自由基的清除率.
1.2.6 统计分析实验数据采用Origin 2018,Design Expert 10 软件分析,每组试验重复3次.
2 结果与分析
2.1 黑藻粗提蛋白粉中蛋白质提取率及蛋白质含量
本论文采用饱和硫酸铵溶液分级沉淀黑藻蛋白质,最终确定使用80%饱和硫酸铵溶液提取黑藻蛋白质,蛋白质提取率为58.7%.凯氏定氮法测定出黑藻粗提蛋白粉中的蛋白质含量为73.64%±2.0.
2.2 单因素实验
不同酶底比、酶解时间、酶解pH值单因素对胰蛋白酶酶解黑藻蛋白的影响如图1所示.从图1(a)可以看出,随着酶底比的增加,酶解物对ABTS自由基清除率呈现先增加后降低的趋势.在酶底比为8%时,所得酶解物对ABTS自由基的清除率最高,为65.1%.酶底比低时(2%~6%),对酶来说,底物较为充足,不能将全部底物酶解转化为酶解产物,因而酶解产物较少,对ABTS自由基清除率较低;随着酶底比增加底物与酶接触机会增多,酶解更充分,产生较多的酶解产物,对ABTS自由基清除率也较高;但随着酶底比的进一步增加(>8%),可能出现酶与底物的结合位点饱和和竞争抑制现象,从而影响底物的酶解,致使酶解物对自由基清除率降低[17].因此,适中的酶底比对获得自由基清除率较高的酶解产物尤为重要.
酶解时间也是获得高活性酶解产物的关键因素.从图1(b)可以看出,随着酶解时间的延长,获得的酶解产物对ABTS自由基清除率呈现先增加后降低的趋势.在酶解时间1~5 h范围内,酶解产物对自由基清除率缓慢增加,在酶解6 h所得酶解物对ABTS自由基的清除率最高,达到65.8%,而在酶解时间>6 h后,酶解产物对自由基清除效率又显著性下降.造成这种现象的原因可能是因为当水解的时间过短时,黑藻蛋白大分子没有水解成具有生物活性的小分子多肽,因而对自由基清除率较低.但水解时间太长,蛋白质过度水解成氨基酸或已没有生物活性短肽链的物质,其对自由基清除率也较低[18-19].
从图1(c)可以看出,在pH 7.5时,所得酶解物对ABTS自由基的清除率最大.这可能是因为pH影响胰蛋白酶分子上氨基和羧基的解离状态,进一步影响胰蛋白酶的活性,或使蛋白酶的空间构象发生改变,甚至破坏酶的结构,导致蛋白酶失活而影响对蛋白质的酶解,造成酶解物中疏水基团未完全暴露,从而影响酶解物的抗氧化性能[20-21].

图1 酶底比(a)、酶解时间(b)、酶解pH值(c)对酶解物清除ABTS自由基的影响Fig.1 Effect of enzyme-to-substrate ratio(a), hydrolysis time(b) and hydrolysis pH(c) on the scavenging radical performance of hydrolysates
通过以上单因素试验结果得出,胰蛋白酶酶解黑藻蛋白质的最佳酶解条件:酶底比为8%、酶解时间6 h、酶解pH 值7.5,为下一步的响应面法优化实验设计提供了理论依据.
2.3 响应面优化实验
单因素实验虽能筛选出酶解反应的最佳条件,但不能分析各因素之间相互作用是否显著[22].为了全面考察影响酶解物抗氧化性能的因素,本论文采用响应面法继续优化胰蛋白酶酶解制备黑藻蛋白酶解物的条件.以酶底比(A)、酶解时间(B)、酶解pH值(C)为自变量,以ABTS自由基清除率为响应值,根据Box-Behnken试验设计原理进行响应面试验,继续优化酶解条件,实验设计方案与实验结果如表2所示.

表2 响应面设计方案与实验结果Tab.2 Experimental design and results for response surface analysis

表2(续)
用Design Expert 10 软件对表2的结果进行多元分析,得到 ABTS自由基清除率(P)与酶底比(A)、酶解时间(B)和酶解pH值(C)的二元多项式回归方程为:ABTS自由基清除率(P)=66.70-0.44×A+1.14×B-0.23×C-0.04×AB+1.27×AC+1.01×BC-4.39×A2-0.56×B2-1.87×C2.


表3 模型回归方程方差分析Tab.3 Analysis of variance (ANOVA) of regression equation
分别固定各因素中的1个因素在0水平, 得其余2个因素的交互作用影响自由基清除的三维响应面图和等高线图, 可以直观地反映各因素的交互作用对酶解产物清除自由基的影响, 如图2所示.从图2(a-1)可知,时间一定时,酶底比增加,ABTS自由基的清除率呈现出先上升后下降的趋势,说明较少或较多的酶底比都会降低酶解物对自由基的清除率.从图2(b-1)可知,pH值一定时,酶底比增加,ABTS自由基的清除率先增大后减小,说明合适的酶底比对酶解产物清除自由基性能尤为重要.从图2(c-1)看出,pH值一定时,随着酶解时间的增加,ABTS自由基的清除率先增大后减小,但减小的趋势不明显,说明较短或较长的时间都不利于提高酶解物对自由基的清除率.

图2 酶底比与酶解时间(a-1、a-2)、酶底比与pH(b-1、b-2)、酶解时间与pH值(c-1、c-2)双因素交互影响ABTS自由基清除率的响应曲面图和等高线图Fig.2 Response surface and contour plots showing the interactive effects of variables on ABTS radical scavenging percentage
等高线是响应面在水平方向的投影,等高线的形状可反映出交互作用是否显著,椭圆等高线表示两因素交互作用显著,圆形等高线表示交互作用不显著[23].图2(a-2)、2(b-2)、2(c-2)的等高线都为椭圆形,说明酶底比与酶解时间、酶底比与酶解pH值、酶解时间与酶解pH值的两因素交互作用对ABTS自由基清除率的影响显著.
如果一个响应面坡度相对平缓, 表明处理条件的变化对响应值的影响不大, 相反, 如果一个响应面坡度非常陡峭, 表明响应值对于处理条件的改变非常敏感[24].图2(a-1)、2(c-1)显示, 固定酶解时间,酶底比和酶解pH值响应面的坡度明显比较陡峭,并且酶底比响应面的坡度更陡峭些,该结果得出与前面方差分析一致的结论:各因素对黑藻蛋白酶解物的抗氧化活性的影响顺序为酶解时间(B)>酶底比(A) > 酶解pH值(C).
通过软件Design Expert 10分析,得到最佳酶解工艺条件:酶底比8.57%、时间5.91 h、pH 7.25,所得酶解物对ABTS 自由基的清除率达到65.6%.考虑到实际实验,最佳酶解条件取:酶底比8.6%、时间5.9 h、酶解pH值 7.3,该优化条件下制备的黑藻蛋白酶解物对ABTS 自由基的清除率达到67.9%,说明响应面得出的最优条件具有可行性.
2.4 响应面优化实验
黑藻蛋白质及其胰蛋白酶酶解物对ABTS、DPPH、羟基自由基和超氧阴离子的清除率见图3.从图3可以看出,相对于黑藻蛋白质,黑藻蛋白质胰蛋白酶酶解物对上述4种自由基的清除率均大幅度提升,分别从38.2%、20.4%、13.9%、28.3%提升到67.9%、40.1%、25.3%、50.1%.这可能是由于黑藻蛋白质经胰蛋白酶酶解成不同分子量的多肽,增加了黑藻蛋白质酶解物对上述4种自由基的清除性能[25].其中,酶解物对ABTS自由基清除率最高,对超氧阴离子自由基清除率次之,这可能是由于不同体系中自由基的形成和清除机理差异所致.帅鸣[26]研究米渣抗氧化肽得出相同的结论:米渣蛋白经酶解后抗氧化性能增强,且对不同体系的自由基呈现不同的清除能力.
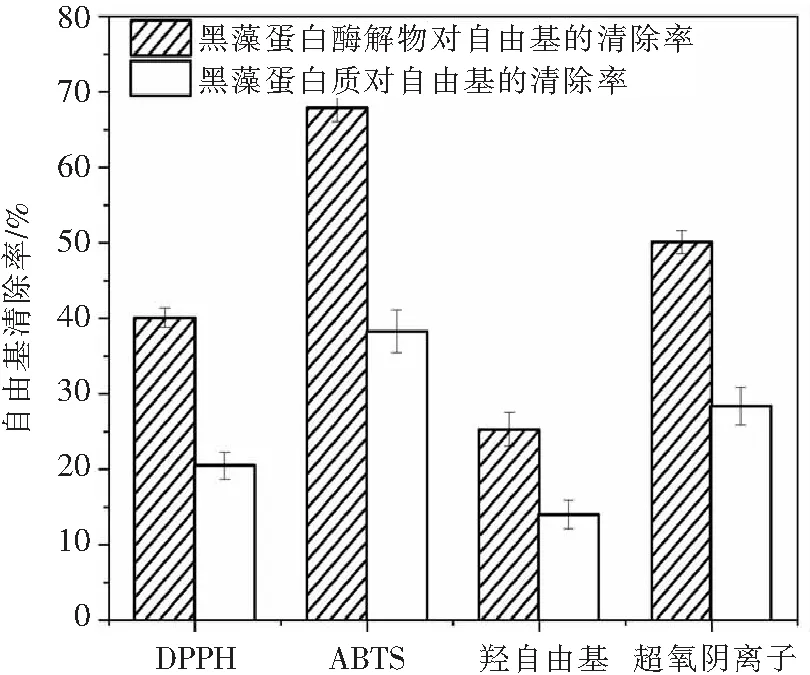
图3 黑藻蛋白质及其胰蛋白酶酶解物对4种自由基的清除率(黑藻蛋白质和酶解物浓度:1 000 μg/mL)Fig.3 Scavenging percentage of HVR protein and its hydrolysates to four kinds of radicals(concentration of HVR protein and its hydrolysates: 1 000 μg/mL)
2.5 黑藻抗氧化肽的分离纯化及抗氧化性能
为了进一步纯化黑藻蛋白酶解物以得到抗氧化性能更好的黑藻抗氧化肽,本实验依次采用超滤和Sephadex G-25凝胶色谱柱分离黑藻蛋白酶解物.黑藻蛋白酶解物经过超滤后得到两组不同分子量分布的组分P-1(<3 kDa)和P-2(3~10 kDa),P-1和P-2对ABTS、DPPH、羟基自由基和超氧阴离子的清除率见图4.从图4可以看出,组分P-1和P-2对上述4种自由基的清除率均有浓度依赖性,且不同浓度的组分P-1对4种自由基的清除率均显著高于组分P-2对4种自由基的清除率.另外,比较图3和图4可以看出,组分P-1对4种自由基的清除率(80.6%、43.1%、31.4%、52.1%)均显著高于未经超滤处理的酶解物对4种自由基的清除率(67.9%、40.1%、25.3%、50.1%).这结果说明小分子量黑藻多肽的抗氧化性能比大分子量黑藻多肽的抗氧化性能强.这可能是由于低分子量的多肽有更多能与自由基结合的活性位点暴露出来[27].这结果与He等[28]研究油菜籽抗氧化肽、Wang等[29]研究双髻鲨肌肉抗氧化肽以及Jiang等[30]研究泥鳅抗氧化肽的结论一致:小分子肽具有较强的抗氧化能力.
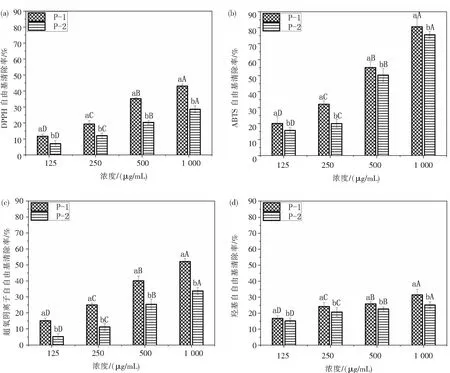
注:大写字母表示不同浓度之间的差异,小写字母表示不同组分之间的差异.图4 超滤后的黑藻抗氧化肽对DPPH (a),ABTS (b),超氧阴离子(c),羟基 (d) 4种自由基的清除率Fig.4 Scavenging percentage of antioxidant peptides prepared by ultrafiltration to DHHP(a),ABTS(b) radical, superoxide anion(c), hydroxyl radical(d)
将组分P-1(<3 kDa)进一步采用Sephadex G-25凝胶色谱柱分离,在各峰值处收集两组分洗脱液,分别冷冻干燥后得到P-1-A 和P-1-B.P-1-A 和P-1-B对ABTS、DPPH、羟基自由基和超氧阴离子的清除率见图5.从图5可以看出,P-1-A 和P-1-B对不同自由基的清除率不同,但清除率均随浓度升高而增加,组分P-1-A 对4种自由基清除率均显著高于组分P-1-B对4种自由基的清除率.比较图5和图4可以看出,在浓度1 000 μg/mL时,P-1-A对4种自由基清除率(88.18%、48.2%、35.5%、54.4%)均显著高于P-1对4种自由基的清除率( 80.6%、43.1%、31.4%、52.1%).这结果说明组分P-1经Sephadex G-25凝胶色谱柱分离后可以获得抗氧化性能更好的黑藻抗氧化肽P-1-A.这实验结果与李婷婷[31]研究鸭胸肉抗氧化肽的结论一致:Sephadex G-25凝胶色谱柱分离后,获得抗氧化性能更好的鸭胸肉抗氧化肽.
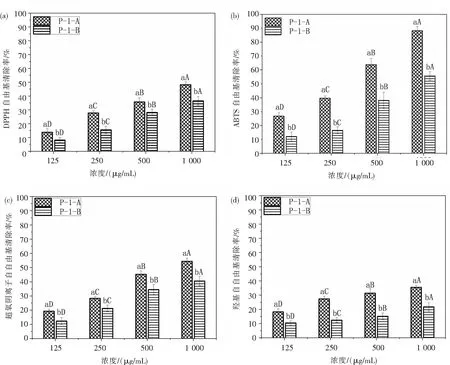
注:大写字母表示不同浓度之间的差异,小写字母表示不同组分之间的差异.图5 Sephadex G-25凝胶柱分离的黑藻抗氧化肽对DPPH (a),ABTS (b),超氧阴离子(c),羟基自由基(d)的清除率Fig.5 Scavenging percentage of antioxidant peptides prepared by separating on G-25 Sephadex column to DHHP(a),ABTS(b), superoxide anion(c), hydroxyl radical(d)
3 结论
在温度37 ℃、固液比为1∶10条件下,以ABTS自由基清除率为响应值,单因素实验和响应面法优化胰蛋白酶酶解黑藻蛋白最佳工艺条件为:酶底比8.6%、酶解时间5.9 h、酶解pH 值7.3,3个因素的影响顺序为:酶解时间>酶底比>酶解pH值.黑藻蛋白酶解物在1 000 μg/mL时对ABTS、DPPH、羟自由基、超氧阴离子的清除率分别为67.9%、40.1%、25.3%、50.1%.采用超滤和Sephadex G-25凝胶柱依次分离纯化,所得黑藻抗氧化肽P-1和P-1-A对ABTS、DPPH、羟自由基、超氧阴离子的清除率分别显著提升到80.6%、43.1%、31.4%、52.1%和88.2%、48.2%、35.5%、54.4%,说明黑藻蛋白酶解物经超滤和Sephadex G-25凝胶柱分离后,成功获得清除自由基性能更强的黑藻抗氧化肽.同时,也说明黑藻蛋白可以制备抗氧化性能较强的抗氧化肽.本研究为开发黑藻抗氧化肽应用于食品、保健品等方面及药理学研究方面提供了更为有效的依据,将产生广阔的经济效益和良好的环境效益.
