不同品系芍药对灰霉病及叶霉病的抗病性差异
2022-01-27钟明志姜媛媛杨瑞武
钟明志,陈 欢,姜媛媛,杨瑞武,张 利*
(1.四川农业大学 理学院,四川 雅安 625000;2.四川农业大学 生命科学学院,四川 雅安 625000)
植物在生长发育过程中,由于自身防御手段有限及外界环境的影响,往往会受到病原菌的侵染,导致植物生长发育过程受阻[1].特别是一些经济作物,受病害影响导致产量下降、质量降低,严重影响经济效益.在植物与病原菌长期相互作用的过程中,植物自身逐渐形成了以生理生化反应为主要手段抵御病原菌侵染的防御机制[2].植物体内存在的一些防御酶均与植物抗病性密切相关,如超氧化物岐化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、过氧化氢酶(CAT)等[3].
芍药(PaeonialactifloraPall.)为芍药科(Paeoniaceae)芍药属(PaeoniaL.),是多年生宿根草本植物[4].以干燥根入药,具有平抑肝阳、柔肝止痛、养血调经、敛阴止汗等功效[5].灰霉病和叶霉病是致植物坏死病原菌[6],拥有广谱的寄生对象,易侵袭老、伤或衰弱的植物[7].芍药生长周期较长,抗逆性较差,干旱和水涝等易导致芍药植株枯萎衰败直至死亡;此外,在生长过程中还易受到灰霉病和叶霉病病原菌的侵染,导致其发育受到影响,严重影响经济效益.Gastón等[8]在智利南部7个地点采集芍药灰霉病病叶,从中分别分离到了灰霉病菌(Botrytiscinerea)、芍药芽孢杆菌(Botrytispaeoniae)和葡萄孢霉菌(Botrytispseudocinerea),在温室接种试验中发现3种病原菌都能对芍药造成损害.Zhao等[9]采集了2个对灰霉病抗性有显著性差异的芍药品种“紫峰玉”和“大富贵”,进行了sRNA测序,鉴定出了4个miRNA可能参与芍药对灰霉病的应答,为芍药抗灰霉病的分子机制提供依据.芍药叶霉病最早经蓝莹等[10]鉴定病原为芍药枝孢霉(CladospriumpaeoniaePass.),主要危害芍药的叶和茎,导致芍药叶片或茎表面生成暗紫红色小斑点,最终导致植株枯焦甚至死亡,严重影响芍药的经济价值.李丽等[11]利用rDNA-ITS以及形态学鉴定手段对芍药叶霉病病原菌进行鉴定,确定山东省芍药叶霉病是由链格孢(Alternaria alternata)和细极链格孢(Alternariatenuissima)两种病原菌引起的复合侵染,为芍药叶霉病的防治提供了理论基础.
针对灰霉病和叶霉病对芍药生长发育带来的不利影响,课题组经专题调研、种质资源收集与评价,对白花川芍药等4个品系药用芍药分别进行灰霉病和叶霉病病原菌接种,观察接种后叶片发病情况及其生理生化指标变化,比较不同品系药用芍药在抗病方面的差异.本研究旨在评价红花川芍药和白花川芍药的抗病差异,为川芍药抗病育种的深入研究和新品种选育提供一定的理论依据.
1 材料与方法
1.1 试验材料
所用芍药包含4个品系,分别由本课题组2008年在四川省中江县自主选育“红花川芍药”(CSY-H)品系和“白花川芍药”(CSY-B)品系;引种至中江县的“杭芍药”(HSY)和“亳芍药”(BSY),分别来自浙江磐安和安徽亳州,经四川农业大学生命科学学院杨瑞武教授鉴定为芍药科芍药属(PaeonialactifloraPall.)“杭芍药”和“亳芍药”.
1.2 试验方法
1.2.1 栽培方法 采用盆栽育苗的方式,选用下底直径18 cm、上口直径25 cm、高27.5 cm的盆栽盆,在盆底铺设砂砾,每盆装载土壤约3 kg,并于底部装入适合的接水盘.将芍头分切至大小均匀的3个芽头,于2017年12月13日在盆中种植芍头,次年叶片展开时接种灰霉病和叶霉病病原菌.
1.2.2 抗病性鉴定 在中国林业微生物菌种保藏管理中心购买编号分别为cfcc87910和cfcc86571的芍药枝孢霉(CladospriumpaeoniaePass.)和灰葡萄孢(BotrytiscinereaPers.)菌株,并接种在PDA培养基上,于25 ℃恒温培养箱中避光培养.
借鉴邓立宝等[12]和李喜玲等[13]的方法,用打孔器将培养的灰葡萄孢菌打成直径4 mm的菌饼,菌丝一面贴在芍药叶片伤口处,用湿润的脱脂棉固定,套袋保湿3 d,分别于接种前(第0 d)及接种后5,10,20,30 d时采集芍药叶片,观察各品系芍药叶片发病情况.采用氮蓝四唑(NBT)法[14]测定SOD活性,采用愈创木酚法[14]测定POD酶活性,采用高锰酸钾滴定法[14]测定CAT活性,参考李忠光等[15]的方法测定PPO活性,参考Tovar等[16]的方法测定PAL活性,采用硫代巴比妥酸法[17]测定MDA含量.
参考石颜通等[18]、李树德[19]的分级标准评定芍药叶片灰霉病病斑等级(表1),并计算病情指数:

表1 芍药灰霉病叶部病斑分级标准
参考杨德翠[20]的方法,用毛刷将PDA培养基上芍药枝孢霉的病原孢子刷下,用无菌水配成3.5×106个·mL-1的孢子悬浮液,将孢子悬浮液喷于芍药叶片的正反面,直至滴水为止,套袋保湿3 d,分别在接种前(第0 d)以及接种后5,10,15,20,30 d时采集各品系芍药叶片,测定叶片的SOD,POD,CAT,PPO,PAL活性和MDA含量,观察各品系芍药叶片发病情况,并参考杨德翠[20]、李树德[19]的分级标准评定芍药叶霉病叶部病斑等级(表2),计算病情指数:

表2 芍药叶霉病叶部病斑分级标准
各品系芍药在感染叶霉病和灰霉病的第30 d,根据病情指数进行抗性水平评价(表3)[18].

表3 芍药灰霉病和叶霉病的抗性水平分类
1.3 数据处理
利用Excel 2016进行数据处理,SPSS 22.0进行显著性分析和方差分析,Origin 9.1进行绘图.
2 结果与分析
2.1 不同品系芍药叶片灰霉病和叶霉病发生程度
如图1和图2所示,在感染灰霉病、叶霉病30 d后,各品系芍药叶片都出现一定的受损和病斑,HSY叶片受损程度及病斑数量和大小均显著高于其他品系.而BSY受灰霉病和叶霉病影响最小,其次是CSY-H和CSY-B.

图1 接菌30 d后不同品系芍药叶片灰霉病发生程度

图2 接菌30 d后不同品系芍药叶片叶霉病发生程度
2.2 灰霉病和叶霉病对芍药叶片生理特性的影响
2.2.1 灰霉病和叶霉病对芍药叶片抗氧化酶系统的影响 如图3所示,随着感染灰霉病天数增加,4个品系芍药的SOD活性、 CAT活性以及HSY和BSY的POD活性均呈先上升后下降趋势;感染叶霉病芍药的SOD和POD活性基本呈上升趋势,CAT活性先上升后下降.
在灰霉病感染下第10 d时,HSY的SOD和POD活性以及BSY与CSY-H的CAT活性均达到峰值,随后开始下降.在第30 d时,CSY-H和CSY-B的POD活性达到最大值,BSY,CSY-B和CSY-H的CAT活性下降到接种前水平,而HSY的CAT活性显著低于接种前(P<0.05).
在接种叶霉病第5~30 d期间,BSY的SOD活性都高于其他品系芍药,在第10~30 d期间,各品系芍药POD活性均显著增加(P<0.05),在第20 d时CSY-H和CSY-B的CAT活性达到峰值,在第30 d时,4个品系芍药的POD活性都达到最大值;整体来说BSY的SOD和POD活性上升幅度更大,且保持了较好的活性.

图3 灰霉病和叶霉病对芍药叶片SOD、POD和CAT活性的影响
2.2.2 灰霉病和叶霉病对芍药防御酶系统的影响 如图4所示,感染灰霉病后,CSY-B和CSY-H的PPO活性和PAL活性、HSY的PPO活性以及BSY的PAL活性均呈先上升后下降趋势;HSY的PAL活性则呈先上升后下降再上升趋势,BSY的PPO活性呈持续上升趋势.在接种灰霉病前,BSY的PPO活性显著低于其他3个品系芍药(P<0.05),感染第5~20 d时,4个品系芍药的PPO活性都显著上升,其中CSY-B和CSY-H的上升速率高于HSY.接种20 d后4个品系芍药PAL活性均达最大值,BSY的PAL活性提升程度高于其他3个品系芍药.
接种叶霉病后,HSY,BSY和CSY-B的PPO活性先增高后下降再增高,CSY-H的PPO,PAL以及CSY-B的PAL逐渐增加,HSY和BSY的PAL活性先升高后降低.CSY-B的PPO活性和PAL活性以及BSY的PPO活性在染病第10 d时达到第一个峰值,随后下降又上升.在第20 d时,BSY和CSY-H的PAL活性达到最大值,30 d时下降到感病前水平,CSY-H的PPO活性在30 d时达到最大值.
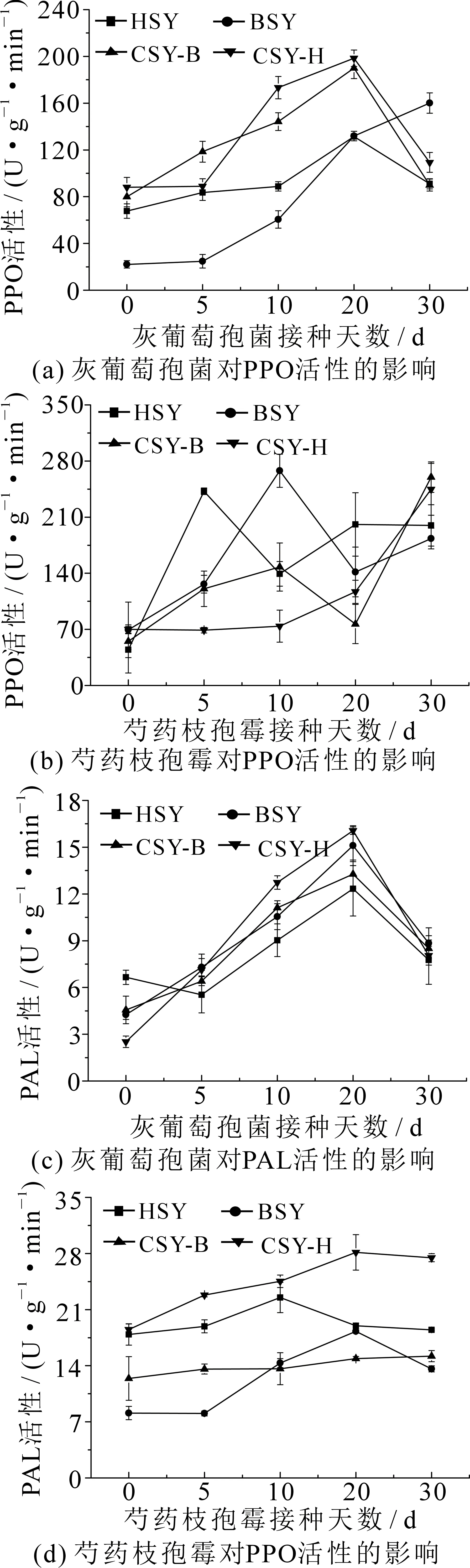
图4 灰霉病和叶霉病对芍药叶片PPO和PAL活性的影响
2.2.3 灰霉病和叶霉病对芍药叶片MDA含量的影响 如图5所示,在感染灰霉病时,4个品系的芍药MDA含量均表现出先上升后下降趋势.在第20 d时达到峰值,且CSY-B,CSY-H以及HSY的MDA含量显著高于BSY(P<0.05).第30 d时,各品系芍药MDA含量开始显著下降(P<0.05),且CSY-B的MDA含量显著高于BSY和CSY-H(P<0.05),与HSY之间差异不显著(P>0.05).在感染叶霉病后,HSY,BSY和CSY-B的MDA含量整体呈上升趋势,而CSY-H的MDA含量先增高后降低.第30 d时,CSY-B,HSY和BSY的MDA含量达到峰值.CSY-H在第5 d时MDA含量达到了最大值,总体来说BSY的MDA含量增加最少.
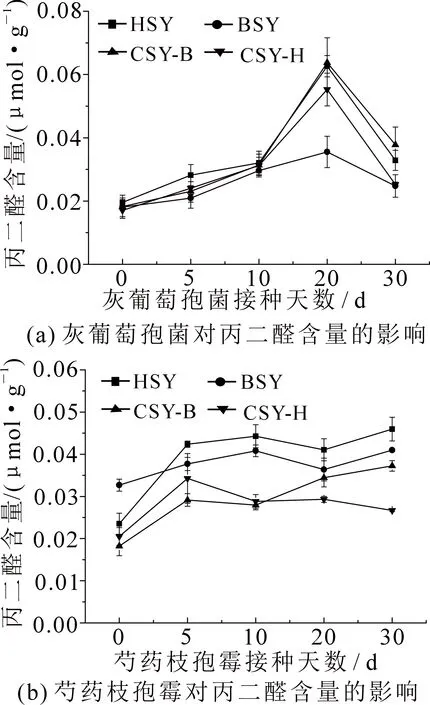
图5 灰霉病和叶霉病对芍药叶片丙二醛含量影响
2.3 不同品系芍药对灰霉病和叶霉病的抗性水平
由表4和表5可以看出,随着感病时间的延长,各品系芍药灰霉病和叶霉病病情均不断加重.在感染灰霉病的情况下,HSY病情发展最快,其次是CSY-B和CSY-H,最后是BSY.在染病的各个时期,BSY和CSY-H病情指数都显著低于HSY和CSY-B.接种灰霉病第30 d时,发现HSY表现为中感,BSY,CSY-B和CSY-H均表现为中抗.
在接种叶霉病第5 d时,发现HSY染病率和感病程度显著低于CSY-H和CSY-B,但随后其病情指数开始不断上升,且病情发展最快.BSY染病最晚,病情发展最慢,其病情指数在各时期均显著低于其他芍药.在接种前期,CSY-H和CSY-B染病最早,病情指数显著高于BSY和HSY,随后两者病情发展缓慢.根据接种叶霉病第30 d时的病情指数,HSY表现为高感,BSY为中抗,CSY-B和CSY-H均为中感.整体上看,BSY对灰霉病和叶霉病抗性最强,其次是CSY-H和CSY-B,HSY对灰霉病和叶霉病的抗性最弱.

表4 不同品系芍药灰霉病病情发展及抗性水平
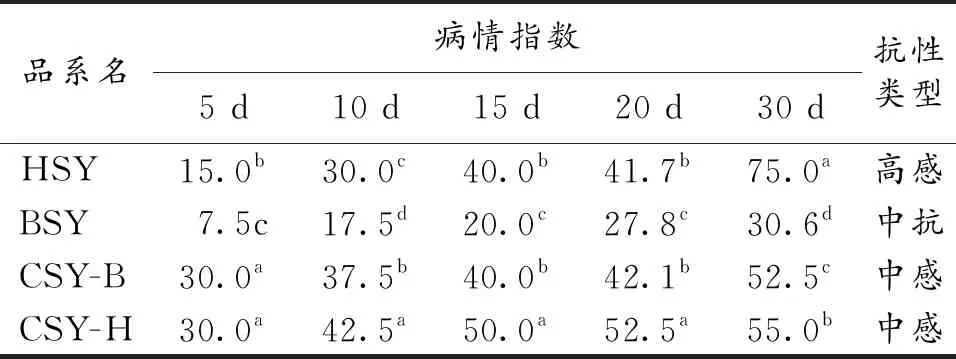
表5 不同品系芍药叶霉病病情发展及抗性水平
3 讨论
大量研究表明,病原菌侵染植物后,植株体内会产生过量的活性氧物质,从而影响自身正常的生理活动,这时保护酶系统则起到了清除活性氧自由基及过氧化物的作用[21].本研究发现,各品系芍药在感染灰霉病后,其SOD,POD和CAT活性发生了先增高后降低的变化,说明在灰霉病感染前期,病原菌复制数量较低,各品系芍药抗性均较强,芍药处于防御应激阶段,抗氧化酶活性较为活跃.而随着病原菌入侵时间增加,各品系芍药抗氧化酶活性开始缓慢下降,说明病原菌复制数量增多,在植物细胞局部位置积累,进而使得芍药体内代谢过程紊乱,生物膜功能受到不利影响,从而抑制了芍药体内抗氧化酶活性[22].
在长期自然选择和人为选育的干预下,抗病品种抗氧化酶的活性和合成效率往往高于感病品种[23].本研究中,BSY无论在感染灰霉病还是叶霉病的情况下,其抗氧化酶活性在达到峰值时的增加幅度都高于其他品系,且下降速度较慢.杨翠徳[20]在研究牡丹感染红斑病后抗氧化酶活性变化的过程中,发现抗病性较强的“鲁菏红” SOD,POD和CAT活性的上升幅度大于易感病的“赵粉”.张成玲等[24]曾利用镰刀菌侵染不同品种甘薯,最终发现SOD,POD和CAT酶活性增加率高低与甘薯品种的抗性呈正相关.
多数植物都存在抵御病原菌侵染的酶,如PPO可以促进醌类化合物生成,对病原菌起到毒害作用,以此来抑制病原菌的侵染[25],PAL参与苯丙烷的代谢,诱导植物产生多种抗菌物质[26].在本研究中,各品系芍药接种叶霉病和灰霉病后PPO和PAL活性都显著高于对照组,且抗病性最强的BSY接种灰霉病后PPO和PAL活性增幅最大.陈夕军等[27]在研究黄瓜感染白粉病后其防御酶活性变化的过程中发现,抗性品种接种后PPO活性迅速上升,而感病品种防御活性酶的上升幅度缓慢.王生荣等[28]曾说明,植物在抵御病原菌入侵的过程中,其PAL活性会增强,抗病品种体内的PAL活性相对感病品种上升幅度更大,活性持续时间更长,积累更多抗菌物质.
大量研究表明,植物受到病原菌入侵后,代谢过程会紊乱,MDA会在植物中积累,而过量的MDA含量会导致感染病原菌细胞的膜系统受到损害[29].因此,MDA含量是病原菌入侵程度的间接反映.本研究中,各品系芍药在灰霉病和叶霉病的感染前期MDA含量开始积累,但由于芍药体内清除活性氧的SOD和POD活性也显著增强,二者协同作用使得MDA含量在感染的后期开始下降.灰霉病和叶霉病抗性更强的BSY,其MDA含量低于其他品系.李捷[30]研究也发现,枸杞感染根腐病后,抗病品种MDA含量的净增加值显著低于感病品种.
系统选育抗病性强的药用植物品种能够减轻药材在生长发育过程中受病原菌影响程度,增加最终产量和药用成分质量,从而增加该药材产业的经济效益.新品种的选育是一个长期复杂的过程,而要选育出抗病性较强的优良品种则需要在选育过程中进行抗病性鉴定和研究.对选育对象直接接种病原菌则是检验选育对象抗病性强弱的有效手段.张恩慧[31]等采用苗期室内人工接种鉴定和田间自然诱发鉴定相结合的方法将TuMV、黑腐病、CMV病原体分别接种于不同品种的甘蓝中,并筛选出了2种抗病性较强的甘蓝材料.陈夕军[32]等利用5个水稻品种“Lemont”、“武育粳3号”、“Jasmine85”、“C418”和“YSBR1”分别于温室苗期接种30个不同的水稻纹枯病菌株,发现各品种抗病性和不同菌株致病力均存在极显著差异,证明5个水稻品种均可作为抗水稻纹枯病鉴定材料.本研究中,接种灰霉病和叶霉病后,BSY,CSY-B和CSY-H表现出的抗病性均强于HSY,且都对灰霉病表现为中抗,而川产道地药材CSY-H和CSY-B药用品质优良、产量高,且目前对川芍药的抗病研究较少[33].因此,CSY-B和CSY-H均可作为进行系统选育的优良抗病候选品系,对于后续川芍药抗病育种的深入研究具有重要意义.
4 结论
本研究通过鉴定CSY-B,CSY-H,HSY,BSY对灰霉病和叶霉病抗性差异,初步明确BSY的抗性最强,对灰霉病和叶霉病均表现为中抗;其次是CSY-B和CSY-H,对灰霉病表现为中抗;HSY抗病性最弱,分别对灰霉病和叶霉病表现为中感和高感.由于CSY-B和CSY-H药用品质较高且研究较少,认为CSY-B和CSY-H均可作为抗病育种研究和新品种推广应用的候选品系.
