乌灵胶囊对卒中后癫痫病人炎性因子及氧化应激水平的影响
2022-01-27余广兰魏俊
余广兰,魏俊
脑卒中是神经内科常见的急性脑血管病,具有高发病率、高致残率和高死亡率的特点,严重威胁人民的生命健康。Jackson在1864年首次提出脑血管疾病与癫痫的关系[1]。脑卒中后癫痫(post-stroke epilepsy,PSE)是指既往无癫痫病史,卒中后在一定时间内发作的癫痫病变,并排除脑部病变和其他代谢性疾病[2]。据统计,PSE整体发病率约3%~30%,在65岁以上的老年新发癫痫病人中,PSE病人的比例可达 30%~49%[3-4]。Tanaka等[5]研究发现,约三分之一的PSE病人在一年内发作复发。PSE作为卒中后常见的并发症,可加重卒中后的脑损伤,严重影响脑卒中病人的生活质量和社会功能,是导致其残疾及死亡的重要原因。因此,如何采用有效措施控制及预防卒中后癫痫发作是亟待解决的课题。欧洲癫痫诊疗指南推荐,对于已经发生卒中后癫痫发作的病人,均应给予抗癫痫药物(antiepileptic drugs,AEDs)辅助治疗[6]。但是,对于AEDs的选择、给药剂量及用药时间并未形成共识。左乙拉西坦是一种新型AEDs,为吡咯烷酮衍生物,口服具有广谱、起效快、生物利用度高及病人耐受性好等特点,且与其他药物之间的相互作用较少,对病人的睡眠和认知功能几乎无不良影响[7]。在国际抗癫痫联盟(international leagueagainst epilepsy,ILAE)建议中,对于成人部分性癫痫发作,左乙拉西坦被作为A级推荐[8]。但据统计,单药治疗PSE在1年内的完全控制率为54%~67%[9]。乌灵胶囊是药用真菌乌灵菌制成的中药制剂,具有补肾健脑、养心安神的功效。研究表明,乌灵菌粉具有抗癫痫的作用[10]。本研究将乌灵胶囊应用于采用左乙拉西坦治疗的PSE病人中,探讨其临床疗效及对病人炎性因子、氧化应激及神经细胞因子水平的影响,现报告如下。
1 资料与方法
1.1 一般资料回顾性分析宜宾市第一人民医院神经内科2015年12月至2018年12月收治的120例PSE病人的临床资料。纳入标准:所有病人均符合第四届全国脑血管病学术会议制定的脑卒中诊断标准[11],并经影像学检查证实为脑卒中;PSE的诊断参照2014年国际抗癫痫联盟制定的标准[12];非诱发性癫痫发作≥2次;均为迟发性癫痫(脑卒中2周后发生)。排除标准:原发性癫痫;卒中前有癲痫病史或有癫痫家族史;伴有严重的基础疾病(恶性肿瘤及心、肺、肝、肾器官功能不全等);合并脑部其他器质性病变(颅内感染、脑肿瘤等);合并代谢性疾病;对本研究所使用的药物有过敏史或过敏反应。所有病人按治疗方法不同分为观察组与对照组,各60例。两组一般资料比较差异无统计学意义(P>0.05)。见表1。
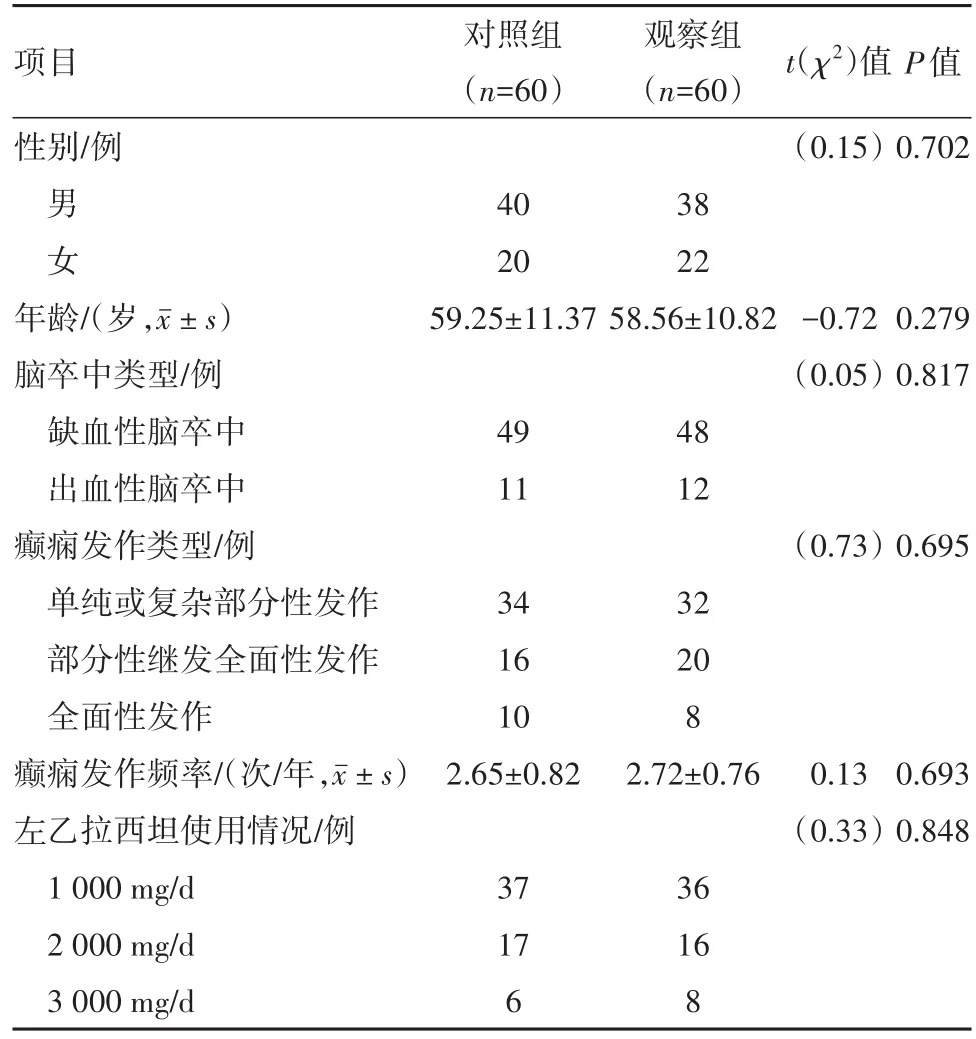
表1 脑卒中后癫痫120例一般临床资料比较
1.2 方法对照组:口服左乙拉西坦片(UCB Pharma S.A.比利时,批号J20160085),起始治疗剂量为500毫克/次,每日2次,根据临床效果及耐受情况,可逐渐增加至1 500毫克/次,每日2次。观察组:在对照组基础上加用乌灵胶囊(浙江佐力药业股份有限公司,批号Z19990048)口服,3粒/次,每日3次。两组均连续治疗6个月。
1.3 观察指标①临床疗效:治疗6个月后评价临床疗效,疗效标准[13]为临床控制:用药期间无癫痫发作;显效:用药期间月癫痫发作频率较治疗前减少≥75%;有效:用药期间月癫痫发作频率减少50%~74%;无效:用药期间月癫痫发作频率减少<50%或增加。总有效=临床控制+显效+有效。②采集两组治疗前及治疗后6个月后清晨空腹外周静脉血,采用ELISA法检测炎性因子:白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α),采用化学比色法检测氧化应激指标:超氧化物歧化酶(SOD)、丙二醛(MDA)、髓过氧化物酶(MPO)、谷胱甘肽过氧化物酶(GSHPx);采用ELISA法检测神经细胞因子:神经元特异性烯醇化酶(NSE)、EF手型钙结合蛋白(S100B蛋白)及脑源性神经营养因子(BDNF)。
1.4 统计学方法采用SPSS21.0软件进行统计学分析。计量资料用±s表示,组间比较采用独立样本t检验,不同时间组内比较采用配对样本t检验。计数资料用例数或率表示,比较采用χ2检验。P<0.05差异有统计学意义。
2 结果
2.1 两组治疗前后临床疗效比较治疗后,观察组总有效率高于对照组(χ2=5.07,P=0.024)。见表2。

表2 脑卒中后癫痫120例两组治疗前后临床疗效比较/例(%)
2.2 两组治疗前后炎性因子水平比较治疗前,两组IL-1β、IL-6、IL-8、TNF-α水平比较差异无统计学意义(P>0.05);治疗后,两组IL-1β、IL-6、IL-8、TNF-α水平低于治疗前(P<0.05),观察组IL-1β、IL-6、IL-8、TNF-α水平低于对照组(P<0.05)。见表3。
表3 脑卒中后癫痫120例治疗前后两组炎性因子水平比较/(pg/mL,±s)
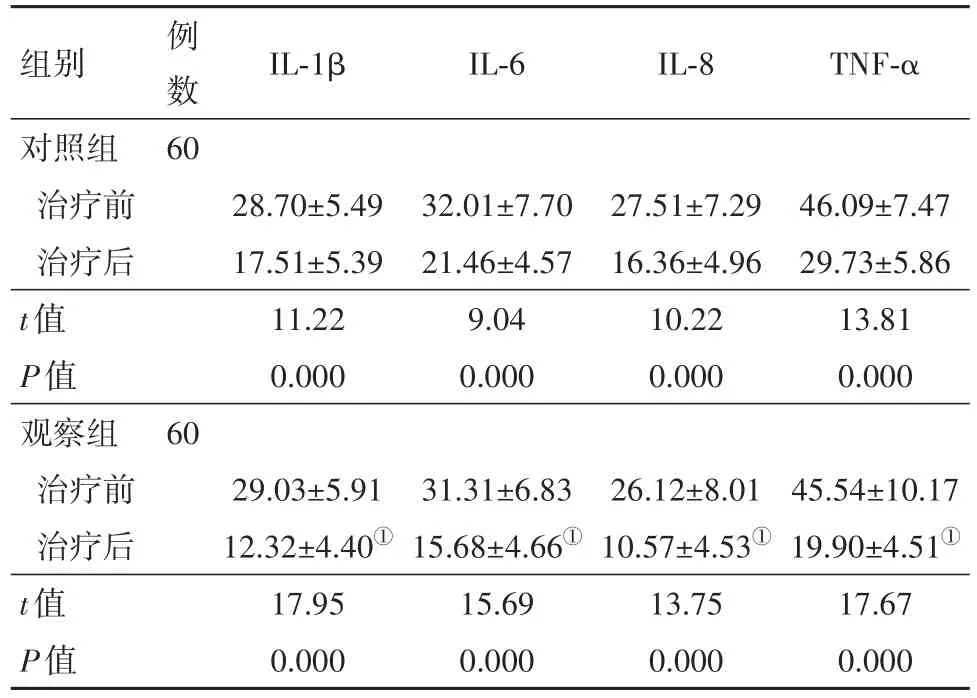
表3 脑卒中后癫痫120例治疗前后两组炎性因子水平比较/(pg/mL,±s)
注:IL-1β为白细胞介素-1β,IL-6为白细胞介素-6,IL-8为白细胞介素-8,TNF-α为肿瘤坏死因子-α。①与对照组比较,P<0.05。
例数6 0 IL-1β组别对照组治疗前治疗后t值P值观察组治疗前治疗后t值P值IL-6IL-8TNF-α 28.70±5.49 17.51±5.39 11.22 0.000 32.01±7.70 21.46±4.57 9.04 0.000 27.51±7.29 16.36±4.96 10.22 0.000 46.09±7.47 29.73±5.86 13.81 0.000 60 45.54±10.17 19.90±4.51①17.67 0.000 29.03±5.91 12.32±4.40①17.95 0.000 31.31±6.83 15.68±4.66①15.69 0.000 26.12±8.01 10.57±4.53①13.75 0.000
2.3 两组治疗前后氧化应激指标比较治疗前,两组SOD、MDA、MPO、GSH-Px水平比较差异无统计学意义(P>0.05);治疗后,两组SOD、GSH-Px水平高于治疗前,MDA、MPO水平低于治疗前(P<0.05);观察组SOD、GSH-Px水平高于对照组,MDA、MPO水平低于对照组(P<0.05)。见表4。
表4 脑卒中后癫痫120例治疗前后两组氧化应激指标比较/±s
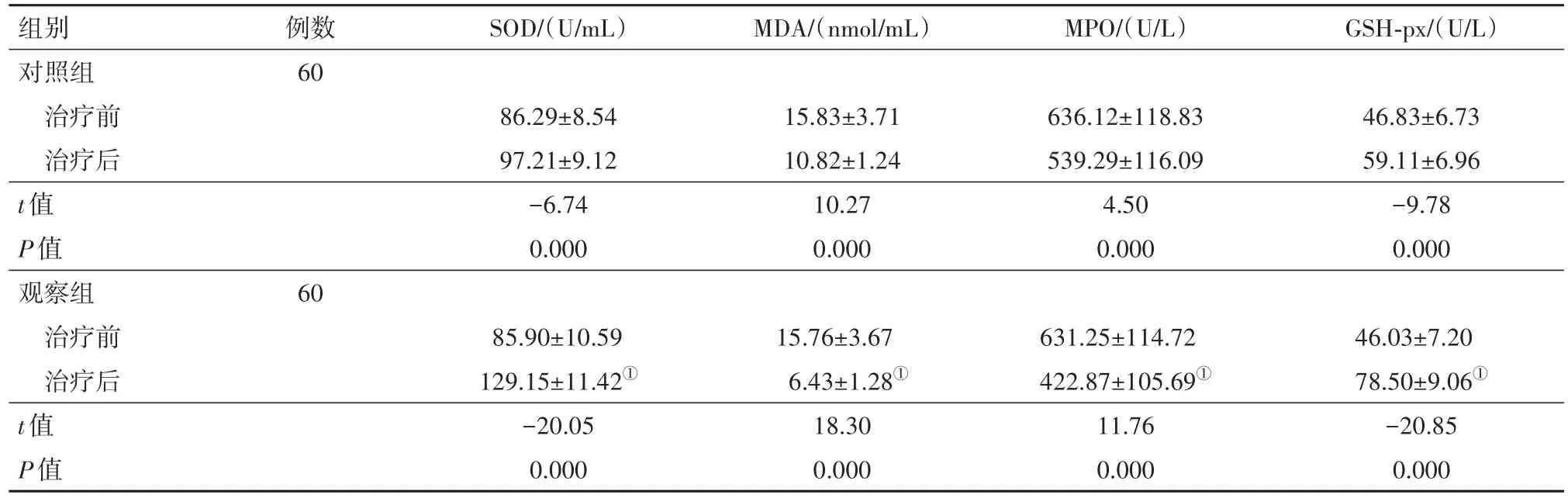
表4 脑卒中后癫痫120例治疗前后两组氧化应激指标比较/±s
注:SOD为超氧化物歧化酶,MDA为丙二醛,MPO为髓过氧化物酶,GSH-Px为谷胱甘肽过氧化物酶。①与对照组比较,P<0.05。
组别对照组治疗前治疗后t值P值观察组治疗前治疗后t值P值例数60 SOD/(U/mL)MDA/(nmol/mL)MPO/(U/L)GSH-px/(U/L)86.29±8.54 97.21±9.12−6.74 0.000 15.83±3.71 10.82±1.24 10.27 0.000 636.12±118.83 539.29±116.09 4.50 0.000 46.83±6.73 59.11±6.96−9.78 0.000 60 46.03±7.20 78.50±9.06①−20.85 0.000 85.90±10.59 129.15±11.42①−20.05 0.000 15.76±3.67 6.43±1.28①18.30 0.000 631.25±114.72 422.87±105.69①11.76 0.000
2.4 两组治疗前后神经细胞因子比较治疗前,两组NSE、S100B、BDNF水平比较差异无统计学意义(P>0.05);治疗后,两组NSE、S100B低于治疗前,BDNF高于治疗前(P<0.05);观察组NSE、S100B低于对照组,BDNF高于对照组(P<0.05)。见表5。
表5 脑卒中后癫痫120例治疗前后两组神经细胞因子比较/(ng/mL,±s)

表5 脑卒中后癫痫120例治疗前后两组神经细胞因子比较/(ng/mL,±s)
注:NSE为神经元特异性烯醇化酶,S100B蛋白为EF手型钙结合蛋白,BDNF为脑源性神经营养因子。①与对照组比较,P<0.05。
例数60 NSE组别对照组治疗前治疗后t值P值观察组治疗前治疗后t值P值S100B BDNF 10.71±1.83 8.38±1.58 7.328 0.000 0.35±0.06 0.21±0.08 10.839 0.000 17.99±4.20 22.90±4.48 5.950 0.000 60 18.16±4.69 26.23±4.31①11.011 0.000 10.45±1.79 6.22±1.23①14.758 0.000 0.36±0.07 0.13±0.03①21.932 0.000
3 讨论
近年来,脑卒中的发病率逐年上升,但通过组织纤溶酶原激活剂和神经保护制剂的应用及机械取栓技术的发展,脑卒中死亡率已有大幅度地下降[1]。脑卒中后常见的并发症PSE是幸存者残疾甚至死亡的重要原因之一[2]。脑组织的特性使其对氧化应激损伤有高度敏感性[14]。研究证实,氧化应激反应引起的氧化损伤在脑卒中的病理过程中起着关键作用[15]。脑卒中发病过程中的氧化应激反应所产生超负荷的活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)等物质,可诱导神经细胞凋亡,进而导致癫痫发作[16]。而癫痫发作会加重血脑屏障的破坏,促进脑部炎症反应,激活星形胶质细胞和小胶质细胞,释放TNF-α、IL-1β、IL-6及高迁移率组蛋白1(high mobility histone1,HMGB1)等炎性因子,降低癫痫发作阈值,造成恶性循环[17]。因此,氧化应激反应及炎性因子对神经系统的作用在PSE发病过程中扮演着重要角色。本研究结果显示,治疗后,两组IL-1β、IL-6、IL-8、TNF-α、MDA、MPO水平低于治疗前,SOD、GSHPx水平高于治疗前(P<0.05)。结果提示,氧化应激反应及炎性因子参与PSE的病理过程。
乌灵胶囊是用我国珍稀药用真菌乌灵菌经现代生物技术制成的纯中药制剂,主要成分为乌灵菌粉,具有抗焦虑及抑郁、调节免疫、调节内分泌、健脑护脑等药理作用,在临床上广泛用于失眠、头痛、焦虑、抑郁等症状及糖尿病、肠易激综合征及慢性疲劳综合征的治疗[18]。研究表明,乌灵菌粉可促进抑制性神经递质γ-氨基丁酸(GABA)进入脑内,提高谷氨酸脱羧酶(GAD)活性促进兴奋性神经递质谷氨酸(Glu)脱羧生成GABA并激活GABA受体,从而发挥抗癫痫作用[19]。除此之外,乌灵菌粉抗氧化应激及炎性因子释放的作用已逐步被证实。白云霞等[20]研究表明,乌灵菌粉能增加动脉粥样硬化兔抗氧化酶活力,抑制C反应蛋白(CRP)、IL-6、TNF-α等炎性因子的产生而降低或缓解动脉粥样硬化。刘凤丽等[21]研究表明,乌灵胶囊可通过提高IL-9,降低IL-1β、IL-10等炎性因子的表达而改善脑卒中后疲劳。本研究结果显示,治疗后,观察组IL-1β、IL-6、IL-8、TNF-α、MDA、MPO水平低于对照组,SOD、GSH-Px水平高于对照组(P<0.05)。结果提示,加用乌灵胶囊较单用左乙拉西坦可进一步降低PSE病人的氧化应激反应并抑制炎性因子释放。
PSE过程中伴随着神经元修复性改变和神经细胞结构的异常。NSE、S100B、BDNF是与神经细胞生长、损伤和修复相关的蛋白,其表达与PSE的发生有关,可以一定程度反映神经系统的损伤程度[22]。本研究结果显示,治疗后,观察组总有效率高于对照组(P<0.05);观察组NSE、S100B低于对照组,BDNF高于对照组(P<0.05)。提示乌灵胶囊辅助左乙拉西坦治疗PSE疗效显著,可以减少NSE、S100B神经损伤因子的释放及增加神经保护因子BDNF的表达,抗氧化应激反应及炎性因子释放可能是乌灵胶囊提高治疗有效率,减轻神经损伤的机制之一。
综上所述,乌灵胶囊辅助治疗PSE,可提高治疗有效率,且能明显减少病人炎性因子释放及降低氧化应激水平并减轻神经损伤。但本研究样本量较小,可能造成结果偏倚。
