硫代硫酸钠硫化废酸中铜离子反应行为的研究
2022-01-27王星凯李一兵张忠林乔冉冉刘世斌
王星凯,李一兵,张忠林,乔冉冉,李 瑜,刘世斌
(太原理工大学 化学化工学院,太原 030024)
冶炼烟气制硫酸是有色金属冶炼烟气最为普遍也最为有效的治理方法[1]。制酸系统采用酸洗净化工艺[2-4],会产生大量含有铅、锌、铁、铜等重金属元素的废酸[5],直接排放将会对环境造成非常严重的污染,而且会对铜等金属元素、硫酸、水资源造成浪费,所以,对废酸进行净化处理并分离有价值的化学物质、实现废酸资源化零排放具有较大的实际意义[6-7]。
目前,冶炼烟气制酸低浓度废酸的处理净化方法主要有:硫化法、石灰铁盐法、生物制剂法、膜处理法等[8-9]。其中,硫化法因其去除率高、成本低、操作简单而被广泛应用。硫化过程常用的硫化剂主要有Na2S与Na2S2O3.经过实验验证,Na2S作为硫化剂除铜在一定条件下可以达到近100%的去除率,其沉铜效果优于Na2S2O3[10].但是,由于废酸的酸度较高,使用Na2S作为硫化剂会产生一定量的H2S气体[11],将会对环境和操作人员造成较大的危害,同时硫的利用率也较低[12]。Na2S2O3作为硫化剂,反应温和可控,利于实施不同离子的分步沉淀分离,对于实现不同有价元素的高价值资源化较为适宜,因此对Na2S2O3作为硫化剂的反应行为进行理论及实验研究极为重要也很有必要。目前,已有相关研究结果发表,其中,王永斌等[13]系统地研究了Na2S2O3硫化富集废酸中铼的最佳工艺条件,铼的沉淀率可达97%;李静等[14]研究了Na2S2O3分步沉淀铜和铼的主要工艺参数影响规律;鲁兴武等[15]研究了Na2S2O3同时沉淀富集铼和铜的最优工艺条件,实现了铜和铼的沉淀率均达到99%以上。然而,Na2S2O3硫化处理废酸中金属离子的反应机制还不够清晰,常常导致硫化剂投入量、反应终点等不易掌握[12],反应主要因素的影响规律也不够系统完善。
由于废酸中的Cu2+浓度比其他金属离子的浓度高,资源回收价值较大,故本文以Na2S2O3硫化Cu2+反应过程为探针反应,通过热力学计算与动力学实验数据,推断Na2S2O3硫化反应可能的反应途径,并以此判断提出增进硫化过程反应速率以及提高CuS选择性的对策,为提高废酸中不同金属离子硫化效率、实现精准分步硫化提供理论及实验依据。
1 实验部分
1.1 实验药品及仪器
五水合硫酸铜(CuSO4·5H2O)、五水合硫代硫酸钠(Na2S2O3·5H2O)、硫酸(H2SO4)、亚硫酸钠(Na2SO3)、升华硫(S)、重铬酸钾(K2Cr2O7)、碘化钾(KI)、可溶性淀粉((C6H10O5)n),均为分析纯,购自国药集团化学试剂有限公司;PTFE微孔滤膜,购自上海兴亚净化材料厂。
原子吸收光谱仪(型号:TAS-990),北京普析通用仪器有限责任公司产;电子天平(型号:FA2004N),上海精密科学仪器有限公司产;Five Easy Plus pH计(型号:FE28),梅特勒托利多仪器(上海)有限公司产;磁力搅拌器(型号:H05-1),上海梅颖浦仪器仪表制造有限公司产;数显恒温磁力搅拌水浴锅(型号:SHJ-4),江苏金坛市宏华仪器厂产。
1.2 实验方法
1.2.1Na2S2O3与Cu2+的硫化反应
量取100 mL一定浓度的稀硫酸溶液置于烧杯中,称取一定量的CuSO4·5H2O加入烧杯并搅拌30 min,然后按照不同的摩尔比称取对应量的Na2S2O3·5H2O加入烧杯,将烧杯封口后固定于恒温磁力搅拌水浴锅中,在设定的温度(30 ℃、50 ℃、70 ℃)下分别反应30 min、60 min、90 min、120 min,反应过程中保持连续搅拌。反应完成后将悬浊液进行抽滤、洗涤(同一条件下的平行实验一组用水洗涤,另一组用二硫化碳洗涤)、烘干操作。反应混合物用原子吸收光谱仪测量铜等元素的含量,由反应前后溶液中Cu2+的浓度得到Cu2+的去除率,称量记录固体产物的质量,所得数据用于计算反应转化率。
1.2.2Na2S2O3与Cu2+的硫化反应途径验证实验
1.2.3反应产物的物理表征
反应固体产物分别采用日本理学(Rigaku)公司的D/max-2700型X射线衍射仪(XRD)表征固体产物的晶体结构,Cu靶,Kα辐射源(λ=0.154 056 nm),靶压为40 kV,靶电流为30 mA,入射狭缝1°,扫描速度为4 (°)/min,石墨单色器,扫描范围采用2θ=15°~75°.
2 结果与讨论
2.1 Cu-S-H2O系的电势-pH图
物质的电极电势反映了该物质的氧化还原能力,可以判断化学反应进行的可能性。其中对于有H+或OH-参加的反应,其电极电势与溶液的pH相关。将电极电势、pH值的函数关系绘制成图,可以帮助判断实现反应的pH与电位范围[16]。通过查阅相关物质的热力学数据[17],计算得到下列关系式。
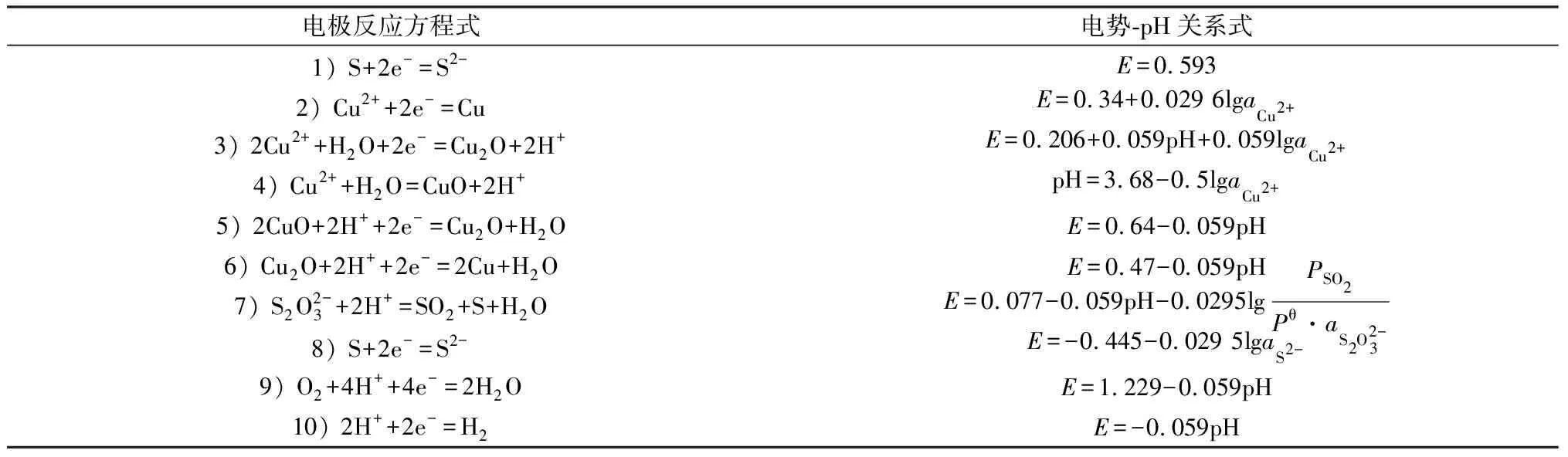
表1 Cu-S-H2O系298 K电极反应方程式与电势-pH关系式Table 1 Cu-S-H2O 298 K electrode reaction equation and potential-pH relationship


图1 298 K下Cu-S-H2O体系电势-pH图Fig.1 Potential-pH diagram of Cu-S-H2O system at 298 K
2.2 实验结果及讨论
2.2.1H2SO4溶液中Na2S2O3+CuSO4硫化反应表象及产物
在酸性条件下,Na2S2O3+CuSO4的反应溶液中较快出现悬浮物,颜色由最初的淡蓝色变为黄色,之后黄色逐渐加深,依次变为土黄色、棕色,最终变为黑色,同时在反应过程中还会产生刺激性气味。实验过程中,收集不同反应时间的产物(初期产物标号为a,中期产物标号为b,后期产物标号为c),并进行XRD表征,结果如图2所示。图2中,衍射谱线a在2θ=23.1°、25.8°、27.7°、31.1°出现的衍射峰分别对应S8(222)、(026)、(206)、(2212)晶面。衍射谱线b在2θ=27.7°、31°与47°出现衍射峰,分别对应CuS(101)、(103)、(107)晶面。同时,对应S8不同晶面的衍射峰并没有消失。衍射谱线c中除了存在b中对应的CuS的衍射峰,又新增加了2θ=29°、32°、52°、59°的衍射峰,分别对应CuS(102)、(006)、(108)、(116)晶面。表象来看,反应初期固体反应产物有S,中后期出现褐色CuS.但是从仪器分辨特性来看,硫化反应的初期、中期都会生成S8、CuS.因此可以初步判定,Na2S2O3硫化Cu2+的反应不会是单一反应,更可能是复合反应,也就是说,表2中途径1并不是废酸中Cu2+等金属离子硫化过程的反应计量方程式。
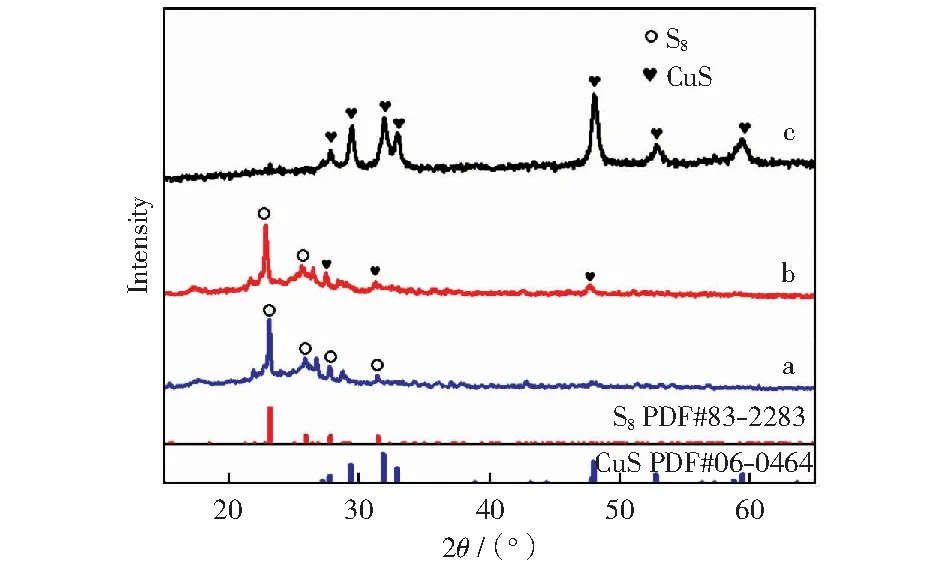
(a)黄色物质;(b)黄棕色物质;(c)黑色物质图2 10% H2SO4,3 g/L Cu2+硫化反应生成物XRD图谱Fig.2 XRD patterns of products produced by curing reaction of 10% H2SO4 and 3 g/L Cu2+

表2 可能的硫化反应途径Table 2 Possible ways of vulcanization reaction
为此,本文依据实验现象与XRD表征结果,结合热力学计算结果及诸多文献的研究工作[18],推测硫化反应还可能存在以下几种途径:
途径1是硫代硫酸根离子与铜离子直接发生反应生成硫化铜沉淀,即单一反应。途径2是硫代硫酸根离子先发生歧化酸解反应生成二氧化硫与硫单质,随后二者与铜离子反应生成硫化铜沉淀,即串联反应模式。途径3是硫代硫酸根离子先发生水解反应生成硫离子,随后一部分硫离子失电子生成硫磺,一部分与铜离子发生沉淀反应生成硫化铜,即串联+平行反应模式。途径4是一部分硫代硫酸根离子与铜离子反应生成硫化铜沉淀,一部分发生歧化反应生成二氧化硫与硫单质,即平行反应模式。
2.2.2H2SO4溶液中Na2S2O3+CuSO4硫化反应的动力学行为
图3是Cu2+质量浓度恒定为1 g/L,30 ℃、50 ℃、70 ℃下,不同酸度溶液中的硫化反应的S、CuS收率与反应时间的关系曲线。由图3(a)可知,两种产物的收率曲线均呈现增函数的特点,即随着反应时间的增加,CuS与S的收率均呈现增长的趋势,不过S的收率增长较缓慢。对比不同产物收率的变化幅度可知,CuS收率随反应温度上升快速提高,而S的收率随着反应温度上升出现小幅降低的现象,CuS的收率远远高于单质S的收率。进一步分析可知,温度从30 ℃升至70 ℃、反应时间为30 min时,CuS的收率变化最大,从7.51%增加到81.21%,增加了大约10倍;反应时间为120 min时S的收率变化最大,从17.11%降低到5.60%,降幅达到67.27%.图3(b)与图3(a)呈现出相同的变化规律,说明酸度的升高并不会影响反应进行的方式,仅对反应的速率产生一定的影响。

Cu2+质量浓度为1 g/L;(a) 10%H2SO4,(b) 20%H2SO4图3 CuS、S收率与反应时间关系图Fig.3 Diagram of CuS and S yields and reaction time
通过上述分析得知,若硫化反应按照途径2(串联反应)进行,由于中间产物SO2、S能进一步转化为CuS,因此中间产物S在反应过程中必然存在一最大值,而实验结果表明随着反应的进行S收率始终呈现增加的趋势,这与串联反应的特点不符,故硫化反应可能不是按照途径2进行。
2.2.3H2SO4溶液中Na2S2O3歧化反应的动力学行为

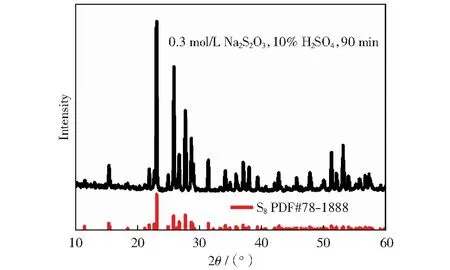
图4 黄色物质XRD图谱Fig.4 XRD patterns of yellow material
图5是不同反应温度下Na2S2O3(0.3 mol/L)在10% H2SO4、20% H2SO4溶液中歧化反应生成S8的收率与时间的关系曲线。图5(a)可以看出,随着反应的进行收率先快速增加,后平缓增加。温度为70 ℃,反应30 min时,S8收率达到了91.06%,反应120 min后收率为93.94%,增幅3.16%。图5(b)与图5(a)的变化趋势一致,但是曲线之间间距较图5(a)大,说明温度对于较高酸度介质中的反应速率影响更显著。

图5 0.3 mol/L Na2S2O3不同温度酸解反应S8收率与时间关系图Fig.5 Diagram of S8 yield and time of 0.3 mol/L Na2S2O3acidolysis reaction at different temperatures
通过上述实验和分析得知Na2S2O3在酸性介质中会迅速生成S8而且反应在30 min之内S8收率达到80%以上反应接近完成,且其收率远远大于Cu2++Na2S2O3+H2SO4体系中S8的收率。如果硫化过程按照途径2进行反应,在Na2S2O3+H2SO4反应速率较高的情况下,S8的收率随反应时间变化的趋势应该呈现明显的抛物线形,然而实验结果并不是如此,实验再次证明硫化过程不是按照途径2进行。
2.2.4H2SO4溶液中SO2+S+CuSO4体系的反应动力学行为
图6是在不同酸度下,Cu2+质量浓度恒定为1 g/L,不同反应温度下SO2+S+CuSO4体系中Cu2+去除率与时间的关系曲线。图6(a)可以看到反应在120 min前,不同温度下反应去除Cu2+的程度基本一致。在120~180 min这段时间内,Cu2+去除率在70 ℃时达到最大去除率4.85%.图6(b)中3条曲线均呈现增加的趋势,30 ℃、50 ℃、70 ℃反应60 min后去除率分别为0.5%、1.99%、2.12%,在反应3 h后达到3.78%、6.3%、6.62%.可见在反应很长时间后,Cu2+的去除率也不是很高。
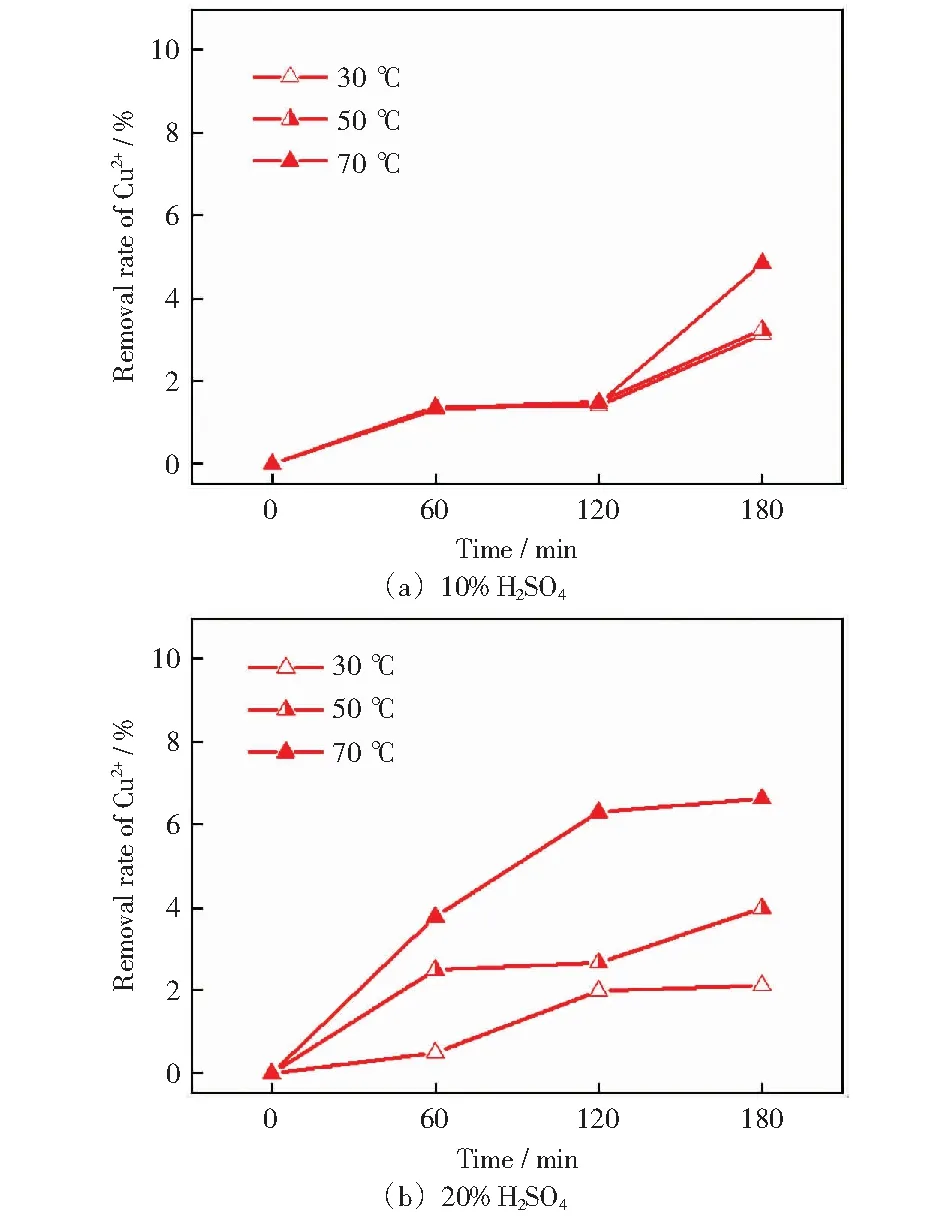
图6 1 g/L Cu2+在H2SO4溶液中的去除率与时间关系图Fig.6 Relation of 1 g/L Cu2+ removal rate with time in H2SO4 solution
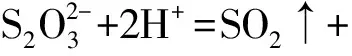
2.2.5Na2S2O3的水解反应及H2SO4溶液中S+CuSO4的反应动力学行为
经过实验证明,纯的水中无论在70 ℃还是30 ℃下,Na2S2O3的转化率均为零,也就是说,Na2S2O3不会发生水解反应生成S2-.因而不可能存在S2-与Cu2+反应生成CuS沉淀。
酸性介质中进行S+CuSO4反应动力学实验结果证明S转化率几乎为零,表明S亦不会与Cu2+发生反应。另外溶度积非常小,而且反应速率很快,如果Na2S2O3水解反应生成S2-,反应初期溶液中足量的Cu2+将使S2-浓度降到很低水平,以至于溶液中几乎不会出现较多S8沉淀,这一推测显然与前述硫酸溶液中Na2S2O3硫化Cu2+的实验现象不相符。再者,由Cu-S-H2O系电势-pH图可知,S得电子变成S2-溶液电位需要达到-0.445 V以下,而反应体系电位一般在0 V以上,故而Cu2+硫化过程的反应途径排除反应途径3.

根据阿伦尼乌斯方程k=Aexp(-E/RT)可知,温度升高,活化能大的反应速率常数增加的倍数大。由图3实验结果可知,随着反应温度的提高生成CuS的反应速率增加的倍数大于生成S8的反应速率增加的倍数,也就是说,生成CuS反应的活化能大于生成S反应的活化能,这一点说明反应体系是一个平行的复合反应体系。对于平行反应来说,当浓度一定时,若主反应的活化能大于副反应的活化能,则温度越高反应的瞬时选择性就越大[19],即温度越高越有利于产物的生成。以上实验现象符合平行反应的特点,故硫代硫酸钠硫化酸中的铜离子最可能按照途径4平行反应实现。
2.2.6稀硫酸介质中Cu2+去除工艺动力学参数的确定
在明确了硫化反应途径后,这节主要研究硫化反应体系中动力学相关问题,确定相关反应的动力学参数。
图7是在酸性条件下,反应温度分别为50 ℃、60 ℃、70 ℃、80 ℃时铜离子与硫代硫酸根离子反应体系中,铜离子浓度与时间的关系曲线。由图可知,不同温度下的曲线呈现出减函数的特点,不过递减的速率不同,温度越高递减速率越快,说明温度越高反应越快。
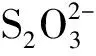
图8 S2+Cu2+反应体系中lnk与1/T关系图Fig.8 Relationship between lnk and 1/T in the reaction system of S2+Cu2+
图9是在酸性条件下,反应温度分别为50 ℃、60 ℃、70 ℃、80 ℃时硫代硫酸根离子与氢离子反应体系中,氢离子浓度与时间的关系曲线,呈现与图7相同的规律,说明温度越高,此反应的速率也越大。

图9 歧化反应H+浓度与时间关系图Fig.9 Relationship between H+ concentration and time
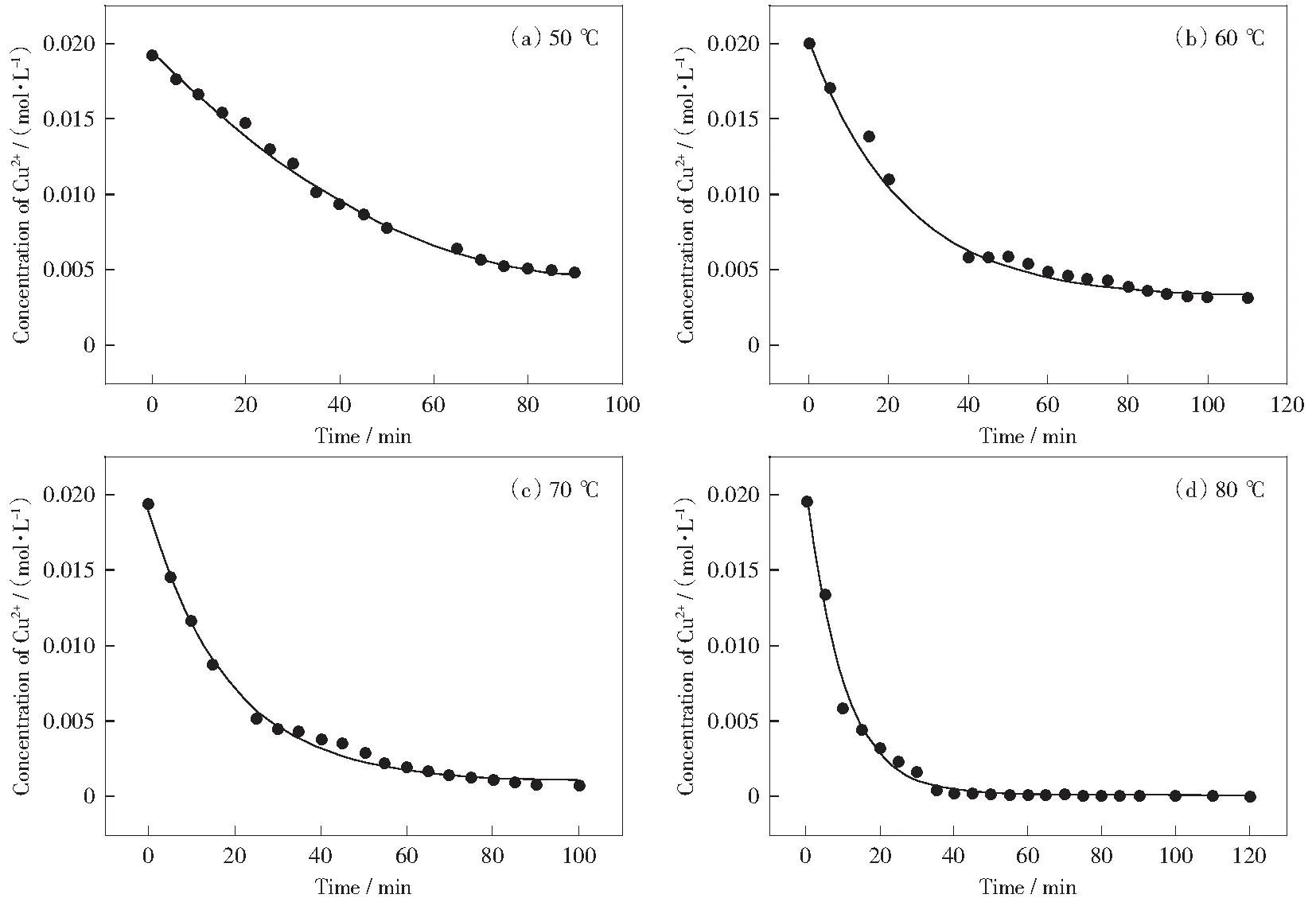
图7 硫化反应Cu2+浓度与时间关系图Fig.7 Relationship between Cu2+ concentration and time

表的动力学参数计算结果Table 3 Calculation results of kinetic parameters of
3 结论
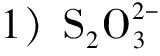
2) Na2S2O3在H2SO4中的歧化反应,反应速度很快且转化率可以达到较高水平。
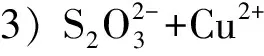

表动力学参数计算结果Table 4 Calculation results of kinetic
4) 经过实验探究反应温度80 ℃、硫化剂加入比为2∶1、反应时间120 min为最佳去除条件,Cu2+去除率达到99.45%.
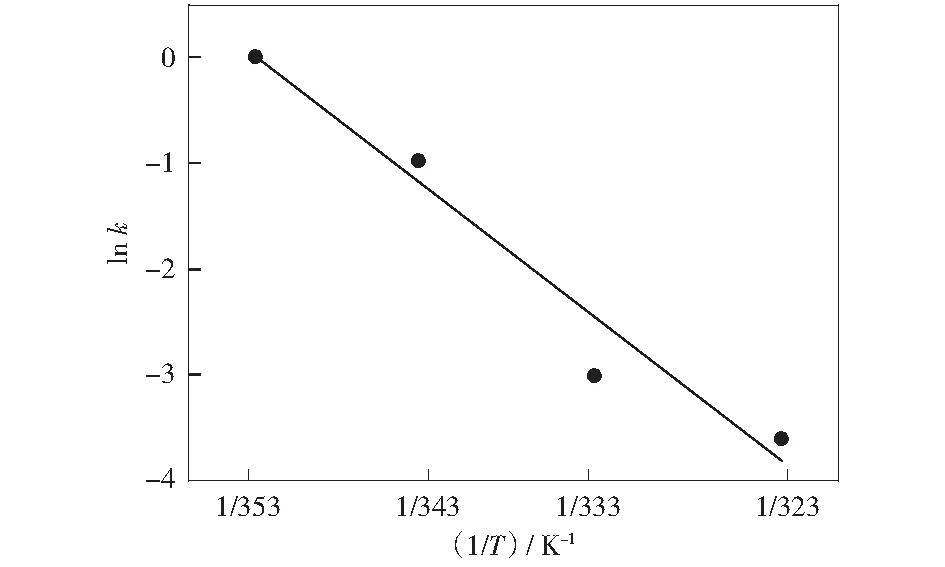
图反应体系中lnk与1/T关系图Fig.10 Relationship between lnk and 1/T in the
