江苏省句容市葡萄炭疽病菌多样性及对苯并咪唑类杀菌剂的抗药性分析
2022-01-27许媛肖婷褚姝频刘吉祥芮东明姚克兵杨敬辉
许媛,肖婷,褚姝频,刘吉祥,芮东明,姚克兵,杨敬辉*
(1.江苏丘陵地区镇江农业科学研究所,江苏 句容 212400;2.江苏省植物保护植物检疫站,江苏 南京 210036)
苏南丘陵地区(句容市)鲜食葡萄产业已成为当地农民增收致富的主导产业[1],且种植面积还在不断增加。根据句容市农业农村局统计数据,截至2019 年,全市葡萄种植面积近3 500 hm2,年产量约6万t。随着种植面积的增加,葡萄病虫害的发生有逐年增加的趋势,葡萄成熟期也是江南地区高温多雨季,葡萄炭疽病发生严重,已成为当地葡萄生产上的主要病害[2]。
葡萄炭疽病主要发生在果实成熟期,腐烂的果实通常覆盖着橘色的分生孢子团。1891年,美国首次对该病进行了报道[3]。目前,在中国绝大多数葡萄产区均有该病害的发生[4-5]。炭疽菌属(Colletotrichumspp.)是一个广泛分布于世界各地的植物病原菌属,对许多大田作物、观赏植物、经济作物和药用植物[6-7]均造成了严重的经济损失。炭疽菌属真菌能侵入植物的多个部位(叶、花、茎和果实),引起果实腐烂、干梢和枯萎等多种症状。各国研究者基于形态学或结合ITS序列分析将C.gloeosporioides和C.acutatum[8]鉴定为导致葡萄炭疽病的病原菌。但有研究表明,C.gloeosporioides和C.acutatum属于复合种(species complexes),Weir等[7]认为C.gloeosporioides复合种群包含22个种和1个亚种,而C.acutatum复合种群则包含29个种[9]。也有研究者利用多基因系统发育分析结合形态学特征将葡萄炭疽病菌鉴定为C.gloeosporioides、C.viniferum、C.fructicola、C.aenigma、C.hebeiense和C.citri等[5,10-12]。江苏省在利用多基因位点检测葡萄炭疽病菌方面鲜有报道,仅Yan等[11]检测出3株C.viniferum,且全部采自常州市。
目前在葡萄病虫害防控中,化学药剂防治仍是葡萄炭疽病的主要防控措施。其中,以苯并咪唑类杀菌剂在葡萄上的应用最为广泛,该类药剂的抗药性也在不断上升[13]。研究表明,苯并咪唑类杀菌剂抗药性的产生与TUB2基因的点突变有关,点突变导致结合位点的氨基酸序列发生改变,TUB2基因中第6、50、167、198、200和240位密码子的变化均可引起病原真菌田间分离株对苯并咪唑类药剂的抗性[14]。其中,TUB2基因第198和200位氨基酸密码子的突变是主要引起炭疽病菌对苯并咪唑类药剂不同抗性表型的分子机制,含E198A 突变的菌株表现为高抗,含F200Y突变的菌株则表现为中抗[15]。本研究利用形态学和分子生物学方法,鉴定引起句容市葡萄炭疽病的炭疽菌种类,对供试菌株进行多菌灵的抗药性检测及抗性位点分析,确定句容市不同炭疽菌种群与多菌灵抗药性之间的关系。
1 材料与方法
1.1 病原菌的采集与分离
从镇江市句容市华阳镇、茅山镇、后白镇和白兔镇11个葡萄园采集葡萄成熟果实部位的炭疽病样本,在无菌超净工作台上直接用灭菌牙签挑取病果表面橘色分生孢子点在马铃薯葡萄糖琼脂(PDA)培养基上,于25 ℃下黑暗培养。产孢后用无菌牙签将分生孢子从培养皿上刮下,悬浮于1 mL 无菌蒸馏水中,梯度稀释1 000倍,取100 μL稀释液涂布15 g·L-1水琼脂平板,25 ℃黑暗条件下培养 1~2 d,再挑取单个发芽的分生孢子于PDA培养基上培养,即可得到单孢纯化后的葡萄炭疽菌孢子。所有菌株采用滤纸片法于-20 ℃冰箱中保存备用。
1.2 形态和培养特征
将-20 ℃冰箱中保存的纯培养菌株接种于直径为90 mm 的PDA平板上活化5 d,用直径为4 mm的打孔器从新鲜菌丝边缘打取菌饼,接种于新的PDA平板中央位置,25 ℃黑暗培养,每个菌株3次重复,并于每天同一时间记录菌落直径,连续记录7 d,分别计算各菌株的平均生长速率,观察记录菌落形态特征。吸取10 μL孢子悬浮液置于载玻片上,使用OLYMPUS BX43显微镜(Olympus Optical Co.,Ltd.,Japan)在400倍视野下对每个菌株产生的分生孢子进行形态观察,并随机选取50个分生孢子测量其长度和宽度。
1.3 DNA提取及目的基因的扩增与测序
1.3.1 菌丝体的收集将待测菌株接种在含有灭菌玻璃纸的PDA培养基上,置于25 ℃条件下黑暗培养10 d,用无菌不锈钢刮勺将菌丝从玻璃纸上刮下,置于2 mL无菌离心管中,50 ℃低温烘干,再用无菌镊子将菌丝体充分捣碎即可得到待测菌丝体。
1.3.2 DNA提取与检测用OMEGA真菌DNA提取试剂盒对51个单孢分离菌株的基因组DNA进行提取,用12 g·L-1琼脂糖凝胶电泳及0.5×TAE缓冲液电泳检测DNA样品。
1.3.3 目的基因的扩增与测序选择钙调蛋白基因(calmodulin gene,CAL)、3-磷酸甘油醛脱氢酶基因(glyceraldehydes-3-phosphate dehydrogenase gene,GAPDH)、β-微管蛋白基因(β-tublin gene,TUB2)进行扩增和测序,扩增引物及其序列见表1。PCR反应体系(50 μL):2×TaqPCR Master Mix 25 μL,10 μmol·L-1上、下游引物各2 μL,模板 DNA 2 μL,以无菌双蒸水补足至 50 μL。引物CL1C/CL2C的反应参数为:94 ℃ 3 min;94 ℃ 40 s,57 ℃ 40 s,72 ℃ 1 min,34 个循环;72 ℃延伸 5 min。引物GDF1/GDR反应参数为:94 ℃ 3 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 30 s,34 个循环;72 ℃延伸 5 min。引物T1/TubR1反应参数为:94 ℃ 3 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 2 min,34 个循环;72 ℃延伸 5 min。取5 μL扩增产物经12 g·L-1琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行纯化、测序。序列在NCBI数据库中进行同源性搜索比对分析。
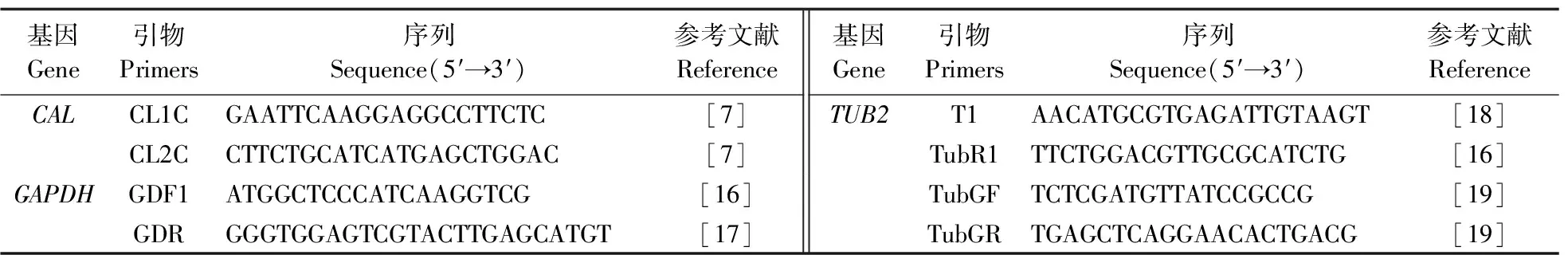
表1 引物名称及其序列Table 1 Primers used in this study
1.4 系统发育分析
用BLAST进行同源性搜索,将序列与GenBank数据库中保存的数据进行比对分析,选择具有高度相似性的序列用于分析。各基因序列按CAL、GAPDH、TUB2的顺序相连形成复合序列,采用MEGA6.06的Clustal W程序对自测的各个复合序列和从GenBank下载的序列(表2)进行比对分析,比对后采用邻接法(Neighbor-joining,NJ)构建系统发育树。

表2 用于系统学分析的炭疽菌菌株和序列Table 2 Strains and sequences of Colletotrichum spp. used in this study

续表2 Table 2 continued
1.5 葡萄炭疽病菌对多菌灵的抗性检测
98.3%多菌灵(Carbendazim)原药,由江苏耕耘化学有限公司提供。药剂用0.1 mol·L-1的盐酸配制成10 g·L-1的母液备用。多菌灵的区分剂量设置为0、1、5、20、100 mg·L-1。用1 mg·L-1多菌灵作为鉴别敏感(S)或中抗(MR)菌株的区分剂量,20 mg·L-1多菌灵作为鉴别中抗(MR)或高抗(HR)菌株的区分剂量[24]。敏感(S)菌株不能在≥1 mg·L-1多菌灵的PDA平板上生长;中抗(MR)菌株不能在≥20 mg·L-1多菌灵的PDA平板上生长;高抗(HR)菌株能在≥20 mg·L-1多菌灵的PDA平板上生长。所有供试菌株均进行3次重复测定。
1.6 抗性位点分析
对TUB2基因进行定点扩增,扩增引物为TubGF和TubGR(表1),PCR反应体系见1.3.3节。反应参数为:94 ℃ 3 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,34 个循环;72 ℃延伸 5 min。
2 结果与分析
2.1 病原菌的分离鉴定及形态学特征
2019年从江苏省句容市各葡萄产区采集的病害样本中分离获得单孢菌株51株,其中12株来自白兔镇,2株来自后白镇,18株来自华阳镇,19株来自茅山镇。菌株信息见表3。通过形态学和分子生物学分析,51株中27株为C.aenigma、16株为C.viniferum、8株为C.fructicola,分离率分别为52.94%、31.37%、15.69%。

表3 从葡萄中分离的炭疽菌菌株Table 3 Colletotrichum strains isolated from grape
图1是分离后的C.aenigma、C.viniferum和C.fructicola在PDA培养基上生长6 d的菌落形态。C.aenigma分离菌株的菌落较均匀,从白色到浅橙色、浅灰色,后来变成深绿色,呈棉絮状(图1-A)。C.viniferum分离菌株的菌落从白色或灰色到浅橙色、浅棕色,呈棉絮状,中央有一些鲜橙色的分生孢子团(图1-B)。C.fructicola菌株的菌落较为均匀,由灰白色慢慢变成深绿色,并长有密集的淡灰色气生菌丝体(图1-C)。
C.aenigma和C.fructicola菌落在PDA培养基上生长速率的平均值和范围相似,而C.viniferum生长速率则相对较慢(表4)。C.aenigma菌落的生长速率为11.47~13.9 mm·d-1,平均为(12.78±0.92)mm·d-1;C.viniferum菌落的生长速率为6.37~9.33 mm·d-1,平均为(7.67±1.11)mm·d-1;C.fructicola菌落的生长速率为12.93~13.93 mm·d-1,平均为(13.33±0.41)mm·d-1(表4)。C.aenigma、C.viniferum和C.fructicola的分生孢子几乎没有差异,分生孢子均为长卵形或圆柱形,端部钝圆。C.aenigma的分生孢子平均长、宽分别为(15.34±1.12)μm、(5.93±0.92)μm,C.viniferum的分生孢子的平均长、宽分别为(15.95±1.47)μm、(5.91±0.86)μm,C.fructicola的分生孢子平均长、宽分别为(14.90±1.46)μm、(5.87±0.89)μm(表4)。

表4 C.aenigma、C.viniferum和C.fructicola的形态特征Table 4 Morphological characterization of C.aenigma,C.viniferum and C.fructicola
2.2 CAL、GAPDH 和 TUB2基因部分序列的系统发育分析
将测序所得的51株葡萄炭疽菌株的CAL、GAPDH和TUB2基因部分序列用DNASTAR软件进行比对分析后分为3类,每个类别选择2株菌株的序列作为代表提交NCBI数据库,获得序列号(表2)。将这6株代表菌株和参考菌株(表2)的各基因序列按CAL、GAPDH、TUB2的顺序相连形成复合序列,再进行系统发育分析,构建系统发育树。在所构建的系统进化树中(图2),C.aenigma、C.viniferum和C.fructicola的自距值分别是100%、98%和68%。

图2 基于Neighbor-joining法构建的葡萄炭疽菌CAL、GAPDH 和 TUB2基因序列拼接系统发育树Fig.2 Phylogenetic tree of Colletotrichum spp. isolates from grapes based on splicing of partial CAL,GAPDH and TUB2 genes sequence
2.3 炭疽病菌对多菌灵的抗性检测
在获得的51株分离株中,敏感菌株(S)有27株,中抗菌株(MR)有16株,高抗菌株(HR)有8株,分别占52.94%、31.37%和15.69%。不同种的葡萄炭疽菌对多菌灵的抗性频率不同,C.aenigma全部为敏感菌株(S),C.fructicola全部为高抗菌株(HR),16株C.viniferum中有2株为敏感菌株(S),其余14株为中抗菌株(MR)(表3)。
2.4 TUB2基因的抗性位点分析
对51株供试菌株的抗性靶标基因(TUB2)进行分析,8株高抗菌株(HR)的TUB2基因第198位密码子由GAG(谷氨酸,E)突变成为GCG(丙氨酸,A)即E198A突变;而14株中抗菌株(MR)的TUB2基因第200位密码子由TTC(苯丙氨酸,F)突变成为TAC(酪氨酸,Y)即F200Y突变;敏感菌株(S)TUB2基因则没有以上2种突变。
3 讨论
关于炭疽菌复合体,由于其形态特征的不稳定性,很难准确识别出炭疽菌属物种[6,25]。当形态学检测将分离菌株分为6组时,通过多位点系统发育分析实际鉴定为7种炭疽菌[26]。目前,通过结合形态学分析和多位点系统发育,能对炭疽菌复合体进行准确鉴定[7,9]。
本研究以江苏省句容市葡萄炭疽病菌为研究对象,利用多基因序列分析结合形态特征对其进行分类和鉴定,发现51株葡萄炭疽菌株分别属于3个种:C.aenigma、C.viniferum和C.fructicola。其中,C.aenigma和C.fructicola属于C.gloeosporioides复合种,而C.viniferum的分类地位还有待进一步确认。
C.aenigma的寄主范围很广,Weir 等[7]最早记载C.aenigma的寄主为沙梨和鳄梨,此外还包括苹果、辣椒、草莓、茶叶等,在全球均有分布[20,27-29]。Yan 等[11]最先在中国北京、河北和陕西等地发现C.aenigma危害葡萄。此前江苏省尚未见相关报道,这是首次发现C.aenigma是引起江苏省葡萄炭疽病的病原菌。C.viniferum最早在中国云南和贵州的葡萄上发现并命名[10],后来在北京、河北、山东、江苏、新疆、福建等地也相继发现了能够侵染葡萄的C.viniferum[11],目前在日本和韩国[30-31]也有相关报道。2019年,He等[28]在中国山东的核桃和草莓上也分离到了C.viniferum,说明C.viniferum除了能够侵染葡萄,也能够侵染其他植物。笔者采集的51株葡萄炭疽病菌菌株中,31.37%为C.viniferum。结合相关报道[10-12],说明C.viniferum在中国普遍存在,且出现的频率高,由此推测C.viniferum很可能是中国葡萄炭疽病菌的优势种。目前该种仅在亚洲国家发现并报道,是不是该种是亚洲地区所特有的种,还有待进一步确认。C.fructicola无论是寄主范围还是地理分布都非常广泛,目前已在多个国家的多种植物上分离到:泰国的咖啡、加拿大的草莓、以色列的勿忘我、尼日利亚的紫薯、巴西的芒果、日本的苹果、美国的桃、中国的茶树、新西兰的鳄梨等[7,10,16,20]。Peng等[10]首次在中国贵州省发现C.fructicola能够引起葡萄炭疽病,而在江苏省这是首次发现C.fructicola是葡萄炭疽病的病原菌。
不同的炭疽菌种类在对相同杀菌剂的反应上可能表现出显著的差异。Han等[32]发现由C.aenigma引起的草莓炭疽病均对多菌灵敏感,而由C.fructicola引起的山药炭疽病中不仅有敏感菌株,同时也有中抗和高抗菌株;Yokosawa等[30]则发现在日本长野县,由C.viniferum引起的葡萄炭疽病菌对嘧菌酯和苯菌灵全部表现为敏感,而由C.fructicola引起的葡萄炭疽病菌对这2种药剂则全部表现为抗性。本研究中,不同种群的葡萄炭疽病病原菌与苯并咪唑类抗药性也有着强烈的对应关系:C.aenigma分离菌株全部对多菌灵敏感,C.fructicola分离菌株全部对多菌灵高抗,而C.viniferum分离菌株中既有敏感菌株(S),又有中抗菌株(MR)。在此前,未发现有报道C.viniferum菌株会对多菌灵产生抗药性。
综上所述,本研究利用CAL、GAPDH和TUB2基因的部分序列结合形态学研究方法对采自江苏省句容市的51株葡萄炭疽病菌进行种类多样性分析,明确了该病菌仅在市域范围内分布就有丰富的多样性,有时是一个葡萄园里都有不同种同时侵染为害。通过对多菌灵抗药性的分析,明确了江苏省句容市葡萄炭疽种群结构与苯并咪唑类杀菌剂抗药性之间的关系。本研究对于进一步全面研究各地葡萄产区的炭疽病病菌种类及抗药性具有借鉴意义和参考价值,也可为葡萄炭疽病的准确诊断、抗性治理提供依据。
