稻田中dsRNA的残留动态模拟分析
2022-01-27彭月张海南韩召军
彭月,张海南,韩召军
(南京农业大学植物保护学院,江苏 南京 210095)
RNA干扰(RNA interference,RNAi)已经发展成为害虫治理的新途径和热门研究领域。早期一般认为,利用RNA干扰技术可以有效治理虫害,不仅特异性强,安全可靠,更为重要的是易于进行抗性治理。因此相关的转基因植物和dsRNA喷雾剂的研究蓬勃发展,目前,基于RNAi的转基因作物已经商品化应用[1]。但基于RNAi的害虫防治仍存在不少限制因素,如多种重要农业害虫对RNAi不敏感,很难研发有竞争力的dsRNA农药;dsRNA普遍存在脱靶效应[2-3],使人们意识到dsRNA田间释放可能会带来生态安全风险。随着研究的深入,人们已经意识到,要推广应用RNAi害虫防控技术,就必须开发有效dsRNA和高效施用技术,研究dsRNA的环境残留、对非靶标生物的毒性和环境归宿等问题[4]。
dsRNA在农田生态系统中的稳定性直接影响施用效果和环境残留。目前已有研究发现,dsRNA农药在野外水土环境中很容易降解。裸露的外源dsRNA由于颗粒吸附和核酸酶降解的共同作用,在土壤中衰减迅速,半衰期一般为15~28 h,在32~48 h检测不到[5-8]。不同浓度、不同序列长度、不同结构(发夹和线形)dsRNA的降解动力学没有明显变化[5-6]。在水生系统中,已有的研究也证实dsRNA不会持续存在,半衰期不到3 d,在4 d后低于检测限[5-6,9-10]。虽然离体植物组织不会赋予核酸任何可测量的保护[11],但农田施用dsRNA可以通过植物根系、叶片等器官进入植物体内,且在全株传递[12-17]。关于茎叶处理dsRNA的稳定性问题,目前研究较少,不过有报道显示,dsRNA在植物上的残留可能与水土环境不同。在温室叶面喷施dsRNA,可以维持对马铃薯甲虫的抗虫效果至少4周[18];利用溶液进行一次性浇灌,也能在柑橘植株体内维持可测定的dsRNA浓度达7周[19]。然而田间应用dsRNA对大豆进行茎叶处理,叶面上施用的dsRNA浓度随时间迅速减少,处理3 d后减少约95%[20]。用细菌表达的dsRNA喷施本氏烟或玉米植株时,有效期仅有5 d[21-22]。由此可以看出,目前不同研究的结果差异较大,可能是测试指标和环境因素不同所致,也可能因处理植物而异,这表明田间dsRNA的稳定性需要进一步研究。
水稻是我国的主要粮食作物,也是继棉花之后抗药性害虫发生最为严重、用药最多的作物。为了减少农药用量并进行抗药性治理,水稻害虫的非化学防治得到了广泛研究,包括基于RNAi的防控技术,目前已报道了多个表达dsRNA的转基因水稻[23-26]。因此,本研究选用稻田生态系统进行研究,通过分析dsRNA在稻田水中、水稻叶片和植株内的残留动态,弄清dsRNA的环境残留,澄清大田应用dsRNA农药的风险度,为风险管控以及设计合理的dsRNA施用技术提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
为节省dsRNA用量(ng级),并避免可能的污染,利用培养箱模拟稻田,采用野外采样结合室内试验检测的方法。稻田土壤及水样采集于江苏省南京市江宁区章村连年耕种水稻的农田(118.862°E,31.979°N),采回的样品放置在塑料培养箱(56 cm×41 cm×26 cm)内,土层为(18±1)cm,水层为(5±1)cm,模拟田间种植水稻,露天放置。水稻品种为‘南粳5055号’。
1.2 主要试剂和仪器设备
dsRNA 体外合成试剂盒T7 RiboMAX system,美国Promega公司;GS201琼脂糖,北京全式金生物科技有限公司;核酸染料溴化乙锭(EB),北京索莱宝科技有限公司;PCR 预混液 2×TaqMaster Mix DNA,南京诺唯赞生物科技有限公司;PCR引物合成和测序由南京金斯瑞生物科技有限公司完成;其他常规生化试剂为国产AR级或进口分装AR级产品。凝胶成像系统Gel Doc2000和PCR 仪T100TMThermal cycler PCR,美国Bio-Rad公司;分光光度计ND-1000 spectrophotometer,美国Thermo Fisher Scientific公司;水平式核酸电泳仪,北京市六一仪器厂。
1.3 dsRNA的制备
为了试验的安全性和避免同源基因的干扰,利用大陆生物不具备的增强型绿色荧光蛋白基因EGFP合成特异性dsRNA。该基因由NCBI网站(http://www.ncbi.nlm.nih.gov/)搜索获得,登录号DQ389577.1。合成dsRNA使用的T7 DNA引物序列:EGFP-404-T7-F:5′-TAATACGACTCACTATAGGGTACGGCAAGCTGACCCTGAAGT-3′,EGFP-404-T7-R:5′-TAATACGACTCACTATAGGGTCCTCGATGTTGTGGCGGATCT-3′(T7启动子序列用下划线进行标注)。利用dsRNA 体外合成试剂盒合成特异性dsRNA(dsEGFP)。将纯化的dsRNA溶于不含核酸酶的水中,-80 ℃保存备用。采用15 g·L-1琼脂糖凝胶电泳,溴化乙锭染色,检查dsRNA纯度;使用分光光度计测量dsRNA浓度,并在使用前按需要进行调整。
1.4 痕量dsRNA简易定量分析
利用TaqDNA 聚合酶直接从dsRNA模板中扩增靶序列的方法[27],以及采用外参照式PCR进行DNA定量的方法[28-29],使用Taq酶直接对dsRNA进行PCR扩增,产物通过电泳扫描进行定量。本研究所用的dsRNA即为定量的标准品模板,其扩增引物:DsEGFP-216-F:5′-GTGACCACCCTGACCTACG-3′,DsEGFP-216-R:5′-CTCCTTGAAGTCGATGCCCTT-3′。通过预试验确定PCR体系:2×TaqMaster Mix 12.5 μL,模板 1 μL,上下游引物各1 μL,无菌去离子水加至25 μL。扩增条件:95 ℃ 3 min,95 ℃ 30 s,57.1 ℃ 30 s,72 ℃ 30 s;28个循环后72 ℃延伸5 min。配制系列已知含量标准品模板样品和待测样品,进行PCR扩增,产物也用同一块15 g·L-1琼脂糖凝胶进行电泳,溴化乙锭染色观察,凝胶成像系统拍照记录,采用ImageJ软件对目标条带灰度进行计算,根据标准品模板量与对应目标条带的灰度值作标准曲线,在线性范围内拟合回归方程。待测样品依据其目标条带的灰度值,用此方程计算其中的模板dsRNA含量。
1.5 稻株点滴处理后的dsRNA残留试验
1.5.1 方法取健壮且长势一致的水稻幼苗,以无土栽培方式种植在铺有海绵的不透明塑料杯(25 mL)中,1杯种植1株,用营养液水培(营养液参照国际水稻研究所的配方),每3 d更换1次营养液。植物在温室培养,相对湿度70%~85%,温度(26±1)℃,光/暗时间为16 h/8 h。定期观察,剔除病株、弱株,保留健株备用。待水稻长至3叶1心期,取1 500 pg·μL-1dsRNA溶液(内含0.01% swilet 408)2 μL点滴在水稻植株第3片完全叶中部,自然晾干,正常水培观察。
1.5.2 dsRNA在叶面上的残留动态测定分别于点滴处理后0(晾干后即取样)、3、6、9 、12、15、20、25、30、35和40 d剪下处理叶片,放入含0.01% swilet 408的200 μL无核酸酶水中,浸泡1 min后,摇床振荡 5 min,取2 μL洗脱液作为模板样品进行定量分析,观察dsRNA在叶片上的残留量变化。每个时间点重复取样3次,检测的平均值×100即为每个叶片上残留dsRNA 的量(pg)。
1.5.3 水稻植株内的dsRNA含量检测将上述每次洗脱处理后的叶片及剩余植株用去离子水冲洗 1 min,用吸水纸擦干水分,液氮冷冻,提取总RNA,检测dsRNA量,验证dsRNA是否被水稻叶片吸收。为了进一步弄清dsRNA被植物叶片吸收后的体内传导状况,按1.5.1方法对3叶1心期水稻幼苗点滴处理,12 d 后沿根基部剪取须根、老叶(第2片)、新叶(第4片)和处理叶(第3片),按照上述方法洗脱、清洗后,将3株稻苗的相同部位一起剪碎,称取(25±1)mg作为1个重复,每个处理设3个重复。不同样品分别提取总RNA(可放于-80 ℃超低温冰箱内暂时保存),定量检测其中的dsRNA含量(pg·mg-1)。
1.6 稻田水中dsRNA的降解试验
1.6.1 方法采用模拟稻田插管试验,将长12 cm、内径10 mm的无底透明亚克力管垂直插入模拟稻田培养箱内,入土深度5 cm,水层深度5 cm。在管中添加dsRNA,使水层中dsRNA质量浓度约为30 pg·μL-1,轻轻扰动混匀,置温室内(温、湿、光同上)定期取样检测,每次取样50 μL(稻田水原位样)。试验共设3组(3只培养箱),每组2个重复(2只插管)。
1.6.2 稻田水不同处理样品的制备为了弄清稻田水不同组分对dsRNA衰减速度的影响,取稻田水处理后获得如下样品:a)稻田水原样,在稻田表面用随机取样法取稻田表层水100 mL;b)稻田水滤样,取a样用定性滤纸过滤2遍,去除水中浮游生物(藻类、枝角类、桡足类和轮虫等)和漂浮固体颗粒物;c)稻田水灭活样,取b样用0.2 μm针头过滤器过滤,放入15 mL离心管中,121 ℃高压蒸汽灭菌30 min。在水样中加入蛋白酶K至最终浓度为50 μg·mL-1,58 ℃孵育2 h,再次高压蒸汽灭菌,程序同前,使水中微生物、蛋白酶类物质失活。d)纯水,商品RNase-Free去离子水。
1.6.3 dsRNA的降解测定取1.6.2节的水样,配制成30 pg·μL-1dsRNA溶液,置温室内(温、湿、光同上)静置,定时取样检测dsRNA含量变化,每个处理均重复3次。取稻田水原样(a)和滤样(b)各配制 10 mL,分别放入15 mL离心管中,每次每管取样1 μL,技术重复2次。为防止污染,用稻田水灭活样(c)和纯水(d)溶解dsRNA,配制成30 pg·μL-1dsRNA溶液后,放入0.2 mL无核酸酶的PCR管中,每管 50 μL,用封口膜密封后静置,定时取样测定dsRNA浓度,每次取样3管。
取样时间:0(dsRNA溶液配制后即取样)、1、2、4、8、12、24 h和2、3、8、13、18、23和28 d,当检测结果呈阴性后,即终止取样。不同时间取样后必须即时进行PCR扩增,扩增产物可以暂存于-80 ℃冰箱,与随后样本的扩增产物一同进行电泳检测。
1.7 统计分析
技术重复数据取平均值,生物学重复数据用平均值±标准差表示。用ImageJ软件计算条带灰度,用SPSS 23.0软件进行单因素方差分析(ANOVA)和线性回归拟合。利用GraphPad Prism 8.0软件绘制图表。
2 结果与分析
2.1 痕量dsRNA简易定量分析方法的测试
依据预试验设置的PCR体系和条件,3倍稀释配制系列浓度模板溶液(300、100、33.3、11.1、3.7、1.2、0.4和0.1 pg·μL-1),利用Taq酶直接对dsRNA进行PCR扩增,并通过产物的电泳扫描进行定量,以检测该方法的可行性。结果如图1所示,PCR目标产物条带清晰,无杂带,当模板的量为1.2~33.3 pg时,不仅肉眼可见PCR产物条带差异(图1-A),且条带扫描灰度值与起始模板量呈线性相关(图1-B),拟合的回归方程表现出良好的线性关系:y=0.006x+0.008(R2=0.992,P<0.05)。
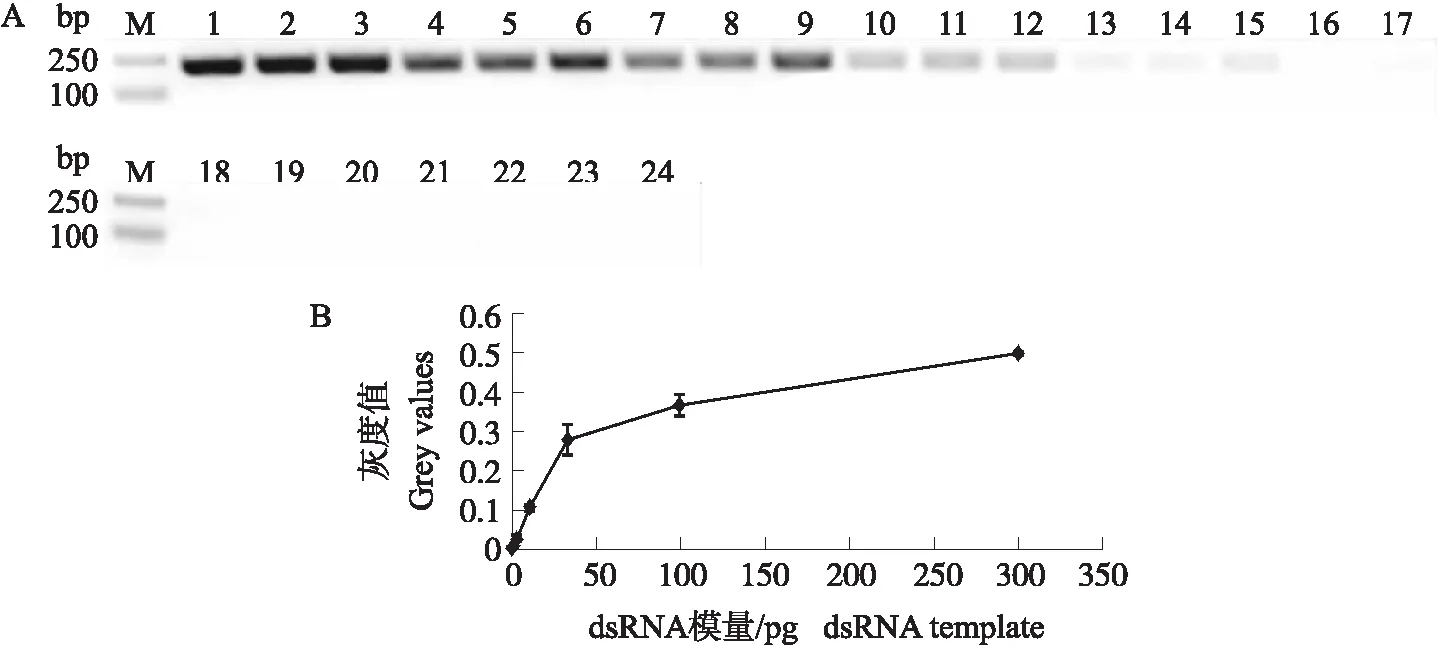
图1 痕量dsRNA简易定量分析方法的测试结果Fig.1 Test results of quantitative analysis method for trace dsRNA A. 不同dsRNA模板含量的PCR产物电泳图(M泳道. 2 kb DNA marker;泳道1~3模板量为300 pg,泳道4~6模板量为100 pg,泳道7~9模板量33.3 pg,泳道10~12模板量为11.1 pg,泳道13~15模板量为3.7 pg,泳道16~18模板量为1.2 pg,泳道19~21模板量为0.4 pg,泳道22~24模板量为0.1 pg);B. PCR扩增产物电泳目标条带灰度值与其模板dsRNA含量的相关关系图(n=3)。A. The electrophoresis graph of the PCR products with different dsRNA template quantity(M lane. 2 kb DNA marker;lanes 1-3 are the product duplicated from 300 pg template dsRNA;lanes 4-6:100 pg;lanes 7-9:33.3 pg;lanes 10-12:11.1 pg;lanes 13-15:3.7 pg;lanes 16-18:1.2 pg;lanes 19-21:0.4 pg;lanes 22-24:0.1 pg);B. Diagram show the relations between dsRNA template quantity and Grayscales of the corresponding PCR products(n=3).
2.2 水稻植株dsRNA的残留动态
在水稻苗叶面点滴2 μL含3 000 pg的dsRNA,定时检测水稻叶片上dsRNA的残留动态,统计结果显示(图2-A):处理前期叶片上的dsRNA衰减较快,之后衰减变缓,基本符合指数衰减曲线(R2=0.716),半衰期为16 d,在40 d时仍能检测到残留dsRNA(为点滴量的20.6%)。将洗脱后的叶片和处理植株其他部分合并提取,检测植株内的dsRNA含量,结果发现叶片点滴处理后,植株内的dsRNA含量逐渐上升,到 12 d 达到最高峰,为点滴处理量的20%,随后又缓慢下降(图2-B)。后期的下降表明植株吸收进入体内的dsRNA也逐步衰减消失。
将叶片表面残留的dsRNA与植株内吸收的dsRNA合并(图2-C),从处理后0 h水稻植株内外的dsRNA总量可以看出,点滴回收率为86.6%,总回收量随时间延长逐步减少(半衰期为27 d),表明dsRNA施于水稻叶片后,会慢慢衰减消失。另外,图2-C还显示,虽然处理后40 d内,植株表面残留量一直大于植株内的含量,但植株表面dsRNA衰减的速度大于体内的衰减速度。
从图2-D可见,不同部位均有dsRNA存在,处理叶与根的含量无显著差异,新叶的含量显著低于其他部位的含量,可能与新叶组织生长快的稀释作用有关,而老叶中的含量最多,显著高于其他部位,可能与组织老化、代谢下降有关。表明点滴在叶片表面的dsRNA会被吸收进植株体内,并进行系统性全株传导。
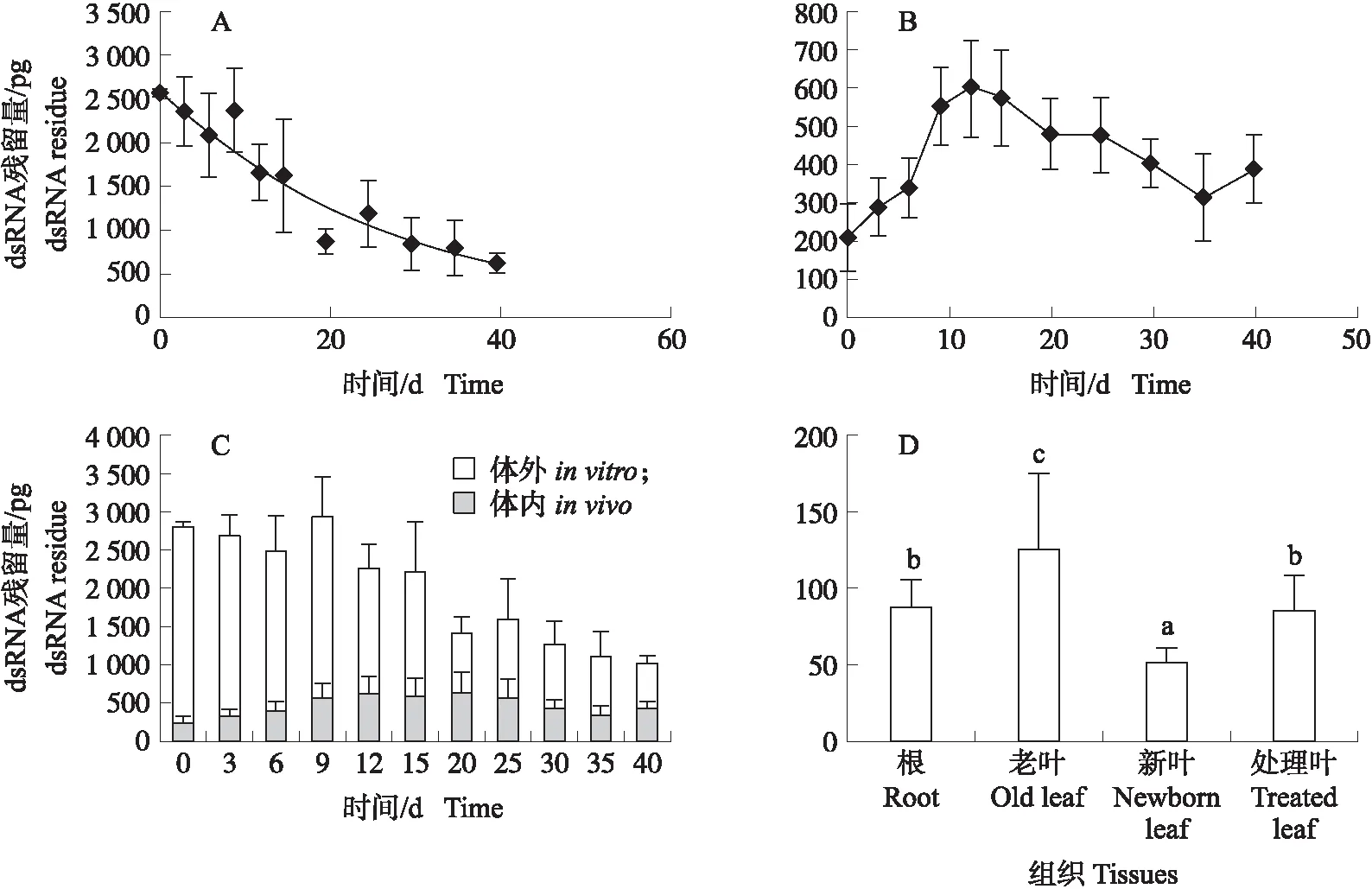
图2 点滴处理后水稻植株内外dsRNA的残留动态Fig.2 Dynamics of residue dsRNA inside and outside of rice plants after topical treatment A. 水稻表面dsRNA的残留动态;B. 水稻体内dsRNA含量的动态变化;C. 水稻植株内外dsRNA总量的动态变化;D. 处理12 d后每株水稻不同部位dsRNA的分布。不同字母表示在0.05水平差异显著。A. Residue dynamics of dsRNA on the surface of rice plants;B. Content dynamics of dsRNA in rice plants;C. Dynamics of the total dsRNA amount on and in rice plants;D. Distribution of dsRNA in different parts of rice plants in 12 days after treatment. Different letters indicate the significant difference at 0.05 level.
2.3 稻田水中dsRNA的残留动态及影响因子分析
从图3可以看出,在插管处理的稻田原位样水中,dsRNA的半衰期在1 h内,24 h后就无法检测到(低于1 pg·μL-1)。采集后未处理的稻田水原样以及经滤纸过滤后的稻田水滤样中,dsRNA的衰减速度差异不大,半衰期均为15 h左右,且72 h后无法检测到。而dsRNA在去除微生物和蛋白质的稻田水灭活样中,与在无核酸酶去离子水中类似,均相对稳定,处理3 d后每5 d取一次样进行检测,到28 d未发现有降解趋势。表明稻田水中的微生物和蛋白因子是加速dsRNA衰减的关键因子,底泥有一定的促进消减作用,而浮游生物、漂浮固体颗粒物和离子没有明显的直接作用。
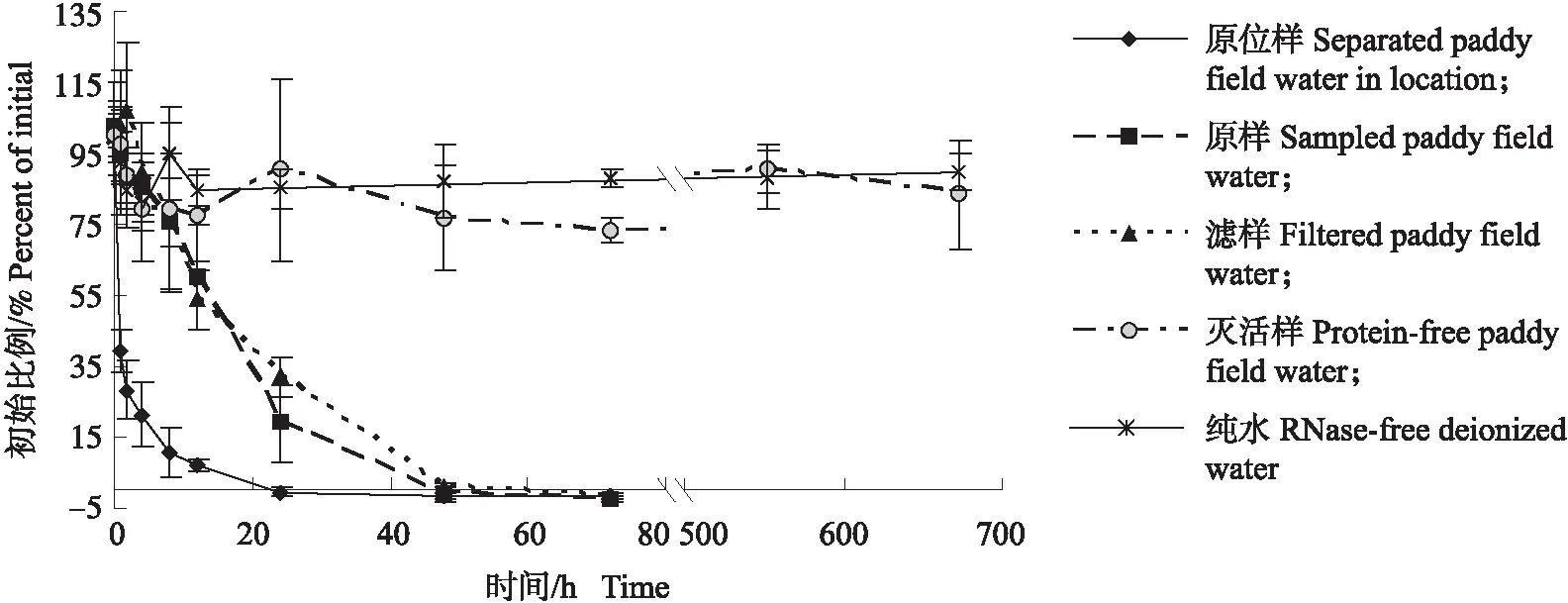
图3 不同处理稻田水中的dsRNA残留动态Fig.3 Residue dynamics of dsRNA in paddy field water of different treatments
3 讨论
本研究借鉴已有的dsRNA扩增技术和DNA电泳扫描定量技术[27-30],利用Taq酶既具有反转录酶活性又具有DNA聚合酶活性的特点,直接以dsRNA为模板进行PCR扩增,扩增产物通过凝胶电泳进行扫描定量,不仅省去了靶序列的反转录步骤,同样节省了痕量dsRNA常规定量PCR检测的昂贵试剂费用。但与定量PCR检测相比,电泳扫描定量的误差较大。通过设置多个技术重复以消除PCR的重复误差,并通过同时在同一块胶上电泳测试样品和标准样品,来减小凝胶和染色对灰度的影响,由此将误差控制在不影响残留监测的范围内。利用系列含量的标准品模板测试后发现,这种简化后的dsRNA定量方法的特异性和灵敏度均较高,模板dsRNA量与PCR产物条带的灰度值在较大范围内呈现良好的线性关系。本研究选择循环数为28进行扩增,发现dsRNA模板量在1.2~33.3 pg时,PCR产物条带灰度值与模板dsRNA含量呈良好的线性相关(R2=0.992)。故可以检测到1.2~33.3 pg的dsRNA样品,灵敏度(1.2 pg)相当于近期常用的最灵敏的痕量dsRNA定量PCR检测方法和荧光定量检测方法[6,8,31-33],可以用于dsRNA的田间残留监测。对dsRNA在水稻植株内外以及不同水样中残留进行测定,虽然每个监测点的数值标准误稍大,但随时间变化的动态趋势完全符合化合物的残留规律,验证了该方法的有效性。
dsRNA在水稻叶表面的半衰期达16 d。叶表面消失的dsRNA部分被水稻植株吸收,并在体内系统传导。点滴处理后水稻体内dsRNA含量升高,涉及叶片的吸收以及可能存在的体内复制(植物体内具有核酸依赖性核酸合成酶),而随着体外dsRNA的衰减,吸收的量逐步下降,同时dsRNA在体内也会被核酸酶切割降解,故点滴处理后一定时间植株体内会出现含量高峰。而高峰出现的时间主要与处理剂量、吸收速度、体内降解和可能的体内合成有关。点滴处理后水稻植株内外的总dsRNA半衰期为27 d,表现出一定的稳定性。这与在其他作物上的试验结果基本一致,如已有报道显示,在大麦上喷雾施用绿色荧光染料(ATTO 488)标记的dsRNA,在木质部、质外体、韧皮部薄壁细胞、伴随细胞和叶肉细胞的共质体等内均检测到绿色荧光信号,并且禾谷镰刀菌在局部和远端未喷雾叶片中的生长均受到抑制[34];在叶片上涂抹马铃薯甲虫(CPB)肌动蛋白dsRNA可以使马铃薯植株免受CPB幼虫侵害至少4周[18];柑橘树通过根部和韧皮部注射吸收的dsRNA至少可以在柑橘中稳定保存57 d[19]。
必须指出,本研究为了节省有限的dsRNA材料,没能进行大田喷雾实验。叶片点滴与田间喷雾相比仍有明显不同,田间喷雾时水稻植株不同部位均会暴露,另外用药的浓度通常也是可变的。虽然有研究证实,不同浓度、不同序列长度、不同结构(发夹和线形)dsRNA的降解动力学没有明显差异[5-6],但水稻叶片上dsRNA的衰减涉及植物的吸收,而植物体内还存在核酸依赖性核酸合成酶,甚至还可能存在dsRNA的合成。另外,大田与温室的明显差异就是随时面临雨水冲刷。本研究发现叶面处理后,大量dsRNA长时间残留叶面上,而水溶性的dsRNA很容易随雨水冲刷进入稻田水中,从而使植株内外的残留半衰期明显缩短,这也可能是田间茎叶喷雾处理对害虫防效期短的重要原因。因此,本研究虽然揭示了dsRNA在稻田残留的动态趋势,但确切的残留参数仍有待利用dsRNA农药进行田间试验进一步研究,而dsRNA的高效应用,必须考虑剂型的防冲刷流失和辅助吸收问题。
dsRNA在稻田水中的半衰期不到1 h。排除底泥的影响,采集稻田表层水进行测定,发现半衰期延长至15 h;过滤去除浮游生物和漂浮固态颗粒物(量较少)对稻田水中dsRNA的衰减没有明显影响;而dsRNA在灭活并去除微生物和蛋白质的稻田表层水中非常稳定,28 d无衰减趋势。底泥的影响可能源自吸附作用,已有研究证实土壤颗粒物对核酸具有吸附作用[8]。而蛋白因子和微生物促使dsRNA快速衰减的实质可能是核酸酶的降解,因为可以降解dsRNA的非专一性核酸酶分布广泛,它们由不同生物合成后分泌或遗存在环境中[35],而稻田水环境生物丰富,且水体不易使核酸酶变性。dsRNA在河流湖泊水的水环境中也迅速降解,半衰期为15~28 h,在96 h内无法检测到[5,9-10]。
综上所述,稻田施用dsRNA,在没有雨水冲刷的情况下可以在植株内外残留较长时间,一旦进入稻田水中则会快速降解并消失。结合之前的研究报道,表达dsRNA的转基因植株也无法给体内的dsRNA提供庇护作用,表达dsDvSnf7的玉米组织浸泡在含有沉淀物和水的微环境中时,dsDvSnf7 也会迅速消散,3 d后无法在组织中检测到[11],我们认为,dsRNA在稻田中施用污染环境的风险较小,但要提高dsRNA农药的防效,延长其有效防治期,就必须考虑剂型的防雨水冲刷,甚至增加植株对dsRNA的吸收,降低稻田水的降解作用等。
