鸡白痢沙门菌ssaV 基因缺失株的构建及其生物学特性分析
2022-01-26徐冠冰王利平崔素宁梁雪瑞段艳红潘鹏涛李雪华殷俊磊职丽娟
徐冠冰,王利平,崔素宁,张 震,梁雪瑞,赵 洁,段艳红,潘鹏涛,李雪华,殷俊磊,职丽娟
(1. 新乡学院医学院,河南 新乡 453003;2. 新乡学院生命科学与基础医学学院,河南 新乡 453003)
引起鸡白痢的鸡白痢沙门菌(Salmonella pullorum)具有宿主专一性的特点,主要感染3 周龄以下的雏鸡,导致急性全身性疾病和高死亡率;青年鸡和成年鸡在感染鸡白痢沙门菌后,其生长性能和生产性能会受到影响。该病可经垂直传播,受污染的种蛋孵化率和出雏率会显著降低,病鸡和带菌鸡是该病的主要传染源,带菌公鸡也可经垂直传播将鸡白痢沙门菌传给母鸡,控制鸡白痢发生和流行的重要措施之一是对种鸡鸡白痢的净化和对种蛋进行彻底消毒[1‐3]。目前,鸡白痢在世界上许多国家仍有发生和流行,尤其是在发展中国家,给养鸡业造成了巨大的经济损失[4‐5]。因此,有必要进一步研究鸡白痢沙门菌的致病机制。
沙门菌在宿主细胞内的存活、增殖与其在宿主细胞内形成的一个特殊的细胞膜区域相关,即沙门菌液泡(SCV),SCV 的形成离不开沙门菌致病岛2(SPI-2)编码的Ⅲ型分泌系统2(T3SS2),因此,SPI-2 编码的T3SS2 在沙门菌致病过程中发挥着重要作用[6‐8]。T3SS2 是注射装置,目前已发现有30 多个效应蛋白可通过该装置进入宿主细胞,为沙门菌的进一步感染提供条件[9]。研究显示,由ssaV基因编码的SsaV 蛋白是T3SS2 注射装置基部结构的重要组成部分,在T3SS2 效应蛋白的分泌过程中发挥着重要作用[10‐11]。目前,尚未见到关于鸡白痢沙门菌ssaV基因研究的报道。继续探究ssaV基因的功能有助于揭示鸡白痢沙门菌的致病机制,为此,构建鸡白痢沙门菌ssaV基因缺失株,对其生长和生化特征、遗传稳定性及毒力等基本生物学特征进行分析,以期为进一步研究鸡白痢沙门菌的致病机制奠定基础。
1 材料和方法
1.1 菌株、质粒及供试动物
鸡白痢沙门菌菌株C79-13 购于中国兽医药品监察所,质粒pKD3(Cmr)和pCP20(Ampr,Cmr)由新乡学院医学院微生物学实验室保存,含质粒pKD46(Ampr)的菌株C79-13/pKD46 及回补质粒pBR322-ssaV(Ampr)由新乡学院医学院微生物学实验室前期构建并保存。海兰白品种雏鸡(沙门菌抗体阴性)由购自北京艾普希隆生物科技有限公司的鸡胚在新乡学院医学院微生物学实验室孵化。供试培养基为LB培养基,需要时加入氨苄青霉素(Amp)的终质量浓度为100 mg/L、氯霉素(Cm)的终质量浓度为34 mg/L。
1.2 主要试剂
高保真DNA 聚合酶、2×TaqDNA 聚合酶预混液、DL2000 Marker、DNA 胶回收试剂盒均购于生工生物工程(上海)股份有限公司。细菌微量生化发酵管购自杭州天和微生物试剂有限公司。
1.3 引物的设计与合成
参照GenBank 中发布的鸡白痢沙门菌序列,针对ssaV基因序列设计引物(表1)。ssaV-cat-F/ssaV-cat-R 用于扩增含Cm 基因的打靶片段,5´端序列与ssaV基因序列同源或互补,3´端序列(下划线)与pKD3 上的Cm 序列同源或互补;ssaV-out-F/ssaV-out-R为缺失株构建后的PCR验证及测序引物;ssaV-in-F/ssaV-in-R为ssaV基因内部验证引物。
1.4 鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV及其回补株C79-13ΔssaV(pBR322-ssaV)的构建
1.4.1 含ssaV基因同源臂打靶片段的制备及电转化 以pKD3 为模板,用含有ssaV同源臂的引物ssaV-cat-F/ssaV-cat-R进行PCR扩增。接着对PCR产物进行琼脂糖凝胶电泳和回收、纯化,并于-20 ℃保存,用作打靶片段。然后利用L-阿拉伯糖诱导C79-13/pKD46 表达重组蛋白,制备感受态,电转化打靶片段至感受态的C79-13/pKD46,利用Cm 抗性平板进行筛选和利用引物ssaV-in-F/ssaV-in-R 进行PCR验证[12‐13]。
1.4.2 缺失株C79-13ΔssaV的鉴定 将1.4.1 中验证正确的菌株,在42 ℃条件下利用温度敏感性丢失pKD46,再制备丢失了pKD46 的C79-13ΔssaV∶∶Cm感受态细胞,电转pCP20,进行Amp和/或Cm抗性筛选,消除Cm 抗性,然后利用温度敏感性丢失pCP20,再采用PCR 和测序对构建的C79-13ΔssaV进行验证[13]。最终获得鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV。
1.4.3 回补株C79-13ΔssaV(pBR322-ssaV)的构建 制备感受态细胞C79-13ΔssaV,将质粒pBR322-ssaV电转至感受态细胞C79-13ΔssaV,进行Amp 抗性筛选,利用引物ssaV-out-F/ssaV-out-R和ssaV基因内部特异性引物ssaV-in-F/ssaV-in-R进行PCR 验证,确认回补株C79-13ΔssaV(pBR322-ssaV)构建成功。
1.5 C79-13ΔssaV的生长曲线绘制
分别挑取菌株C79-13、C79-13ΔssaV与C79-13ΔssaV(pBR322-ssaV)至LB 液体培养基过夜培养,然后分别将其转接至LB 液体培养基,调整其初始OD600约为0.05,取15 mL 调整的菌液于37 ℃、180 r/min条件下连续振荡培养14 h,每隔2 h测定一次OD600,绘制其生长曲线。
1.6 C79-13ΔssaV的生化特性测定
分别挑取C79-13、C79-13ΔssaV与C79-13ΔssaV(pBR322-ssaV)单菌落接种于葡萄糖、赖氨酸脱羧酶、蔗糖、甘露糖、甘露醇、山梨醇、乳糖、麦芽糖、丙二酸盐、鸟氨酸脱羧酶、尿素酶、阿拉伯糖和硫化氢等生化鉴定管,37 ℃过夜培养,观察每株菌的生化鉴定结果。
1.7 C79-13ΔssaV的遗传稳定性分析
在LB 液体培养基中将C79-13、C79-13ΔssaV连续传代培养30 代,分别选取每株菌的第10、20、30 代的培养产物,提取其基因组,利用引物ssaVin-F/ssaV-in-R 进行PCR 扩增,产物经琼脂糖凝胶电泳后观察结果,分析其遗传稳定性。
1.8 C79-13ΔssaV的体内竞争试验
分别挑取C79-13 和C79-13ΔssaV∶∶Cm 单菌落于LB 液体培养基,37 ℃、180 r/min 过夜培养。分别调整其浓度为1.5×107cfu/mL,经口服途径将400 μL C79-13ΔssaV∶∶Cm和C79-13的混合菌液接种3日龄雏鸡,接种量为6.0×106cfu/只(n=3,C79-13ΔssaV∶∶Cm 和C79-13 各为3.0×106cfu/只),同时设置对照组,仅以相同途径接种等量的PBS,用无抗和Cm 抗性的LB 固体培养基计数细菌的接种量,计算输入指数(输入C79-13ΔssaV∶∶Cm的量与C79-13的量的比值)。在接种的第3 天分别采集雏鸡的肝脏和脾脏样品,利用无抗性的LB平板和Cm抗性的LB平板测定样品中C79-13ΔssaV∶∶Cm和C79-13的载量,计算输出指数(输出C79-13ΔssaV∶∶Cm 的量与C79-13的量的比值),然后根据输出指数与输入指数的比值计算竞争指数(Competitive index,CI)[14]。
1.9 C79-13ΔssaV对雏鸡的毒力试验
分别在LB 液体培养基中接种C79-13、C79-13ΔssaV与C79-13ΔssaV(pBR322-ssaV),过夜培养,然后利用PBS洗涤3次并悬浮,分别调整每株菌的浓度。取3 日龄雏鸡40 只,平均分成4 组,A组以5.0×106cfu/只的剂量口服接种C79-13,B 组以5.0×108cfu/只的剂量口服接种C79-13ΔssaV,C 组以5.0×106cfu/只的剂量口服接种C79-13ΔssaV(pBR322-ssaV),D 组作为对照组仅口服接种200 μL PBS,观察14 d 并统计死亡情况,评价菌株对雏鸡的毒力。
2 结果与分析
2.1 鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV及其互补株C79-13ΔssaV(pBR322-ssaV)的构建
利用ssaV-cat-F/ssaV-cat-R 引物扩增出1 124 bp 的同源臂片段(图1A),结果符合预期。利用引物ssaV-in-F/ssaV-in-R 对带有Cm 抗性的ssaV基因缺失株C79-13ΔssaV∶∶Cm 进行PCR 验证,未扩增出大小为212 bp的条带(图1B),与预期相符。利用引物ssaV-out-F/ssaV-out-R、ssaV-in-F/ssaV-in-R分别对C79-13ΔssaV进行PCR 验证,结果见图1C,并对ssaV-out-F/ssaV-out-R 的扩增产物进行测序,结果均符合预期,表明C79-13ΔssaV成功构建。利用引物ssaV-out-F/ssaV-out-R、ssaV-in-F/ssaV-in-R对抗性筛选的C79-13ΔssaV(pBR322-ssaV)进行PCR 验证,结果如图1D 所示,引物ssaV-out-F/ssaV-out-R 扩增出474 bp 的条带,引物ssaV-in-F/ssaV-in-R 扩增出212 bp 条带,与预期结果一致。表明ssaV基因回补株C79-13ΔssaV(pBR322-ssaV)构建成功。
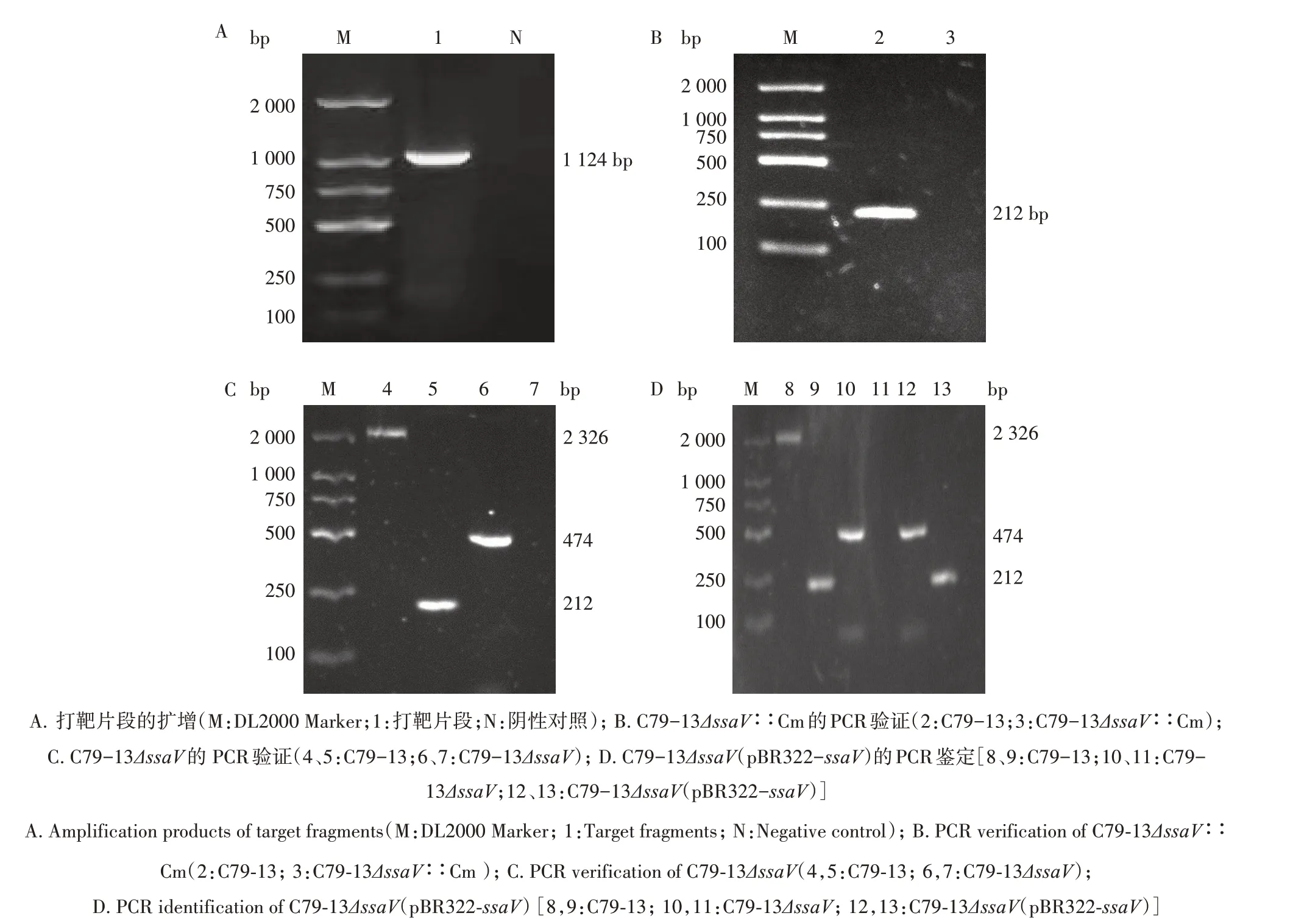
图1 缺失株C79-13ΔssaV与回补株C79-13ΔssaV(pBR322-ssaV)的PCR鉴定Fig.1 PCR indentification of C79-13ΔssaV and C79-13ΔssaV(pBR322-ssaV)
2.2 C79-13ΔssaV的生长特性
从图2 可以看出,鸡白痢沙门菌C79-13、C79-13ΔssaV和C79-13ΔssaV(pBR322-ssaV)的生长特性基本一致,说明ssaV基因对鸡白痢沙门菌的生长特性没有影响。
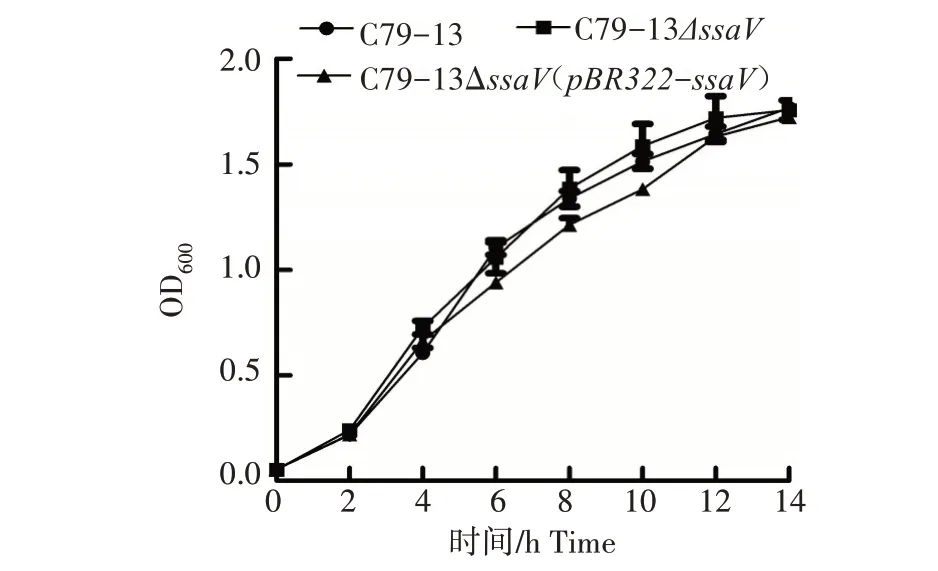
图2 C79-13、C79-13ΔssaV和C79-13ΔssaV(pBR322-ssaV)的生长曲线Fig.2 Growth curves of C79-13,C79-13ΔssaV and C79-13ΔssaV(pBR322-ssaV)
2.3 C79-13ΔssaV的生化特性
生化特性测定结果显示,C79-13、C79-13ΔssaV和C79-13ΔssaV(pBR322-ssaV)的生化特性一致,均能发酵甘露醇、甘露糖、阿拉伯糖、葡萄糖、鸟氨酸脱羧酶和赖氨酸脱羧酶,而不能发酵蔗糖、麦芽糖、乳糖、硫化氢、山梨醇、丙二酸盐和尿素酶等。说明ssaV基因的缺失没有影响鸡白痢沙门菌的生化特性。
2.4 C79-13ΔssaV的遗传稳定性
分别以C79-13 和C79-13ΔssaV的第10、20、30代传代物的基因组为模板,用ssaV基因内引物ssaV-in-F/ssaV-in-R 进行PCR 扩增。结果显示,野生株C79-13 中扩增出212 bp 条带,而C79-13ΔssaV中均未扩增出相应大小条带(图3)。说明鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV具有良好的遗传稳定性。
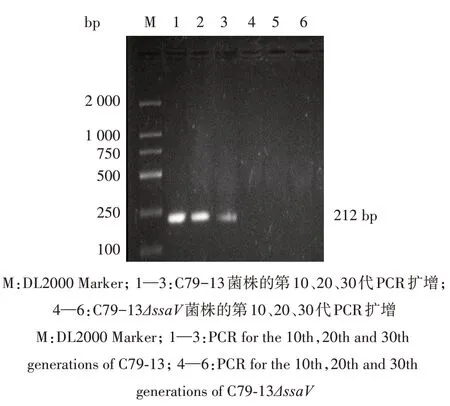
图3 ssaV基因缺失株C79-13ΔssaV的遗传稳定性鉴定Fig.3 Genetic stability identification of ssaV genedeletion strain C79-13ΔssaV
2.5 C79-13ΔssaV的体内竞争试验结果
结果显示,缺失株C79-13ΔssaV与野生株C79-13在雏鸡肝脏样品中的竞争指数为0.028 7,在脾脏样品中的竞争指数为0.028 3,竞争指数均远小于1(图4)。说明鸡白痢沙门菌ssaV基因缺失后,其在雏鸡体内的定殖能力降低。
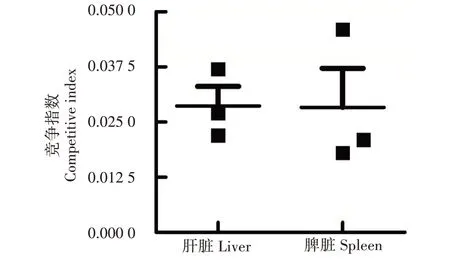
图4 缺失株C79-13ΔssaV和野生株C79-13在雏鸡体内的竞争指数Fig.4 Competitive index of C79-13ΔssaV and C79-13 in chickens
2.6 C79-13ΔssaV的毒力试验结果
经口服接种C79-13(5.0×106cfu)、C79-13ΔssaV(5.0×108cfu)和C79-13ΔssaV(pBR322-ssaV)(5.0×106cfu)后,雏鸡的存活率分别为40%、60%和50%(图5),即野生株C79-13 对雏鸡的半数致死量(LD50)小于5.0×106cfu,缺失株C79-13ΔssaV对雏鸡的LD50大于5.0×108cfu,表明C79-13ΔssaV的LD50至少是C79-13 LD50的100 倍。以上结果说明,鸡白痢沙门菌缺失ssaV基因后,其毒力明显下降。
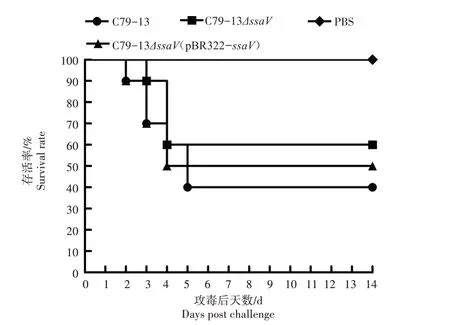
图5 C79-13、C79-13ΔssaV和C79-13ΔssaV(pBR322-ssaV)对雏鸡的毒力Fig.5 Virlence of C79-13,C79-13ΔssaV and C79-13ΔssaV(pBR322-ssaV)to chickens
3 结论与讨论
鸡白痢沙门菌给许多国家的养鸡业带来了巨大的经济损失[1,15‐17],与鸡白痢沙门菌致病机制相关的研究有待进一步深入。宿主细胞感染沙门菌后,沙门菌可在宿主细胞内生成沙门菌液泡(SCV),并存活于其中进行免疫逃逸[6]。SCV 功能的维持离不开一系列沙门菌毒力因子的参与,其中起主要作用的是沙门菌致病岛2(SPI-2)编码的Ⅲ型分泌系统2(T3SS2)及其分泌的效应蛋白。作为深度参与调控T3SS2 效应蛋白分泌的跨膜内膜蛋白,SsaV 蛋白也是T3SS2装置必不可少的成分[11,18]。
本试验选取ssaV基因作为研究对象,基于λred 同源重组技术完成了对鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV的构建,并初步分析了其基本生物学特性。结果表明,鸡白痢沙门菌ssaV基因的缺失不影响其生长和生化特性,说明ssaV基因是鸡白痢沙门菌生长代谢非必需的。有研究发现,鸡白痢沙门菌SPI-2的缺失对其生长特性和生化特性也没有影响,这与SPI-2 是沙门菌在进化过程中从外界水平获得的DNA 片段有关,ssaV基因位于SPI-2上,是伴随着SPI-2 的获得而获得的[19‐20],推测ssaV基因缺失也不影响鸡白痢沙门菌的生长特性和生化特性,这与本研究结果一致。整个SPI-2 缺失的鸡白痢沙门菌菌株的遗传稳定性良好[19]。本研究结果表明,鸡白痢沙门菌SPI-2 上的ssaV基因缺失株C79-13ΔssaV也具有良好的遗传稳定性。本研究结果显示,ssaV基因的缺失会降低鸡白痢沙门菌在雏鸡体内的定殖能力,且导致其毒力显著下降。有研究结果表明,鼠伤寒沙门菌、伤寒沙门菌及肠炎沙门菌ssaV基因缺失后,它们的毒力显著下降,且这些缺失株均具有良好的免疫原性,可作为减毒活疫苗候选株[21‐23],这也为基于ssaV基因研发鸡白痢减毒疫苗提供了思路。
综上,本研究基于λ-red 同源重组技术完成了对鸡白痢沙门菌ssaV基因缺失株C79-13ΔssaV的构建,鸡白痢沙门菌缺失基因ssaV后,其在雏鸡体内的定殖能力降低,并且其毒力也明显下降。表明鸡白痢沙门菌ssaV基因与其致病性密切相关,这为后期基于ssaV基因深入研究鸡白痢沙门菌的致病机制及鸡白痢减毒活疫苗的研发等提供了依据。
