马铃薯疮痂病菌Streptomyces scabies拮抗细菌筛选及鉴定
2022-01-26台莲梅陈志垚王钰琪金光辉靳学慧
台莲梅,陈志垚,王 鹏,王钰琪,金光辉,靳学慧,2
(1. 黑龙江八一农垦大学农学院/黑龙江省作物-有害生物互作生物学及生态防控重点实验室,黑龙江 大庆163319;2. 黑龙江省植物抗性研究中心,黑龙江 大庆 163319)
马铃薯营养价值高,对环境的适应能力强,可作为粮食作物供人们生活所需,也可作为经济作物应用到多种行业中,而且其单产增产潜力大,发展前景十分广阔[1]。然而,近几年马铃薯疮痂病日益加重,造成了严重的经济损失。马铃薯疮痂病是由多种链霉菌(Streptomycesspp.)引起的一种土传病害,可在块茎表面形成深度不一、面积不等的病斑,使马铃薯的品质与经济价值下降,市场竞争力降低,同时造成加工过程中马铃薯清洗难度增大,去皮厚度增加,大大提高了加工成本[2‐4]。目前,马铃薯各产区疮痂病的发生程度逐渐加重[5],而现有防治措施效果不理想[6‐9],限制了马铃薯产业的发展。因此,寻找一种绿色高效的疮痂病防治方法,成为了马铃薯产业亟待解决的问题。
生物防治具有绿色、高效、经济、安全等优点。随着绿色农业的发展,生物防治逐渐成为土传病害防控研究的热点[10]。国外对于马铃薯疮痂病生物防治的研究报道较早,非致病性链霉菌可以抑制疮痂链霉菌(Streptomyces scabies)的生长[11];假单胞菌、枯草芽孢杆菌能降低马铃薯疮痂病的发病率[12‐13];MENG 等[14]在温室试验中利用解淀粉芽孢杆菌BAC03 降低了马铃薯疮痂病的发病程度。国内学者研究报道,枯草芽孢杆菌、苏云金芽孢杆菌、贝莱斯芽孢杆菌、甲基营养型芽孢杆菌、解淀粉芽孢杆菌对疮痂链霉菌均有一定的抑制作用,其中关于枯草芽孢杆菌的报道最为广泛,不同菌株对疮痂链霉菌的拮抗效果存在明显差异[15‐17]。挖掘更多的生防菌株,可以为马铃薯疮痂病生物防治提供更为丰富的菌种资源。在菌株鉴定的过程中,多数学者仅采用16S rDNA一种分子鉴定手段,不利于近缘菌种间的区分。鉴于此,从疮痂病发病地块健康马铃薯植株根际土壤中分离筛选对黑龙江省马铃薯疮痂病优势病菌(Streptomyces scabies)具有明显抑制效果的细菌菌株,并通过形态学、生理生化特性以及16S rRNA 与gyrB基因序列相结合的分子生物学方法等鉴定并明确其分类地位,为生防菌剂的开发和马铃薯疮痂病的生物防治提供参考。
1 材料和方法
1.1 材料
1.1.1 供试土样及病原菌 供试土样采集自黑龙江省齐齐哈尔市克山农场马铃薯疮痂病发病地块健康植株根际。
供试病原菌:疮痂链霉菌(Streptomyces scabies)、马铃薯早疫病菌(Alternaria solani)、番茄灰霉病菌(Botrytis cinerea)、水稻胡麻斑病菌(Bipolaris oryzae)、玉米圆斑病菌(Bipolaris zeicola)、玉米大斑病菌(Exserohilum turcicum)、大豆根腐病菌(Fursariu oxysporum)、玉米弯孢霉叶斑病菌(Curvularia lunata)、马铃薯黑痣病菌(Rhizoctonia solani)。
1.1.2 供试培养基 YME 培养基:酵母提取物4 g、麦芽浸提物10 g、葡萄糖4 g、琼脂20 g、蒸馏水1 000 mL;PDA 培养基、NA 培养基以及LB 培养基参照《植病研究方法》进行配制[18]。
1.1.3 主要试剂和仪器 主要试剂:细菌基因组提取试剂盒DP302-02[天根生化科技(北京)有限公司];氧化酶试纸、硫化氢试纸、细菌生化鉴定管(杭州微生物试剂有限公司);2×TaqPCR Master Mix、DL 2000 DNA Marker、4S GelRed 核酸染料、试验所用引物(生工生物工程上海股份有限公司)。主要仪器:光学显微镜(OLYMPUS 公司);PCR 仪、凝胶成像系统、电泳仪(Bio-Rad公司)。
1.2 试验方法
1.2.1 拮抗菌的分离与筛选
1.2.1.1 拮抗细菌的分离 采用土壤稀释分离法进行分离[19]。称取10 g 土样,配成10-4、10-5、10-6倍稀释液,分别取100 μL在NA固体培养基上进行涂布,每个土壤样品每个稀释梯度均重复4 次,30 ℃培养24 h 后,挑取形态不同的菌落分别进行划线纯化培养。重复纯化3 次后将得到的单菌落转移到NA 试管斜面培养基中,编号记录后放入4 ℃冰箱保存备用。
1.2.1.2 拮抗细菌的初筛 将斜面保存的细菌在LB培养基上划线活化,30 ℃培养24 h。用接种环刮取疮痂链霉菌菌种涂于YME平板上,然后将活化后的细菌点接于涂满疮痂链霉菌的YME 平板培养基中央,并以不接细菌的处理作为对照,每个处理重复3 次。30 ℃培养7~10 d 后,观察比较抑菌圈大小,判断抑菌效果,选取对疮痂链霉菌有抑菌作用的细菌菌株进一步复筛。
1.2.1.3 拮抗细菌的复筛 将初筛获得的菌株活化后接种于LB 培养液中,30 ℃、160 r/min 振荡培养48 h,发酵液经12 000 r/min 离心3~5 min 后,吸取上清液,经细菌滤膜过滤,得到无菌上清液。
用接种环刮取疮痂链霉菌菌种涂于YME 平板上,然后将无菌牛津杯放置于涂满疮痂链霉菌的YME 平板培养基中央,吸取200 μL 无菌上清液于牛津杯中,以无菌LB 培养液作为对照,每个处理重复4次,30 ℃培养7~10 d,观察抑菌圈大小。
1.2.2 拮抗细菌对薯块的安全性测定 用75%乙醇溶液对马铃薯块茎进行表面消毒,用无菌水清洗2 次,晾干表面水分后,用无菌刀将薯块切成厚0.5 cm 左右的薯片,将薯片在1×108cfu/mL拮抗细菌培养液中浸润后,放在铺有无菌滤纸的培养皿中,同时设置无菌蒸馏水浸润(CK)和LB 培养液浸润,每个处理重复3 次,28 ℃放置3~5 d 后观察薯片腐烂程度。
1.2.3 拮抗细菌对供试病原菌的抑制作用测定
将5 mm 供试病原菌菌饼置于PDA 培养基中央,在距离菌饼2.5 cm 处放置5 mm 无菌滤纸片,取3 μL 拮抗细菌培养液滴加于滤纸上,28 ℃培养5~7 d,测量抑菌带宽度,计算抑制率。抑制率=抑菌带宽度/拮抗菌距离菌饼的距离×100%[20]。
1.2.4 拮抗细菌的盆栽防效试验 盆栽试验采用直径28 cm 的花盆,选取健康有芽的马铃薯块茎,将其切成大小相近的三角块,选取芽长一致的块茎备用。取1×109cfu/mL 疮痂链霉菌菌悬液80 mL 加入土壤充分混匀后备用。试验共设置3 个处理:处理1 在接入致病菌的土壤中加入100 mL 无菌水作为空白对照(CK),处理2 在接入致病菌的土壤中加入100 mL无菌LB培养液充分混匀,处理3在接入致病菌的土壤中加入100 mL 1×108cfu/mL 拮抗细菌发酵液充分混匀。将薯块播入花盆后放置在温室中,每盆2 株,每个处理3 盆,重复4 次,待马铃薯成熟后,调查薯块的发病情况,计算发病率、病情指数及防效,数据采用SPSS Statistics 17.0 进行方差分析。发病级别根据病斑占块茎面积的百分比分为6 个等级:0级,无病斑;1级,0%<病斑面积占比≤5%;2级,5%<病斑面积占比≤12.5%;3级,12.5%<病斑面积占比≤25%;4 级,25%<病斑面积占比≤50%;5 级,病斑面积占比>50%。
发病率=发病薯粒数/调查总薯粒数×100%,
病情指数=Σ(各病级薯粒数×发病级别)/(调查总薯粒数×最高发病级别)×100,
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.2.5 拮抗细菌的鉴定
1.2.5.1 形态学及生理生化鉴定 将筛选出的拮抗细菌接种在LB 固体培养基上,30 ℃培养24 h 后观察菌落形态。生理生化性质鉴定参照《芽胞杆菌第二卷芽胞杆菌分类学》《伯杰细菌鉴定手册》以及《常见细菌系统鉴定手册》[21‐23]。
1.2.5.2 分子生物学鉴定 待鉴定菌株DNA 采用细菌基因组提取试剂盒DP302-02 提取。将筛选出的拮抗菌在LB 培养液于30 ℃、160 r/min 下培养14~18 h后进行DNA提取。
16S rDNA 扩增:采用细菌通用引物27F(5´-AGAGTTTGATCCTGGCTCAG-3´)和1492R(5´-GG‐TTACCTTGTTACGACT-3´)进行基因扩增[24]。反应体系:2×TaqPCR Master Mix 12.5 μL、上下游引物各1 μL、DNA 模板0.5 μL、ddH2O 10 μL;反应程序:95 ℃5 min;94 ℃1 min,55~58 ℃1 min,72℃90 s,30个循环;72 ℃10 min。
gyrB基因扩增:采用引物gyrB-F(5´-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNA‐ARTTYGA-3´)和gyrB-R(5´-AGCAGGGTACGGAT‐GTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3´)进行基因扩增[25]。反应体系:2×TaqPCR Master Mix 12.5 μL,上下游引物各0.5 μL、DNA 模板1 μL、ddH2O 10.5 μL;反应程序:94 ℃5 min;94 ℃30 s,55~58 ℃30 s,72 ℃1 min,35 个循环;72 ℃10 min。
PCR 扩增产物由北京六合华大基因科技有限公司进行测序,结果在NCBI 上进行BLAST 比对后,选取GenBank 中同源性较高的菌株序列,利用MEGA 7.0 软件中的Neighbor-Joining Tree 法(重复抽样1 000次)构建系统发育树。
2 结果与分析
2.1 拮抗菌的分离与筛选
从采集的土样中分离出细菌181 株,经初筛后得到对马铃薯疮痂病菌具有明显拮抗效果的菌株,进一步进行复筛,最终筛选出1 株具有明显抑制效果的菌株,抑菌圈直径达到37 mm(图1),将其编号为BKS51。

图1 菌株BKS51对疮痂链霉菌的抑制效果Fig.1 The inhibitory effect of strain BKS51 on Streptomyces scabies
2.2 菌株BKS51对马铃薯薯块的安全性
培养5 d 后,经BKS51 菌液浸润过的薯片没有腐烂迹象(图2),说明菌株BKS51 具有一定的安全性,不会引起马铃薯薯块的腐烂。
2.3 菌株BKS51对供试病原菌的抑制效果
菌株BKS51对供试8种植物病原菌均有明显抑制效果(表1),其中,对玉米圆斑病菌的抑制效果最好,抑制率达67.2%,显著高于其他病原菌(P<0.05);BKS51 对水稻胡麻斑病菌和玉米大斑病菌的抑制效果也较好,抑制率分别达到了62.4%和59.5%;对大豆根腐病菌抑制效果最差,抑制率为42.9%。可见,菌株BKS51具有良好的广谱抗菌性。

表1 菌株BKS51的抑菌谱测定Tab.1 Determination of antibacterial spectrum of strain BKS51
2.4 菌株BKS51的盆栽防效
由表2 可见,处理1(CK)和处理2(LB)马铃薯发病严重,发病率均达到100%,CK的病情指数高达72.5,处理2(LB)的病情指数虽然低于CK,但发病程度也较高,病情指数为58.7,显著高于处理3(拮抗菌BKS51处理)。处理3马铃薯发病情况较轻,发病率为39.7%,病情指数为13.0,另外,BKS51 对马铃薯疮痂病的防效达到了81.0%,显著高于处理2,进一步说明菌株BKS51 对马铃薯疮痂病具有较好的防治效果。
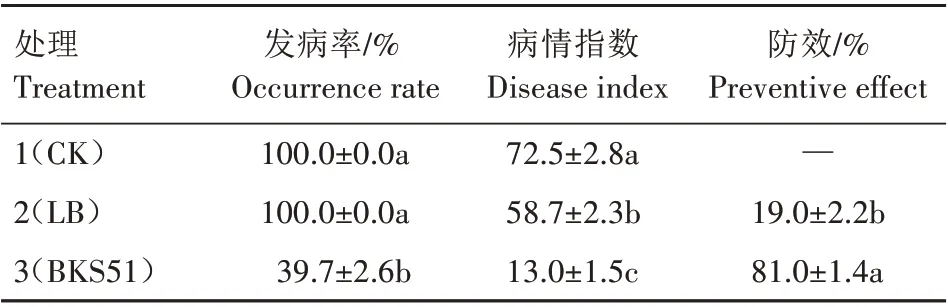
表2 菌株BKS51的盆栽防效测定Tab.2 Determination of potted control effect of strain BKS51
2.5 菌株BKS51的鉴定
2.5.1 形态学鉴定 菌株BKS51 在LB 培养基上的菌落形态为圆形、乳白色、不透明,表面有褶皱状凸起,无光泽、边缘不整齐,无色素产生(图3A)。染色后在光学显微镜下观察,菌株BKS51 菌体呈杆状,含芽孢(图3B)。
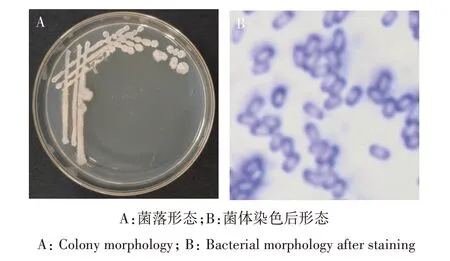
图3 菌株BKS51的菌落形态及菌体形态Fig.3 Colony morphology and cell morphology of strain BKS51
2.5.2 生理生化鉴定 生理生化鉴定结果显示,菌株BKS51 为革兰氏阳性菌,兼性厌氧,具有过氧化氢酶及氧化酶活性,代谢过程中不产生硫化氢气体;糖酵解试验中,蔗糖发酵呈阳性,葡萄糖发酵呈阴性,代谢过程中不产生气泡;能够分解淀粉和明胶;V-P、硝酸还原、精氨酸双水解、脲酶反应均呈阳性;吲哚、柠檬酸、丙二酸盐、MR 反应均呈阴性;在含1%~9% NaCl 的LB 培养基上均可正常生长,当培养基中NaCl 含量达到10%时,菌株停止生长(表3)。通过生理生化试验的鉴定结果,结合形态学特征,依据《伯杰细菌鉴定手册》初步确定菌株BKS51属芽孢杆菌属,参照《芽胞杆菌第二卷芽胞杆菌分类学》中的标准,可将菌株初步鉴定为解淀粉芽孢杆菌。

表3 菌株BKS51的生理生化特性Tab.3 Physiological and biochemical characteristics of strain BKS51
2.5.3 分子生物学鉴定 菌株BKS51 的16S rRNA基因序列长度为1 418 bp。将序列提交NCBI 后获得GenBank登录号MW577627,经BLAST比对发现,菌株BKS51 的16S rRNA 基因序列与解淀粉芽孢杆菌(B.amyloliquefaciens)、贝莱斯芽孢杆菌(B.velezensis)、暹罗芽孢杆菌(B.siamensis)等菌株的基因序列相似性达到99%以上,系统发育树结果显示,BKS51 与B.amyloliquefaciens和B.velezensis同属一个分支,支持率较低,难以区分BKS51 的种类(图4)。
菌株BKS51 的gyrB基因序列长度为1 119 bp,将序列提交NCBI 后获得GenBank 登录号MW579411,经BLAST 比对发现,菌株BKS51 的gyrB序列与解淀粉芽孢杆菌(B.amyloliquefaciens)基因序列的相似性最高,达到99.93%,系统发育树显示,BKS51 与B.amyloliquefaciens同属一个分支,且支持率较高(图5)。
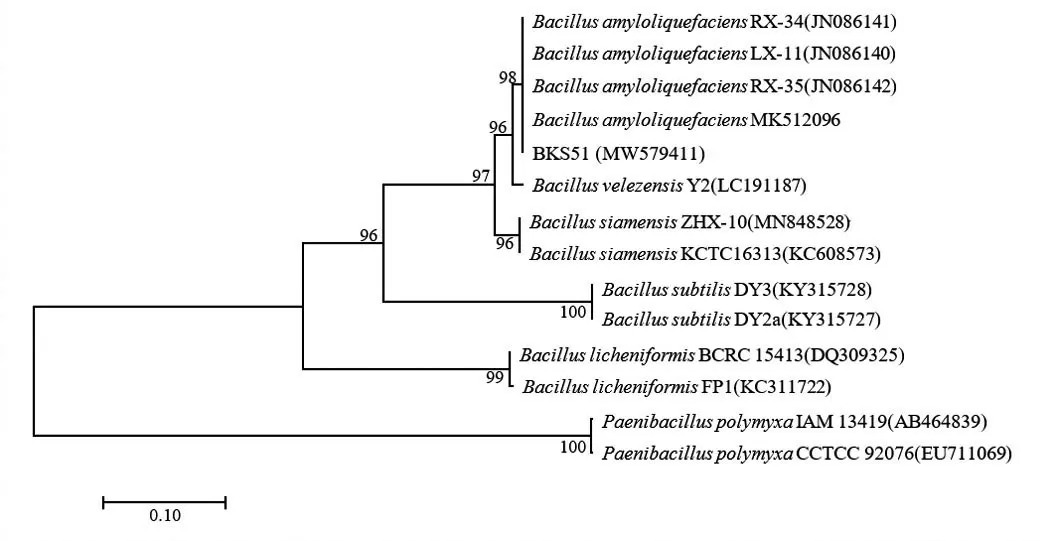
图5 基于gyrB基因序列构建的菌株BKS51的系统发育树Fig.5 Phylogenetic tree of strain BKS51 constructed based on gyrB gene sequence
结合形态特征、生理生化特性以及16S rRNA和gyrB基因序列分析结果,将菌株BKS51 鉴定为解淀粉芽孢杆菌。
3 结论与讨论
从马铃薯疮痂病发病地块健康植株根际土壤中分离得到181 株细菌菌株,经过筛选获得1 株对疮痂链霉菌(S. scabies)具有显著拮抗效果的菌株BKS51,经形态学、生理生化特征及分子生物学鉴定,该菌株为解淀粉芽孢杆菌,其抑菌圈直径达37 mm,盆栽防效达到81.0%。目前报道的对马铃薯疮痂病菌具有拮抗作用的菌株有苏云金芽孢杆菌(B. thuringiensis)、枯草芽孢杆菌(B. subtilis)、甲基营养型芽孢杆菌(B. methylotrophicus)以及贝莱斯芽孢杆菌(B.velezensis),这些拮抗菌对疮痂链霉菌(S.scabies)的抑菌圈直径为21.4~29.56 mm[17,26‐27]。本研究筛选出的菌株BKS51 对S. scabies的抑菌圈直径为37 mm,优于前人的研究结果。菌株BKS51的抑菌效果也优于高同国等[28]分离得到的解淀粉芽孢杆菌12-82(抑菌圈直径为26.2 mm)。在GenBank 下载12-82 的序列,与BKS51 进行比对发现,2株菌株序列间存在差异,可能属于不同菌系。
传统的细菌分类鉴定方法主要是通过形态特征以及生理生化特性来确定细菌的分类地位,但是这样的方法繁琐耗时,而且在试验过程中往往会出现假阳性的结果,很大程度上影响鉴定结果。如今,随着分子生物学的飞速发展,16S rRNA 基因序列已经广泛应用于细菌鉴定或者构建细菌的系统进化关系上[20]。但16S rRNA 基因序列相似度较高,难于区分亲缘关系近的菌种。本研究发现,基于16S rRNA 基因序列构建的系统发育树中,菌株BKS51 与B.amyloliquefaciens和B.velezensis聚集在同一分支上,不能区分出BKS51的种类。DNA 促旋酶B 亚基编码基因gyrB作为一种新的蛋白质编码基因,一定程度上弥补了16S rRNA基因序列的不足。gyrB基因的进化率大于16S rRNA 基因,不发生水平转移,并普遍存在于细菌中,满足了作为系统发育靶基因的要求,目前,已有很多国内学者通过结合16S rRNA 与gyrB的基因序列分析来进行近缘菌株的区分[20,24,29‐31]。因此,本研究进一步通过菌株BKS51的gyrB基因序列构建系统发育树,结果表明,菌株BKS51 只与B.amyloliquefaciens聚集在同一分支上。
芽孢杆菌可以分泌多种具有生物活性的代谢产物,包括脂肽类、蛋白质类、核酸类、多烯类等抗菌物质[32‐33],代谢物质的产生是生防菌发挥生防作用的重要机制。本研究结果表明,菌株BKS51 的无菌发酵液对疮痂链霉菌产生了抑制效果,说明其产生的代谢产物具有较强的抗生作用,但代谢产物的种类及性质有待进一步研究。
