酸性环境对肾小管上皮细胞自噬-溶酶体通路的影响
2022-01-26陈小翠李志航杨陈刘华锋
陈小翠,李志航,杨陈,刘华锋
(广东医科大学附属医院肾病研究所 湛江市慢性肾脏病防治重点实验室,广东 湛江 524001)
肾脏是维持机体酸碱电解质平衡的重要器官之一。慢性肾脏病常引起酸碱电解质紊乱,肾脏泌酸功能受限,引起代谢性酸中毒[1-2]。研究发现,代谢性酸中毒所引起的小管腔内低pH酸性环境可以多种途径直接诱导肾小管上皮细胞(tubular epithelial cell,TEC)功能异常。酸性环境可使残余TEC产氨作用增强,促使细胞肥大和增生;通过旁路途径激活补体系统,持续损伤TEC;通过激活富含脯氨酸的酪氨酸激酶2,引起TEC内活性氧类产生增多,损伤小管;增大TEC线粒体负荷压力,持续刺激下会引起线粒体膜电位丢失,导致细胞能量系统无法维持[3]。
自噬溶酶体系统是重要的自我保护机制之一,对维持细胞的稳定至关重要[4]。近年研究发现,在环孢素肾毒模型[5]、顺铂肾毒模型[6-7]和脓毒血症肾毒模型[8]以及单侧肾梗阻模型[9]和肾缺血再灌注损伤模型[10]中均存在TEC自噬诱导现象,而自噬具有保护TEC、抵抗危险因素损伤的作用。此外,自噬激活在蛋白尿和晚期糖基化终末产物所致的TEC损伤过程中也发挥重要的保护作用[11-12]。目前酸性环境下自噬-溶酶体系统是否作为一种保护机制被激活尚不清楚。本研究旨在通过体外实验探讨代谢性酸中毒所致酸性环境对TEC自噬-溶酶体的影响,以进一步探求酸性环境导致TEC损伤的潜在机制。
1 材料与方法
1.1材料
1.1.1细胞和试剂 人TEC(HK-2)细胞株(美国ATCC公司生产,批号:63848926)购自美国模式菌种收集中心。含1%青霉素-链霉素双抗(批号:1970741)、10%胎牛血清(批号:2176404)、杜尔贝科改良伊格尔完全培养基(批号:8120469)均购自美国Gibco公司。盐酸(批号:1098214)、anti-微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)-Ⅱ(批号:0000090954)均购自美国Sigma公司。四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium assay,MTT)试剂盒(批号:053320200806)、含1 mmol/L苯甲基磺酰氟(批号:051020202825)、RIPA(Radio Immunoprecipitation Assay)裂解液(批号:042121200708)、辣根过氧化物酶结合的抗小鼠IgG和抗兔IgG(批号:112120200408、112020200305)均购自上海碧云天公司。蛋白酶-磷酸酶抑制剂(批号:2020A1CP1260)购自北京普利莱公司。BCA(Bicinchoninic Acid Assay)蛋白检测试剂盒(批号:RL242683)购自美国Thermo Fisher公司。乙烯膜(批号:R1BB12933)购自美国EMD Millipore公司。ECL(ClarityTMWestern ECL)化学发光液(批号:P10026378)购自美国Bio-Rad公司。anti-p62/SQSTM1(批号:GR33369111-1)购自美国Abcam公司,anti-β-肌动蛋白(β-actin)(批号:K2818)购自美国Santa Cruz公司,anti-转录因子EB(transcription factor EB,TFEB)(批号:lot3)购自美国Bethyl Laboratories公司。串联荧光蛋白质粒tfGal3(RFP and GFP tandem fluorescent tagged Galectin-3 probe,批号:639013)购自美国 Addgene公司。Lipofectamine 3000转染试剂盒(批号:1831599)购自美国Invitrogen公司。牛血清白蛋白溶液(批号:AR0004)购自美国BOSTER公司。
1.1.2仪器 pH仪(型号:FE28型)购自梅特勒-托利多仪器(上海)有限公司生产,酶标仪(型号:Elx800型)购自美国Biotek公司,0.22 μm过滤器(型号:ROKB83855)购自德国Millipore公司,Azure C500 Western Blot成像系统(型号:50043)购自美国Azure biosystems。
1.2方法
1.2.1细胞培养及处理 在含1%青霉素-链霉素双抗的10%胎牛血清杜尔贝科改良伊格尔完全培养基中进行细胞培养及正常消化传代。采用pH仪检测,利用盐酸将含10%胎牛血清的杜尔贝科改良伊格尔完全培养基的pH值调至7.4、7.0、6.6及6.2,且培养基经0.22 μm过滤器过滤除菌后使用,每次现用现配。利用不同pH培养基培养HK-2细胞24 h后获得的细胞进行后续检测。利用蛋白免疫印迹检测溶酶体新生关键TFEB。
1.2.2细胞活力检测 利用MTT试剂盒检测不同pH培养基对细胞增殖及毒性的影响。按每孔5 000个细胞在96孔板上种植HK-2细胞,待细胞贴壁后,换不同pH培养基继续培养24 h。按照试剂盒要求,每孔加入10 μl的MTT溶液37 ℃孵育继续4 h后,每孔加入100 μl二甲基亚砜溶解液再继续孵育,直至全部溶解。利用酶标仪在570 nm检测各孔的光吸收值,进行3次独立重复实验。
1.2.3蛋白免疫印迹检测 利用含1 mmol/L苯甲基磺酰氟和蛋白酶-磷酸酶抑制剂的RIPA裂解液提取HK-2细胞的总蛋白。裂解液于4 ℃、13 000×g离心15 min,取上清液;利用BCA蛋白检测试剂盒测定蛋白浓度。蛋白标本加入蛋白免疫印迹上样缓冲液经加热处理后,行12%十二烷基磺酸钠-聚丙烯酰胺变性凝胶电泳分离;然后将胶上蛋白转印至聚偏氟乙烯膜上。聚偏氟乙烯膜经含5%牛血清白蛋白的磷酸盐-吐温20缓冲溶液室温封闭1 h后,加入稀释至合适浓度的一抗试剂,于4 ℃孵育过夜。次日经清洗后,将聚偏氟乙烯膜膜与结合辣根过氧化物酶的二抗共同在室温条件下孵育2 h。再次清洗后,加入ECL化学发光液,底物显色。利用Azure C500 Western Blot成像系统捕获信号,并用Image J软件(美国NIH)分析结果。进行4次独立重复实验。
1.2.4溶酶体损伤检测 利用串联荧光蛋白质粒tfGal3检测溶酶体破裂情况[13]。根据说明书,利用Lipofectamine 3000转染试剂盒,将2 μg/ml tfGal3质粒转染HK-2细胞,而后细胞进行相应刺激。收集细胞后,于Leica激光共聚焦显微镜下观察荧光信号并拍照,利用Photoshop软件分析细胞内荧光颗粒的数量。

2 结果
2.14组HK-2细胞活力比较 pH 7.4组、pH 7.0组、pH 6.6组、pH 6.2组HK-2细胞活力分别为(100.00±9.59)%、(96.30±7.85)%、(87.69±9.91)%、(75.06±9.62)%,各组HK-2细胞活力比较差异有统计学意义(F=17.109,P<0.001)。pH 6.6组和pH 6.2组HK-2细胞活力明显低于pH 7.4组(P=0.011、P<0.001),pH 6.2组HK-2细胞活力低于pH 7.0组(P<0.001),其他两组间比较差异无统计学意义(P>0.05)。
2.24组HK-2细胞LC3-Ⅱ、p62表达水平比较 各组HK-2细胞LC3-Ⅱ、p62表达水平比较差异有统计学意义(P<0.01),与pH 7.4组相比,pH 7.0组HK-2细胞LC3-Ⅱ表达水平升高(P=0.008),pH 6.2组LC3-Ⅱ 表达水平低于pH 7.0组和pH 6.6组(P=0.002、P=0.016),其他两组间比较差异无统计学意义(P>0.05)。与pH 7.4组相比,pH 7.0组和pH 6.6组HK-2细胞p62表达水平均明显降低(P=0.001、P=0.001),pH6.2组高于pH 7.0组和pH 6.6组(P=0.002、P=0.002),其他两组间比较差异无统计学意义(P>0.05)。见表1、图1。
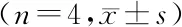
表1 4组HK-2细胞LC3-Ⅱ与p62表达水平比较
2.34组HK-2细胞溶酶体结构相关指标比较 与pH 7.4组相比,pH 7.0组HK-2细胞内黄色荧光颗粒和红色荧光颗粒均略升高;与pH 7.4组和pH 7.0组相比,pH 6.6组HK-2细胞内黄色荧光颗粒和红色荧光颗粒显著增多,且黄色荧光颗粒 /红色荧光颗粒比例增加,但损伤溶酶体仍可通过自噬依赖途径进行降解;与pH 7.4组、pH 7.0组、pH 6.6组相比,pH 6.2组HK-2细胞内黄色荧光颗粒增多,呈片状存在,红色荧光颗粒几乎完全消失,见图2。

注:LC3为微管相关蛋白1轻链3,β-actin为β-肌动蛋白
2.44组HK-2细胞TFEB表达情况比较 pH 7.4组、pH 7.0组、pH 6.6组、pH 6.2组HK-2细胞内TFEB倍数变化分别为(1.00±0.03)、(1.04±0.07)、(0.84±0.16)、(0.77±0.10),4组比较差异有统计学意义(F=12.540,P<0.001),与pH 7.4组相比,pH 6.6组和pH 6.2组HK-2细胞内TFEB表达水平均明显降低(P=0.016、P=0.001),pH 7.4组与pH 7.0组HK-2细胞内TFEB表达水平比较差异无统计学意义(P=0.904);与pH 7.0组相比,pH 6.6组和pH 6.2组TFEB表达水平亦明显低于(P=0.003、P<0.001),pH 6.6组和pH 6.2组TFEB表达水平比较差异无统计学意义(P=0.584)。见图3。

注:GFP为绿色荧光蛋白,mRFP为单体红色荧光蛋白,Gal3为半乳糖凝集素3,Merge为合并;黄色荧光颗粒代表破裂受损的溶酶体,红色荧光颗粒代表通过自噬依赖途经在被清除的溶酶体
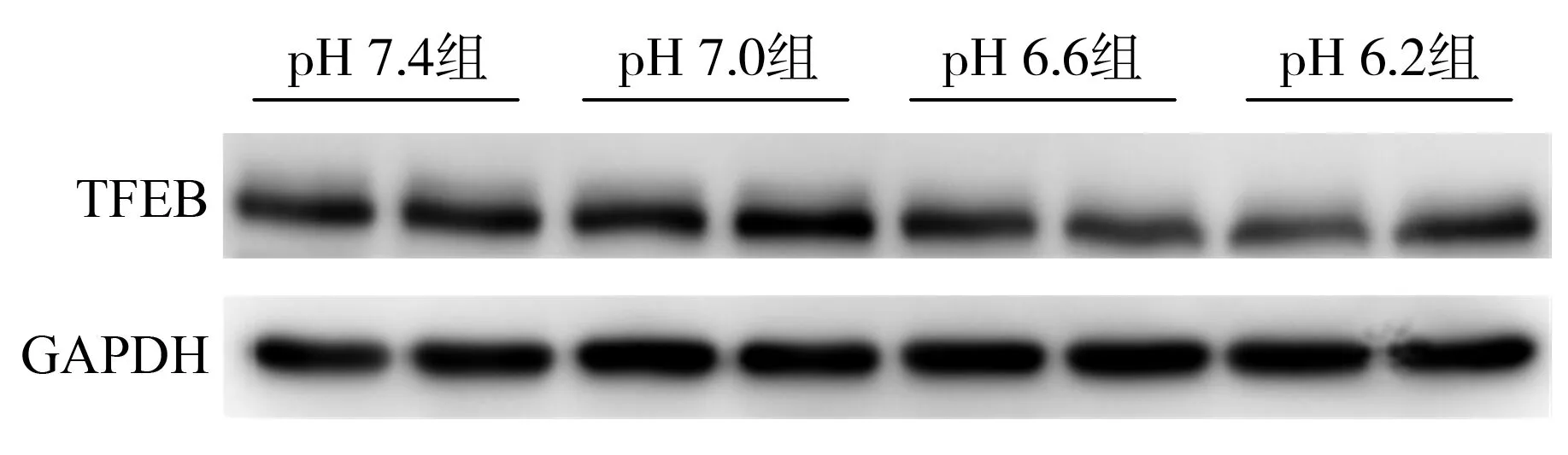
注:TFEB为转录因子EB,GAPDH为甘油醛-3-磷酸脱氢酶
3 讨 论
组织局部酸化是多种慢性炎症性疾病的主要表现,包括缺血、动脉粥样硬化、风湿性关节炎、慢性肾脏病等。既往关于酸性环境对浸润的中心粒细胞等免疫细胞影响的研究较多,对类似肾脏固有细胞的作用分子机制研究较少。线粒体是TEC关键的细胞器之一,其结构和功能稳定对于高耗能TEC至关重要[14]。既往研究发现,酸性环境可以诱导TEC内线粒体呈现碎片化,即线粒体分裂增多而融合减少[15];呈现碎片化的线粒体可以通过Drp1介导的途径激活线粒体特异性自噬,以清除碎片化的线粒体,维持整体线粒体功能的稳定[16]。既往研究中,氯化铵模拟酸性环境刺激TEC,可诱导TEC发生自噬,清除受损的线粒体,降解堆积的泛素化蛋白[17]。可见,轻微的细胞酸性环境激活细胞自噬起保护作用。本研究结果显示,随着酸性程度的增强,自噬通路先呈现活化(表现为自噬体蛋白LC3-Ⅱ上升而底物p62下降);而随着酸性程度进一步增强,自噬-溶酶体通路可能受到抑制(表现为LC3-Ⅱ、p62恢复,且与pH 7.4组比较无明显差异,而细胞活力显著下降)。因此,培养基环境对HK-2细胞自噬-溶酶体通路变化呈酸性程度依赖性,随着酸性程度的增强,细胞自噬的保护机制逐渐丧失,细胞活力明显下降。
自噬通路活性依赖于自噬体的形成以及溶酶体对自噬体的有效降解,因此,随着酸性环境加剧而引起的自噬通路障碍可能与溶酶体结构和功能受到干扰有关[18]。有文献报道,酸性环境可引起乳腺癌细胞[19]和前列腺癌细胞[20]溶酶体的肿胀、数量减少、细胞内外周化。在肾脏固有细胞研究方面,应用NH4Cl模拟酸性刺激可显著上调肾脏系膜细胞[21]和TEC内溶酶体pH值[22],抑制溶酶体组蛋白酶B和蛋白酶L的活性,抑制蛋白降解,从而促进细胞肥大。通过蛋白质组学研究发现,NH4Cl诱导的代谢性酸中毒大鼠模型分离纯化的TEC内,溶酶体组蛋白酶B的蛋白表达明显降低[23]。在本研究中,利用转染tfGal3的HK-2细胞实验发现,随着细胞外环境的不断酸化,HK-2细胞内溶酶体逐渐出现膜透化。这种溶酶体的膜透化会引起腔内pH值升高,溶酶体酶活性下降甚至降解能力的削弱,从而影响自噬体的降解,导致自噬保护作用丧失。既往研究报道,尿蛋白[24]和晚期糖基化终末产物[25]可以通过诱导溶酶体发生膜透化,抑制自噬体降解,造成自噬通路阻滞,最终导致TEC损伤。半乳糖凝集素3是一种β-半乳糖苷结合凝集素,广泛存在于细胞质和细胞核。当溶酶体发生膜通透化时,串联荧光蛋白的半乳糖凝集素3迅速浸润至破裂的溶酶体囊腔中,并与β-半乳糖苷富集的溶酶体内膜结合,表现为黄色荧光颗粒(即绿色荧光和红色荧光双阳性)。损伤的溶酶体可被选择性地包裹入自噬体,与剩余的、有功能的溶酶体结合,从而被降解,此过程被称为溶酶体自噬[26]。在溶酶体自噬过程中,绿色荧光由于溶酶体的酸性环境而淬灭,红色荧光因耐受酸性环境而持续存在,因此在共聚焦显微镜下,黄色荧光颗粒变成红色荧光单独阳性颗粒。
TFEB是调控溶酶体稳定和自噬通路的关键转录因子。溶酶体结构完整和功能正常时,TFEB被磷酸化停靠在溶酶体膜上;一旦溶酶体发生膜透化等损伤,TFEB脱磷酸化,转位进入细胞核,启动溶酶体相关基因的表达,促进溶酶体新生和溶酶体稳态的恢复[27]。在疾病状态下,TFEB的活性或表达受到抑制,则引起溶酶体稳态异常。本研究中,酸性环境引起TFEB的表达下降可能是酸性环境导致自噬-溶酶体通路异常的主要原因。
本研究中,pH 6.2组HK-2细胞内并未出现明显的自噬底物堆积,这与既往在糖尿病肾病状态下TEC的损伤表现不同[25]。严重的酸性环境可能同时影响自噬体的形成,所以未出现明显的自噬底物堆积现象(p62表达增多),但这一推断需要后续进一步研究的证实。本研究缺少体内实验证据,故仍需后续研究完善。
综上所述,细胞外酸性环境可能通过干扰自噬-溶酶体通路导致TEC活力下降。
