Nrf2及其信号通路在脓毒症相关脏器损伤中的研究进展
2022-01-26张晓慧宁海慧邢博民马玉清
张晓慧, 郭 娜, 宁海慧, 邢博民, 马玉清
脓毒症是一种由感染反应失调引发的威胁生命的多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),具有高发病率、高病死率的特点[1]。目前关于脓毒症的病理生理和损伤机制尚未完全阐明,但氧化应激一直被认为在其中起着关键作用[2]。核转录因子-E2相关因子2(nuclear transcription factor-erythroid 2-related factor 2,Nrf2)通过调节细胞的抗氧化防御系统,在脓毒症的治疗中起着重要作用[3]。本文就Nrf2相关信号通路及其在脓毒症器官损伤中的研究进展进行综述,以期为临床治疗脓毒症提供新的治疗策略。
1 Nrf2结构
Nrf2是CNC(cap′-n′-collar)家族成员最重要的转录因子之一,含有605个氨基酸残基,形成了从Neh1到Neh7的7个结构域。Neh1含有一个高度保守的亮氨酸拉链式结构(bZIP),负责与小Maf蛋白(small Maf protein)结合形成异二聚体,进而识别并结合抗氧化反应原件(antioxidant response elements, ARE)[4]。Neh2是主要的调节结构区,含有DLG和ETGE两个基因序列,对Nrf2和Kelch 样环氧氯丙烷相关蛋白-1 (kelch-like ECH-associated protein l, Keap1)之间的相互作用、Nrf2的稳定性及Nrf2泛素化至关重要[5]。Neh3位于C末端,通过与Nrf2转录辅助激活子染色质解螺旋酶DNA结合蛋白6(CHD6)结合,反式激活ARE依赖基因的表达[6]。Neh4和Neh5是转录激活(TA)域,当Nrf2进入细胞核与小Maf蛋白形成二聚体,并与ARE结合,此时转录不能立即启动,还需要Neh4、Neh5与环状单磷酸腺苷(CAMP)反应原件结合,协同启动转录过程[7]。Neh6是一段富含氨基酸的不依赖Keap1的Nrf2降解区域,负向调控Nrf2[8]。Neh7是近几年新发现的结构域,可通过与视黄醇X受体(RXRa)相互作用抑制Nrf2的激活[9]。Neh1-Neh7所具有的结构多样性的特点,是调控下游靶基因的表达,抵御氧化应激,减轻脓毒症的结构基础。Nrf2被认为是CNC家族中最强的转录调节因子。
2 Nrf2相关信号通路
2.1Keap1/Nrf2/ARE通路 Keap1是分子质量为69ku的多肽,具有五个结构域,分别是N末端的NTR区、BTB区、DGR区、连接片段IVR区和C末端的CTR区,其中BTB、DGR、IVR为三个主要功能区[10]。BTB区含有半胱氨酸(Cys)151,可与Cul3的泛素E3连接酶复合体相互作用促进Nrf2泛素化[11]。DGR区含有六个重复的Kelch序列,可以特异性的结合Nrf2的N末端Neh2结构域,并对其进行负性调节。IVR区中富含大量半胱氨酸,是氧化剂和亲电试剂发生反应的区域,其中Cys288和Cys297对于抑制Nrf2活性至关重要[12]。生理状态下,胞浆中的Nrf2与其抑制因子Keap1结合,然后用Keap1把它固定在由肌动蛋白组成的细胞骨架上[13]。当发生脓毒症时,氧化应激随之发生,Nrf2与细胞内的Keap1解偶联并在多种蛋白激酶的磷酸化作用下转移进入细胞核,与小Maf蛋白形成异二聚体,识别并结合ARE,促进下游抗氧化酶和Ⅱ相解毒酶基因的表达,减少机体的氧化应激损伤[14]。
2.2磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)/Nrf2通路 PI3K是最初被发现与癌基因产物密切相关的一种胞内磷脂酰肌醇激酶,在细胞存活、增殖及凋亡中发挥重要作用[15]。Akt是一种丝氨酸/苏氨酸蛋白激酶,为PI3K的主要下游效应分子。PI3K/Akt 信号通路通过抑制细胞凋亡,调控细胞周期和代谢,对脓毒症具有一定的保护作用[16]。当机体受到氧化应激时,PI3K被激活,可将其底物3,4二磷酸磷脂酰肌醇(PIP2)转化为3,4,5三磷酸磷脂酰肌醇(PIP3),进而与Akt结合并转位至胞膜,与定位于胞膜上的三磷酸磷脂酰肌醇依赖性蛋白激酶1(PDK-1)结合,最终完全激活Akt[17]。激活的Akt可促进下游信号分子Nrf2的磷酸化[18]。
2.3沉默信息调节因子1(Sirt1)/Nfr2通路 Sirt1是一种高度保守的烟酰胺腺嘌呤二核苷酸依赖的Ⅲ类核组蛋白去乙酰化酶[19]。Sirt1是乙酰化酶家族研究最多、最具有代表性的成员,相对分子质量约为120 kDa,主要由N-末端、催化核心、别构部位、C-末端四部分组成,其中别构部位和催化核心构成了Sirt1的活性中心,参与基因转录、细胞凋亡及氧化应激等多种生理功能的调节[20]。Sirt1可通过改变Keap1的构型,引发Keap1和Nrf2解离,进而促进Nrf2的核转位,激活某些抗氧化基因的表达[21]。
2.4促分裂原活化的蛋白激酶(MAPK)/Nrf2通路 MAPK可分为3个亚群,即胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、p38和c-Jun氨基酸激酶(c-Jun N-terminal kinase, JNK)。p38是相对分子质量约为38kD的酪氨酸磷酸化蛋白激酶,在机体内广泛表达,磷酸化p-38是其活化状态,参与炎症、氧化应激及凋亡等一系列生理过程[22]。ERK包括8个中亚型,其中ERK1/2是MAPK家族的重要成员[23]。ERK1/2在受到氧化应激、缺血、缺氧等刺激时可被激活,活化的ERK可磷酸化多种核内信号蛋白。JNK又被称为应激活化蛋白激酶(stress activated protein kinase, SAPK),由JNK1、JNK2和JNK3组成,其中JNK1和JNK2在全身各组织均有表达,JNK3仅在脑中表达[24]。ERK1/2、p38、JNK三者可协同磷酸化Nrf2,促进其与细胞质中的Keap1解离,使Nrf2活化[25]。
2.5Nrf2/核转录因子-κB (NF-κB)通路 被激活的Nrf2可以活化NF-κB,在炎症反应中发挥保护作用。NF-κB是由p65和p60两个亚基组成的二聚体,在体内分布和作用十分广泛。静息状态下,NF-κB异二聚体与其抑制性蛋白(inhibitor kapaa B, IκB)结合并将其固定在胞质中。当受到炎症因子、氧化应激刺激时,IκB迅速被IκB激酶磷酸化,导致IκB的降解而释放NF-κB,NF-κB进入细胞核与相应基因结合,调控促炎细胞因子、趋化因子和黏附分子等的表达[26]。
3 Nrf2及其信号通路与脓毒症相关脏器损伤
3.1脓毒症急性肺损伤(ALI) 脓毒症ALI是临床上急危重症患者死亡的主要病因,病死率高达35.1%~46.1%,其发病机制的复杂性决定了临床治疗的局限性。目前发现,炎症、氧化应激及自噬在脓毒症ALI的发生、发展中具有重要作用,Nrf2相关信号通路与ALI息息相关。研究发现,激活Nrf2相关通路可降低ALI造成的相关炎症因子水平,减少肺泡和肺间质炎症细胞浸润并降低髓过氧化物酶(MPO)、丙二醛(MDA)含量。Ni等[27]发现,橙花叔醇(nerolidor, NERO)干预后可明显增强脂多糖(LPS)诱导的腺苷酸活化蛋白激酶(AMPK)、Nrf2、血红素加氧酶1(HO-1)蛋白的表达,提示橙花叔醇通过AMPK/Nrf2/HO-1通路减轻了LPS诱导的肺部炎症反应。此外,活化Nrf2通路可改善与ALI相关的超氧化物歧化酶(SOD)水平降低,肺内皮屏障破坏,改善脓毒症大鼠肺组织的氧化应激损伤。Zhao 等[28]研究发现,萝卜硫素(0sulforaphane,SFN)通过活化Nrf2/HO-1信号通路,SOD水平增加,降低肺组织氧化应激水平,改善肺组织损伤。研究表明,在盲肠结扎穿孔(CLP)诱导的脓毒症小鼠模型中,野生型小鼠(WT)给予H2治疗后,相对于模型组,Nrf2的下游信号分子HO-1的表达水平下降,SOD和过氧化氢酶(CAT)表达水平明显增高,同时MDA表达明显降低,而敲除Nrf2后,氢气的保护作用随之消失,提示氢气通过Nrf2/HO-1信号通路,发挥脓毒症小鼠肺损伤的保护作用,减轻脓毒症ALI/急性呼吸窘迫综合征(ARDS),提高小鼠生存率。与此同时,Nrf2相关通路的激活还通过调控肺组织凋亡和自噬蛋白水平,改善脓毒症相关肺损伤。Wang等[29]采用体内外实验,发现青藤碱(sinomenine, SIN)药物治疗组相对于模型组,Nrf2、Keap1和HO-1表达明显增高,SOD水平升高,MDA水平下降,同时抑凋亡蛋白B淋巴细胞瘤-2基因(Bcl-2)表达增加,自噬相关蛋白自噬相关基因-5(Atg5)和自噬效应蛋白(Beclin1)表达降低,表明青藤碱可通过Nrf2/Keap1和自噬减轻脓毒症ALI。
3.2脓毒症急性肾损伤(AKI) 脓毒症AKI是急危重症领域的一种常见综合征,在重症医学科发病率甚至超过50%,严重威胁患者的生命安全,但其确切发病机制目前尚不清楚[30]。已证实氧化应激和炎症在脓毒症AKI的发病机制中具有重要作用。肾脏是ROS损伤较为敏感的器官,而研究发现,Nrf2的激活可增加肾组织SOD含量,降低血清肌酐(Cr)和血清尿素氮(BUN)水平。实验证实[31],右美托嘧啶(DEX)可通过激活Nrf2及其下游分子HO-1,明显增加肾脏组织中SOD的表达,改善肾脏功能,减轻脓毒症AKI。渥曼青霉素(wortmannin)可能通过PI3K/Nrf2信号通路诱导Akt蛋白表达上调,肾脏组织Nrf2和HO-1升高,SOD含量增长[32]。此外,激活Nrf2通路还可抑制脓毒症AKI释放促炎症因子,增强自噬以改善脓毒症AKI。Xu等[33]发现,金槲皮素(gold-quercetin, GQ)可激活Nrf2,抑制NF-κB通路,减少炎症反应,减轻脓毒症AKI。Feng等[34]建立LPS所致AKI脓毒症大鼠模型,发现人脐带血单核细胞(UCBMC)可能通过激活Nrf2,增加HO-1和微管相关蛋白1轻链3(LC3)-II的表达,提高PTEN诱导假定激酶1(PINK1)、线粒体融合蛋白2(mfn2)和E3泛素连接酶(Parkin)水平,说明Nrf2可能通过增强自噬及改善线粒体损伤,保护LPS诱导的人肾皮质近曲小管上皮细胞(HK-2)损伤。
3.3脓毒症心肌损伤 心脏是脓毒症常见的靶器官之一,心脏功能障碍是脓毒症患者常见的死亡原因。近期研究发现,激活Nrf2可能通过Nrf2/HO-1信号通路逆转脓毒症导致的心肌炎症细胞浸润和心肌细胞凋亡,抑制心肌损伤和心功能障碍,发挥心肌保护作用。罗晓梅等[35]研究发现,与造模组相比,心丹参注射液(danshen injection,DSI)治疗组Nrf2、HO-1、醌氧化还原酶-1(NQO1)表达增加,心肌细胞凋亡和活化半胱天冬酶(cl-caspase)-3、cl-caspase-9、Bcl-2关联x蛋白(Bax)表达降低,进一步检测发现,p-65的表达明显降低,提示DSI可能通过Nrf2抑制NF-κB,减轻脓毒症所致心功能障碍。程梅等[36]用SD大鼠构建脓毒症心肌模型,结果发现与假手术组相比,模型组心肌组织Nrf2、HO-1、信使RNA(mRNA)及蛋白的表达明显升高,这可能与机体自身代偿功能相关,而与模型组相比,利多卡因(lidocaine, Lido)干预组Nrf2、HO-1 mRNA和蛋白表达水平升高,肌红蛋白(Myo)、心肌肌钙蛋白Ⅰ(cTnⅠ)表达水平明显降低,心肌病理损伤明显好转。Maresin1是来源于n-3不饱和脂肪酸促炎消退介质。Nrf2/HO-1信号通路还可下调炎症因子水平,改善脓毒症心肌损伤,降低脓毒症小鼠病死率。有研究[37]表明,Maresin1处理可明显增加Nrf2的表达,诱导HO-1表达,同时p-65、IL-1β、IL-6、TNF-α含量明显下降,减轻LPS诱导的心肌损伤。
3.4脓毒症肝损伤 脓毒症常累及肝脏,造成急性肝损伤,是脓毒症患者死亡的危险因素之一。脓毒症急性肝损伤的发病机制目前尚不完全清楚,多认为与氧自由基损伤、过度炎症反应有关[38]。实验显示,Nrf2通路的激活可改善脓毒症急性肝损伤所造成的肝组织SOD、谷胱甘肽(GSH)含量下降以及肝功能障碍。肖雷等[39]通过LPS制备脓毒症模型,检测肝组织Nrf2和HO-1 mRNA蛋白表达升高,给予丹参川芎嗪注射液后,肝组织病理损伤减轻,GSH水平和SOD、谷胱甘肽转移酶(GST)活性明显升高,并且谷草转氨酶、谷丙转氨酶水平降低,提示丹参川芎嗪注射液可能通过Nrf2/HO-1信号通路,增强肝组织的抗氧化能力,降低LPS诱导的肝损伤。而Nrf2通路还可通过下调炎症因子水平改善脓毒症AKI。兰戴天等[40]在CLP诱导的脓毒症模型中发现,松果菊苷(echinaco-side, ECH)可能通过Nrf2通路降低肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β、高迁移率族蛋白1(HMGB1)的含量,增加CD4+和CD8+含量和比值,对脓毒症肝损伤有一定保护作用。研究[41]也证实,骨髓间充质干细胞(BMSCs)在LPS造模的脓毒症损伤模型中可以下调肝组织的TNF-α、IL-6水平,降低血清转氨酶水平,增加组织再生,这可能与其激活Nrf2通路有关。
3.5脓毒症肠损伤 肠道是脓毒症时最容易受到损害的靶器官,在脓毒症早期即存在肠屏障受损致通透性增加,细菌、毒素入血,造成远隔脏器损伤衰竭甚至死亡[42]。研究发现,激活Nrf2/HO-1信号通路可升高脓毒症肠组织抗氧化蛋白水平,降低炎症因子水平,发挥肠道保护作用。Yu等[43]研究证实,给予2%的H2干预后,野生型脓毒症小鼠肠组织Nrf2、HO-1表达升高,SOD、CAT含量明显升高,TNF-α、 IL-6、HMGB1含量下降,敲除Nrf2基因后,脓毒症小鼠体内的炎症和氧化应激反应无明显改善,肠道损伤无明显减轻,推测H2通过调节Nrf2/HO-1信号通路,降低野生型CLP小鼠体内的炎症和氧化应激反应,提高脓毒症小鼠存活率,说明吸入2%H2可能是治疗严重脓毒症所致肠道损伤的治疗策略。最近的一项研究[44]表明,线粒体辅酶Q(MitoQ)可缓解氧化损伤,改善线粒体功能。Zhang等[45]研究发现,MitoQ预处理可通过调节Nrf2信号通路,降低LPS诱导炎症反应和氧化应激,改善肠道损伤,说明氧化应激引起的线粒体功能障碍,在脓毒症的病程进展中具有重要作用。
3.6脓毒症免疫系统损伤
在脓毒症过程中,炎症反应失调造成过度抗炎反应,免疫系统功能抑制,诱发机体进一步感染,造成脓毒症不良预后[46]。在机体中,Nrf2主要集中在脾和肝等免疫器官中,研究显示,Nrf2水平与氧化应激及自然免疫反应水平相关。张雷等[47]通过CLP大鼠尾静脉注射转化生长因子(TGF-β1)发现,TGF-β1参与脓毒症大鼠的免疫抑制,抑制肝、脾中Nrf2表达和单核细胞增殖,促进凋亡。Nrf2可调节微生物刺激的先天免疫反应,抑制促炎细胞因子基因转录,抑制干扰素基因刺激因子(STING)应答[48]。Tolani等[49]研究发现,Nrf2参与抑制巨噬细胞中的信号传导及转录激活因子1(STAT1)通路,导致脓毒症期间的免疫抑制。Mills等[50]研究发现,4-辛基衣康酸(4-OI)可通过某些位点Keap1半胱氨酸残基的烷基化来活化Nrf2,降低LPS处理的巨噬细胞中IL-1β的产生,表明4-OI可能通过Nrf2/Keap1信号通路下调巨噬细胞的炎症因子水平。
大量研究证实,Nrf2信号通路对脓毒症器官损伤具有一定保护作用,现将Nrf2及其相关信号通路在脓毒症器官损伤保护作用的调控介质、代表机制及其发挥作用的物质进行总结。见表1。
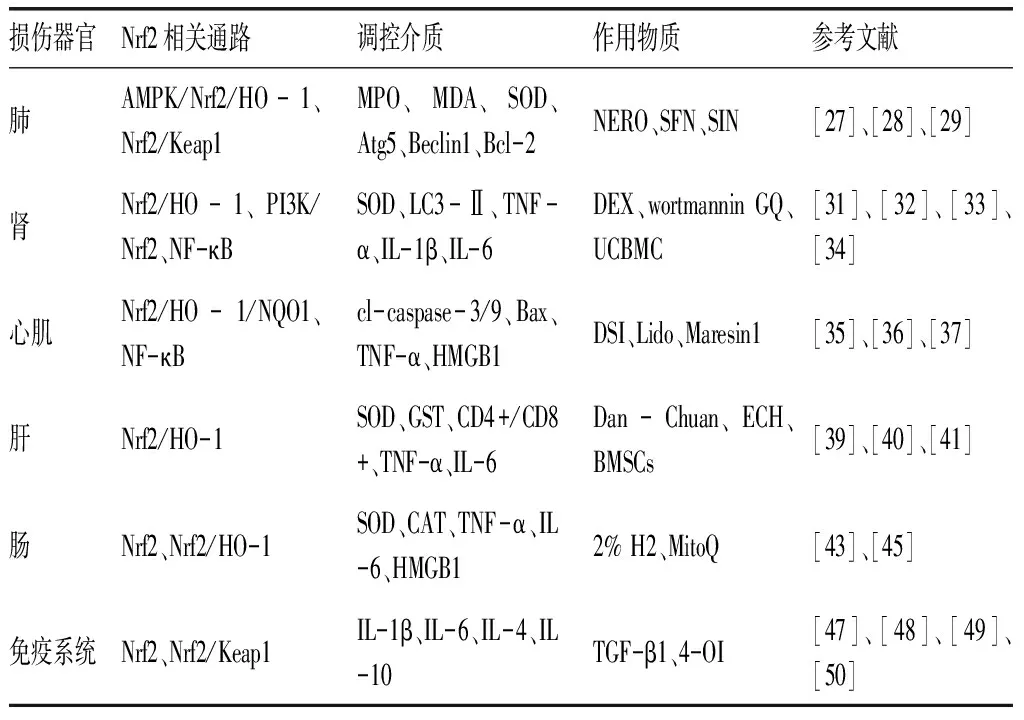
表1 Nrf2及其相关信号通路在保护脓毒症器官损伤的代表机制及影响
3 Nrf2信号通路在脓毒症中的前景与展望
目前,针对脓毒症的治疗主要以控制炎症反应、氧化应激及凋亡,改善脏器损伤为主,而脓毒症所造成的病死率仍居高不下。Nrf2及其相关信号通路可能参与了保护脓毒症相关器官损伤,因此,Nrf2靶向药物治疗对脓毒症应用前景广泛。研究[51]显示,曲美他嗪(TMZ)可能通过靶向Nrf2信号通路直接促进Nrf2和趋化因子受体CXCR2 (CXCR2)启动子区域的结合,上调CXCR2作用于中性粒细胞,减少CLP及LPS造模导致的心功能障碍。Chen等[52]研究发现,一种前列腺素代谢物15k-PGE2可靶向前列腺素还原酶2(PTGR2),修饰Keap1/Nrf2信号通路,减轻脓毒症炎症反应。此外,研究发现,甘草甜素激活Nrf2从细胞质到细胞核的易位,而小干扰RNA(siRNA)敲除Nrf2可以明显降低NQO1和HO-1的mRNA表达,表明甘草甜素靶向Nrf2基因,减轻脓毒症所致HMGB1的分泌和肝脏损伤[53]。
综上所述,Nrf2可通过抗炎、抗氧化、抗细胞凋亡等作用来减轻脓毒症器官损伤。Nrf相关信号通路主要有Keap1/Nrf2/ARE通路、PI3K/Akt/Nrf2通路、Sirt1/Nfr2通路、MAPK/Nrf2通路、Nrf2/NF-κB通路等,这些通路并非独立,往往相互交联,共同参与脓毒症的发生、发展过程,激活Nrf相关信号通路的机制及作用底物有待进一步研究,开发以Nrf2为作用靶点的药物对于治疗脓毒症具有重要意义,有望为临床治疗脓毒症提供新的干预措施。
