猪白细胞介素-22分子特征的初步研究
2022-01-25李美娣刘汉清傅嘉莉
李美娣,刘汉清,武 力,傅嘉莉
(1.广东华农高科生物药业有限公司,广东 广州 510642;2.华南农业大学 兽医学院,广东 广州 510642)
2000年,白细胞介素-22(interleukin-22,IL-22)首次在经过IL-9处理的BW5147鼠T淋巴瘤细胞中被发现[1],属于IL-10家族的细胞因子,与IL-10家族其他细胞因子具有相似的蛋白质基序,通常参与保护性免疫,以预防炎症或自身免疫病[2-4],也可以被类似的受体识别。目前,IL-22已确定由活化的先天淋巴样细胞(ILC)、CD4+T细胞、NK细胞、Th17细胞和DC细胞产生[5-9]。大部分哺乳动物IL-22已经被克隆成功,但目前还未见关于猪IL-22(poIL-22)的相关研究。本试验主要研究poIL-22的分子特征,为poIL-22的进一步研究提供基础。
1 材料与方法
1.1 菌株、细胞和猪样品pcDNATM3.1/myc-His (-) A购自Invitrogen公司;新鲜组织心脏、脑、肝脏、脾脏、肺脏、肾脏、气管、小肠、胃、背最长肌、脑、附睾,从长白猪中分离,液氮冷冻至RNA提取;RNAiso plus试剂盒、pMD-18T载体,购自上海生工生物有限公司;ReverTra Ace®qPCR RT Kit、KOD FX DNA聚合酶购自TOYOBO公司;HiPure Tissue DNA Kit购自Magen公司;胶回收试剂盒购自QIAGEN公司;Endo-free Plasmid Kit购自Omega公司;引物序列,由上海生工生物有限公司合成,如表1所示。
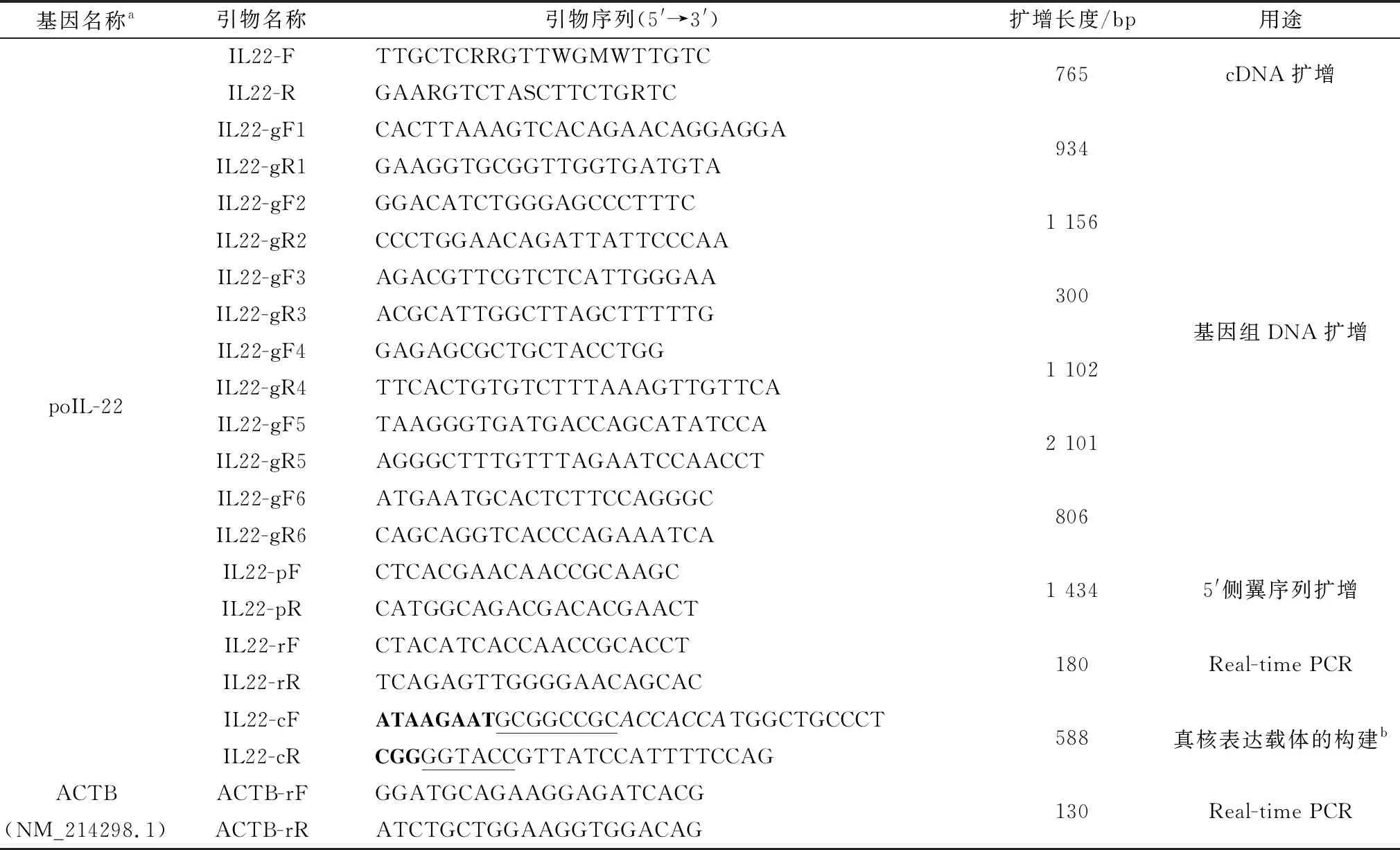
表1 引物序列
1.2 总RNA分离和cDNA合成用RNAiso plus试剂盒提取猪组织中总RNA,按照RT-qPCR试剂盒进行cDNA合成,具体方法:将提取的总RNA在65℃下预热5 min,然后置于冰上,加入2 μL 5× RT buffer,0.5 μL RT Enzyme Mix,0.5 μL引物和无核酸酶的水,总体积为10.0 μL。将反应溶液在37℃下孵育30 min,98℃下加热5 min,并在-80℃下保存直至使用。
1.3 猪IL-22克隆用RT-qPCR试剂盒合成猪脑cDNA的第1链,使用KOD FX DNA聚合酶从大脑cDNA文库克隆poIL-22。RT-PCR反应体系包含:2.5 μL cDNA,10.0 μL 2×PCR buffer,0.4 mmol/L dNTP,引物IL22-F和IL22-R各0.3 μmol/L,0.5 U KOD FX。反应条件如下:94℃预变性2 min;98℃ 10 s,68℃ 30 s,共40个循环;最后68℃延伸10 min。通过1%琼脂糖凝胶电泳检查PCR产物,并将其克隆到pMD-18T载体中进行测序。
1.4 poIL-22的同源性比较和系统进化树构建在NCBI BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/)搜索与poIL-22序列相似的核酸和蛋白质序列,使用ClustalW(http://www.ebi.ac.uk/Tools/clustalw2/index.html)对poIL-22和其他物种IL-22进行同源性比较。使用带有成对删除选项的Nei-Gojobori方法计算进化差异和相似性百分比,并通过在分子进化遗传分析(MEGA)7.0软件(http://www.megasoftware.net)中使用Bootstraps(1 000)计算来确认可重复性。然后使用MEGA 7.0进行了1 000个排列的mantel检验,以评估进化距离与种群相似性之间的相关性。
1.5 poIL-22序列分析通过GENSCAN程序(http://genes.mit.edu/GENSCAN)搜索poIL-22基因开放阅读框(ORF),然后使用Expasy网站上的翻译工具(http://cn.expasy.org/tools/dna.html)确定poIL-22的氨基酸序列。使用ProtParam软件(http://cn.expasy.org/tools/protparam.html)预测poIL-22的理化性质,包括相对分子质量、等电点、氨基酸组成、消光系数、半衰期和不稳定指数。使用TargetP程序(http://www.cbs.dtu.dk/services/TargetP/)预测poIL-22的亚细胞位置。使用SignalP 4.1程序(http://www.cbs.dtu.dk/services/SignalP/)预测poIL-22蛋白中的信号肽。使用Proscan(http://pbil.ibcp.fr)鉴定poIL-22蛋白中的蛋白基序。使用NetILos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)和NetOGlyc 4.0 Server(http://www.cbs.dtu.dk/services/NetOGlyc)鉴定poIL-22蛋白中包含的磷酸化位点和糖基化位点。
1.6 poIL-22结构建模通过Jpred 4服务器(http://www.compbio.dundee.ac.uk/jpred4/index.html)预测poIL-22二级结构,此外,还通过ROBETTA服务器(蛋白质同源性/分析识别引擎)(http://www.robetta.org)与人白介素22(PDB:3g9v)构建了poIL-22的三维(3D)结构。使用PROCHECK(http://services.mbi.ucla.edu/PROCHECK/)检查3D结构,以评估立体化学和拓扑分析,并上传到Qmean服务器(http://swissmodel.expasy.org/qmean/cgi/index.cgi),以评估蛋白质模型的质量并确定潜在的不可靠区域。然后可以通过PyMOL程序(www.pymol.org)可视化有用的模型,该程序还用于分析poIL-22中的二硫键结构域。
1.7 基因组结构测定和启动子分析使用HiPure Tissue DNA Kit分离了长白猪小肠组织的基因组DNA,将它们作为模板,以如下所述扩增poIL-22的基因组序列和5′侧翼区序列。首先,使用NCBI BLAST程序获得poIL-22的基因结构,并使用6对特异性引物(表1)以获得poIL-22的全长基因组序列。用引物IL22-pF和IL22-pR来扩增poIL-22 5′侧翼区序列的1 434 bp片段。使用KOD FX DNA聚合酶获得poIL-22的DNA序列。然后将PCR产物在1%琼脂糖凝胶上电泳,并克隆到pMD-18T载体中进行测序。
GENSCAN Web服务器(http://stanford.edu/~chis/GENSCAN.html)和Genomatix软件包(https://www.genomatix.de/index.html)中的Exon Mapper程序用于预测内含子-外显子的结构以及位于poIL-22基因组序列中的多腺苷酸化信号,由GT-AG规则确定[10]。通过Genomatix软件中的MatInspector程序和GPMiner程序(http://gpmi-ner.mbc.nctu.edu.tw/)分析poIL-22的启动子序列,以表征位于5′侧翼区域的转录结合位点。
1.8 组织分布分析通过RT-qPCR对猪各种组织的逆转录产物进行猪IL-22的表达分析。使用Primer Premier 5.0设计IL-22和ACTB的引物对(IL22-rF、IL22-rR和ACTB-rF、ACTB-rR)来扩增IL-22基因。RT-qPCR的反应条件:95℃预变性3 min;95℃ 15 s,60℃ 1 min,45个循环。通过循环阈值(Ct)鉴定每个RT-qPCR的拷贝数,并通过2-△△Ct计算组织中的差异表达。
1.9 真核表达载体的构建通过PCR将pMD18T-IL22中不含IL-22信号肽的编码序列克隆到哺乳动物表达质粒pcDNATM3.1/myc-His(-)A中,因该载体包含His标签和c-myc表位,后面可通过Western blot检测重组基因的表达,并通过镍柱亲和层析纯化重组蛋白。用含有NotⅠ和KpnⅠ酶切位点(序列下划线)的引物(IL22-cF和IL22-cR)扩增poIL-22,扩增的poIL-22片段和载体pcDNATM3.1/myc-His(-)A均用内切酶NotⅠ和KpnⅠ酶切,酶切片段用胶回收试剂盒纯化回收,再用T4DNA连接酶进行连接,然后使用Endo-free plasmid Kit试剂提取构建好的重组质粒。
2 结果
2.1 poIL-22基因的克隆与特征分析用引物IL22-F和IL22-R克隆了poIL-22全长DNA片段,如图1所示。对重组质粒pMD18T-IL22进行了测序可知poIL-22 cDNA大小为765 bp(GenBank登录号KX588234)。通过使用ORF finder软件进行分析如图2所示,poIL-22的ORF框架为573 bp,(A+T)%=49.04%,(C+G)%=50.96%。翻译起始位点(ATG)位于26,TAG终止密码子位于598。通过BioEdit软件检测到poIL-22的蛋白质序列,其为191个氨基酸。
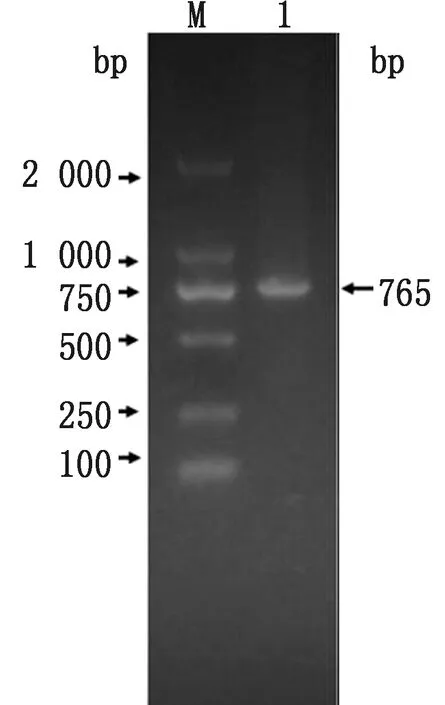
M.DL2000 DNA Marker;1.poIL-22

图2 poIL-22 cDNA的核苷酸和多肽序列
2.2 poIL-22基因的序列同源性比较如表2可见,poIL-22解链温度为84.92℃,(C+G)%为50.96%,将poIL-22 cDNA序列与来自各种物种的IL-22编码区的序列(CDS)进行比对,可见poIL-22的CDS与大多数大型陆生哺乳动物IL-22的序列相似性超过60.00%。
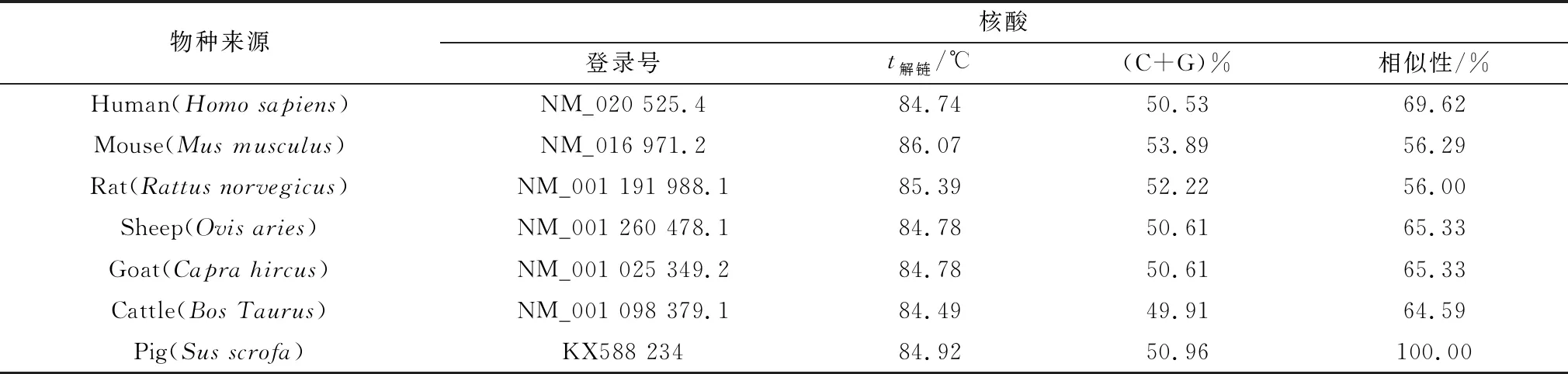
表2 IL-22序列参数
如表3可见,poIL-22与其他物种IL-22的相对分子质量、等电点、不稳定指数等具有高度的相似性,poIL-22中的负残基和正残基数基本在18~19之间,氨基酸脂肪族指数约100,平均亲水性(小于0)和不稳定性指数(约40),脂肪族指数值可以直接说明蛋白质的结构稳定性,脂肪族指数越高则表明结构越稳定。因此,poIL-22和其他IL-22蛋白是稳定的蛋白。总体平均亲水度值小于0表示该蛋白质中包含许多亲水残基,该蛋白质可能是亲水性蛋白质。小于40的不稳定性指数表明poIL-22是一种稳定的蛋白质。在pH 7.0时,poIL-22的肽带电荷为6.95,为中性酸。

表3 IL-22氨基酸参数
2.3 poIL-22的结构和功能磷酸化位点是信号蛋白功能所必需的,也可能影响大多数细胞因子的活性状态[11],糖基化是大多数真核细胞中常见的修饰反应,对于蛋白质的稳定性很重要[12]。如表4可见,poIL-22在功能域中包含8个磷酸化位点和3个糖基化位点(表3)。如图3可知,将poIL-22氨基酸序列上传到Proscan服务器以识别其功能域,可见其共享保守的IL-22结构域,氨基酸40~179。IL-22结构域由2对半胱氨酸,Cys40/Cys133、Cys90/Cys179组成。

蓝色块代表信号肽结构域,黄色块代表功能区;“N”和“C”字母代表蛋白质的左右末端;黑色突出显示的是保守的半胱氨酸
如图4A所示,poIL-22二级结构含有6个保守的序列结构位于α 螺旋处,在N端包含3条延伸链(β折叠),在C端含有1条螺旋链。在图中,显示出6个保守的序列结构域位于α螺旋处。表4中的磷酸化位点和糖基化位点也大多位于α螺旋处。因此,Asn54(Helix A)和Asn98(Helix C)的糖基化位点可能对稳定poIL-22结构有用。序列和结构的相似表明poIL-22和poIL-10可能与具有共同区域的特定受体结合。图4B显示了人IL-22的3D结构模型,该模型证实了与IL-10中的受体相互作用的Helix A和Helix F可能含有与受体相互作用的残基[13-14],先前的研究表明region 1(Asn21~Arg22)和region 6(Gly133~Glu134)中的位点在结合IL-10或IL-22受体中发挥了重要作用[15]。另外poIL-22还含有2对半胱氨酸(Cys),它们形成了2个分子内二硫键:Cys6~Cys100和Cys57~Cys146(图4C),2个键连接AE环和CF螺旋。二硫键的存在对于poIL-22的稳定性很重要,也有助于IL-22受体与poIL-22之间的特异性识别。
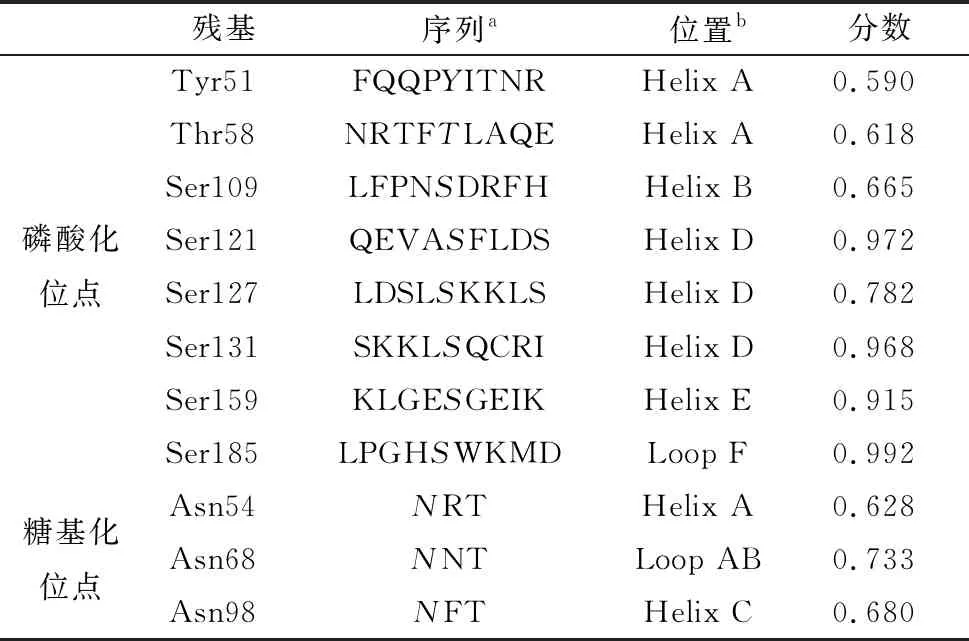
表4 poIL-22中预测的修饰位点 分数
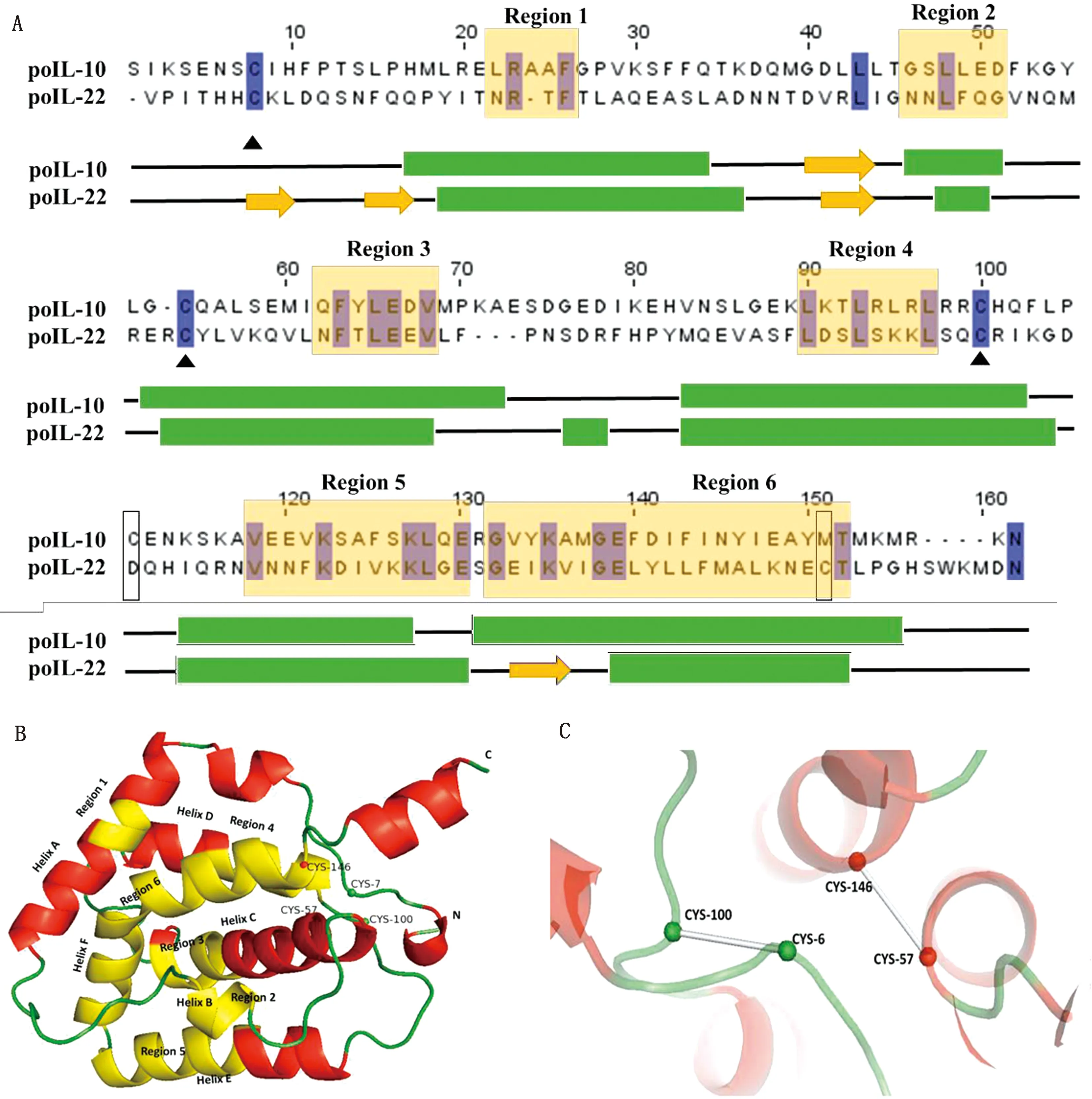
A.poIL-22 和poIL-10的二级结构(绿色方块标记代表poIL-22的6个螺旋(helix)区域;黄色块标记代表poIL-10的6个helix和1个折叠);B.人IL-22的3D结构模型(红色区域代表helix序列;黄色区域代表保守结构域);C.poIL-22的Cys及二硫键
2.4 系统发育树分析通过MEGA 7.0软件构建了poIL-22基因和其他物种IL-22基因之间的系统发育树,如图5所示,poIL-22基因与牛和绵羊的根系一致,与人和小鼠处于同一分支;与其他牲畜的IL-22在遗传上接近,与鱼类和家禽相距较远。
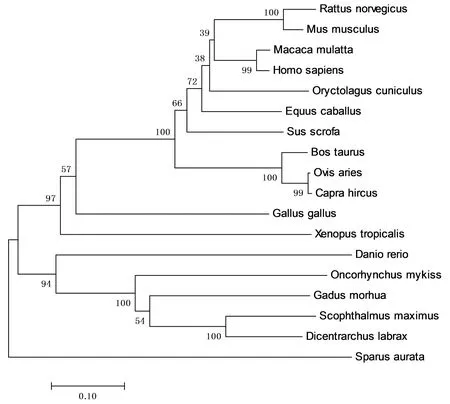
物种名称和GenBank登录号如下: Bos taurus(NM_001098379.1);Capra hircus(NM_001285758.1)1;Ovis aries(NM_001260478.1);Equus caballus(JL616449.1);Oryctolagus cuniculus(GBCK01073366.1);Homo sapiens(NM_020525.4);Macaca mulatta(NM_001194724.1);Mus musculus(NM_016971.2);Rattus norvegicus(NM_001191988.1);Gallus gallus(NM_001199614.1);Gadus morhua(FM207988.2);Dicentrarchus labrax(KJ818327.1);Oncorhynchus mykiss(NM_001164064.1);Scophthalmus maximus(JQ349070.1);Sparus aurata(JX976628.1);Xenopus tropicalis(NM_001142253.1);Danio rerio(NM_001020792.1)
2.5 poIL-22基因的基因组结构poIL-22基因的染色体位置和基因组结构如图6所示,通过BLAST程序将鉴定出的poIL-22 cDNA序列与猪基因组组装(Sscrofa 10.2)进行比较,结果显示,poIL-22 cDNA染色体的精确位置是猪5号染色体,poIL-22基因位于干扰素γ(IFN-γ)和线粒体分布与形态蛋白1(MDM1)之间,并靠近IFN-γ和IL-26。该研究还得出了poIL-22基因的5′侧翼序列和3′侧翼序列。并且图6中的3′侧翼序列显示poIL-22包含聚腺苷酸化信号(AATAAA)。
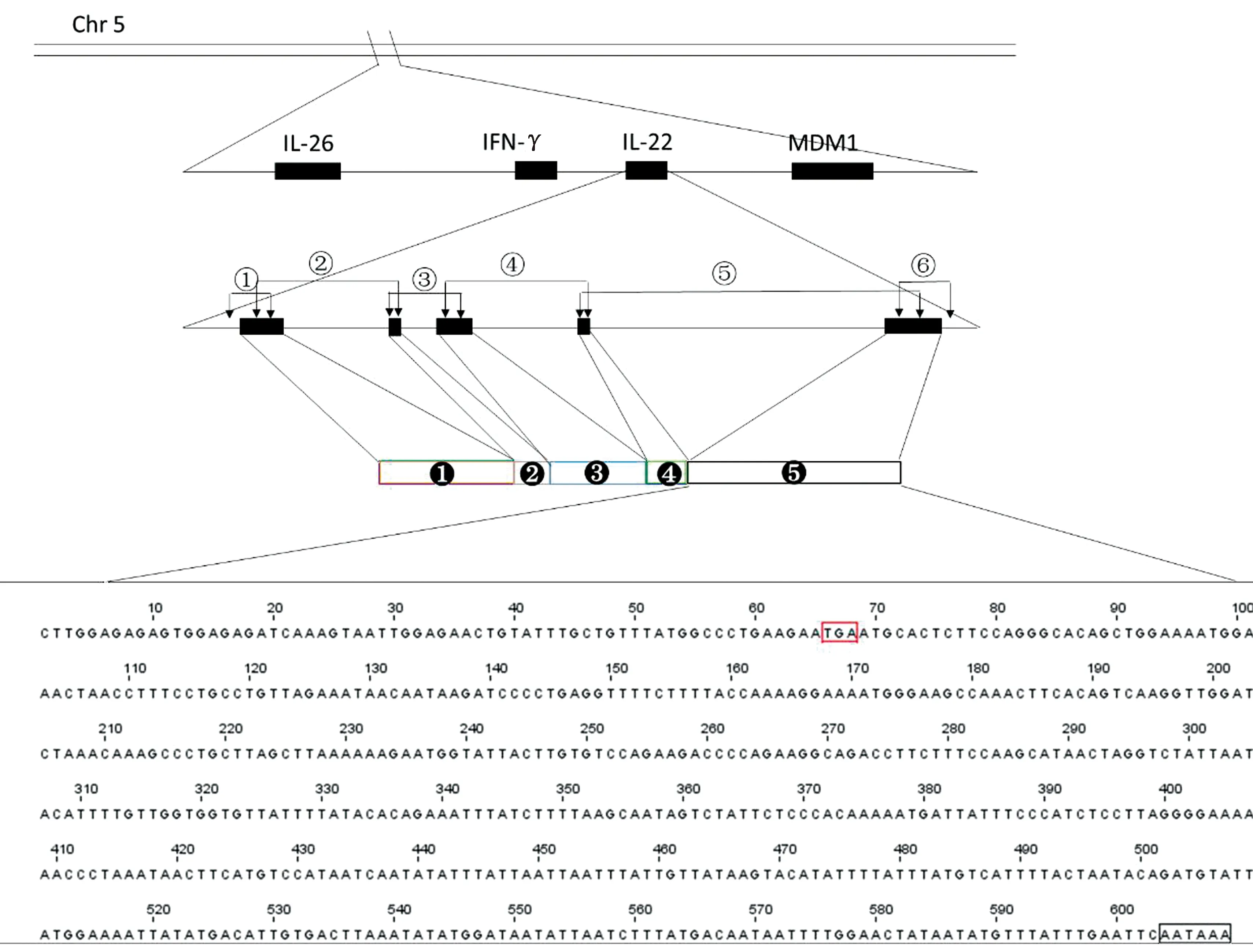
IL-26.白介素26; IFN-γ.干扰素γ; MDM1.线粒体分布和形态蛋白1;黑色方块.表示编码区域;带黑色圆圈的数字.表示外显子的数量;底部的序列.为poIL-22的3′侧翼序列;终止密码子和poly(A)尾部分别用红色和黑色标记
poIL-22的基因组与其他畜禽IL-22基因高度同源,如表5所示,猪与羊都是有5个外显子和4个内含子且大小相当,牛与马则有6个外显子和5个内含子,猪与羊的外显子2~5部分与牛与马的外显子3~6部分的结构相似,因此可以得出畜禽IL-22基因彼此具有相似的基因组结构。
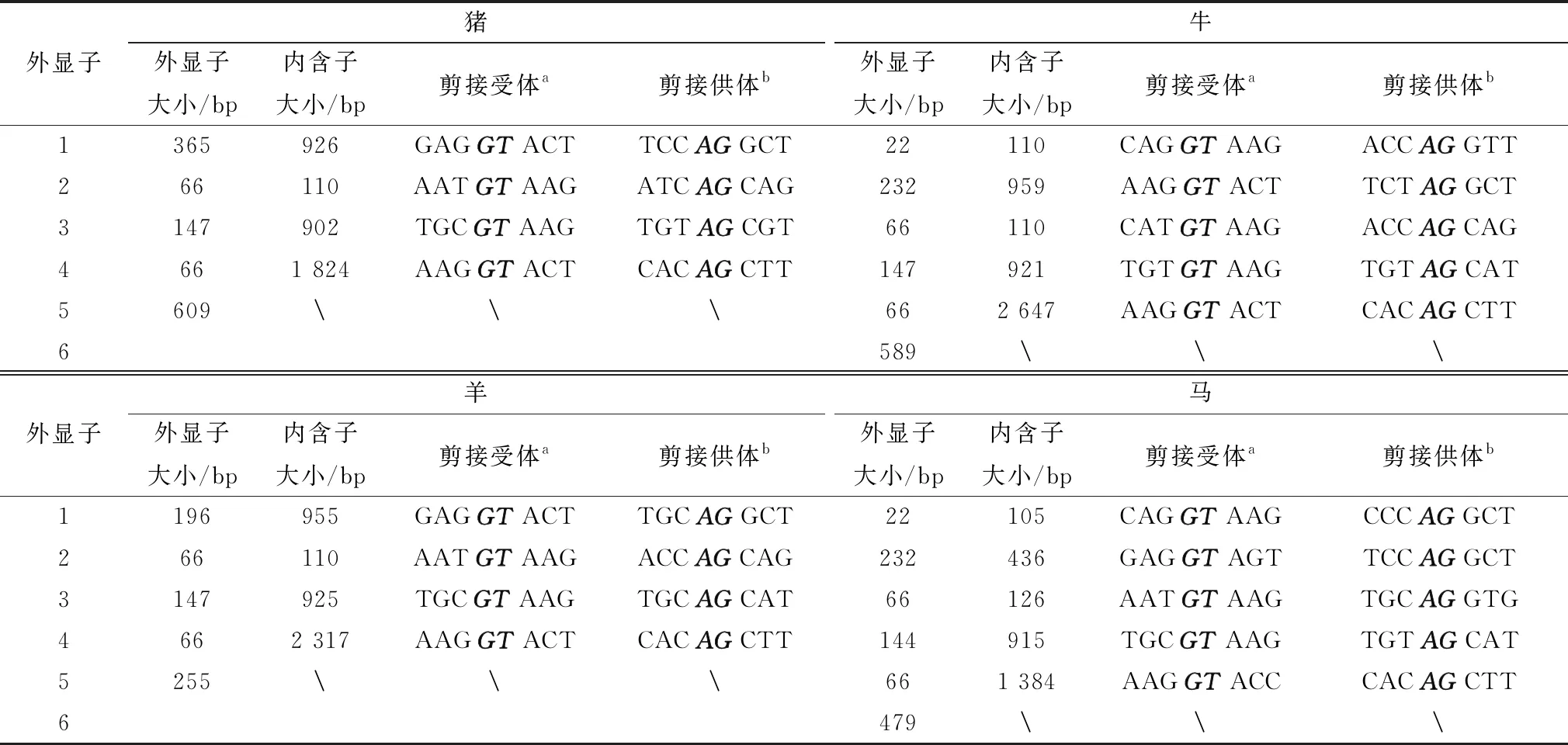
表5 猪、牛、羊、马的肝脏中IL-22基因外显子内含子大小
2.6 poIL-22 mRNA表达的组织分布如图7所示,poIL-22可在组织中广泛分布,其中在皮肤和心脏的水平最高,其次是脾脏、小肠和脑,而在其他组织中的水平较低。这表明poIL-22主要参与黏膜免疫(皮肤和小肠)和心血管系统(心脏和大脑)的功能。
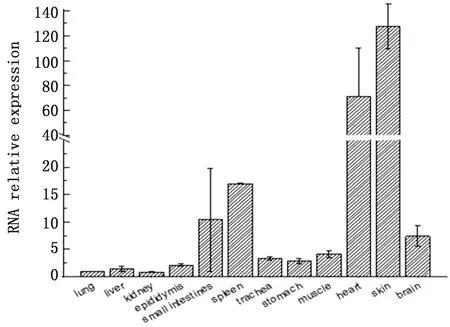
图7 poIL-22在组织分布情况
3 讨论
本研究成功克隆了一种新型的细胞因子poIL-22,并对其分子特征进行了研究,结果表明其相对分子质量约21 kDa,是一种稳定的亲水蛋白和碱性蛋白,其在皮肤、小肠、心脏、脑、脾脏等组织中也具有较高的水平。poIL-22基因与其它物种的IL-22一样,位于IFN-γ和IL-26基因座附近,也都具有高度保守的序列。
研究表明,IL-22在组织中的表达没有规律性。在低脊椎动物中,IL-22在鳕鱼腮中呈组成型表达,而在胆、性腺、头部和肾脏中表达水平很低[16],但在鲻鱼中,它主要在肾脏中表达,在肝脏、肠和脾脏中很少见[17]。青蛙中IL-22的表达虽然表现出多种模式,但仅在肠和脾脏中可以检测到[18]。在哺乳动物中IL-22的分布也不固定。在小鼠中,IL-22主要在肾脏、心脏、胸腺和脑中检测到[1]。因此,IL-22的组织分布不稳定似乎表明IL-22在各种动物中没有固定的功能。如上所述,poIL-22在心血管系统,特别是胚胎期中,可能还具有免疫功能以外的功能。试验结果也表明了IL-22在黏膜免疫中的重要作用。在哺乳动物中,T细胞的种类(包括Th17细胞,γδ T细胞和NK T细胞)被确定为IL-22的主要表达形式[4,19]。因此,在胃肠道等黏膜中的高表达可能表明T细胞可以调节IL-22的稳态。虽然在人类或其他低等脊椎动物物种IL-22中已经报道了类似的结果,但在畜禽IL-22中仍然很少见。本试验结果显示poIL-22在猪各组织中均有表达,在黏膜组织皮肤和小肠中具有较高的表达量,在胸腺、肌肉、心脏、脑等也有很高的表达量,而在肝脏中表达量较低,这表明poIL-22可能主要对心血管系统和黏膜的功能发挥作用。
本试验研究表不仅可以为poIL-22作为免疫佐剂的使用提供可靠的证据,而且有助于了解IL-22对家畜的保护机制。
