LPS处理奶牛乳腺上皮细胞后外泌体中差异miRNA分析
2022-01-25张天琦许浩天赵文苹李思妍王建发
张天琦,许浩天,赵文苹,李思妍,连 帅,王建发,武 瑞
(黑龙江八一农垦大学 动物科技学院 黑龙江省牛病防制重点实验室,黑龙江 大庆 163319)
奶牛乳腺既是合成牛乳的唯一场所,也是牛体重要疾病高发组织,由于奶牛乳腺组织具有独特的结构、生理功能和组织微环境,含有独特的细胞亚群和功能分子,面临多种致病微生物的威胁,从而形成了独特的区域免疫特性[1]。乳腺上皮细胞是细菌感染与乳腺免疫的初始交汇处。在这个初始交汇处,乳腺上皮细胞既是抵御病原微生物入侵的天然屏障,同时也启动了机体对病原微生物最早的免疫识别和免疫应答,并发挥了协调后续免疫分子、免疫细胞应答的重要作用[2]。外泌体是细胞主动向胞外分泌的大小均一的囊泡样小体,可借助内部包裹的miRNA等成分,影响细胞迁移、免疫应答、炎症反应等生物过程[3]。奶牛乳腺感染时上皮细胞外泌体分拣的miRNA可能发生改变,进而影响乳腺炎症的发生发展过程。系统研究乳腺感染时乳腺上皮细胞外泌体miRNA变化,将有助于全面认识乳腺感染时乳腺上皮细胞的第一道防线作用,对科学防控奶牛乳腺疾病具有重要意义。
SUN等[4]研究发现,金黄色葡萄球菌感染奶牛后,乳汁外泌体中包裹的14种miRNA发生改变,其中bta-miR-2285g-3p、378b、502b、396-5p等显著上调,bta-miR-223、142-5p、1246、10a等显著下调。JIN等[5]比较了大肠杆菌和金黄色葡萄球菌感染奶牛乳腺上皮细胞后miRNA表达模式变化情况,发现大肠杆菌感染后bta-miR-2339、499、23a和99b发生了显著变化,金黄色葡萄球菌感染后bta-miR-184、24-3p、148、486和let-7a-5p发生了显著变化[5]。LUORENG等[6]研究了感染大肠杆菌、金黄色葡萄球菌对奶牛乳腺组织中miRNA表达模式的影响,认为bta-miR-144、451和7863可作为奶牛乳腺大肠杆菌、金黄色葡萄球菌的标志性miRNA。ZHANG等[7]鉴定出奶牛乳腺上皮外泌体中存在638种蛋白质,使用蛋氨酸和雌二醇刺激乳腺上皮细胞后所产生外泌体中6种蛋白的表达量增加。前述研究主要关注乳腺感染时,乳腺组织整体、乳腺上皮细胞内和乳汁外泌体miRNA变化情况,奶牛乳腺感染时乳腺上皮细胞的第一道防线作用仍未被充分揭示。
本研究利用超速离心法分离脂多糖(LPS)处理奶牛乳腺上皮细胞外泌体,利用多种外泌体表征方法对外泌体进行表征,利用高通量测序和分析方法筛选了LPS刺激奶牛乳腺上皮细胞后外泌体中差异miRNA,预测量差异miRNA的靶基因及其功能聚类,旨在分析乳腺感染时乳腺上皮细胞外泌体中miRNA变化,为系统认识奶牛乳腺感染时乳腺上皮细胞的免疫防御机制提供研究依据。
1 材料与方法
1.1 奶牛乳腺上皮细胞处理方法按照实验室前期研究[8],采用酶消化法分离鉴定奶牛乳腺上皮细胞(DCMECs)。将DCMECs接种于24孔细胞培养板,培养至80%融合后,取出细胞培养板,去除培养基,PBS清洗细胞后每孔分别加入含LPS(宝信生物)质量浓度为0,5,10,25,50,100 mg/L的培养基,孵育不同时间,进行细胞毒性检测(MTT,碧云天)和细胞形态学观察,确定LPS的刺激浓度和刺激时间。
1.2 奶牛乳腺上皮细胞透射电镜观察方法将生长在盖玻片或聚苯乙烯盖片上的单层细胞取出,置青霉素瓶内,用4℃ PBS缓冲液漂洗3次。2%冷的戊二醛固定30 min,冷PBS缓冲液漂洗3次,1%锇酸固定30 min,PBS缓冲液漂洗过夜。脱水、渗透后将明胶囊装满混合包埋剂,倒盖在单层细胞上,60℃固化2 h,分离盖片与包埋剂,透射电镜(日立H-7650)观察细胞器形态结构变化和细胞外囊泡数量。
1.3 奶牛乳腺上皮细胞外泌体分离方法使用超速离心法分离细胞外泌体,简要步骤如下:将乳腺上皮细胞培养上清分装于50 mL离心管内;按照300×g10 min、2 000×g10 min、10 000×g30 min、100 000×g70 min、再次100 000×g70 min 程序低温超速离心(贝克曼库尔特),用100 μL PBS缓冲液重悬沉淀。将收集到的样品转移到1.5 mL的离心管中,-80℃冰箱中保存备用。
1.4 外泌体形态学鉴定方法取5 μL外泌体样品,用PBS稀释至25 μL,滴加于有碳涂层的铜网上沉淀1 min,滴加3%的磷钨酸溶液30 μL,用滤纸从边缘处吸去多余的液体,干燥2 min。用透射电子显微镜(日立H-7650)进行成像,观察外泌体形态。
1.5 外泌体RNA提取、文库构建和测序使用苯酚/氯仿萃取法提取外泌体中总RNA,采用TruSeq RNA Sample Prep Kit试剂盒构建小RNA文库(Illumina),用生物分析仪(安捷伦2100)进行文库质检。利用Quant-iT picoGreen dsDNA Assay Kit试剂盒(赛默飞世尔)对文库进行定量,采用HiSeq 2500测序仪(Illumina)Hiseq Single-End模式测序,获得样品中总RNA的序列原始数据。
1.6 RNA测序数据分析序列原始数据分析:采用去接头软件去除接头序列(派森诺基因),过滤序列用于后续分析。对序列长度在18~36 nt之间的过滤后数据进行统计。对单样品内完全相同的序列进行去重复处理并统计序列丰度。
miRNA 序列比对和注释:利用miRDeep2软件(德国马克斯·德尔布吕克研究所),结合miRBase数据库(http://www.mirbase.org/)进行去重复序列与参考基因组序列间的比对。将去重序列比对到本物种在miRBase库中的成熟miRNA和前体miRNA序列。
新miRNA预测:使用mireap软件分析未注释到任何信息的序列,并进行新miRNA预测分析。
差异表达分析:根据各样品中miRNA的表达量数据,采用DESeq(德国马克斯·德尔布吕克研究所)对miRNA进行差异分析,并按照表达量倍数差异(|fold change|>2)和表达差异显著性(P<0.05)筛选出差异的保守miRNA。
1.7 差异miRNA靶基因预测及GO和KEGG富集分析使用miranda数据库(http://www.microrna.org/),以牛mRNA的3′UTR序列为目标序列,对差异表达的miRNA序列,进行靶基因预测。利用Gene Ontology数据库(http://geneontology.org/)分析差异miRNA靶基因富集于何种生物功能。利用KEGG Pathway数据库(http://www.genome.jp/kegg/)分析差异miRNA靶基因富集于何种信号通路。
2 结果
2.1 LPS刺激浓度和刺激时间筛选如图1A所示,乳腺上皮细胞活力随着LPS刺激浓度的增加而逐渐降低,10 mg/L质量浓度的LPS刺激24 h后,乳腺上皮细胞活力与对照组相比极显著降低(P<0.01)。采用10 mg/L的LPS处理乳腺上皮细胞6 h 后,用透射电镜法观察乳腺上皮细胞内部结构的变化情况。由图1B可见,10 mg/L的LPS处理乳腺上皮细胞6 h,对其线粒体结构、细胞核结构、高尔基体结构均无明显影响,但乳腺上皮细胞外泌体(黑色箭头)分泌数量减少。结合上述结果,后续研究使用10 mg/L的LPS处理乳腺上皮细胞6 h后收集细胞培养上清并提取外泌体。
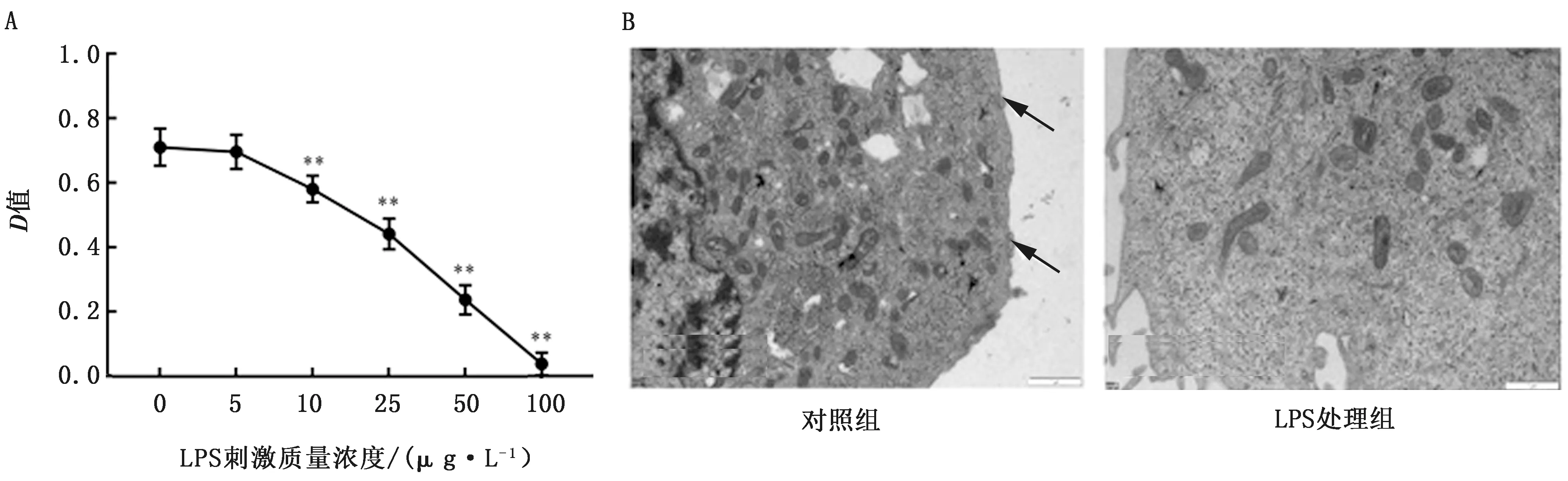
A.不同浓度LPS孵育24 h后对奶牛乳腺上皮细胞活力的影响;B.LPS处理6 h后奶牛乳腺上皮细胞电镜观察结果(×6 000),黑色箭头所指为外泌体
2.2 外泌体鉴定采用透射电镜对所提取样品形态进行观察,由图2可见,2组外泌体大小均一,直径均在40~150 nm之间,呈圆形或椭圆形的茶托样膜泡结构,符合外泌体的形态学特征。
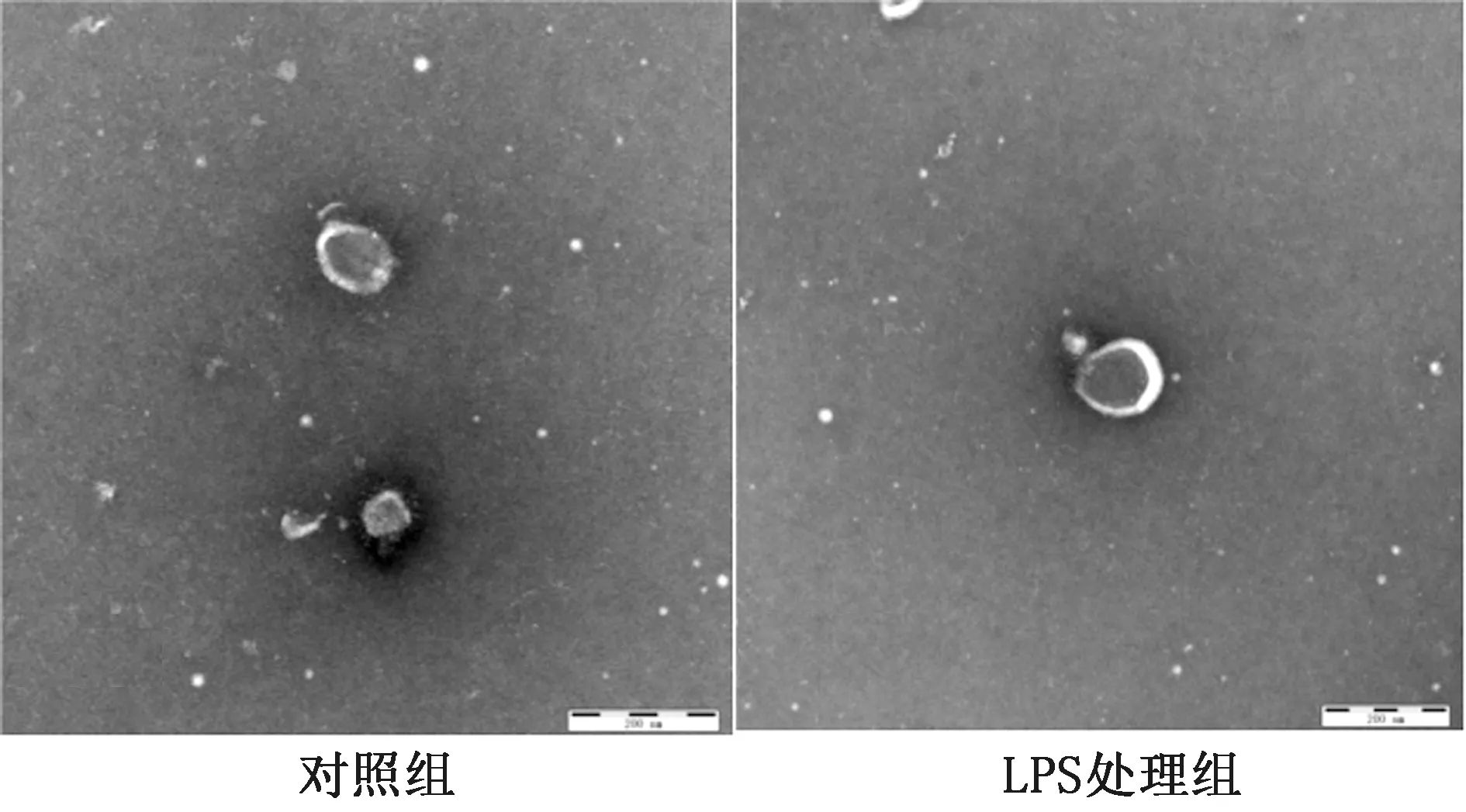
图2 外泌体透射电镜形态学鉴定结果(标尺为200 nm)
2.3 RNA测序过滤去除重复序列后,对照组外泌体序列数为11 926 357,LPS处理后外泌体序列数为12 349 937。将过滤后miRNA序列与miRBase数据库中牛类成熟miRNA和前体miRNA序列进行比较,发现对照组外泌体中含有400种牛成熟miRNA和443种牛前体miRNA,LPS处理后外泌体中含有189种牛成熟miRNA和204种牛前体miRNA。证实LPS刺激奶牛乳腺上皮细胞后外泌体中分拣的miRNA数量显著减少。此外,LPS刺激奶牛乳腺上皮细胞后外泌体中分拣的核仁小RNA(snoRNA)和核小RNA(snRNA)数量也大幅减少,但分拣的rRNA和tRNA数量增加,包含的未知功能的RNA数量也较对照组增多。使用软件mireap对上述结果中未注释的序列进行新miRNA预测,共预测到新miRNA 124种。
2.4 差异miRNA分析利用DESeq软件对差异表达的miRNA进行分析,比较正常奶牛乳腺上皮细胞分泌外泌体和LPS刺激乳腺上皮细胞后外泌体中miRNA表达情况。由表1可见,LPS刺激后,外泌体中共有43个表达差异的miRNA,其中miR-125a、125b、205、451等21个miRNA显著上调,miR-11987、11977、133a、2285aw等23个miRNA显著下调。

表1 LPS刺激乳腺上皮细胞后外泌体中 主要差异miRNA信息
2.5 差异miRNA靶基因分析43个差异表达miRNA对应43 784个靶基因,其中miR-451的靶基因最少,只有168个,miR-15b的靶基因最多,有1 975个,表2为选取的部分高评分值miRNA靶基因。由表可见,预测的差异miRNA靶基因主要包括活化白细胞黏附分子(CD166)、Ig样细胞黏附分子(Ig-CAM)、免疫球蛋白基因超家族成员5(IGSF5)、血小板生成素(THPO)、类血管动蛋白-2、电压门控性钾通道E1(KCNE1)、β-羟丁酸脱氢酶(3HBDH)等与白细胞黏附、免疫应答、血管通透性、酮体代谢功能有关的基因。

表2 LPS刺激乳腺上皮细胞后外泌体中主要差异miRNA靶基因信息
将差异miRNA靶基因进行GO与KEGG pathway显著性富集分析,可见其靶基因主要参与蛋白结合、代谢过程、细胞通讯调节等生物过程(图3),靶基因主要参与癌症中的转录失调、肿瘤坏死因子信号通路、Th17细胞分化和调节机制、磷脂酰肌醇信号系统、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路(图4)。
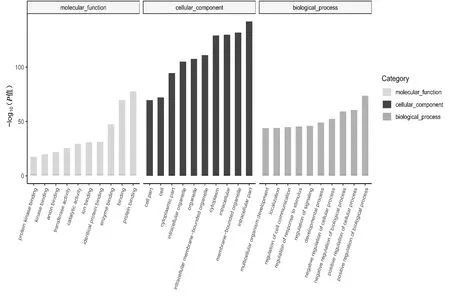
图3 差异miRNA靶基因GO分析
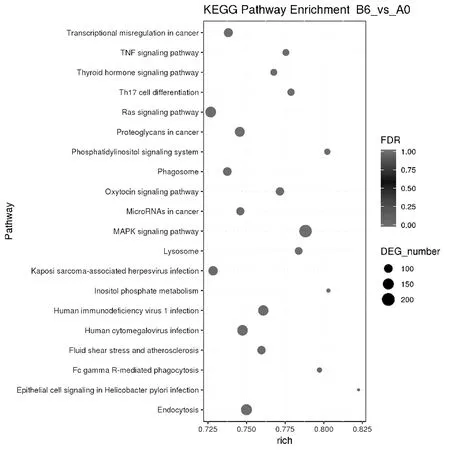
图4 差异miRNA靶基因KEGG通路分析
3 讨论
以往对乳汁外泌体的研究普遍关注其对人体免疫功能或幼畜发育的影响[9-12],未见乳腺上皮细胞外泌体调控动物本身免疫功能的报道。本研究所分离外泌体粒径较ZHANG等[7]分离的奶牛乳腺上皮细胞外泌体粒径(平均小于50 nm)更大。国际上将由多囊泡体与细胞膜融合形成的直径为30~200 nm 的细胞外囊泡称为外泌体[13]。因此,本研究分离的样品更符合外泌体粒径的分类标准。LPS刺激间充质干细胞后外泌体分泌量增加[14],本研究发现LPS刺激奶牛乳腺上皮细胞后,外泌体浓度及其分拣miRNA种类减少,这可能与乳腺上皮细胞属于分泌型细胞的特性有关,确切机制仍需进一步研究。
本研究发现,LPS刺激乳腺上皮细胞后外泌体中23个miRNA显著下调。其中,miR-125a可以通过靶向趋化因子4基因抑制人血管平滑肌细胞炎症小体NLRP3[15],而LPS可以激活NLRP3炎症小体进而诱导牛乳腺上皮细胞炎症性坏死[16]。miR-125a上调可能与抑制NLRP3炎症小体诱导的炎症性坏死有关。miR-125b存在于人乳汁和牛奶中,LPS刺激牛单核细胞后可上调miR-125b表达[17],牛感染副结核分枝杆菌6个月后血清中miR-205表达量提高2倍[18],提示miR-125b、205可能与牛抗炎免疫功能相关。金黄色葡萄球菌感染奶牛乳腺组织miR-451、144表达量上调,而大肠杆菌感染奶牛乳腺组织miR-451、144表达量下调[6],推测可能与外泌体分拣miR-451、144量增多有关。在23种显著下调的miRNA中,miR-133a具有较广泛的生物学功能,可调控牛背最长肌发育[19],在热应激和脂肪组织能量代谢平衡调控过程中发挥重要作用[20-21]。本研究发现LPS刺激乳腺上皮细胞后外泌体中bta-miR-133a分拣量下调,可能与乳腺上皮细胞脂代谢功能改变有关,确切机制仍需进一步研究。
在主要差异miRNA可能的靶基因中,CD166是一种属于免疫球蛋白受体超家族的细胞表面黏附分子,可并促进肿瘤微环境中上皮间质转化过程[22]。miR-148a下调表达4.6倍可促进CD166表达,这可能与乳腺炎症过程中的上皮间质转化过程有关。THPO又称巨核细胞生长衍生因子,对巨核细胞的生长分化和血小板生成具有刺激作用。在炎症过程中,活化的血小板与中性粒细胞结合后可以促进中性粒细胞的黏附、迁移和胞外诱补网的形成功能[23]。因此,miR-15b、205、34a、34b可能共同靶向THPO基因,进而调控中性粒细胞功能。3HBDH是从球形红杆菌中提取的一种酶,可以使β羟丁酸脱氢[24],miR-125a和125b上调可抑制3H-BDH表达,这可能与乳腺上皮细胞脂代谢功能改变有关。
MAPK通路是细胞增殖、应激、炎症、分化、凋亡等信号转导通路的共同交汇通路之一[25]。差异miRNA靶基因聚类于MAPK通路可能与LPS引发的乳腺上皮细胞炎症有关。内吞作用是通过质膜的变形运动将细胞外物质转运入细胞内的过程[26],所预测差异miRNA靶基因聚类于内吞通路可能与外泌体的形成过程有关。RAS信号传导途径是起始于酪氨酸激酶受体的一种重要的细胞信号传导方式,Ras通过催化其效应底物来调节一系列与细胞生长、分化、凋亡有关的重要功能[27],所预测差异miRNA靶基因聚类于RAS通路可能与LPS引发的乳腺上皮细胞状态改变有关。
此外,本研究还对乳腺上皮细胞外泌体中的新miRNA进行了预测,累计预测出124种符合新miRNA特征的序列。这些研究为进一步分析乳腺感染时乳腺上皮细胞外泌体中miRNA的功能作用提供了基础。
