不同断奶时间对羔羊瘤胃组织形态和真菌群落结构的影响
2022-01-25李海琴贾建磊侯生珍
李海琴,贾建磊,侯生珍
(青海大学 农牧学院,青海 西宁 810016)
反刍动物拥有复杂多样的瘤胃微生物,不仅能有效的降解纤维和半纤维素,为反刍动物提供能量,其自身还能合成复合性维生素B、必需氨基酸。瘤胃微生物的存在对于反刍动物营养物质的利用和吸收至关重要[1-2]。瘤胃真菌在纤维组织的降解中扮演着重要的角色:在降解纤维性饲料时能产生多种水解酶,如纤维素酶、半纤维素酶、酯酶、漆酶和纤维小体等[3-4],同时真菌丰富的假根系统能够穿透植物饲料,在物理破坏的作用下将体积较大的饲料分解为小片段,为纤维降解酶、细菌等提供更多的附着点,加快降解速率。有研究发现真菌在纯培养时降解纤维的能力比那些利用抗生素驱除细菌后得到的真菌降解纤维的能力要强[5]。
新生羔羊瘤胃微生物区系还未建立,瘤胃不具备发酵功能。羔羊断奶前后是瘤胃功能及结构发育的主要阶段。断奶羔羊从母乳饲喂到采食固体饲料,瘤胃组织结构和微生物区系会发生显著变化。羔羊采食固体饲料,饲料在瘤胃中发酵的产物丁酸盐、丙酸盐等刺激瘤胃上皮发育,同时外来微生物随饲料进入瘤胃内[6]。随着羔羊日龄的逐渐增加,羔羊瘤胃内菌群从兼性厌氧菌发展转变为以厌氧菌为主,瘤胃内的微生物区系逐渐趋向于成熟[7]。羔羊过早断奶,接触固体颗粒饲粮后会由于断奶及含植物蛋白质饲粮等应激阻碍瘤胃的生长发育[8];断奶过晚,母乳喂养难以满足羔羊快速发育对营养物质的需求。适宜的断奶时间既有利于瘤胃生长发育和微生物区系的建立,又可以降低饲料来源不同对营养物质摄入的影响,提高绵羊的生长性能。
本研究选择30,40,50日龄(d) 3个断奶时间,通过研究断奶时间对羔羊瘤胃组织形态的及羔羊瘤胃真菌组成及多样性的影响,为青海省海东地区主要绵羊品种(小尾寒羊)羔羊的适宜断奶时间以及瘤胃微生物构建提供理论依据。
1 材料与方法
1.1 试验设计选择体质量(3.17±0.52) kg、体况、胎次相近的青海省海东地区小尾寒羊双胎羔羊120只,采用单因素试验设计,随机分为3组,每组40只;分别于30,40,50 d断奶,断奶后采用相同能量、蛋白水平日粮饲养至90 d,日粮组成及营养水平见表1。

表1 羔羊日粮配和及营养水平(干物质基础) %
1.2 饲养管理所有实验动物从出生后7 d开始饲喂开食料,饲粮营养水平同上(精饲料)。断奶羔羊每天每只初始饲喂量见表2,所有羔羊每日饲喂量相同,每5 d按比例增加饲喂量(精饲料∶青贮玉米∶燕麦干草=7∶2∶1,干物质计算),其中精料每次每只羔羊增加0.015 kg。每天饲喂2次(8:00和17:00),自由饮水。羔羊在进入圈舍之前进行全面消毒,饲养过程重每天清扫圈舍。所有试验羔羊均进行免疫注射和内外寄生虫的防治。
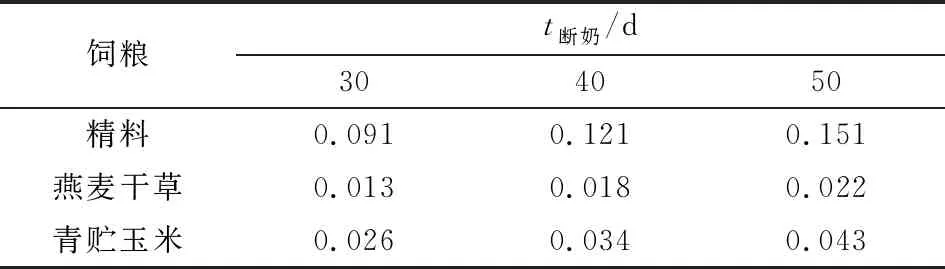
表2 羔羊饲粮饲喂量(干物质基础) kg
1.3 样品采集所有羔羊在断奶前测体质量并做好记录,饲养至90 d后,每组随机选择6只羔羊再次测体质量,早上空腹,颈动脉放血屠宰后,解剖,取出瘤胃内容物用匀浆机混匀,取上层液体4层纱布过滤,将滤液装于5 mL冻存管中,液氮带回实验室-80℃冷冻保存,用于后期瘤胃细菌多样性的测定。瘤胃组织用生理盐水清洗后,取瘤胃背囊组织样品各4 cm2,放置于4%多聚甲醛中进行固定,用于组织形态学的观察。
1.4 样品分析瘤胃组织在固定液中固定72 h,然后在不同浓度的葡萄糖溶液中下脱水,包埋剂冷冻包埋,切取5~7 μm连续切片,用苏木精和伊红(HE)染色,观察乳头高度、乳头宽度、黏膜层厚度和肌层厚度。使用Olympus DP21图像采集。使用Image-Pro Plus 5.1 图像分析系统进行测量。每一个样本进行3张非连续性切片的观察,每张切片选取3个视野,每个视野中测定5组试验数据。瘤胃乳头的密度测定:使用解剖显微镜对平方厘米瘤胃组织样品瘤胃乳头直接计数,每个羔羊选择6个组织样本计数。
瘤胃真菌的测序工作外包给百迈克生物公司(北京,中国)。每组选择6只试验动物,提取DNA以后,根据真菌18S rDNA基因的ITS1区域,通过引物,序列为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;2043R:5′GCTGCGTTCTTCAT-CGATGC-3′。根据保守区设计得到引物,在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行测序。
1.5 数据分析通过Excel 2013对数据进行初步整理,应用SAS 9.0软件,采用Kruskal-Wallis对数据进行分析,P<0.05表示差异显著。
2 结果
2.1 断奶时间对羔羊体质量及平均日增重的影响由图1可知羔羊在断奶时3组羔羊体质量差异不显著(P>0.05);所有羔羊饲养至90 d测体质量,通过计算得出40 d 断奶组平均日增重显著高于其他2组(P<0.05),30 d断奶组与50 d断奶组间差异不显著(P>0.05)。
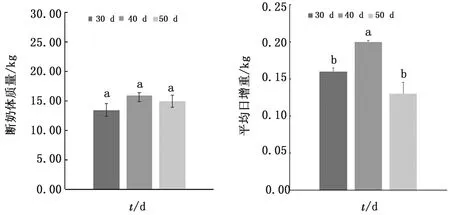
图1 断奶时间对羔羊体质量的影响
2.2 断奶时间对羔羊瘤胃组织形态发育的影响由表3可知,羔羊瘤胃乳头高度40 d断奶组羔羊显著高于30 d断奶组(P<0.05),50与30,40 d断奶组差异均不显著(P>0.05);乳头宽度、密度3组差异不显著(P>0.05);角化层厚度40 d断奶组显著低于30 d(P<0.05),50 d断奶组与30,40 d差异不显著(P<0.05);瘤胃肌肉层40 d断奶组显著高于50 d(P<0.05),30 d断奶组与40,50 d差异不显著(P>0.05)。

表3 断奶时间对羔羊瘤胃组织形态的影响
2.3 瘤胃真菌 OTUs比较使用QIIME[9](version 1.8.0)软件中的 UCLUST[10]对Tags在97%的相似度水平下进行聚类、获得OTU,利用Venn图展示样品之间共有、特有 OTU 数目如图2,3组共有OTUs 178个;40 d断奶组(B区)羔羊特有OTUs最多,50 d(C区)断奶组次之,30 d(A区)断奶组最少。
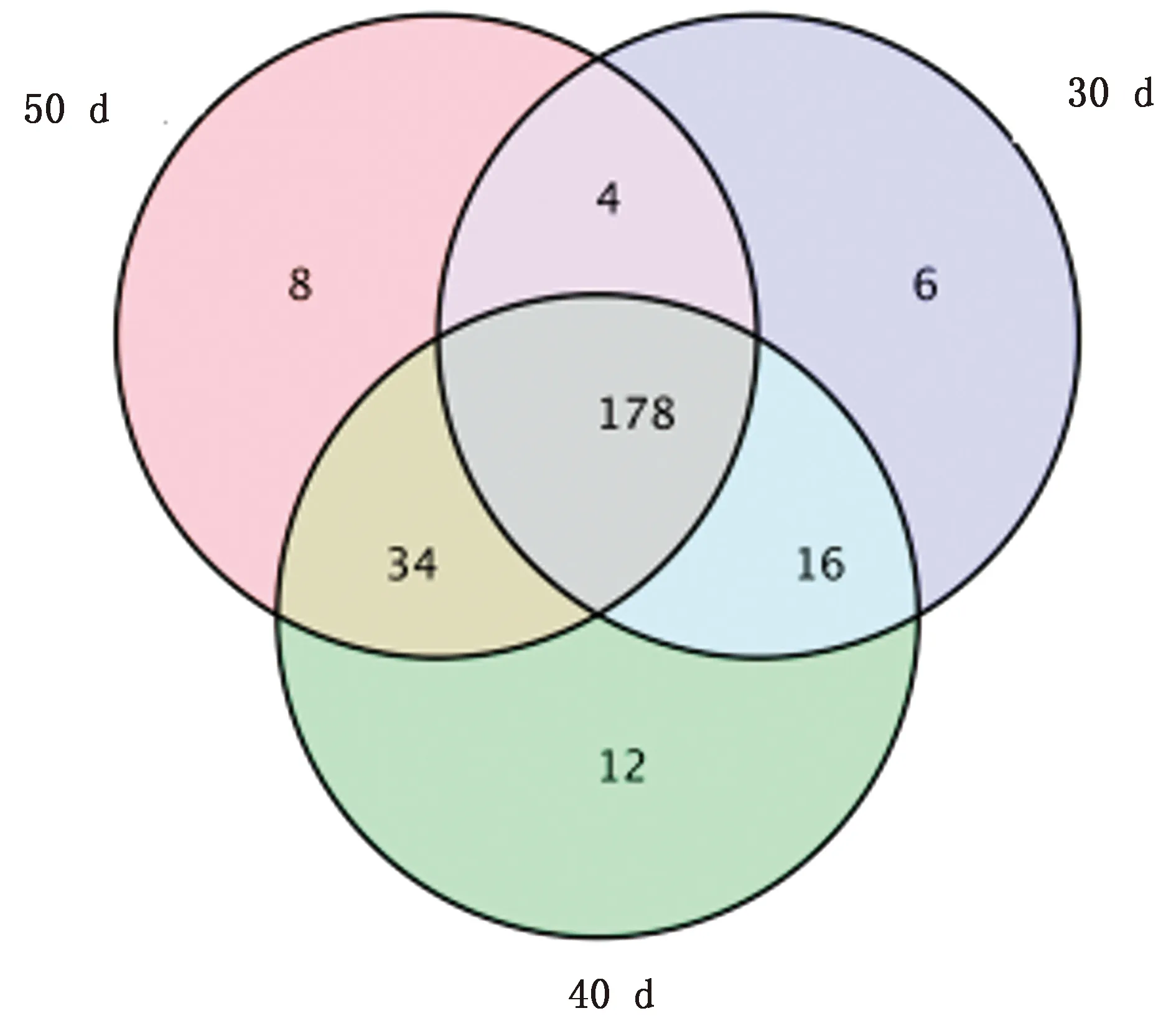
图2 不同断奶时间羔羊瘤胃液真菌Venn 图
2.4 PCA分析基于UniFrac加权主坐标分析表明,3个断奶时间组聚类于不同的坐标位置,不同断奶时间对于瘤胃微生物(细菌)的菌落的发育有影响。
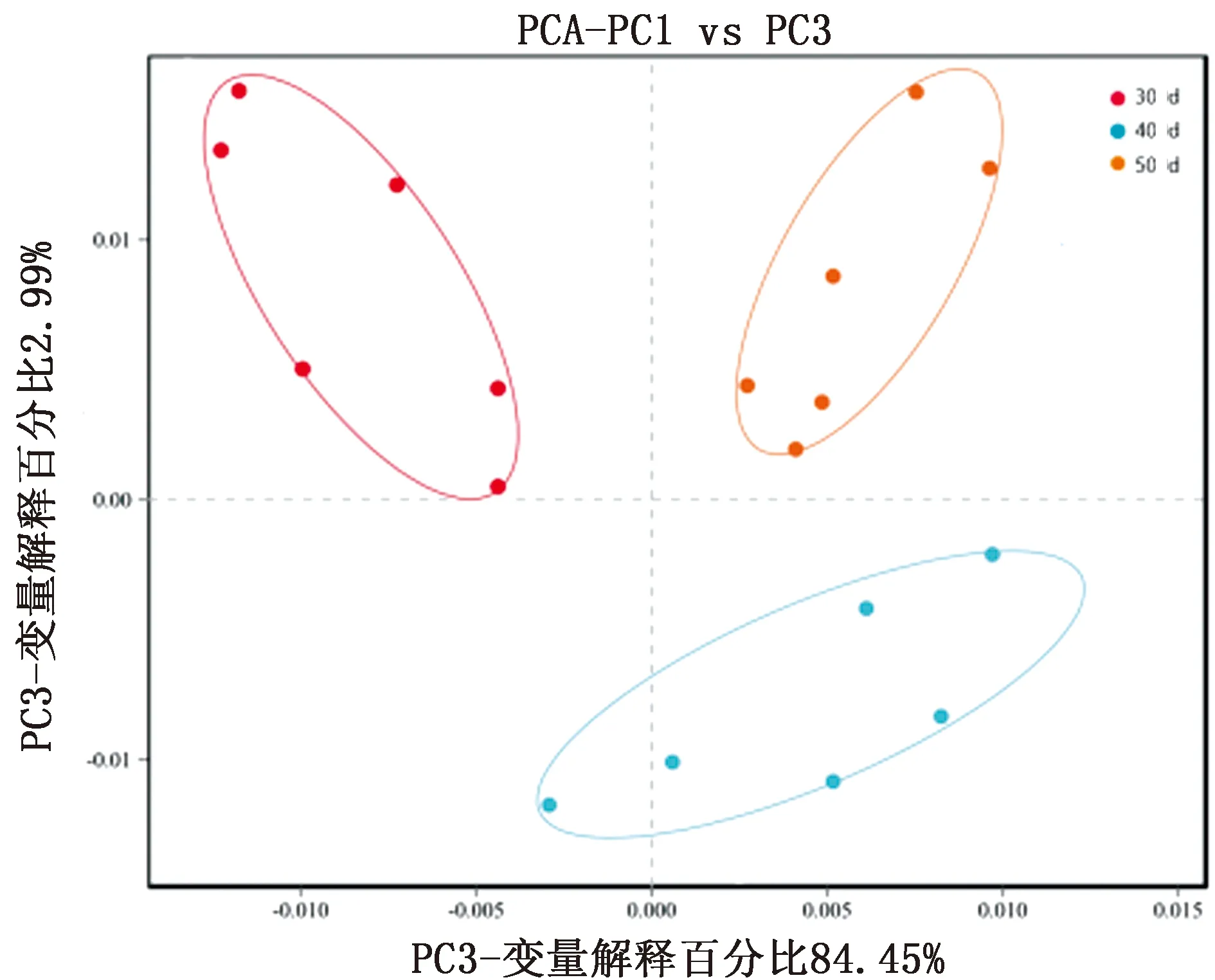
图3 Unifrac 加权主坐标分析图
2.5 Alpha 多样性分析从表4中可知40 d断奶组ACE指数和Chao1指数均显著高于30 d,50和30,40 d断奶组差异不显著(P>0.05)。多样性指数中Shannon 指数40 d断奶组显著高于30 d组(P<0.05),50和30,40 d断奶组差异不显著(P>0.05)。Simpson 指数40 d断奶组显著低于30 d组(P<0.05),50和30,40 d断奶组差异不显著(P>0.05)。

表4 样品多样性指数
2.6 瘤胃真菌菌群结构差异变化分析
2.6.1门水平 从表5中可知,羔羊瘤胃液在门水平共检测出6个菌门,其中子囊菌门(Ascomycota)是3组羔羊瘤胃液优势菌门。30 d断奶组Ascomycota丰度显著高于40 d断奶组(P<0.05),50 d断奶组与30,40 d断奶组差异均不显著(P>0.05); 担子菌门(Basidiomycota)、丝足虫门(Cercozoa),40 d 断奶组显著高于30 d组(P<0.05),50 d断奶组与30,40 d断奶组差异均不显著(P>0.05)。
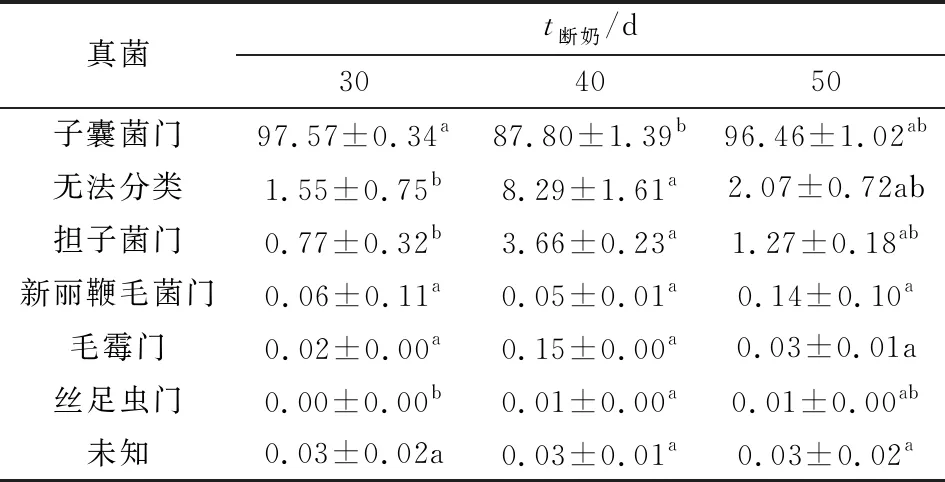
表5 瘤胃真菌菌群在门水平物种丰度表
2.6.2属水平 3组羔羊属水平丰度前10的真菌见表6,由表可知德巴利酵母属(Debaryomyces)、青霉属(Penicillium)为本研究优势菌,德巴利酵母属(Debaryomyces)30 d断奶组显著高于40 d组(P<0.05),50 d断奶组与30,40 d断奶组差异均不显著(P>0.05)。Penicillium、小不整球壳属(Plectosphaerella)、Boeremia、新刺毛茎点霉属(Neosetophoma)40 d断奶组均显著高于30 d组,50 d断奶组与30,40 d断奶组差异均不显著(P>0.05)。沃德霉属(Wardomyces)40 d显著高于50 d断奶组(P<0.05)。30 d断奶组与40,50 d断奶组差异不显著显(P>0.05);帚枝霉属(Sarocladium)、毕赤酵母属(Pichia)、麦角菌属(Claviceps) 3组间差异不显著(P>0.05)。
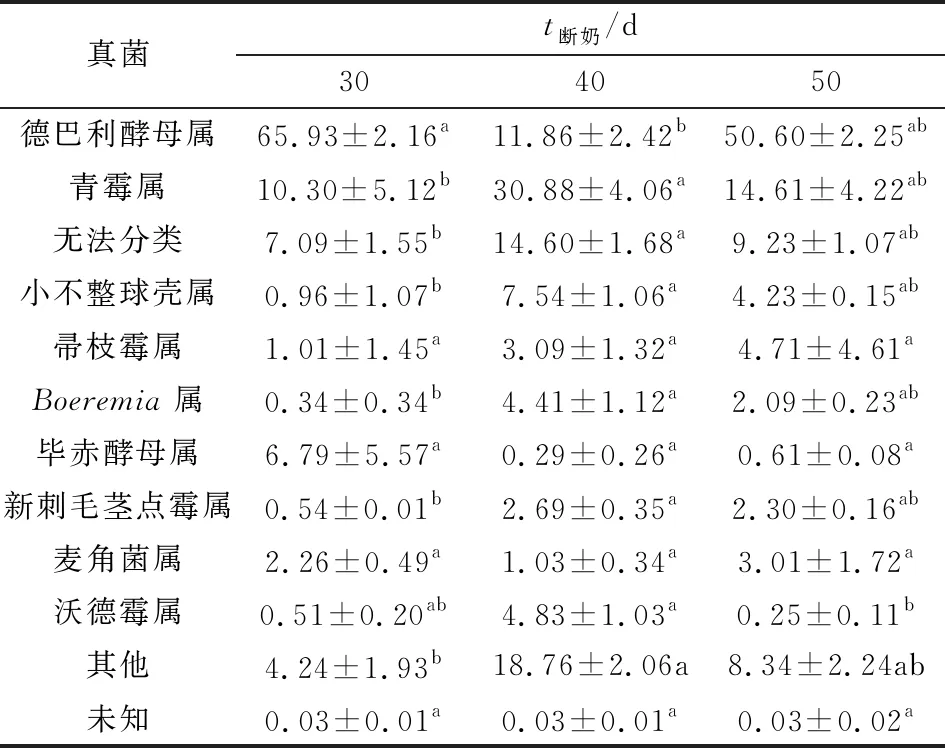
表6 瘤胃真菌菌群在属水平物种丰度表
3 讨论
3.1 断奶时间对羔羊瘤胃组织形态的影响瘤胃是反刍动物关键的消化器官,羔羊瘤胃的发育与固体饲料的采食密切相关。断奶前的羔羊由于网状沟的反射性闭合,母乳直接绕过瘤胃进入皱胃,大部分能量的摄入由母乳提供[11],此阶段瘤胃发育缓慢;断奶后的羔羊采食固体饲料,不仅能够为瘤胃乳头的发育提供物理刺激,同时发酵产物(挥发性脂肪酸等)提供了化学刺激[12]。本研究结果表明:羔羊40 d 断奶组平均日增重显著高于其他组,瘤胃乳头高度40 d断奶组显著高于30 d断奶组,50 d断奶组的乳头高度与30,40 d差异不显著,瘤胃乳头高度和密度3组间差异不显著。小尾寒羊羔羊在第40天断奶能促进瘤胃乳头的发育,增加瘤胃吸收面积。有研究发现,早期断奶的犊牛瘤胃乳头的表面积大于常规饲养犊牛[13]。曹少奇[14]在对断奶后哈萨克羔羊胃肠发育的研究中表明哈萨克羔羊于38或45 d 断奶更有利于促进其胃肠道的发育;柴建民[15]对湖羊早期断奶羔羊研究发现,羔羊在20 d进行早期断奶瘤胃发育和生长性能较好;郭江鹏等[16]研究表明羔羊在28 d瘤胃功能已基本发育完善,能有效地发酵固体饲料,并产生较高浓度的挥发性脂肪酸,提供瘤胃上皮发育所需要的能源,促进瘤胃组织形态学的发育。而本研究结果中40 d断奶羔羊瘤胃乳头发育较好,造成研究结果的不同可能与羔羊品种以及开食料的不同有关。青海东部农区小尾寒羊在第40天断奶符合羔羊瘤胃发育规律的同时及时的给予了瘤胃必要的物理和化学的刺激。本研究发现,角化层厚度40 d断奶组显著低于30,50 d断奶组的角化层厚度均与30,40 d差异不显著,瘤胃肌肉层40 d断奶组显著高于50,30 d断奶组与40,0 d差异不显著。瘤胃内食糜在于瘤胃上皮不断的摩擦中,角质层细胞脱落,使得瘤胃上皮维持适宜的角质层数,当瘤胃上皮角质层过厚,则会降低瘤胃对营养物质的吸收能力[17],因此羔羊在第40天断奶瘤胃组织形态发育最好,能很好的促进羔羊对营养物质的消化与吸收。
3.2 断奶时间对羔羊瘤胃真菌反刍动物瘤胃微生物区系的建立受多种因素的影响,瘤胃最初微生物的定植是由分娩和初乳的喂养等过程,通过与母体的各种接触获得[18],随着羔羊日龄的增大,以及固体饲料的采食等因素,反刍动物瘤胃内微生物区系逐渐向成熟的菌群聚集。本研究中40 d断奶组羔羊特有OUT数最多,Chao1和Ace指数显著高于其他组。40 d断奶组Shannon指数显著高于其他2组,Simpson指数显著低于其他2组。在40 d断奶羔羊瘤胃内物种丰度和均匀度均最大,羔羊在40 d断奶瘤胃菌群的多样性高于30,50 d断奶组。
厌氧真菌是反刍动物瘤胃内植物性饲料降解过程中重要功能菌,能够有效的降解植物细胞壁,多数瘤胃厌氧真菌能分解纤维素,可产生纤维素酶、半纤维素酶和果胶酶等[19],同时真菌的假根系统通过穿透作用在植物材料内部扩张,使植物纤维变得疏松,有利于其他微生物与植物材料的接触[20]。在本研究中门水平共检测出6个菌门,Ascomycota是3组羔羊瘤胃液优势菌门。Ascomycota是真菌界最大的一类微生物,主要参与营养循环中顽固有机物质的降解;Ascomycota中部分真菌也可通过分泌胞外酶将有机质分解为小分子物质后再将小分子吸收进胞内代谢,它们可以分泌降解纤维素和木质素的酶类[21]。在本研究中30 d断奶羔羊瘤胃内Ascomycota丰度高达97%,显著高于40 d断奶组。羔羊在第30天断奶能够增加瘤胃内纤维消化主要菌Ascomycota的数量。其余菌门中Basidiomycota、Mucoromycota、Cercozoa,40 d断奶组显著高于其他2组,但丰度均小于5%。
在属水平羔羊瘤胃中Debaryomyces、Penicillium的丰度在3组羔羊中最高,Debaryomyces具有很强产β-葡萄糖苷酶的能力其菌体本身就含有十分丰富的优质蛋白质,含有丰富的B族维生素和维生素E,常常作为反刍动物饲料添加剂,不仅能够提供丰富的营养物质及促生长因子,还能在动物的胃肠发育过程中起到平衡肠道微生物态、完善免疫等作用;酵母菌可以分泌具有较高活性的消化酶。所产生的代谢产物(B 族维生素、氨基酸等)能够被动物直接吸收利用,有利于动物生长性能及自身健康[22]。Penicillium隶属于Ascomycota,是丝状真菌中最具代表性的菌属之一,丝状真菌对纤维素、半纤维素和木质素有很强的分解作用,能分泌胞外酶,其菌丝具有机械穿插作用,能降解难降解有机物如纤维素和木质素,促进生物化学作用[23],本研究中Debaryomyces30 d断奶组丰度最高达到65%以上,Penicillium和Plectosphaerella40 d断奶组显著高于其他2组。Penicillium和Plectosphaerella在40 d断奶组中丰度达到5%以上。其余丰度低于5%属水平真菌Boeremia、Neosetophoma、Wardomyces均为40 d断奶组差异显著高于其他2组。羔羊在30 d断奶瘤胃内Debaryomyces的数量最多,40 d断奶羔羊瘤胃内Debaryomyces丰度偏低,在10%以上,但在丰度前10 的瘤胃细菌中有6种,瘤胃真菌的丰度40 d断奶组均显著最高,说明在40 d 断奶对羔羊瘤胃微生物的多样性和丰富度有显著的影响。
综上,40 d断奶羔羊瘤胃内真菌多样性和丰富度显著高于30,50 d断奶羔羊;门水平真菌主要聚集在Ascomycota;属水平下德巴利酵母属和青霉属为本研究中所有羔羊优势菌属。在第40天断奶,能够更好的帮助羔羊改善瘤胃微生物区系结构,促进羔羊的进一步发育。
