山羊伪结核棒状杆菌LY20株分离鉴定及病理组织学观察
2022-01-25王锐鸿池雪林陈仕龙曾显成
王锐鸿,林 昶,池雪林,陈仕龙,曾显成*
(1.福建农林大学 动物科学学院 蜂学学院,福建 福州 350002;2.福建省农业科学院 畜牧兽医研究所,福建 福州 350012)
伪结核棒状杆菌感染是由伪结核棒状杆菌(Corynebacteriumpseudotuberculosis,CP)引起山羊、绵羊、牛、骆驼、兔等多种动物和人的体表、内脏器官发生干酪性淋巴结炎为主要特征的一种人兽共患慢性传染病,也是世界上公认的难以治愈的传染病之一[1-3]。本病对小反刍动物山羊和绵羊危害最大,发病率7%~50%[4-5],病羊以成年羊只为主,表现为食欲减退、逐渐消瘦、生产性能下降、泌乳与繁殖功能障碍、产死胎、畸型胎,严重者甚至死亡。根据伪结核棒状杆菌感染部位不同,临床上分为体表型、内脏型和混合型等3种类型,其中体表型最为普遍,常表现为颌下淋巴结、腮腺淋巴结、肩前淋巴结和股前淋巴结等浅表淋巴结肿大,破溃后流出灰白色或淡黄色稠状脓液,无臭味。伪结核棒状杆菌是一种兼性胞内寄生菌,对外界环境抵抗能力强,容易造成持续性感染,市场上还没有可用的疫苗,药物治疗效果不理想,一旦侵入羊群,很难彻底根除[6]。据世界动物卫生组织(OIE)统计,该病至少已在美洲、非洲、亚洲、欧洲和大洋洲中的64个国家中存在[4]。目前,我国云南、四川、陕西、安徽、广西等地区均有报道[7-11],并呈逐渐增多的趋势,对养羊生产带来巨大的经济损失。本研究采集福建某羊场临床表现皮肤脓肿山羊的脓液,进行细菌分离、形态及培养特性观察,生理生化特性及16S rRNA PCR鉴定,确定病原菌为CP,同时对分离菌进行毒力基因检测、药敏试验及病理组织学观察,为该病的防控及致病机理研究提供参考依据。
1 材料与方法
1.1 病料来源无菌采集福建某山羊养殖场临床上表现皮肤脓肿疑似感染羊CP的患病羊脓液样品,在冷藏条件下及时送实验室做细菌分离培养及鉴定。
1.2 主要试验试剂及仪器DL2000 DNA Marker、rTaq DNA聚合酶购自宝生物工程(大连)有限公司。血琼脂基础、营养琼脂、营养肉汤、生化微量鉴定管、药敏纸片均购自杭州滨和微生物试剂有限公司。胎牛血清(HyClone)购自赛默飞世尔生物化学制品(北京)有限公司。高纯DNA提取试剂盒购自罗氏公司(Roche)。快速法革兰染色液购自珠海贝索生物技术有限公司。普通梯度PCR仪(CF-F9677)购自卡尤迪生物科技(北京)有限公司。电泳电源(power600)购自北京百晶生物技术有限公司。凝胶成像分析系统(Tanon-3500)购自上海天能科技有限公司。石蜡切片机(RM2235)和光学显微拍照系统(LEICA ICC50 W)购自德国徕卡微系统有限公司。
1.3 实验动物5~6周龄清洁级ICR小鼠,体质量(25.0±0.3) g,购自福州吴氏实验动物贸易有限公司。采血制作血琼脂平板的健康成年兔2~3 kg,购自本校派尼尔兔园。
1.4 细菌分离培养及形态观察从采集的脓液中分离细菌,划线接种于营养琼脂平板和鲜血琼脂平板,于37℃恒温培养箱中培养,观察生长情况及菌落特征。挑取单个菌落接种含5%胎牛血清的营养肉汤进行细菌增殖传代培养,将纯化后的菌体用30%缓冲甘油和冷冻干燥保存。用脓液及纯化后的菌液制作细菌涂片、染色及形态观察。
1.5 细菌生化鉴定采用细菌微量生化反应管对纯化培养后的分离菌进行生化鉴定,具体操作方法参考试剂说明书,接种后的生化管置37℃恒温培养箱,24 h后观察反应结果。
1.6 药敏试验采用K-B纸片扩散法对分离菌进行药敏试验,操作方法及判断标准根据药敏纸片说明书进行。具体步骤为:在超净工作台中,用无菌棉棒将培养至0.5麦氏浊度的菌液均匀的涂布在含5%胎牛血清的营养琼脂平板上,贴上药敏纸片,37℃培养24 h后,测量抑菌圈直径判定试验结果。
1.7 16S rRNA扩增及序列分析收集培养24 h的菌液进行细菌DNA的提取,先用细菌16S rRNA通用引物(27F:AGAGTTTGATCMTGGCTCAG,1 492R:CGGYTACCTTGTTACGACTT)进行PCR扩增,测序及序列比对。参考GenBank羊CP(登录号:CP024995)设计2对分段扩增16S rRNA全长引物:16S-1(1 269 bp),上游:GGCGTTGTTATGGTGCTGAT,下游:TGTCAAGCCCA-GGTAAGGTTC;16S-2(1 087 bp),上游: AGG-CGATACGGGCATAACTT,下游:CAACAAACAACACTTCCCACAAT。反应体系为25.00 μL:10×PCR buffer 2.50 μL,dNTP Mix(2.5 mmol/L)2.00 μL,上、下游引物(10 μmol/L)各1.00 μL,rTaq DNA聚合酶(5 U/μL)0.25 μL,DNA 模板1.00 μL,用灭菌超纯水补至25.00 μL。反应条件为:预变性95℃,5 min;变性95℃,50 s,退火57℃,30 s,延伸72℃,50 s,做35个循环;72℃后延伸10 min。PCR产物上样1%琼脂糖凝胶电泳,凝胶成像系统拍照保存。将鉴定后的PCR产物送福州尚亚生物技术有限公司测序,测序结果提交NCBI比对分析,用DNAStar、MEGA 5.2等生物信息学软件组装及分析序列,并构建分子遗传树。
1.8 毒力因子检测参考GenBank公布的CP毒力因子基因序列,分别设计PLD、Nan-H、FagA、FagB、FagC、FagD、OppA、OppB、OppC、OppD、OppF共11个毒力因子引物(表1),引物由福州尚亚生物技术有限公司合成。PCR反应体系及反应条件均参考16S rRNA扩增方法。

表1 CP毒力因子PCR扩增引物
1.9 动物致病性试验挑取单菌落接种含血清的营养肉汤,收集培养24 h的菌液,根据平板计数法算出细菌的菌落形成单位(colony-forming units,CFU),用生理盐水将菌液浓度调整为4.4×108CFU/mL。试验组12只小鼠,腹腔和皮下分别接种6只,接种量为0.2 mL/只;对照组12只小鼠用等量生理盐水分别腹腔和皮下接种,每组各6只。同等条件下饲养,观察及记录小鼠情况,及时剖检死亡小鼠,取材固定制作病理切片。
1.10 病理切片制作及观察取出经10%甲醛固定液固定48 h的组织标本,放入脱水筐用流水冲洗30 h,将组织标本修成适合大小,经自动脱水机酒精梯度脱水,二甲苯透明、浸蜡,包埋机包埋,石蜡切片机切成5 μm的薄片,苏木精-伊红染色(HE),中性树胶封片,在光学显微镜下观察组织病变。
2 结果
2.1 临床病变患病山羊被毛粗乱、精神沉郁、食欲减退、体质量下降,耳根部及后肢前方体表皮下可见卵圆形大小的脓肿(图1A),前期触摸较坚硬,随着时间延长,逐渐变软,破溃后排出大量淡黄色糊状脓汁(图1B)。

A.病羊右侧后肢上方出现脓包;B.病羊耳根部脓包破溃
2.2 细菌分离培养及形态观察分离菌在37℃下恒温培养24 h,普通琼脂平板生长贫瘠,鲜血琼脂平板可见圆形、表面光滑、易推动的乳白色菌落(图2A、B);含血清的营养肉汤静置培养呈均匀混浊,管底出现白色沉淀(图2C),摇晃后可见絮状、颗粒状混浊(图2D),液体表面有一层白色菌膜(图2E),并将分离菌命名为LY20株。用临床脓液和肉汤培养菌液制作涂片(图3)后革兰染色、油镜观察,可见革兰阳性菌,单个散在、“V”字形或簇状排列,呈不透明的棒状或球杆状。
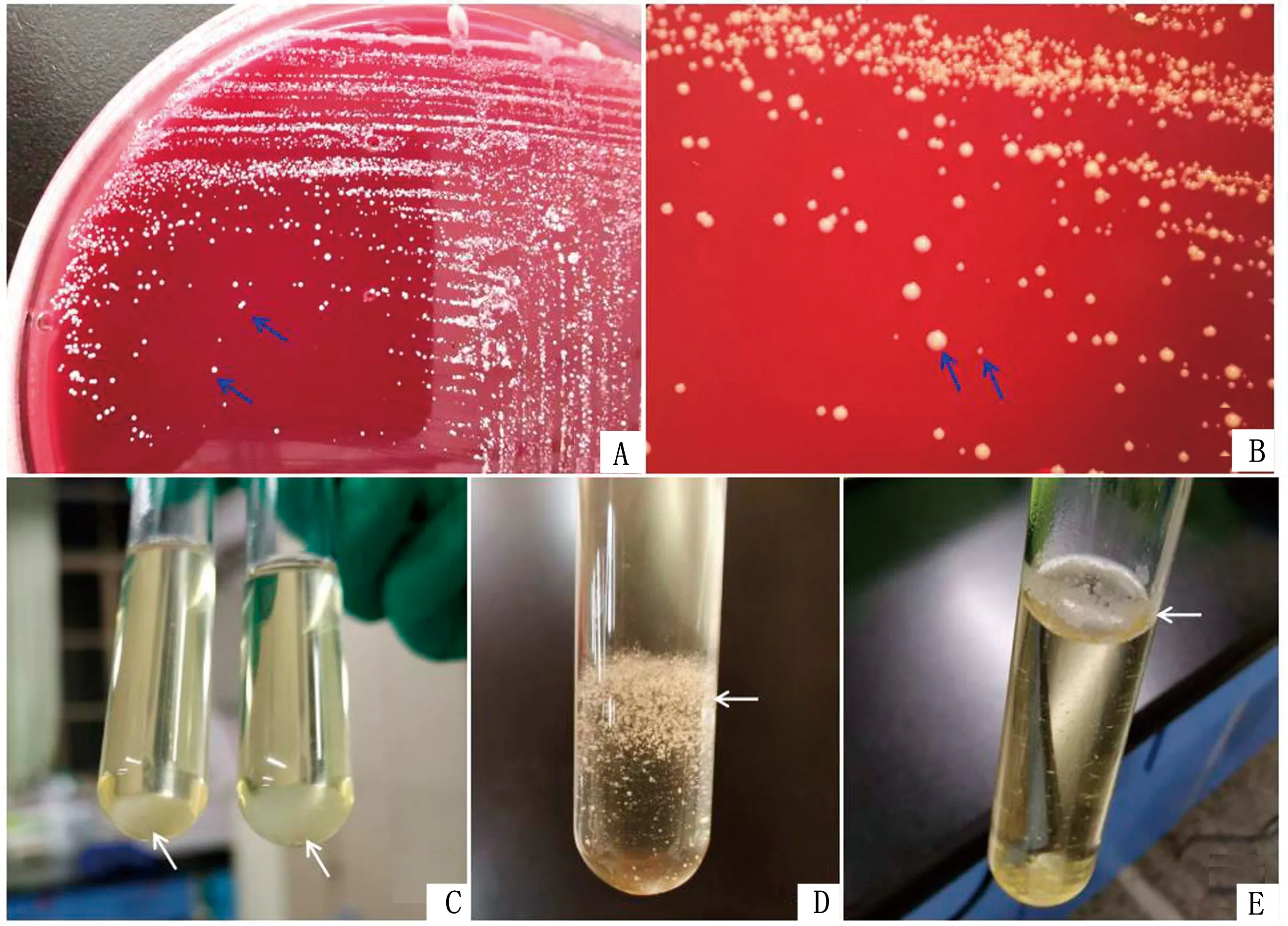
A.血琼脂平板生长表现;B.血琼脂平板菌落显微观察 (×5);C~E.分离菌在营养肉汤生长出现絮状沉淀及白色菌膜
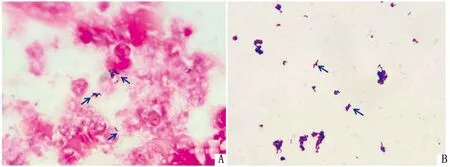
A.山羊临床病例脓汁涂片染色镜检;B.分离菌菌液涂片染色镜检
2.3 细菌生化试验分离细菌能分解葡萄糖,不分解乳糖、麦芽糖、甘露醇和蔗糖;西蒙氏枸橼酸盐、硫化氢、靛基质、硝酸盐还原试验、甲基红(MR)试验和V-P试验结果呈阴性,尿素试验呈阳性。参照伯杰氏细菌鉴定手册进行生化鉴定,结果与伪结核棒状杆菌相符。
2.4 16S rRNA PCR鉴定及序列分析提取分离菌DNA,用16S rRNA通用引物及分段扩增伪结核棒状杆菌16S rRNA全长的2对引物(16S-1和16S-2)进行PCR扩增,取7 μL扩增产物上样琼脂糖凝胶电泳,凝胶成像系统观察,可见在1 504,1 269和1 087 bp 大小处均有1条明亮的特异性条带(图4)。将鉴定后的PCR产物送生物公司进行测序,组装得到分离菌16S rRNA全长为1 528 bp,提交NCBI进行BLAST比对,结果与CP同源性最高。用分离菌16S rRNA全长及GenBank中公布17条参考序列构建分子遗传进行树(图5),HEY+G模式,最大似然法,1 000次重复计算,结果CP、白喉棒状杆菌和肾棒状杆菌形成3个独立分支,而分离菌聚在CP分支,亲缘性最近。同源性分析显示,分离菌与CP同源性为99.9%~100.0%,而与同属的白喉棒状杆菌和肾棒状杆菌同源性分别为97.2%和95.2%。
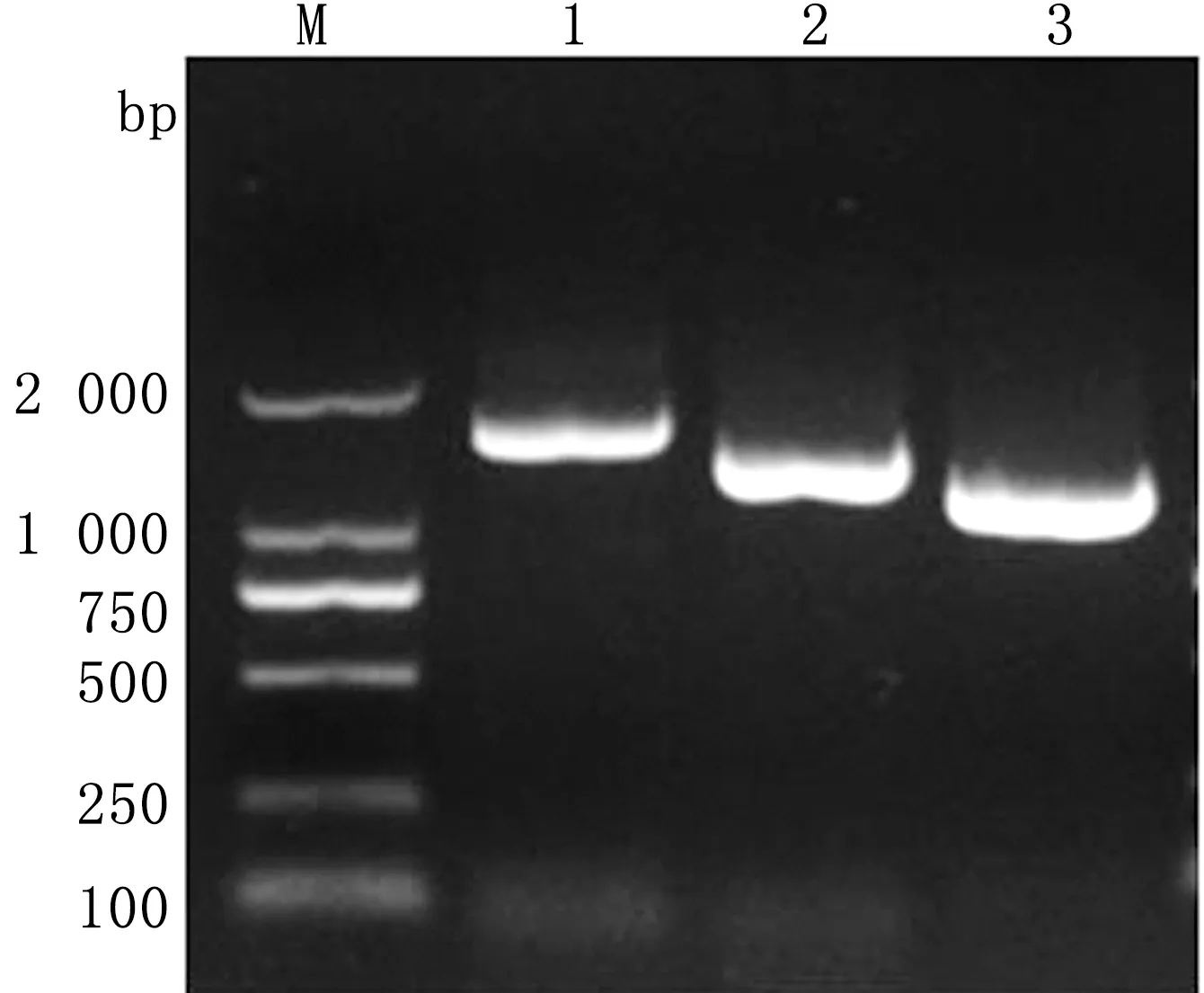
M.DL2000 DNA Marker;1.16S rRNA通用引物;2.16S-1;3.16S-2

图5 分离菌16S rRNA基因序列进化树分析
2.5 毒力基因检测及进化树分析用设计的11对CP毒力基因引物进行PCR扩增,经1%琼脂糖凝胶电泳检测,结果均出现单一的目标条带(图6)。选取毒力因子PLD进行全基因扩增,测序组装后获得PLD基因全长924 bp,GC含量47.8%,编码307个氨基酸,相对分子质量为33.9 kDa。采用Mega5.2软件,最大似然法K2模式下构建PLD核苷酸进化树分析(图7),结果CP分成羊型和马型2个独立分支,本次分离菌与羊型聚在同一分支,亲缘性最近,与另一个分支马型CP亲缘性较远。核苷酸和氨基酸同源性比较显示,分离菌与羊型CP同源性分别为99.9% 和99.7%,与马型CP的同源性分别为98.1%~98.2%和97.4%。
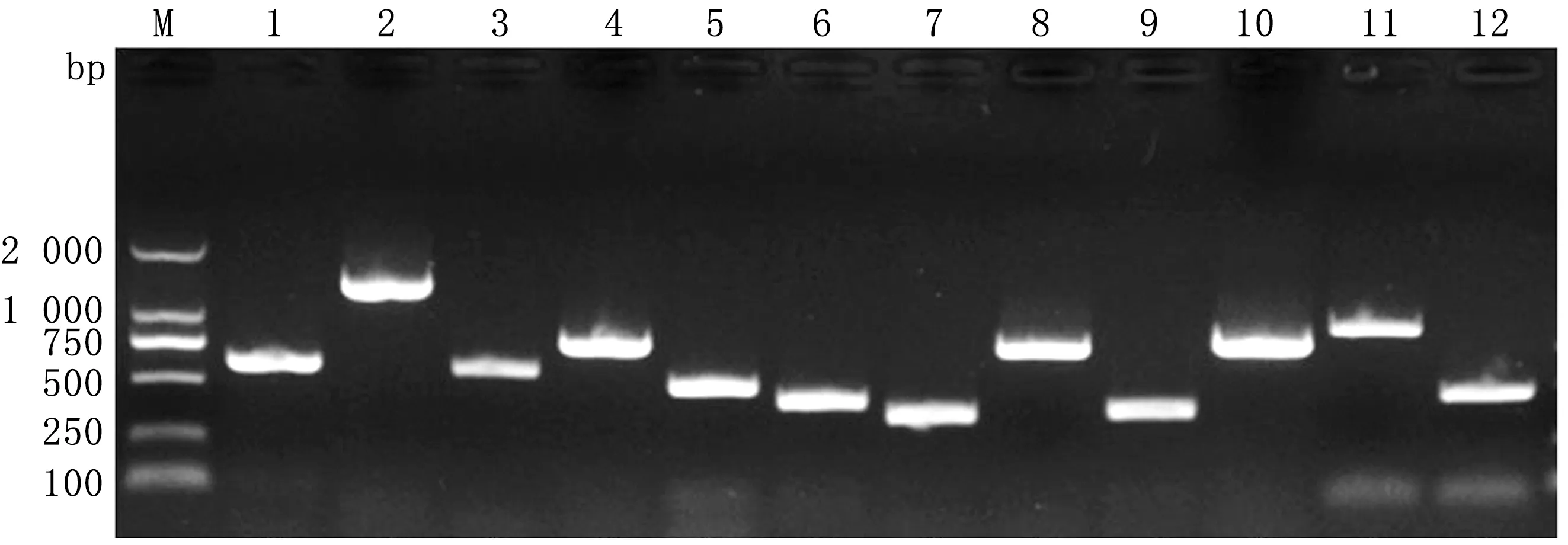
M.DL2000 DNA Marker;1.PLD(608 bp);2.PLD-all(1 308 bp);3.NanH(568 bp);4.FagA(757 bp);5.FagB(492 bp);6.FagC(427 bp);7.FagD(370 bp);8.OppA(744 bp);9.OppB(387 bp);10.OppC(491 bp);11.OppD(817 bp);12.OppF(455 bp)
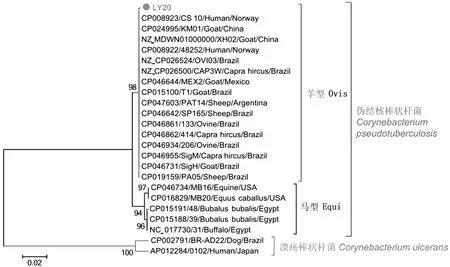
图7 CP PLD基因核苷酸进化树分析
2.6 动物接种试验小鼠腹腔接种分离菌后,表现打堆、精神萎靡,48 h内病死率100.0%,剖检后肉眼可见十二指肠扩大,充满液体,呈透明状;直肠膨大、表面通红、出血;肝脏、肺脏出血或淤血。皮下接种小鼠96 h后,可见接种部位隆起、化脓,破溃后形成结痂(图8A),打开结痂流出浓稠淡黄色脓液(图8B)。正常对照小鼠表现正常。
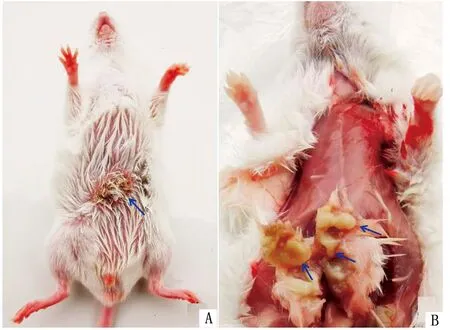
A.接种部位出现化脓、结痂;B.皮下出现化脓灶
2.7 病理组织学观察小鼠感染分离菌死后迅速取材制作病理切片,光镜下观察可见肝脏淤血(图9A);脾脏组织(图9B)白髓可见较多淋巴细胞坏死(黑色箭头),胞核固缩、碎裂、消失,有的与周围组织边界较模糊(蓝色箭头),红髓可见较多髓外造血灶;肺脏组织(图9C、D)肺泡间质可见大量中性粒细胞浸润(绿色箭头),大量肺泡壁毛细血管和血管充血(蓝色箭头),多见血管腔中炎性栓子(黑色箭头),有的血管结构被破坏,结构不清,局部肺泡腔可见渗出的水肿液,轻度出血(蓝色箭头)。肾脏组织(图9E、F)被膜可见大量的疑似蓝紫色细颗粒的菌团(黑色箭头),肾小管排列紧密,髓质可见个别肾小管上皮细胞坏死(蓝色箭头),胞核固缩。十二指肠(图9G、H)绒毛数量明显减少,残留的肠绒毛变短、变钝,相互融合,肠绒毛上皮脱落(黑色箭头),固有层裸露,可见少量淋巴-浆细胞浸润(绿色箭头);固有层腺体数量丰富,较多肠腺底部潘氏细胞减少(蓝色箭头),肠腔可见较多脱落的肠组织。直肠组织(图9I、J)可见较多肠上皮细胞脱落(黑色箭头);固有层腺体数量轻度减少,杯状细胞大量减少,间隙变大,间质可见少量渗出的纤维素(蓝色箭头),伴少量的淋巴细胞浸润(黄色箭头),大量间质可见明显出血(红色箭头);黏膜下层严重水肿;肠腔可见大量出血性坏死物。皮肤组织(图9K、L)表现化脓坏死性肌炎;肌细胞数量大量减少,溶解、坏死(蓝色箭头),肉芽组织增生修复(黑色箭头),可见大量增生成纤维细胞和毛细血管,伴大量中性粒细胞浸润(绿色箭头)。

A.肝脏(×40);B.脾脏(×20);C~D.肺脏(×20);E~F.肾脏(×20);G.十二指肠(×5);H.十二指肠(×20);I.直肠(×5);J.直肠(×20);K.皮肤(×2);L.皮肤(×20)
2.8 药敏试验采用K-B纸片法进行药敏试验,检测了分离菌对41种常用药物的敏感性(图10),结果表明,分离菌对环丙沙星、恩诺沙星、复方新诺明、四环素、红霉素、美罗培南、哌拉西啉/他唑巴坦、强力霉素、氯霉素、亚胺培南、克拉霉素等28种药物敏感;对阿奇霉素和链霉素等6种药物表现中介;对阿米卡星、卡那霉素、多黏菌素B等7种药物耐药。
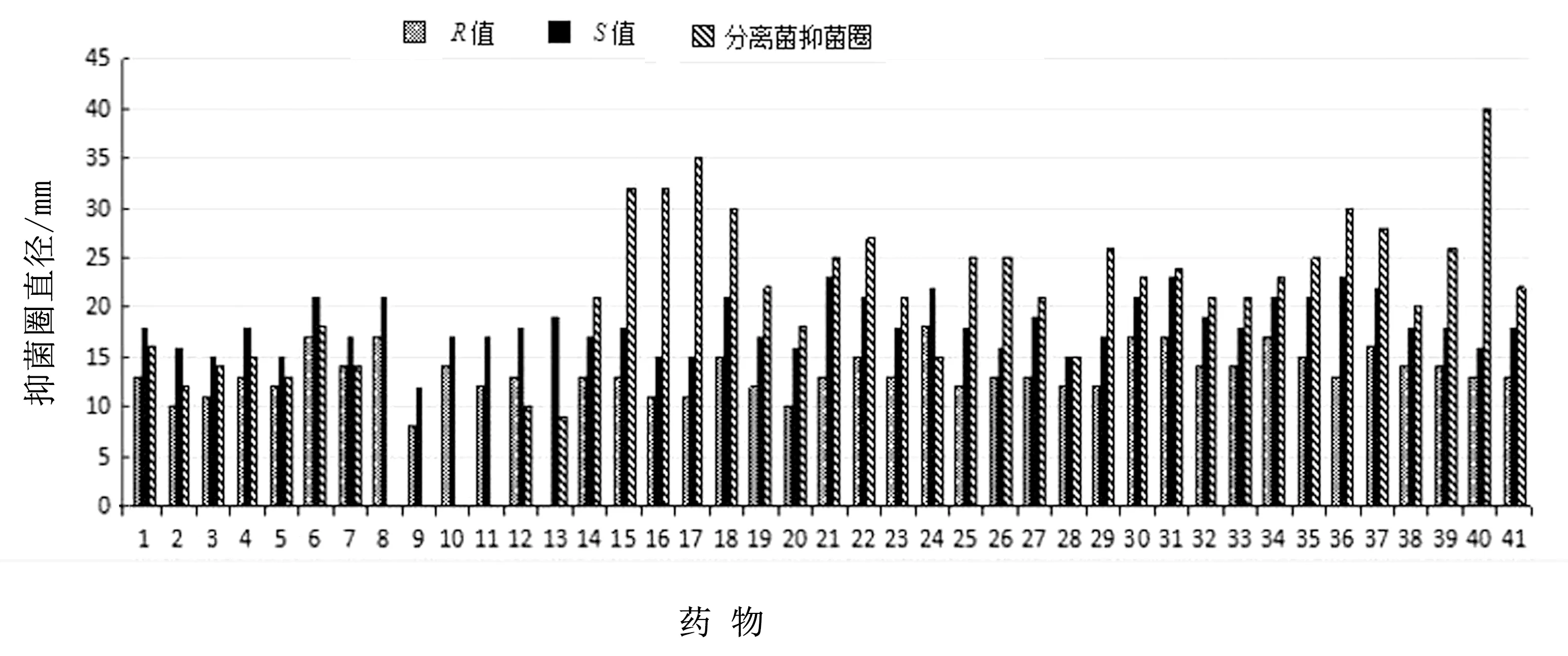
1.阿奇霉素;2.甲氧嘧啶;3.链霉素;4.林可霉素;5.庆大霉素;6.头孢他啶;7.阿米卡星;8.氨曲南;9.多黏菌素B;10.呋喃唑酮;11.磺胺异恶唑;12.卡那霉素;13.荼啶酸;14.阿莫西林;15.阿莫西林/棒酸;16.氨苄西林/棒酸;17.氨苄西林/舒巴坦;18.恩诺沙星;19.氟罗沙星;20.复方新诺明;21红霉素;22.环丙沙星;23.克拉霉素;24.洛美沙星;25.氯霉素;26.美罗培南;27.米诺环素;28.奈替米星;29.诺氟沙星;30.哌拉西啉/他唑巴坦;31.强力霉素;32.四环素;33.头孢克洛;34.头孢克肟;35.头孢哌酮/舒巴坦;36.头孢曲松;37.头孢噻肟;38.头孢西叮;39.头孢唑啉;40.亚胺培南;41.乙酰螺旋霉素;*判定标准:(1)抑菌圈直径≥S值,敏感;(2)抑菌圈直径≤R值,耐药;(3)R值<抑菌圈直径 CP是一种革兰阳性、兼性胞内寄生菌,是导致山羊干酪性淋巴结炎的重要病原菌。本菌是法国细菌学家Nocard于1888年首次从牛淋巴管炎分离得到,现已在世界许多地区的山羊养殖场中广泛流行,严重影响了羊肉、羊奶和羊毛的品质和产量[3,12],给养羊业带来了重大的经济损失。NABIH等[13]从177只处于哺乳中后期奶山羊中采集了336份奶样,其中24份样品中分离出CP,检出率为7.14%。许国洋等[14]利用多重PCR方法检测临床采集的80个山羊脓液样本,结果CP单一感染的检出率为68.80%,与其他细菌混合感染总检率高达92.50%。KOMALA等[15]采用琼脂凝胶沉淀试验(AGPT)和酶联免疫吸附试验(ELISA)方法,调查了8个农场579只绵羊和山羊干酪性淋巴结炎的感染状况,结果检出阳性36例,感染率为17%。本试验从福建某山羊养殖场患皮肤脓肿的山羊脓液中分离到1株细菌,该菌在鲜血琼脂平板培养24 h后,菌落呈乳白色、易被推动且琼脂表面不留痕迹,沾有菌落的接种环用酒精灯火焰灼烧时发出丝丝声音,并向四处飞溅,主要是CP细胞壁中含有较多脂类的缘故。16S rRNA分子遗传进化树显示,分离菌聚在伪结核棒状杆菌分支,亲缘性最近,同源性达99.9%~100.0%,而与同属的白喉棒状杆菌和肾棒状杆菌同源性分别为97.2%和95.2%,从分子生物学方面证明分离菌为伪结核棒状杆菌。张斯旂等[16]、许国洋等[14]对山羊皮下脓肿病原鉴定,结果表明CP、金黄色葡萄球菌及化脓隐秘杆菌是3种最主要的病原菌。由于临床上引起山羊皮肤脓肿的病原较为复杂,且常混合感染,仅凭临床经验难以鉴别,确诊需借助实验室进行。药敏结果可知,分离菌对环丙沙星、四环素等28种药物敏感,对阿米卡星、卡那霉素、多黏菌素B等7种药物耐药,表明分离菌已产生耐药。 分离菌感染小鼠病理组织学观察发现,脾脏组织白髓有较多淋巴细胞坏死,红髓有髓外造血灶,这表明病原菌已侵害到机体的免疫器官,同时判断动物机体可能出现严重缺血状态,产生红细胞、粒细胞及血小板,需要恢复髓外造血功能,目前还未见到相关报道。脾脏是机体重要的免疫器官,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,一旦遭到病原菌的破坏,就会严重影响其免疫调节功能。十二指肠、直肠上皮细胞脱落、坏死、出血、淋巴细胞浸润,表明病原菌能够损伤消化系统。本试验内脏器官病理变化主要表现为充血、出血、坏死、炎症细胞浸润,没有观察到内脏器官的化脓病灶,这可能与小鼠腹腔接种后急性死亡有关。皮肤组织可见化脓坏死性肌炎、肉芽组织增生,这与潘淑惠等[17]、兰宇等[18]用CP人工皮下接种山羊和家兔所描述的临床及病理变化相一致。由于CP感染后能在皮肤表面形成一层厚而致密的肉芽肿包囊,这也是导致在临床上用药效果不佳、难以防治此病的重要原因。 CP的致病力与其毒力因子密切相关,目前已知的毒力因子主要包括:磷脂酶D(PLD)、分枝菌酸、σ因子、寡肽透过酶(OppA、OppB、OppC、OppD和OppF)和与铁摄取和调节相关毒力因子(FagA、FagB、FagC和FagD),另外还有假定毒力因子:小菌毛蛋白(SpaC)、神经氨酸酶或唾液酸酶(NanH)、真核样丝氨酸/苏氨酸蛋白激酶G(PknG)以及分泌铜锌依赖的超氧化物歧化酶(SodC)[19]。其中PLD是CP中最主要的毒力因子[20],它分泌磷脂酶D可以催化细胞膜上的蛋白质和脂质的分解[21],从而增加血管的通透性,导致血浆从血管渗出进入周围组织,有助于细菌从感染的初始部位扩散到淋巴结[22-23],此外,PLD具有细胞毒性能导致皮肤坏死[24]。MCNAMARA等[25]研究表明使PLD基因失活时,能显著减少山羊临床发生淋巴结脓肿和干酪性淋巴结炎。本研究检测分离菌毒力因子情况,结果检测到PLD、NanH、FagA、FagB、FagC、FagD、OppA、OppB、OppC、OppD和OppF共11个毒力因子。其中FagA、FagB、FagC和FagD位于PLD下游,参与铁的摄取,有利于CP在宿主体内持续性感染,敲除Fag基因后,病毒毒力降低[26]。FU等[27]通过高通量测序对CP感染山羊脾脏组织的基因表达差异分析,认为该菌可以进化出一种获得铁的机制,这种机制能促进细菌在细胞内的生存,实现免疫逃逸。由于棒状杆菌属细菌中只有CP和溃疡棒状杆菌能产生PLD,因此,构建PLD核苷酸进化树选用溃疡棒状杆菌做外源基因,结果显示CP分成羊型和马型2个独立分支,分离菌与羊型分支菌株同源性为99.9%,而与马型分支菌株同源性为98.1%~98.2%。研究表明,分离菌携带多个毒力基因,进一步验证了该菌具有较强的致病力,且可以根据PLD基因分子遗传来推测宿主的来源。3 讨论
