鉴别布鲁菌S2疫苗株的双重实时荧光PCR方法的建立与应用
2022-01-25赵明海许中衎沈子莹王传彬梁春南
董 浩,原 霖,赵明海,刘 巍,许中衎,沈子莹,徐 阳,王传彬*,梁春南*
(1.中国食品药品检定研究院,北京 102600;2.中国动物疫病预防控制中心,北京 102600)
布鲁菌病(简称布病)是由布鲁菌(Brucellaspp.)感染而引起的一种危害严重的人兽共患传染病。布鲁菌主要侵害患病动物的生殖系统,以母畜发生流产和公畜睾丸炎为主要特征。人感染布病以发热、乏力、流产、睾丸炎等为主要症状,严重影响患者的生活质量,甚至丧失劳动能力和生育能力。布病感染人类时,需要及时进行抗生素治疗,若治疗不及时则容易转变成慢性感染[1]。
疫苗免疫是流行率较高的地区控制布鲁菌病最有效的方法之一。根据原农业部和卫计委印发的《国家布鲁菌病防治计划(2016—2020年)》的相关规定,对一类地区的牛羊场群采取全面免疫,奶畜原则上不免疫的措施[2]。我国目前使用的布病疫苗主要有布鲁菌A19疫苗、布鲁菌S2疫苗和布鲁菌M5疫苗。其中布鲁菌S2疫苗是使用最多的布病疫苗,同时也是唯一一种可以对怀孕动物进行免疫的疫苗[3]。
动物布病的检测主要以血清学检测方法为主,但是现有血清学检测方法与大肠杆菌、耶尔森菌的部分血清型存在交叉反应,同时我国所使用的布病疫苗所产生的免疫抗体和野毒株自然感染抗体无法进行区分[4]。
实时荧光PCR技术(real-time PCR,RT-PCR)是一种对基因组进行检测的相对定量技术,该技术目前已广泛用于人类传染病的诊断和病原定量以及动物病原体的检测、畜禽产品的检验检疫、生物制品的检测等领域。早期的相关研究,也有多篇基于实时荧光PCR技术建立布鲁菌病分子检测方法并进行临床应用的相关报道[5-7]。
2016年,DI等[8]对布鲁菌S2疫苗株和猪种布鲁菌1330株进行了比较基因组学分析。同一年,红梅[9]也对布鲁菌S2疫苗株的全基因组序列进行了测序分析,并尝试表达差异基因编码的蛋白,从而建立相应的血清学鉴别诊断方法。在本研究中,拟基于布鲁菌S2疫苗株和其他种布鲁菌的差异序列,建立一种准确、特异、快速地鉴别布鲁菌S2疫苗株的实时荧光PCR方法。
1 材料与方法
1.1 菌株与基因组模板羊种布鲁菌标准株16M、牛种布鲁菌标准株2308、猪种布鲁菌标准菌株1330、犬种布鲁菌标准菌株RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株的基因组均由国家动物布鲁菌病参考实验室惠赠;大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌均由本实验室保存。
1.2 主要试剂与仪器细菌基因组DNA提取试剂盒,购自西安天隆科技有限公司;GoTag Probe qPCR Master Mix,购自Promega公司;TE缓冲液购自北京索莱宝科技有限公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒均购自Omega公司;BamHⅠ和EcoRⅠ限制性内切酶以及T4连接酶购自NEB公司。GeneRotex全自动旋转式核酸提取仪购自西安天隆科技有限公司;NanoDrop2000和ABI7500实时荧光PCR仪购自赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1引物及探针的设计 根据早期文献对于猪种布鲁菌S2疫苗株基因组的分析结果[10],以及GenBank数据库中公布的羊种布鲁菌标准株16M、牛种布鲁菌标准株2308、猪种布鲁菌标准菌株1330、犬种布鲁菌标准菌株RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株的基因组序列,设计了1对特异性引物和1条探针(S2-F/R/Probe),用于鉴别S2疫苗株与其他种布鲁菌菌株。参考早期文献中设计的IS711特异性引物和探针作为检测布鲁菌的通检引物探针(Bru-F/R/Probe)[11]。引物和探针序列均由生工生物工程(上海)股份有限公司合成,引物和探针序列详见表1。

表1 引物和探针序列
1.3.2质粒标准品的制备 基于猪种布鲁菌S2疫苗株的特异性缺失序列,设计相应的特异性引物S2-F(BamHⅠ)和S2-R(EcoRⅠ),以牛种布鲁菌标准株2308株为模板,PCR扩增长度为314 bp的目的片段。PCR扩增程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共30个循环;72℃ 10 min。回收目的扩增片段,经过BamHⅠ和EcoRⅠ双酶切后,克隆入pUC19载体。挑取PCR检测为阳性的克隆送生工生物工程(上海)股份有限公司进行测序。获得的阳性质粒命名为pUC-S2。将含有pUC-S2阳性质粒的感受态细胞,培养至稳定期后,使用质粒提取试剂盒提取质粒pUC-S2。利用Nanodrop2000测定质粒的浓度,换算质粒拷贝数。使用TE缓冲液对阳性质粒进行适当稀释。
以牛种布鲁菌标准株2308株为模板,PCR扩增布鲁菌保守的IS711插入序列中长度为463 bp的目的片段,引物序列见表1。PCR扩增程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共30个循环;72℃ 10 min。回收目的扩增片段,经过BamHⅠ和EcoRⅠ双酶切后,克隆入pUC19载体。挑取PCR检测为阳性的克隆送生工生物工程(上海)股份有限公司进行测序。获得的阳性质粒命名为pUC-IS711。将含有pUC-IS711阳性质粒的感受态细胞,培养至稳定期后,使用质粒提取试剂盒提取质粒pUC-IS711。利用Nanodrop2000测定质粒的浓度,换算质粒拷贝数。使用TE缓冲液对阳性质粒进行适当稀释。
1.3.3双重实时荧光PCR反应条件的优化 用矩阵法进行实时荧光PCR扩增,筛选引物和探针的搭配浓度,以获得最佳的扩增效果。
1.3.4双重实时荧光PCR特异性试验 分别以大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌等灭活细菌核酸为模板进行双重实时荧光PCR 检测,并设置1个牛种布鲁菌标准株2308核酸阳性对照和1个空白对照(水)。同时,分别以羊种布鲁菌标准株16M、牛种布鲁菌标准株2308、猪种布鲁菌标准菌株1330、犬种布鲁菌标准菌株RM6/66、布鲁菌A19疫苗株和布鲁菌S2疫苗株灭活细菌核酸为模板进行双重实时荧光PCR 检测,同时设置1个空白对照(水)。
1.3.5双重实时荧光PCR标准曲线的绘制 分别将1.3.2中构建的质粒标准品pUC-IS711和pUC-S2,使用TE缓冲液进行10倍梯度稀释,模板浓度为1×106,1×105,1×104,1×103,1×102拷贝/μL的质粒标准品,进行实时荧光PCR检测,用ABI7500荧光定量PCR仪配套软件绘制标准曲线。
1.3.6双重实时荧光PCR敏感性试验 分别将1.3.2中构建的质粒标准品pUC-IS711和pUC-S2使用TE缓冲液进行10倍梯度稀释,模板为浓度为1×106,1×105,1×104,1×103,1×102,1×101,1×100拷贝/μL的质粒标准品,每个稀释度做3个重复,进行实时荧光PCR检测,以测定该双重实时荧光PCR方法的敏感性。
1.3.7重复性试验 分别采用浓度为1×106,1×104,1×102拷贝/μL的质粒标准品进行实时荧光PCR试验,每个浓度的模板分别进行了批内重复3个和3次批间重复试验,以评估所建立方法的重复性。
1.3.8临床样品检测 分别采用建立的双重实时荧光PCR方法,对国家动物布鲁菌病参考实验室惠赠的92份临床流产奶牛阴道拭子核酸样品(对应流产奶牛的布病抗体均为阳性),及本实验室采集的S2疫苗阴道免疫绵羊的组织脏器样品进行检测。同时,用现行行业标准奶牛布鲁菌病PCR诊断技术(NY/T 1467-2007)的套式PCR方法对上述样品进行检测。
2 结果
2.1 重组质粒标准品的构建以牛种布鲁菌标准株2308株为模板,PCR扩增布鲁菌保守的IS711插入序列和S2疫苗株缺失序列,PCR产物经电泳检测,分别在463和314 bp出现和预期相符的目的条带。2种PCR产物回收后分别克隆入pUC19载体,经过PCR鉴定和测序分析发现,2个重组质粒(pUC-IS711和pUC-S2)构建成功。
2.2 双重实时荧光PCR反应条件的优化结果及标准曲线的建立通过体系优化,双重实时荧光PCR的最佳反应体系为20.0 μL:GoTaq®Probe qPCR Master Mix 10.0 μL,10 μmol/L 的上、下游引物各 0.6 μL,10 μmol/L 的探针各0.6 μL,DNA 模板 2.0 μL,加入无核酸酶的水补齐 20.0 μL。反应程序确定为95℃ 2 min;95℃ 15 s,60℃ 1 min,40个循环。每个循环第 2 步,60℃ 1 min,分别收集FAM和VIC荧光信号。
提取pUC-IS711和pUC-S2标准品质粒,换算拷贝数后分别进行10倍倍比稀释后作为模板,采用优化好条件的双重实时荧光PCR进行扩增。试验结果显示,在使用1×106~1×102拷贝/μL的质粒标准品作为模板时,布鲁菌IS711通检荧光的扩增效率E=99.648%,R2值为0.999(图1A);布鲁菌S2疫苗缺失序列荧光扩增效率E=99.830%,R2值为1.000(图1B)。
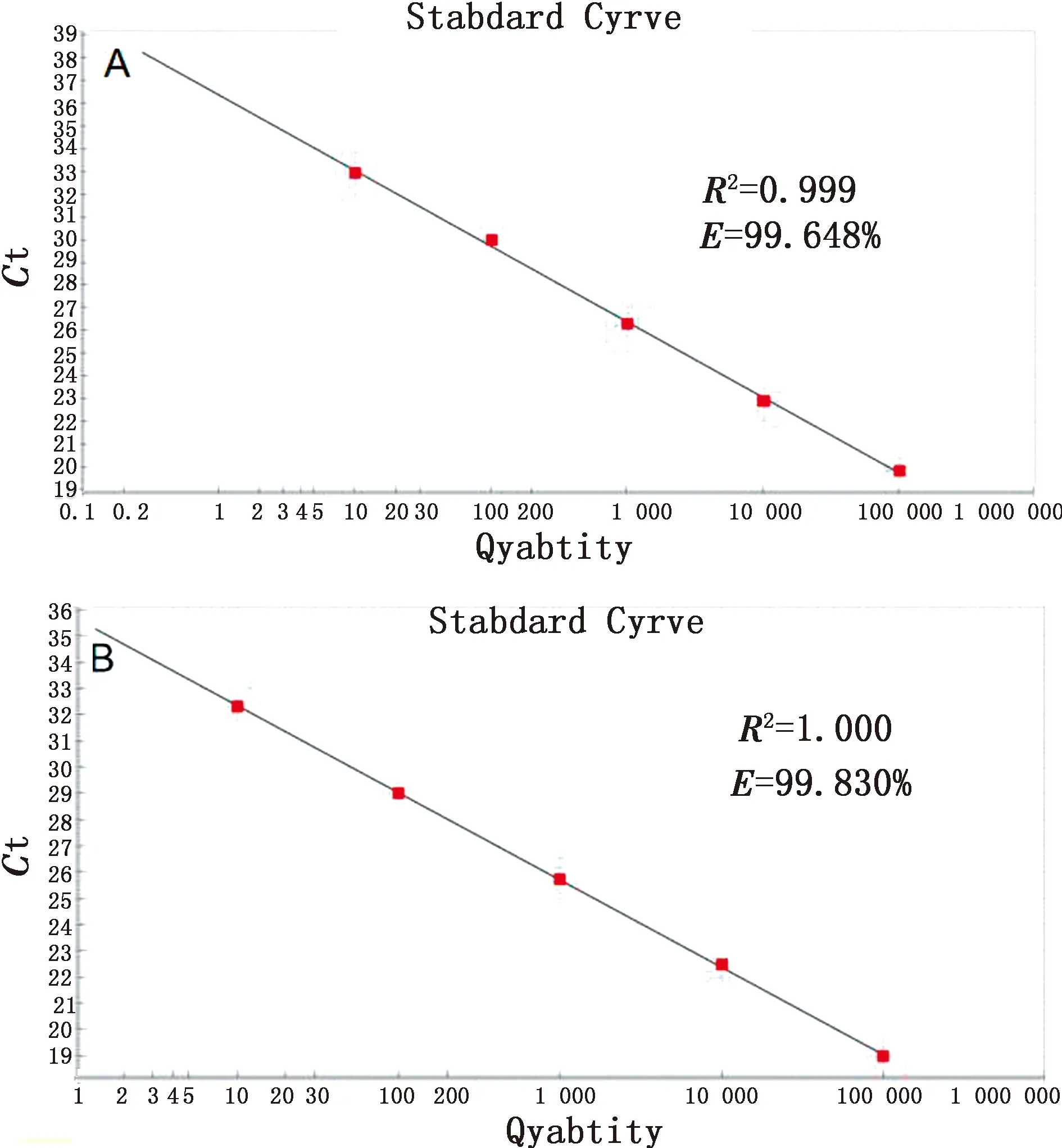
A.使用pUC-IS711标准品绘制的标准曲线;B.使用pUC-S2标准品绘制的标准曲线
2.3 特异性试验分别以羊种布鲁菌标准株16M、牛种布鲁菌标准株2308、猪种布鲁菌标准菌株1330、犬种布鲁菌标准菌株RM6/66、布鲁菌A19疫苗株、布鲁菌S2疫苗株、大肠杆菌、鼠伤寒沙门菌、金黄色葡萄球菌、无乳链球菌和小肠结肠炎耶尔森菌的核酸作为模板,同时以ddH2O为阴性对照,采用优化好条件的双重实时荧光PCR进行扩增。试验结果显示,布鲁菌S2疫苗株出现1条S型特异性扩增曲线(图2A),其他布鲁菌均出现2条S型特异性扩增曲线。受篇幅限制只展示羊种布鲁菌标准株16M(图2B)。非布鲁菌的其他细菌核酸样品均未出现特异性的扩增曲线。
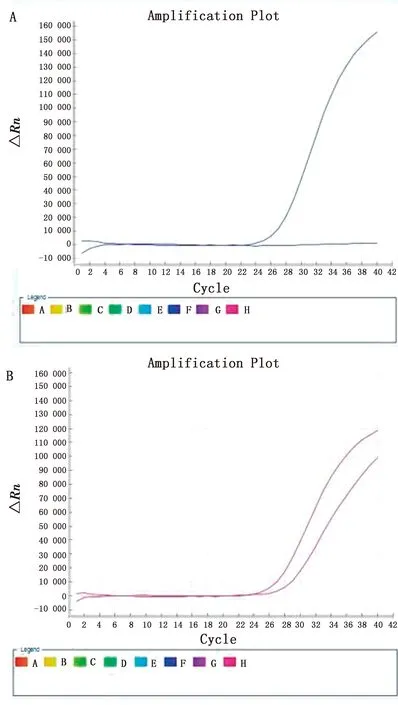
A.S2疫苗株核酸的扩增曲线;B.羊种布鲁菌标准株16M核酸的扩增曲线
2.4 敏感性试验结果为了测试双重实时荧光PCR敏感性,将pUC-IS711和pUC-S2标准品质粒分别进行10倍倍比稀释后作为模板,采用优化好条件的双重实时荧光PCR进行扩增。试验结果显示,布鲁菌IS711通检荧光的最低检测限为1×101拷贝/μL,布鲁菌S2疫苗缺失序列荧光的最低检测限为1×101拷贝/μL(图3)。
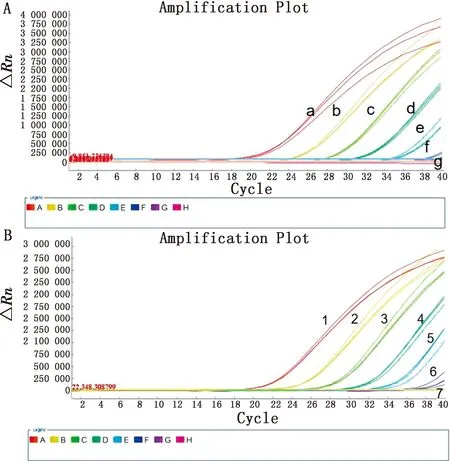
A.不同浓度pUC-IS711标准品的扩增结果(a~g.1×106~1×100 拷贝/μL的标准品);B.不同浓度pUC-S2标准品扩增结果(1~7.1×106~1×100 拷贝/μL的标准品)
2.5 重复性试验为了测试双重实时荧光PCR的重复性,分别采用浓度为1×106,1×104,1×102拷贝/μL的2种质粒标准品进行了批内重复和批间重复试验。结果如表2所示,批内和批间的变异系数均小于3%,这说明建立的双重实时荧光PCR具有良好的重复性。

表2 双重实时荧光PCR的批内和批间重复试验
2.6 临床样品检测利用建立的双重实时荧光PCR对国家动物布鲁菌病参考实验室惠赠的92份临床流产奶牛阴道拭子核酸样品,及本实验室采集的20份S2疫苗阴道免疫绵羊的组织脏器样品进行检测。结果表明,92份临床流产奶牛阴道拭子样品,双重实时荧光检出87份阳性(均为非S2疫苗株的布鲁菌),套式PCR检测出53份阳性。20份S2疫苗阴道免疫绵羊的组织脏器样品,双重实时荧光PCR和套式PCR均检出了20份阳性,而且采用双重实时荧光PCR成功鉴别出这20份样品中的布鲁菌核酸为S2疫苗株(表3)。
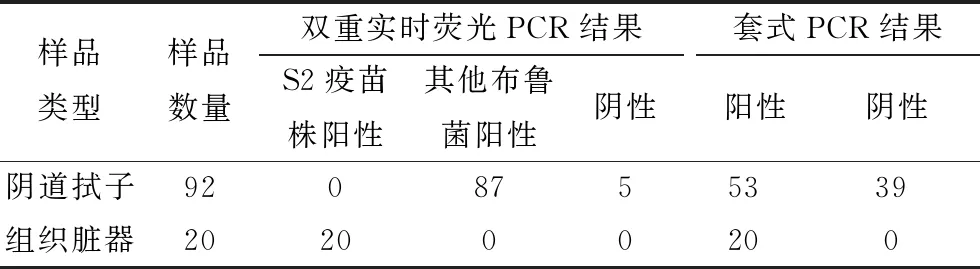
表3 双重实时荧光PCR和套式PCR检测临床样品的比较 份
3 讨论
由于我国目前使用的A19、S2和M5布病疫苗都具有完整的脂多糖结构,导致使用上述疫苗免疫家畜后产生的免疫抗体与野毒株感染的抗体无法区分,这也是困扰我国乃至全球绝大多数国家布病防控的一个瓶颈。
根据《布鲁菌病防治技术规范》的规定,为了排除疫苗免疫抗体的干扰,S2、M5、A19菌苗免疫接种过的动物,在接种后18个月(猪接种后6个月)才能通过血清学检测判定动物是否感染野毒菌株。然而,如此长的时间周期显然不符合动物疫病防控的“早、快、严、小”的原则,也不利于及时剔除群体中的传染源。虽然有文献报道,可以采用半抗原-琼扩试验的方法对S2疫苗免疫的羊可以从血清学水平实现一定程度的鉴别诊断[13]。但是由于该方法目前应用范围有限,真实鉴别效果有待通过更多试验数据进行验证。
随着新一代测序技术的发展,越来越多布鲁菌的全基因组序列被测并上传到GenBank数据库,这使得通过比较基因组学筛选疫苗株特定的诊断靶标成为可能。2012年,谭鹏飞等[14]经过序列比对发现,NCBI上发表的猪种布鲁菌疫苗株基因组序列存在25 bp的缺失。基于该特征性缺失片段设计特异性的引物,并结合布鲁菌AMOS-PCR方法中的猪种1型特异性引物,他建立了双重PCR检测方法。该双重PCR方法的判定标准:同时出现500和285 bp 2条带,判为疫苗株阳性;没带均判为疫苗株S2阴性,即非疫苗株S2;若出现285 bp单一条带判为猪种布鲁菌1型菌株。采用此方法可以实现对S2疫苗株的鉴别诊断。2015年,张岩[10]也基于S2疫苗株在iclR基因的缺失序列,设计核酸长度为29 bp的寡核苷酸探针,并用地高辛进行标记,最低能够检测到10 pg的PCR片段,能够在10 h内鉴别出布鲁菌S2疫苗株。
相比上述2个采用双重PCR和斑点杂交的方法进行布鲁菌S2疫苗株的鉴别,本研究同样也是基于S2疫苗株iclR基因的缺失序列设计了1套对S2疫苗株进行鉴别的引物及探针,配合布鲁菌IS711通检引物和探针,实现对S2疫苗株的鉴别诊断。本研究建立的双重实时荧光PCR对布鲁菌的通检和S2疫苗株鉴别的最低检测限都可达到10 拷贝/μL,敏感性比上述双重PCR和斑点杂交方法均有所显著提升,操作也更加简便。而且,实时荧光PCR技术更容易在分子检测实验室中推广使用。除此之外,本研究建立的双重实时荧光PCR不与常见的牛羊病原菌发生交叉反应,重复性好,临床样品检测效果也优于目前我国农业行业标准中规定的套式PCR方法,在处理拭子等细菌含量较低的样品时,优势更加明显。综上所述,本研究建立了一种可以对布鲁菌S2疫苗株进行鉴别诊断的双重实时荧光PCR方法,其有着比较理想的敏感性、特异性和重复性,可用于临床家畜组织样品布鲁菌核酸的有效检测,对我国布病的早期诊断和综合防控具有较大意义。
