羊源土曲霉的鉴定及致病性
2022-01-25俄木曲者
向 益,张 桦,王 利,魏 勇,俄木曲者,苗 斌,陈 勇
(1.西南民族大学 青藏高原动物遗传资源保护与利用国家教育部重点实验室,四川 成都 610041;2.西南民族大学 动物科学国家民委重点实验室,四川 成都 610041;3.四川省畜牧科学研究院,四川 成都 610066;4.四川省巴中市南江黄羊科学研究所,四川 南江 635600)
曲霉属(Aspergillus)是自然界中的一大类真菌,目前为止,已有300多亚种被鉴别,其中,黄曲霉、土曲霉、杂色曲霉、构巢曲霉等是导致人和动物患侵袭性曲霉病(IA)的主要病原菌。IA是免疫功能低下患者中最常见的机会性丝状真菌感染形式,据报道,在IA病例中,由土曲霉引起的IA已达到12.5%[1]。土曲霉是引起免疫功能低下和高危患者高发病率和高死亡率的病原菌之一。从浅表感染到严重侵袭性感染,土曲霉已成为机会性真菌感染的一个重要病原菌[2]。研究表明,和烟曲霉、黄曲霉相比,大多数土曲霉菌株对两性霉素B存在耐药性,所以土曲霉感染引起的死亡率更高[1]。土曲霉是一种机会性致病菌,通常引起人耳真菌病[3]、眼眶曲霉病[4]、灰指甲[5]、间质性膀胱炎以及肺曲霉病[6]。除此之外,土曲霉还可引起怀孕母马患胎盘炎而流产[7]、引起复发性血管肉瘤患者的颅内土曲霉脓肿,并发张力性气颅[8],引起患有免疫缺陷的儿童发生肝炎[9],同时引起外伤患者继发椎间盘炎症[10]。器官移植后的患者易继发烟曲霉、黄曲霉和土曲霉感染,损伤心脏、肾脏、肺脏等组织[11]。由此可见,土曲霉除引起体表及肺部感染以外,同时也可引起动物体各组织器官发生严重病理损伤。目前为止,少见有关土曲霉感染小鼠的致病性研究。本研究通过形态学及ITS基因鉴定了1株土曲霉菌株,并进行了小鼠感染试验,通过血清生化指标、病理组织学、霉菌组织分布检测来研究其对小鼠的致病性,以期为土曲霉病的诊断和防制提供科学资料。
1 材料与方法
1.1 病料来源2019年5—6月四川某羊场多数湖羊出现精神萎靡,采食量低,腹泻等症状。严重时,羊卧地不起,甚至死亡,怀孕母羊瘫软、流产、产死胎或弱胎。无菌采集病羊的心脏、肝脏组织于马铃薯葡萄糖琼脂培养基。
1.2 主要仪器及耗材PCR仪(S100)和凝胶成像系统(CL1000)均购自Thermo Fisher Scientific公司;石蜡切片机(RM2235)购自Leica公司;马铃薯葡萄糖琼脂(PDA)培养基购自青岛海博生物技术有限公司;AST、ALT、ALP、CREA、UREA、UA、总蛋白(TP)、GLB、ALB测定试剂盒购自迈克生物科技有限公司;组织DNA提取试剂盒购自北京索莱宝科技有限公司;六胺银染色(GMS)试剂盒购自北京雷根生物技术有限公司。
1.3 菌株鉴定将接种后的PDA培养基28℃ 恒温培养5 d后,挑取单菌落纯化培养5 d,直接涂布镜检,观察其形态特征。挑取单菌落接种于液体马铃薯葡萄糖培养基,37℃,180 r/min培养48 h后用真菌DNA提取试剂盒提取总DNA,PCR扩增ITS基因。真菌通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。 PCR反应程序:98℃预变性2 min;98℃变性10 s;56℃退火10 s,72℃延伸30 s,共35个循环;72℃延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测,回收目的条带并测序。引物合成及测序由上海生工生物工程股份有限公司完成。测序结果经BLAST比对,用Mega 6.0 软件构建ITS基因系统进化树。
1.4 菌株毒力基因检测以提取的MSF2菌株总DNA为模板,PCR扩增毒力基因(引物序列见表1)。PCR扩增程序:98℃预变性2 min;98℃变性10 s,退火(温度见表1)15 s,72℃延伸30 s,共35个循环;72℃再延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测后,于凝胶成像系统观察。

表1 毒力基因引物序列
1.5 动物感染试验20只昆明小鼠,体质量为(18±2) g,雌雄各半,购自四川省成都市中医药研究所。土曲霉无菌接种于PDA培养基,纯化培养5 d 后按照文献[12]的方法制备霉菌孢子悬液,并用浊度计将浓度调整为5×107CFU/mL。20只小鼠随机分成对照组和试验组,10只/组。试验组小鼠腹腔注射0.3 mL孢子悬液,对照组小鼠注射同体积的生理盐水,试验周期为7 d。在试验周期内,观察对照组和试验组小鼠的临床变化,记录试验组小鼠死亡情况,试验结束后,解剖所有小鼠,观察其剖检变化,取其心脏、肝脏、脾脏、肺脏等组织固定于4%多聚甲醛溶液保存,采集所有小鼠眼眶血,分离血清保存于-20℃,用于AST、ALT、TP、UREA、CREA等生化指标检测。
1.6 组织ITS基因扩增参照组织DNA提取试剂盒说明,提取心脏、肝脏、脾脏、肺脏、肾脏、肠组织的总DNA,其浓度及质量于紫外分光光度计检测合格后(D260 nm/D280 nm=1.8~2.0),于-20℃保存备用。以上述提取的各组织的总DNA为模板,PCR扩增ITS基因,反应程序同1.3。
1.7 病理组织切片GMS染色采集小鼠的心脏、肝脏、脾脏、肺脏等组织常规脱蜡、透明、包埋,制成病理组织切片后,脱蜡至水,用GMS染色试剂盒对上述组织染色,染色后脱水、封片,风干后于光学显微镜下观察结果。
1.8 病理组织切片HE染色采集小鼠心脏、肝脏、脾脏、肺脏等组织于4%多聚甲醛固定,经流水冲洗24 h后,30%~100%乙醇逐级脱水1 h,二甲苯透明30 min,浸蜡、包埋、切片、60℃烤片,逐级脱蜡至水,苏木素染色15 min,盐酸分化,氨水复蓝,伊红复染2 min,再逐级乙醇脱水、二甲苯透明,最后中性树胶封片,在光学显微镜下观察各组织病理变化。
1.9 数据处理试验数据先经Excel初步整理后,用SPSS 18.0统计分析软件对数据进行统计学分析,组间采用单因素方差分析(ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著,用Graphpad prism 5.0软件制图。
2 结果
2.1 菌株鉴定结果从病羊心脏、肝脏组织分离到具有相似形态的菌落,其在PDA培养基上生长速度缓慢,质地为绒毛状,初期为淡黄色,后期呈黄褐色,背面为淡黄色(图1A)。直接涂片镜检,发现其分生孢子头呈疏松放射状,黑褐色色素沉积,分生孢子梗光滑、透明,有分支菌丝,分生孢子为球形(图1B),初步鉴定分离株为土曲霉。扩增该分离株ITS基因得到长度为595 bp的条带(图2A),提交到GenBank获得登录号:MW412636。BLAST比对发现与MN429211.1Aspergillusturreus的同源性达99.81%(图2B)。综合鉴定该分离株为土曲霉,并命名为MSF2株。

A.MSF2菌株培养结果;B.MSF2菌株镜检结果
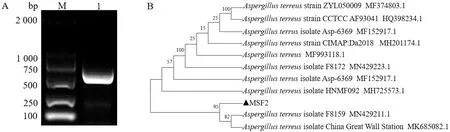
M.DL2000 DNA Marker;1.ITS基因PCR产物
2.2 菌株毒力基因检测MSF2菌株毒力基因PCR扩增结果显示:Alb1扩增阳性,大小为303 bp;Rho1阳性,大小为220 bp;PKAR阳性,大小为224 bp;Cat1阳性,大小为330 bp;Alp2阳性,大小为130 bp;AspF1阳性,大小为201 bp(图3)。
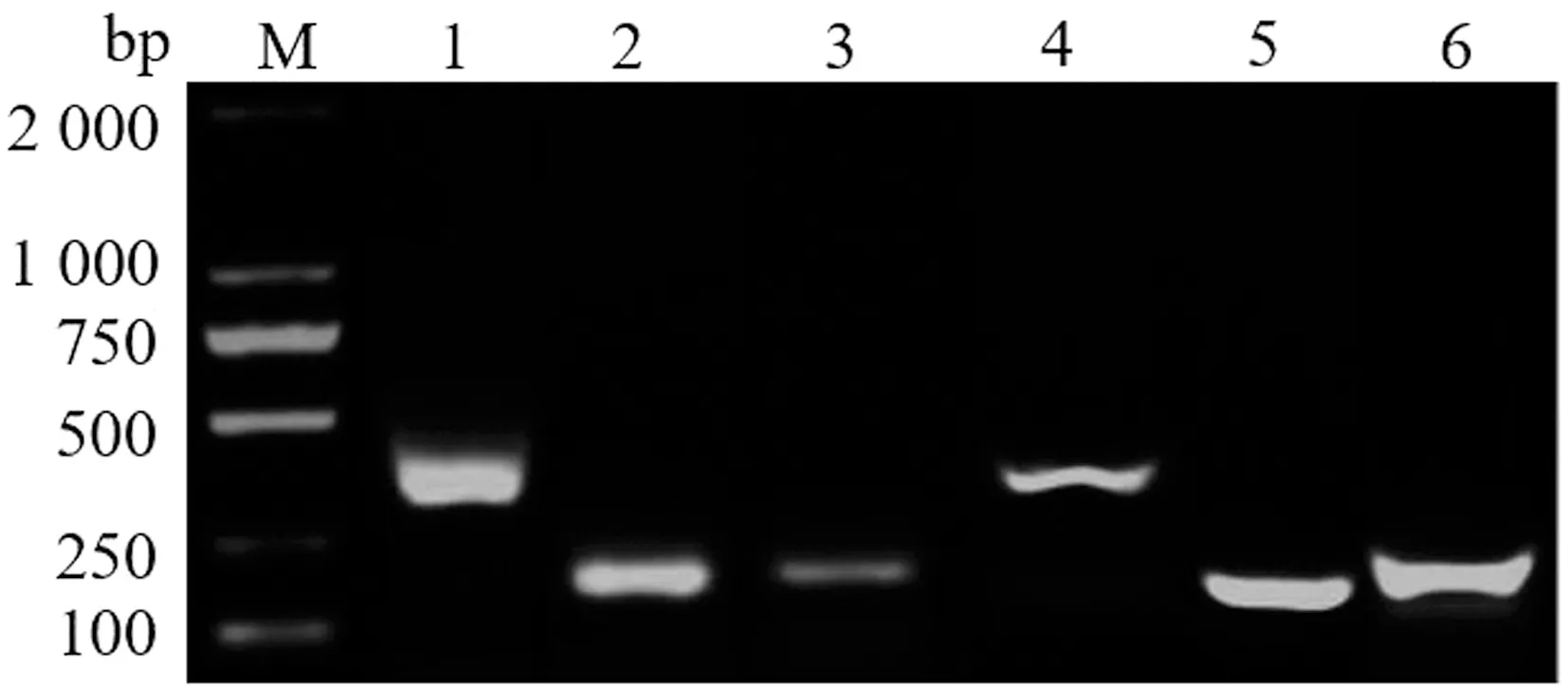
M.DL2000 DNA Marker;1.Alb1基因PCR产物;2.Rho1基因PCR产物;3.PKAR基因PCR产物;4.Cat1基因PCR产物;5.Alp2基因PCR产物;6.AspF1基因PCR产物
2.3 临床症状及剖检变化孢子悬液注射小鼠后2 d,小鼠开始出现精神萎靡、食欲下降、弓背、站立不稳等临床症状,攻毒5 d后开始有小鼠死亡,死亡率为30%。剖检试验组小鼠发现其腹部积淡黄色液体,内脏器官黏连,其肾脏、脾脏组织肿大、颜色加深;肺脏表面有大小不一出血点,颜色苍白;小肠黏膜出现红色血栓。
2.4 血清生化指标检测生化检测结果显示,与对照组相比,试验组小鼠ALB含量降低(P<0.05),GLB含量升高(P<0.01),提示小鼠机体发生炎症反应;ALP、ALT、AST含量升高(P<0.01),提示小鼠肝功能被损害;UREA、CREA和UA含量显著升高(P<0.01),提示小鼠肾功能受损(图4)。
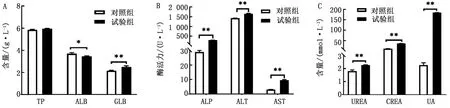
A.蛋白生化指标;B.肝脏生化指标;C.肾脏生化指标。*.P<0.05差异显著;**.P<0.01差异极显著
2.5 组织ITS基因检测提取各组小鼠心脏、肝脏、脾脏、肺脏、肾脏、小肠组织DNA,PCR扩增真菌ITS基因,试验组小鼠脏器均扩增出595 bp的条带(图5),经测序比对后,均为土曲霉。对照组小鼠各脏器ITS基因扩增呈阴性。

M.DL2000 DNA Marker;1.心脏ITS基因;2.肝脏ITS基因;3.脾脏ITS基因;4.肺脏ITS基因;5.肾脏ITS基因;6.小肠ITS基因
2.6 组织GMS染色真菌GMS染色结果显示,试验组小鼠的心肌细胞上出现被染成黑色菌丝(图6A);肝细胞间出现黑色且有分支的菌丝(图6B); 脾脏红髓区出现被染成黑色的细小菌丝(图6C);肺组织中出现黑棕色成团菌丝聚集(图6D);肾组织中出现被染成棕褐色、粗大、呈45°分支的菌丝(图6E);小肠组织间可见被染成黑色的霉菌菌丝(图6F)。

A.心脏;B.肝脏;C.脾脏;D.肺脏;E.肾脏;F.小肠
2.7 病理组织切片观察试验组小鼠病理组织切片结果显示,心肌细胞肿大,细胞核增大,胞浆内充满淡红色物质,呈玻璃样变性(图7A);肝细胞肿胀变性,肝索结构模糊,部分肝细胞坏死,肝窦扩张、充血,中央静脉周围炎性细胞聚集(图7B);脾脏红髓区大量红细胞聚集,淀粉样变性(图7C);肺泡扩张、肺泡毛细血管充血、炎性细胞浸润、肺泡上皮细胞脱落,淡红色纤维素性物质渗入肺泡腔(图7D);肾小管上皮细胞肿胀、变性、坏死、脱落,毛细血管充血(图7E);小肠部分绒毛脱落,肠腺内有红细胞聚集(图7F);上述组织中均可看见少量圆形透明孢子侵入(箭头)。
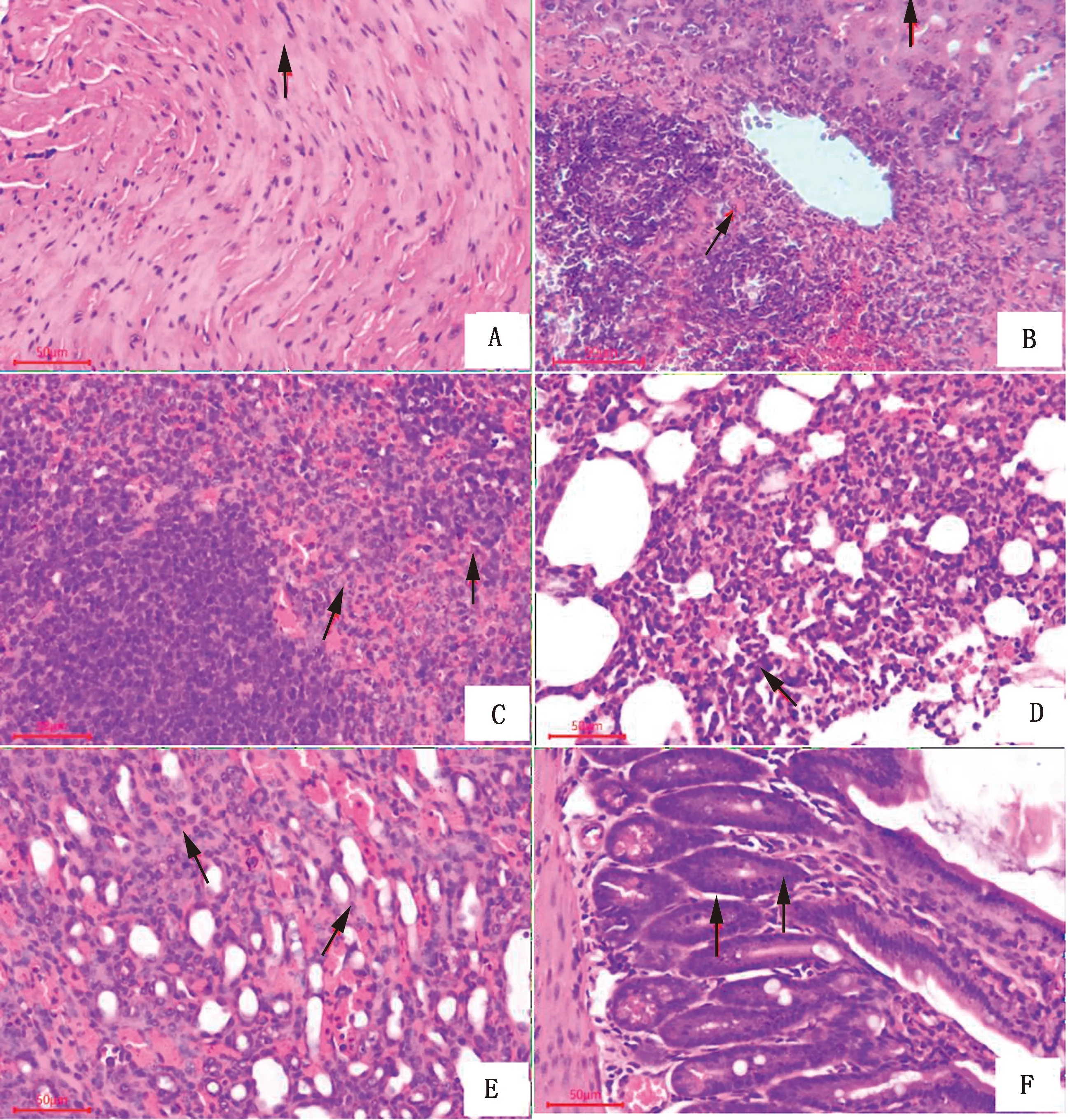
A.心肌细胞肿大、玻璃样变,可见透明孢子 (箭头);B.肝细胞肿胀变性,肝窦充血,炎性细胞浸润,可见透明孢子 (箭头);C.脾红髓区充血,白髓区淀粉样变性,少量孢子侵入(箭头);D.肺泡隔充血,肺泡上皮细胞脱落,有少量孢子侵入(箭头);E.肾小管上皮细胞变性,毛细血管充血,霉菌孢子侵入组织间(箭头);F.小肠绒毛脱落,黏膜可见少量透明孢子(箭头)
3 讨论
土曲霉是曲霉属中的一种,可根据其生长特性、形态结构进行初步鉴定。MORTAZ等[13]报道土曲霉A1120菌株在沙堡罗葡萄糖琼脂上培养48~72 h,出现光滑的淡黄色粉末状菌落,随后变成黄褐色,镜检发现其有隔膜和透明菌丝,呈球状或椭圆形。SINGH等[14]报道土曲霉FHM0035菌株在PDA上培养时,初期呈现黄色菌落,后期菌落颜色变暗,镜检发现其分生孢子透明、光滑,呈现分隔菌丝状。KIRSCHNER等[15]报道土曲霉CK12菌株在PDA上生长快速,呈淡黄色菌落,镜检发现其分生孢子较大、呈球形。本研究中,土曲霉MSF2菌株在PDA上的生长特性与镜检的形态特征与上述结果基本一致。
曲霉属真菌的分生孢子能通过空气传播并且能在各种环境中存活、生长,感染人和动物发病,主要是内部多种毒力因子共同作用的结果[16]。分生孢子黑素(Alb1)基因与黑色素形成有关,色素可帮助真菌在环境中存活[17]。小G蛋白(Rho1)基因参与了曲霉细胞壁的形成,敲除烟曲霉Rho1后,烟曲霉几乎不能生长[16]。蛋白激酶A调节亚基(PKAR)与过氧化氢酶1(Cat1)分别编码编cAMP依赖蛋白激酶和去除ROS酶,可帮助曲霉提高入侵能力及抵抗机体免疫系统的杀伤作用[18]。碱性蛋白酶(Alp2)编码碱性丝氨酸蛋白酶,可降解弹性蛋白、胶原蛋白,与真菌营养吸收、信号转导及毒性有关[19]。核糖核酸酶(Aspf1)是核糖体毒素的一种,是烟曲霉的主要过敏原,进入宿主后,核糖毒素通过使核糖体失活来抑制蛋白质生物合成,从而导致细胞死亡[20]。TSAI等[21]从人源烟曲霉菌株中检测到了Alb1、Rhol、PKAR、Cat1基因,证实了毒力因子在烟曲霉侵袭感染中的重要性。ALVAREZ等[20]从人源黄曲霉中检测到了Alp2、Aspf1、Cat1基因,证实缺失这些毒力因子后会减弱黄曲霉引起的小鼠气道炎症反应。ABAD等[19]从人源烟曲霉中检测到了Alp2、Cat1毒力基因,并研究了其在烟曲霉致病机理中的重要作用。目前这些毒力因子仅在烟曲霉中有报道,本研究从土曲霉MSF2菌株扩增出上述毒力因子,提示该菌株具有较强的致病性。
土曲霉通常对免疫功能低下的患者产生严重危害。KNUDTSON等[22]报道土曲霉引起牛胎盘炎并导致流产,GMS染色发现胎盘子叶、胎儿眼睑部有分支、不规则菌丝,支气管内周围粒细胞、纤维蛋白和巨噬细胞聚集。TRACHANA等[9]报道土曲霉感染引起免疫缺陷的儿童出现高热、腹胀等症状,超声检查其肝脏肿大,活检发现其肝脏出现炎性细胞浸润、肝窦严重充血等炎症反应。TAKAGI等[10]报道了受伤患者继发土曲霉感染,引发椎间盘炎症,组织病理学检查显示小梁骨之间的肉芽和肉芽肿中有大量中性粒细胞的浸润,呈现慢性化脓性骨髓炎症,并从椎骨间分离出了土曲霉菌株。SCHETT等[23]报道土曲霉引起急性淋巴细胞白血病患者由土曲霉感染而引起的心内膜炎,尸检发现其主动脉栓塞,脾脏和肾脏肿大,PAS染色发现二尖瓣大量菌丝被染成红色。目前,关于土曲霉引起小鼠组织脏器病变的研究尚少,SHARMA等[24]用土曲霉和黄曲霉混合感染大鼠,研究其肝脏的病变特点,发现试验小鼠肝脏肿大,组织学观察发现肝窦扩张充血、肝细胞坏死、脂肪变性、单核细胞浸润。SLESIONA等[25]报道土曲霉感染小鼠后引起肝脏苍白化,肝细胞空泡化脂肪变性,肺脏中性粒细胞和单核细胞浸润,脾脏和肾脏没有明显病理变化。本研究中,土曲霉除可引起心脏、肾脏、脾脏组织发生病变,与上述结果不一致,可能与菌株来源不同或菌株毒力差异有关。
本研究通过形态学及扩增ITS基因,鉴定MSF2菌株为土曲霉,并扩增了毒力基因,通过小鼠感染试验研究了对小鼠的毒性作用,为土曲霉菌病的诊断和治疗提供参考资料。
